
¿QUÉ SON LAS MICOTOXINAS, CÓMO SE FORMAN Y CUÁL ES LA IMPORTANCIA DE SU PRESENCIA EN EL PIENSO?
Las micotoxinas son metabolitos secundarios de determinadas especies de hongos presentes en cereales por todo el mundo. Son producidas antes (hongos patógenos de las plantas) o tras la cosecha de los cereales, o incluso durante el almacenaje (hongos saprófitos). Se forman bajo condiciones ambientales favorables, cuando se da la temperatura y humedad adecuadas.
La estructura y propiedades tóxicas de las micotoxinas difieren y no se alteran durante el almacenamiento o tras los típicos tratamientos térmicos del pienso (p. ej. durante la peletización).
A nivel general, las micotoxinas tienen un impacto significativo, incluyendo:
- ⇰ Mortalidad de los animales tras la exposición a elevados niveles
- ⇰ Retraso en el crecimiento
- ⇰ Deterioro de la inmunidad
- ⇰ Empeoramiento de los parámetros productivos
- ⇰ Alteraciones reproductivas
- ⇰ Daños tisulares
- ⇰ Incremento de los costes veterinarios
Los efectos de las micotoxinas en animales, especialmente en cerdos, se observan en un amplio rango de gravedad, desde casos agudos con morbilidad y mortalidad significativa a los más frecuentes casos subagudos/ crónicos con síntomas inespecíficos.
A diferencia de los agentes microbianos, las micotoxinas no inducen una respuesta inmunitaria humoral directa como mecanismo de defensa en cerdos. Sin embargo, pueden actuar como agentes perjudiciales con efectos variables sobre los órganos y tejidos en función de su tropismo y mecanismo de acción.
Inflamación, alteración de las funciones celulares, necrosis y apoptosis celular, así como varios efectos negativos sobre el sistema inmunitario (merma de la respuesta inmunitaria innata y adquirida) y la expresión/síntesis/regulación de citoquinas (alteración de la respuesta inflamatoria) son solo una pequeña parte del alcance de los efectos de las micotoxinas en porcino.

¿CUÁLES SON LAS PRINCIPALES MICOTOXINAS QUE AFECTAN ACTUALMENTE A LA SALUD DE LOS CERDOS Y EN QUÉ TIPO DE MATERIAS PRIMAS O PIENSOS SE DETECTAN CON MAYOR FRECUENCIA?
Los hongos productores de micotoxinas más importantes pertenecen a los géneros Aspergillus, Penicillium, Fusarium, Alternaria y Claviceps. Entre las más de 300 micotoxinas existentes, algunas tienen un gran impacto sobre la salud y productividad de los cerdos.
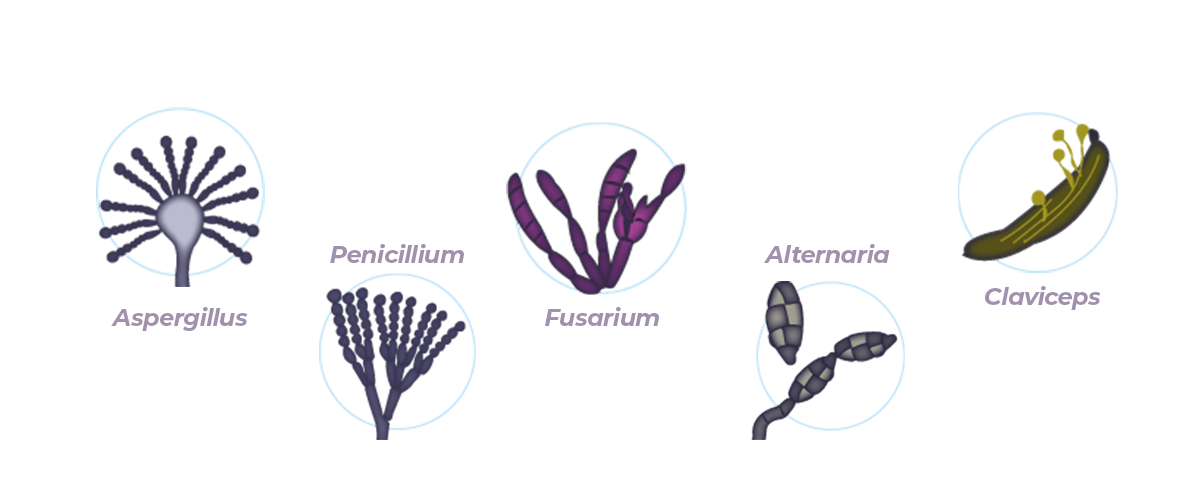
Concretamente, las aflatoxinas (AF) B1, B2, G1 y G2, el deoxinivalenol (DON – tricotecenos tipo B), la zearalenona (ZEN), las fumonisinas (FB1, FB2, FB3) y la ocratoxina A (OTA) tienen una importancia significativa por sus efectos devastadores sobre la producción porcina a nivel mundial.
- 🔎 Las AFs son producidas por Aspergillus flavus, A. parasiticus y A. nomius.
- 🔎 El DON es producida principalmente por Fusarium graminearum y Fusarium culmorum.
- 🔎 La OTA es producida por varias especies de Aspergillus y Penicillium, tales como Penicillium verrucosum A. ochraceus, A. westerdijkiae, A. steynii, A. carbonarius y A. niger.
- 🔎 La ZEN es una toxina de Fusarium producida principalmente por F. graminearum, F. culmorum, F. cerealis, F. equiseti y F. roseum tanto en el campo como durante el almacenamiento.
- 🔎 Las FBs son producidas principalmente por Fusarium verticillioides y F. proliferatum.
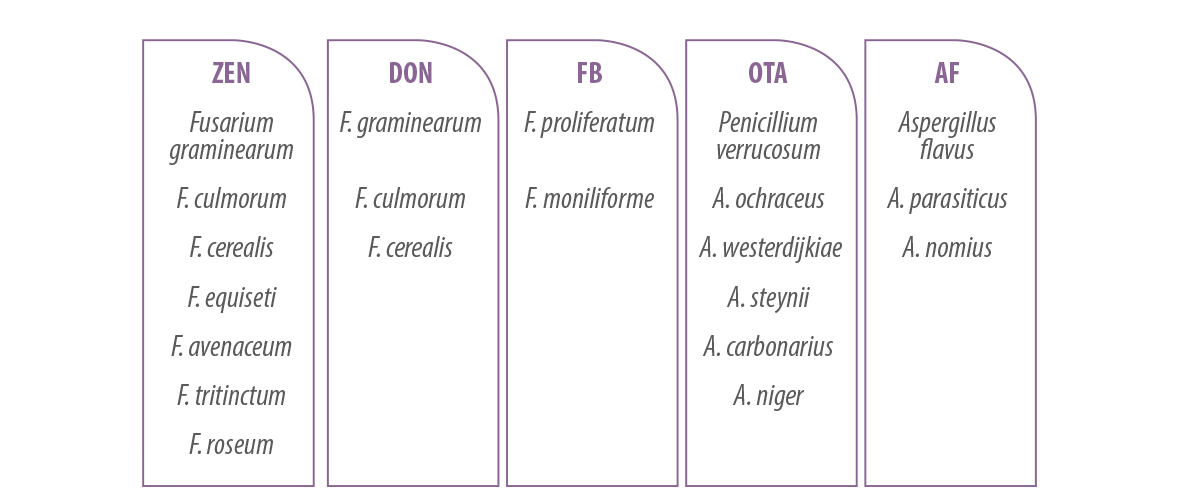 Tabla 1. Principales micotoxinas en porcino y los hongos que las producen.
Tabla 1. Principales micotoxinas en porcino y los hongos que las producen.
Otras micotoxinas como T-2, nivalenol, o alcaloides ergóticos son relativamente significativos en el porcino, especialmente en determinadas regiones en las que la contaminación de los cereales con los hongos responsables de su producción es más común.
Recientes estudios a nivel global sobre cereales y piensos sugieren que el maíz es el cereal más frecuentemente contaminado. Por otro lado, la cebada, el trigo, el sorgo, la soja y otros cereales también estarían estar contaminados.
Debemos tener en cuenta que muchos hongos pueden producir más de una micotoxina y que se utilizan varios tipos de cereales en la formulación de piensos para cerdos, pudiendo estar esos cereales contaminados por más de una micotoxina. Por ello, la presencia de varias micotoxinas en el pienso final de los cerdos es un hallazgo frecuente, mientras que la detección de una micotoxina en único tipo de cereal o pienso es la excepción en la mayoría de los casos.
Para poder comprender la amenaza que supone la presencia micotoxinas en los piensos para porcino en todo el mundo, debemos tener en cuenta que, por ejemplo, varias especies de Fusarium pueden producir más de una micotoxina.
- ⇰ F. graminearum es capaz de producir DON, ZEN, 3- u 15-acetil DON, nivalenol, diacetoxiscirpenol.
- ⇰ Por otro lado, una micotoxina puede ser producida por varias especies de Fusarium. Así, ZEN puede ser producida por F. graminearum, F. culmorum, F. cerealis, F. equiseti, F. avenaceum, F. tritinctum y F. roseum.

¿QUÉ CONDICIONES CONTRIBUYEN A LA FORMACIÓN DE ESTAS MICOTOXINAS?
La temperatura y la humedad son factores vitales para el desarrollo de los hongos y la producción de micotoxinas.
- ⇰ F. roseum productora de ZEN tiene un rango de temperatura óptima de 7-15ºC y está muy influenciada por la alternancia entre temperaturas altas y bajas durante la maduración de los cereales.
- ⇰ Los hongos Fusarium (típicos hongos de campo) están bien desarrollados y producen micotoxinas cuando hay una elevada humedad relativa (>70%) o humedad del cereal (>22%), con temperaturas que varían desde menos de 25ºC para la produccion de FB, 7-21ºC para ZEN y 26-28ºC para la producción de DON.
- ⇰ Los hongos típicos del almacenamiento, tales como Aspergillus spp. (aunque A. flavus puede producir AFs antes de la cosecha) y Penicillium spp, pueden producir micotoxinas incluso cuando con unos niveles de humedad del cereal del 12-18% y temperaturas de 10-50°C (24-35ºC para producción de AFs y 12-25ºC para produccion de OTA, respectivamente).
- ⇰ Unas temperaturas ambientales cálidas, bajas precipitaciones y condiciones secas favorecen la producción de AFs.
Debido a la fuerte conexión entre las condiciones ambientales y la producción de micotoxinas, se debe tener en cuenta el tipo y nivel de contaminación de los cereales varía de un año a otro.
Los largos periodos de almacenamiento en condiciones de elevada humedad o temperatura, el daño ocasionado por los insectos en los cereales, los granos rotos y almacenados en instalaciones con unas condiciones deficientes de limpieza (silos o líneas de alimentación con moho) también pueden influir en los niveles de micotoxinas en los cereales y piensos.
El cambio climático global y las condiciones climáticas extremas e inesperadas con rápidos cambios en temperatura y humedad deberían tenerse en cuenta, ya que pueden favorecer el crecimiento de los hongos y la producción de micotoxinas en los cereales.

¿CÓMO ACTÚAN ESTAS MICOTOXINAS A NIVEL ORGÁNICO Y CUÁLES SON LAS CONSECUENCIAS DE SU INGESTIÓN PARA LA SALUD DE LOS CERDOS?
Cada una de las micotoxinas mencionadas puede inducir una variedad de efectos deletéreos en varios órganos y tejidos.
Según diversos estudios, se ha sugerido que las AFs atacan preferentemente al hígado de los cerdos (también importante para su bioactivación), mientras que la OTA tiene como principal diana el riñón e hígado, la ZEN tiene tropismo por el tracto genital, el DON hacia el tracto gastrointestinal y el hígado, y la FB hacia el tracto gastrointestinal, el hígado y los pulmones. Sin embargo, esto no significa que el DON no tenga ningún efecto sobre el tracto genital, o que la ZEN no afecte al tracto gastrointestinal.
No obstante, aunque las micotoxinas se presentan por separado, su efecto es simultáneo, lo que abre todo un nuevo capítulo en lo que respecta al enfoque clínico y las investigaciones relacionadas con sus interacciones en varios tejidos y órganos (sinérgicas, aditivas o antagonistas) cuando estas micotoxinas son ingeridas simultáneamente por los cerdos.
AFLATOXINAS
Las AFs afectan principalmente al hígado (con importantes propiedades carcinogénicas) a través de su producto reactivo epoxidante, aflatoxina 8,9-epóxido, que se une al ADN (generando aductos de guanina) o proteínas, conduciendo a daño hepatocelular.
- ⇰ Las AFs también tienen efectos perjudiciales sobre los sistemas digestivo (anorexia, reducida ganancia de peso), reproductivo e inmunitario.
Su efecto inmunosupresor puede resultar en una mayor susceptibilidad a las infecciones bacterianas, víricas, fúngicas y parasitarias, reduciendo también la eficacia de la vacunación, incluso a niveles de intoxicación subclínica.
- ⇰ Además de ser hepatotóxicas, tienen propiedades mutagénicas, carcinógenicas y, posiblemente, teratogénicas en animales. Se han categorizado como carcinógenos humanos Clase I por la Agencia Internacional para la Investigación del Cáncer (IARC).
- ⇰ Las AFs reducen la absorción de nutrientes y la ganancia de peso.
- ⇰ La exposición crónica a bajas dosis resultan en ictericia (coloración pálido-amarillenta del hígado) con puntos hemorrágicos en el hígado y grados variables de fibrosis y cirrosis, necrosis centrolobulillar difusa y degeneración grasa. Pueden observarse lesiones carcinomatosas en los animales adultos tras largos periodos de exposición.
- ⇰ La aflatoxicosis aguda se asocia a inflamación del yeyuno e íleon con fenómenos hemorrágicos en el lumen. Puede provocar la muerta tras la ingestión de niveles extremadamente altos.
DEOXINIVALENOL Y FUMONISINAS
DON y FB inducen alteraciones importantes en el tracto digestivo (vómito inducido por DON y alteraciones de la integridad y función de la barrera intestinal) y el sistema inmunitario de los cerdos, pudiendo observarse edema pulmonar en casos extremos de toxicosis por FB.
La alteración de la integridad de la barrera intestinal puede conducir a una mayor susceptibilidad a las infecciones entéricas en animales que consumen dietas contaminadas.

DEOXINIVALENOL
El DON, también conocido como vomitoxina debido a su efecto inductor de la emesis en cerdos, se une a la subunidad ribosómica 60S, impidiendo la actividad de la peptidil transferasa e inhibiendo la síntesis proteica, además de tener efectos estimuladores o supresores sobre el sistema inmunitario.
La toxicosis por DON suele manifestarse con retraso en el crecimiento y las pérdidas económicas derivadas. Otro efecto del DON es la reducción de la ingestión voluntaria de pienso, lo que resulta en un mayor retraso del crecimiento y una mayor susceptibilidad a las enfermedades.
Por otro lado, también tiene efectos directos, incluyendo trastornos metabólicos tales como alteraciones en la absorción de nutrientes y citotoxicidad.
La reducción en la ganancia de peso tras el consumo de pienso contaminado con DON se relaciona probablemente con una alteración del deseo de comer y de la motilidad intestinal. Las alteraciones en la señalización neuroendocrina y la elevación de los niveles de serotonina parecen ser factores clave en el retraso en el crecimiento observado.
FUMONISINA B
El principal mecanismo de acción de las FBs se basa en la inhibición de la esfinganina N-aciltransferasa (ceramida sintasa), conduciendo a una alteración de la síntesis de ceramida y del metabolismo de los esfingolípidos, con la acumulación de esfinganina y esfingosina en sangre y tejidos.
La alteración del ratio esfinganina-esfingosina (ratio Sa/So) es un sensible biomarcador relacionado con la exposición a FBs.
Las FBs son micotoxinas carcinógenas, constituyendo la FB1 el 70% de las fumonisinas. Esta micotoxina es considerada como un carcinógeno humano potencial (clase 2B) por la IARC.
La intoxicación aguda del porcino cono elevados niveles de FB se caracteriza por producir edema pulmonar, lo que se relaciona con los efectos cardiovasculares tóxicos de las FBs.
Se ha reportado que la ingestión de FB resulta en severos daños morfológicos y funcionales a nivel intestinal de forma similar a los ocasionados por la ingestión de DON, habiéndose observado la interacción sinérgica y aditiva entre DON y FB1 a nivel intestinal.
OCRATOXINA A
La OTA es un potente inhibidor de la síntesis proteica considerada como un importante agente inductor nefrotóxico inductor de nefropatía en el porcino (fibrosis intersticial y alteraciones tubulares) debido a la unión de la OTA a transportadores de iones específicos a nivel renal.
Asimismo, puede provocar daño hepático con degeneración grasa y necrosis, afectando también al sistema inmunitario con la supresión de la proliferación de linfocitos.
- ⇰ Se ha demostrado que la OTA tiene un efecto depresor del apetito en cerdos con la consiguiente reducción en la ganancia de peso y el empeoramiento de la eficiencia alimentaria.
- ⇰ También se han observado úlceras gástricas, poliuria y polidipsia como consecuencia de la ingestión de OTA.
ZEARALENONA
La ZEN, debido a su potencia estrogénica, actuando como la hormona esteroidea sexual endógena 17-b-estradiol y uniéndose a los receptores estrogénicos, tiene tropismo hacia el sistema reproductivo, alterando la fertilidad e induciendo un síndrome de hiperestrogenismo con inflamación edematosa y enrojecida de la vulva.
El porcino es sensible a la ZEN, que puede inducir:
- ⇰ Prolapso vulvar
- ⇰ Daños en los folículos ováricos
- ⇰ Nacimiento de lechones con splay-leg y abortos
- ⇰ Inflamación crónica del tracto genital, especialmente en el caso de ingestión de pienso muy contaminado.
Adicionalmente, se han sugerido varios efectos citotóxicos, embriotóxicos, genotóxicos y otros (p. ej.: efectos sobre la regulación neuroendocrina) a raíz de estudios in vitro e in vivo en cerdos con algunos de las toxinas mencionadas.
NIVELES DE CONTAMINACIÓN
Según la Comisión Europea (EC/32/2002 modificada por EC/100/2003, EC/576/2006) los niveles máximos de contaminación por AFB1 permitido en piensos destinados al porcino son de 0,2 ppm.
Niveles máximos recomendados de contaminación:
- 🔎 0,9 ppm DON
- 🔎 5 ppm total FBs
- 🔎 0,05 ppm OTA (pienso complementario y completo para cerdos)
- 🔎 0,1 ppm ZEN (pienso complementario y completo para nulíparas y lechones) o 0,25 ppm ZEN (pienso complementario y completo para cerdas reproductoras y cerdos de engorde)

¿CUÁLES SON LOS PRINCIPALES SÍNTOMAS QUE PODEMOS ENCONTRAR ASOCIADOS A LA EXPOSICIÓN A MICOTOXINAS EN CERDOS?
El diagnóstico clínico es bastante difícil en la mayoría de casos crónicos asociados a piensos contaminados con bajos niveles de micotoxinas.
Como principio general, trastornos clínicos significativos (p. ej.: síndrome de hiperestrogenismo) en órganos específicos que podrían estar asociados con determinadas micotoxinas, en un rango específico de edad (p. ej.: nulíparas) y que se manifiestan tras un cambio en la dieta (p. ej.; compra de nuevas materias primas, cambio de productor del pienso, etc.) debe incluir las micotoxinas como prioritarias en el diagnóstico diferencial.
No obstante, el abordaje clínico debe estar acompañado de los análisis laboratorios pertinentes del pienso y de las muestras biológicas (suero/ tejidos) para alcanzar un buen diagnóstico.
Los típicos síntomas inducidos por micotoxinas generalmente se asocian a intoxicaciones agudas, mientras que la observación de síntomas clínicos relacionados con casos crónicossubagudos son menos evidentes. Los casos de mortalidad debida a niveles de contaminación extremadamente altos de micotoxinas (p. ej.: AFs) son poco frecuentes. Los signos clínicos que podrían atribuirse a otros agentes (p. ej.: agentes infecciosos) deben distinguirse de los observados en los casos de micotoxicosis.
A modo de ejemplo, el retraso en el crecimiento asociado a AFs – o DON- o FBs también puede atribuirse a otros agentes. Por ello, un examen clínico meticuloso es esencial.
Por otro lado, el hiperestrogenismo inducido por ZEN tiene claros efectos sobre los genitales externos, lo que es útil para el diagnóstico.
Sin embargo, cuando estos efectos visibles no están presentes de forma evidente (p. ej.: casos esporádicos de pseudogestación o repeticiones del estro), otros posibles factores (p. ej.: Síndrome Reproductivo y Respiratorio Porcino –PRRS) deben tomarse en cuenta. Así, el veterinario debe tener en cuenta que cuando se presentan estos casos, podría darse una situación mixta con una infección por PRRS y una toxicosis por ZEN en condiciones de campo.
Otro hecho a tener en cuenta es la capacidad de las micotoxinas mencionadas para debilitar la respuesta inmunitaria de muchas maneras:
- ⇰ Las AFs pueden alterar la capacidad de presentación de antígeno de las células dendríticas, reducir la síntesis de citoquinas proinflamatorias e incrementar la producción de citoquinas antiinflamatorias.
- ⇰ Dependiendo de la dosis, el DON puede actuar como un agente inmunoestimulador o inmunosupresor. También puede inducir estrés ribotóxico y la respuesta inflamatoria subsiguiente.
- ⇰ Las FBs alteran el balance de citoquinas e in luyen sobre la respuesta in lamatoria, mientras que la OTA y la ZEN también afectan a la síntesis de determinadas citoquinas in lamatorias.

¿CUÁLES SON LOS FACTORES QUE DETERMINAN LA TOXICIDAD DE UNA MICOTOXINA DETERMINADA?
Varios estudios de investigación publicados señalan a la dosis y el tiempo como los principales factores que afectan las consecuencias tóxicas generales de las micotoxinas en porcino.
Adicionalmente, las patologías concurrentes podrían afectar a los “resultados” finales (extensión y severidad de los síntomas clínicos y los hallazgos patológicos) en los casos de micotoxicosis.
Asimismo, determinados rangos de edad podrían ser más susceptibles que otros, como es el caso de las cerdas prepuberales afectadas por el síndrome de hiperestrogenismo inducido por ZEN.
TOXICIDAD DOSIS-DEPENDIENTE
Las concentraciones de DON en pienso de 1-8 ppm inducen síntomas clínicos como rechazo parcial al alimento y retraso en el crecimiento, mientras que concentraciones superiores a 10 ppm se asocian a un rechazo total del pienso.
Por otro lado, unos niveles de ZEN en pienso superiores a 1 ppm pueden inducir signos clínicos sutiles (1-5 ppm en el pienso de cerdas prepuberales se asocia a vulvovaginitis).
Unos niveles de AFs en pienso superiores a 0,2 ppm han demostrado ser capaces de inducir alteraciones medibles en la productividad porcina, mientras que niveles similares de contaminación del pienso por OTA puede conducir a lesiones renales tras largos periodos de exposición.
Unos niveles de FBs por encima de 25 ppm inducen signos clínicos significativos. No obstante, la alteración relativa de su biomarcador de exposición (ratio Sa/So) puede verse tras la ingestión de pienso contaminado con 5 ppm de FBs. El edema pulmonar en porcino puede esperarse con unos niveles de contaminación del pienso por FBs por encima de 100 ppm.

AL RECIBIR UN LOTE DE PIENSO EN LA GRANJA, ¿QUÉ DEBEN BUSCAR LOS PRODUCTORES QUE LES PUEDA ALERTAR SOBRE LA CONTAMINACIÓN CON MICOTOXINAS?
El examen macroscópico del pienso en el momento de su recepción es importante.
Alteraciones macroscópicas, tales como cereales dañados, insectos, olor desagradable, mayor humedad y sensación “pegajosa” a la hora de mezclar el pienso, así como un incremento de la temperatura del pienso, especialmente en las capas profundas, son indicios que podrían asociarse a la presencia de hongos.

Se debe tener en cuenta que estos factores tan llamativos no siempre se correlacionan con una producción significativa de micotoxinas, pero se deben considerar como un indicio potencial de producción de micotoxinas, siendo importante realizar un muestreo y evitar introducir piensos sospechosos en la granja. En esta situación, el pienso debería quedarse “en suspenso” hasta la realización de los análisis pertinentes de micotoxinas.
El muestreo y análisis regular del pienso o materias primas tiene una importancia enorme en la prevención de micotoxicosis. prevention of mycotoxicosis.
Hipócrates de Kos (460 – 377 AC), médico de la antigua Grecia, afirmaba que “es mejor prevenir que curar”, por ello, la prevención de la micotoxicosis en porcino siempre será mejor que tratarla, tanto a nivel sanitario y de bienestar, como desde el punto de vista económico.

EN EL CASO DE UNA POSIBLE MICOTOXICOSIS EN CERDOS, ¿CUÁLES SON LOS PASOS A REALIZAR A LA HORA DE CONFIRMAR NUESTRAS SOSPECHAS?
Siempre hay que tener en cuenta que la primera información proviene de un examen clínico meticuloso de los animales. Por ello, es vital que el veterinario pueda relacionar los síntomas de micotoxicosis con el agente casual. Sin embargo, tal y como he mencionado anteriormente, tales síntomas pueden ser sutiles o podrían atribuirse a otras causas (p. ej.: retraso en el crecimiento, lechones con splay-leg, etc.
- ⇰ Al principio del diagnóstico, el veterinario debe incluir la micotoxicosis en el diagnóstico diferencial, basándose en los signos clínicos y los hallazgos de necropsia.
- ⇰ A continuación, relacionar los signos clínicos con recientes cambios en el pienso (p. ej.: introducción de una nueva materia prima) o con otras alteraciones de los parámetros reproductivos y productivos, así como la ausencia de respuesta a los antimicrobianos habituales u otras medidas terapéuticas frente a agentes infecciosos que se hayan utilizado en el pasado, debería aumentar las sospechas sobre un posible caso de micotoxicosis.
Como ejemplo, es frecuente ver que casos que incluyen síntomas clínicos de trastornos reproductivos y recientes cambios de pienso son firmes candidatos de toxicosis por ZEN, sola o en combinación con DON.
MUESTREO DE PIENSO
El muestreo del pienso es crucial, ya que puede ser un elemento significativo para el diagnóstico certero, pero también por los posibles resultados falsos negativos o falsos positivos.
Es importante contar con personal formado que se haga responsable de el muestreo representativo del pienso con el fin de minimizar el efecto de los errores del muestreo en los resultados analíticos. Una forma segura de evitar tales incidencias es implementar unos protocolos de muestreo adecuados, tal y como se describe en las regulaciones de la Comisión Europea (EC/152/2009 & EC/613/2013).
ÓRGANOS & TEJIDOS
En cuanto a los órganos y tejidos, el muestreo debe enfocarse hacia los órganos y tejidos o muestras biológicas basándose en los patrones metabólicos y de excreción (toxicocinéticos) de cada una de las micotoxinas sospechosas y de sus metabolitos.
Por ello, los estudios laboratoriales deben incluir la detección de la micotoxina parental sospechosa en las muestras biológicas, pero también debería incluir la detección de metabolitos en los sustratos adecuados, tales como orina y heces en animales vivos, o residuos en bilis, riñones e hígado de animales sacrificados o muertos.
El análisis de muestras de sangre y suero/ plasma es una opción útil. Sin embargo, a la hora de analizar en busca de micotoxinas y sus metabolitos, el momento de la última ingestión y la biodisponibilidad/ tasa de absorción de cada toxina puede ser determinante en la detección del agente causal.
Asimismo, los hallazgos macroscópicos de necropsia (p. ej.: edema pulmonar o úlceras gástricas) junto con las alteraciones microscópicas (p. ej.: fibrosis renal, necrosis hepática) pueden conducir al diagnóstico definitivo.
Con el fin de incrementar la precisión del diagnóstico, además del análisis del pienso se recomienda analizar:
- 🔎 AFM1 en hígado u orina cuando se sospecha de toxicosis por AFs.
- 🔎 Metabolitos de OTA en riñón cuando esta micotoxina tiene una fuerte presencia en el diagnóstico diferencial.
- 🔎 Residuos de FB, principalmente en hígado y riñón, junto con la medición de aspartato aminotransaminasa (AST), gamma glutamil transferasa (GGT), bilirrubina y colesterol en suero sanguíneo en el caso de una posible toxicosis por FB.
- 🔎 De forma similar, los niveles en sangre de DON o ZEN y sus metabolitos puede ser útil en el diagnóstico clínico (teniendo en cuenta la rápida metabolización del DON), aunque la detección en bilis es igual o incluso más útil.
- 🔎 Siempre que haya un claro biomarcador de exposición como el ratio Sa/So en suero sanguíneo, plasma o tejidos (p. ej.: hígado) en casos de toxicosis por FB, también se deberá analizar. Otros marcadores aceptables de exposición a micotoxinas, según la Agencia Europea de Seguridad Alimentaria (EFSA), son:
- ⇰ Aflatoxina M1 en leche
- ⇰ OTA en riñones y suero sanguíneo
- ⇰ DON y sus metabolitos en sangre
- ⇰ ZEN, a- y b-zearalenol en plasma sanguíneo o excreción de ZEN/metabolitos

¿CUÁLES SON LOS PRINCIPALES ERRORES QUE SE COMETEN A LA HORA DE RECEPCIONAR EL PIENSO EN NUESTRAS GRANJAS O DURANTE EL PROCESO DIAGNÓSTICO?
Los principales errores que se cometen con respecto al análisis de pienso y su introducción en la granja son:
- ⇰ Selección de una fuente de pienso basado únicamente en el coste o “exceso de confianza” en la fuente.
- ⇰ Ausencia de un programa de vigilancia regular (o un uso mínimo/ incorrecto de los tests de detección de micotoxinas a la recepción).
- ⇰ Recolección de muestras de pienso no representativas.
En cuanto al proceso de diagnóstico, el veterinario debe ser consciente de los patrones metabólicos de cada micotoxina con el fin de enviar las muestras correctas en el momento adecuado.
- ⇰ Por ejemplo, el hecho de que el metabolito de la ZEN (a-zearalenol) tenga una mayor potencia en porcino que el tóxico parental, la existencia de circulación enterohepática de ZEN, así como el hecho de que el ZEN tiene una buena absorción (aproximadamente el 80-5%) en el yeyuno (principalmente) e íleon de los cerdos tras la ingestión oral, y que su vida media plasmática es de aproximadamente 87 horas, debe tomarse en consideración a la hora de realizar el muestreo.
- ⇰ Por el contrario, las FBs tienen una baja biodisponibilidad (el 3-6% de la dosis oral ingerida es absorbida), pero experimenta una extensa hidrolización parcial (pHFB1) o total (HFB1), mientras que la OTA es absorbida en aproximadamente el 66% en cerdos y transportada (unida proteínas plasmáticas en un 99%) a través del sistema portal y distribuida a diferentes tejidos y órganos.
- ⇰ El DON tiene una absorción significativa en cerdos tras la exposición oral y tiene una vida media plasmática de 1-4 horas, así como una baja metabolización, siendo el momento de la toma de muestras muy importante en este caso.
Tener conocimientos sobre los patrones metabólicos de las micotoxinas facilitará:
- ⇰ La selección de los animales con la edad y estado productivo adecuados para el muestreo
- ⇰ El análisis de la presencia de las toxinas y sus metabolitos en el sustrato adecuado
- ⇰ La recolección del tipo y número adecuado de muestras
- ⇰ La elección del momento adecuado para el muestreo
Los animales con signos clínicos sospechosos recientes (p. ej.: pseudogestación, vómitos) deberían ser los seleccionados para el muestreo. Las muestras de pienso deberían ser analizados lo antes posible tras su recolección, ya que la humedad y temperatura pueden afectar a los resultados del análisis. Idealmente, las muestras biológicas deberían ser analizadas al poco tiempo de haberlas tomas, aunque es posible congelarlas (-18ºC) antes del análisis.

UNA VEZ QUE SE HAN TOMADO Y ENVIADO LAS MUESTRAS PARA SU ANÁLISIS, ¿QUÉ TÉCNICAS PODEMOS REALIZAR? ¿QUÉ INFORMACIÓN PODEMOS OBTENER DE ESTAS PRUEBAS Y CÓMO PODEMOS INTERPRETAR SUS RESULTADOS?
Hoy en día, la HPLC/MS-MS es ampliamente utilizada en una variedad de sustratos (pienso, leche, suero sanguíneo, bilis, etc.) y se considera un método muy fiable en cuanto a precisión y sensibilidad. Un laboratorio acreditado debería ser el encargado de hacer este tipo de análisis.
No obstante, el ELISA es la primera opción de análisis del pienso a su recepción, mientras que los tests rápidos aplicables sobre los ingredientes básicos pueden ayudar a minimizar el riesgo y mejorar la prevención global de micotoxicosis en la granja.
A modo de ejemplo, los glucósidos y sulfatos de ZEN pueden detectarse y deben tomarse en consideración a la hora de interpretar los resultados de un caso clínico, ya que mediante la hidrólisis de la forma parental del tóxico en el tracto digestivo, en conjunto pueden corresponderse con la cantidad total de ZEN que afecta a la reproducción en la granja.
Considerados de manera conjunta, la interpretación de los resultados debe hacerse teniendo en cuenta los hallazgos clínicos, post-mortem, microscópicos y laboratoriales (p. ej.: alteraciones de los parámetros bioquímicos del suero sanguíneo).
Sobre Panagiotis Tassis
Panagiotis Tassis Profesor Adjunto de la Facultad de Medicina Veterinaria (Instituto aprobado EAVE) de la Universidad Aristóteles de Tesalónica, Grecia. Es miembro del equipo docente de Clínica de Animales de Producción, centrado en la medicina y reproducción Porcina.
Tiene más de 15 años de experiencia clínica y de investigación sobre medicina y reproducción porcina. Habiendo ejercido de Coordinador Científico o Colaborador en varios proyectos de investigación sobre varios aspectos de la medicina y reproducción porcina, su ámbito de estudio incluye los efectos in vivo e in vitro de las micotoxinas en reproductores, así como ensayos sobre la eficacia de adsorbentes de micotoxinas, la evaluación clínica de la eficacia de vacunas frente a la mayoría de los patógenos porcinos, la eficacia de alternativas a los productos antimicrobianos en piensos, estudios sobre las alternativas a la castración y la implementación de programas veterinarios de manejo y bioseguridad.
Ha publicado estudios sobre medicina y reproducción porcina en varias revistas veterinarias internacionales y ha participado como ponente en numerosos congresos y simposios nacionales e internacionales.




 Prevención de micotoxicosis
Prevención de micotoxicosis