Ram C. Bhujel, PhD
Profesor Asociado de Investigación
Director del Aqua-Centre Asian Institute of Technology (AIT), Bangkok, Tailandia
Email: [email protected]
Hacia el año 2100, se estima que la creciente población mundial se duplicará, llegando a los 15.000 millones de habitantes, por lo que se necesitará más pescado para satisfacer sus necesidades.
Los productos alimentarios procedentes de la acuicultura son la mayor fuente de proteína animal de alta calidad1.
Se estima que en 2018 se consumieron 156,4 millones de toneladas de alimentos acuáticos2. Más de la mitad (82 millones de toneladas) procedían de la acuicultura.
El aumento necesario de la oferta para la creciente población debe provenir de la acuicultura (Figura 1). La producción anual de la acuicultura ha crecido mas de un 500%, mas de 15 millones de toneladas desde 1986 hasta 1995.
Una industria de la acuicultura en rápido crecimiento necesita más pienso. Este es es el principal recurso y representa hasta el 70-80% del coste de producción.

Figura 1. El cultivo en jaulas en ríos y lagos es una actividad de acuicultura en crecimiento en Asia.
 El alto coste y la baja calidad de los piensos son los problemas principales. El alto coste y la baja calidad de los piensos son los problemas principales. |
Micotoxinas – Un problema oculto
La calidad de los piensos depende principalmente, de los ingredientes utilizados y del nivel de contaminación con micotoxinas.
 Las micotoxinas son bastante comunes en los alimentos y los piensos (Figuras 2 y 3).
Las micotoxinas son bastante comunes en los alimentos y los piensos (Figuras 2 y 3).

Figura 2. Granos utilizados como ingredientes para la alimentación de peces y animales.

Figura 3. Formación sobre formulación de piensos mediante programación lineal y fabricación organizada en Aqua-Centre, AIT, Tailandia (para más información: [email protected]).
Las pérdidas económicas potenciales y los peligros para la salud humana debidos a las micotoxinas, no han sido completamente interiorizados.
⇰ Es necesario crear conciencia y hacer que la gente entienda la gravedad del problema.

Figura 4. Pienso enmohecido por un problema durante el almacenamiento.
¿Qué son las micotoxinas?
Las micotoxinas son subproductos o metabolitos secundarios de los hongos que tienen efectos nocivos.
⇰ Son moléculas relativamente pequeñas, pero, al ser químicamente estables, no se destruyen con la cocción o el procesamiento normal del pienso.
Las micotoxinas son producidas por diversos grupos de hongos de los géneros Aspergillus, Fusarium y Penicilium3,4.
La reproducción de los hongos se produce mediante esporas que se dispersan fácilmente a distancia por el viento. También pueden adherirse al cuerpo de insectos, aves y roedores y ser transportados a grandes distancias.
Las esporas de los hongos pueden infectar las plantas en cualquier etapa.
 De hecho, un estudio reciente demostró que se detecto contaminación por micotoxinas en el 60-80% de las muestras de productos agrícolas analizadas en un año, lo que supone aproximadamente tres veces más que la cifra reportada anteriormente (25%)5.
De hecho, un estudio reciente demostró que se detecto contaminación por micotoxinas en el 60-80% de las muestras de productos agrícolas analizadas en un año, lo que supone aproximadamente tres veces más que la cifra reportada anteriormente (25%)5.
Historia de las micotoxinas
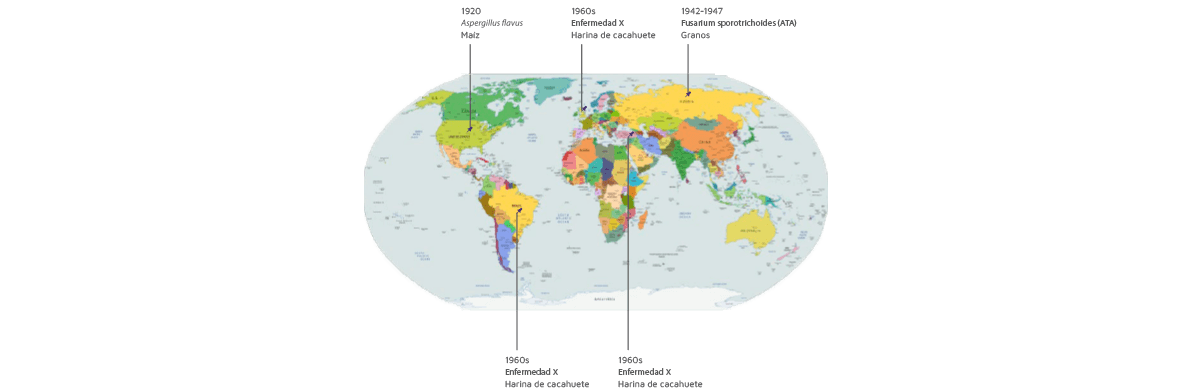
1920
La primera descripción histórica de las micotoxinas se remonta a 1920 en EE.UU.: un moho amarillo, Aspergillus flavus, fue identificado por primera vez como patógeno del maíz6.
1942-1947
La verdadera preocupación por las micotoxinas comenzó en Rusia debido a los brotes masivos de Aleukia Tóxica Alimentaria (ATA) en humanos entre 1942 y 1947, afectando hasta el 10% de la población en algunos distritos7.
⇰ Esto ocurrió cuando los alimentos escaseaban debido a las guerras y la gente consumía los granos que quedaban en el campo, los cuales estaban colonizados por Fusarium sporotrichioides8.
1960s
Durante la década de los 60, se notificaron más de 500 casos de brotes denominados “Enfermedad X” en Turquía relacionados con las micotoxinas.
⇰ Posteriormente, se descubrió que una micotoxina presente en la harina de cacahuete importada desde Brasil9,10 estaba relacionada con una enfermedad similar en las aves de corral de ese país. La misma “enfermedad X” observada en Turquía también apareció en el Reino Unido.
Micotoxinas en la acuicultura
El primer caso micotoxicosis detectado en peces podría ser el de la trucha arco iris (Onchorynchus mykiss) producida en criaderos en Estados Unidos, el cual se atribuyó a la harina de algodón11.
Los piensos son el principal recurso para la cría intensiva, ya que representan el 50-70% del coste de producción. La harina de pescado se considera el mejor ingrediente para la alimentación en acuicultura, pero por cuestiones de sostenibilidad, se ha desaconsejado su uso y se ha intentado sustituirla por ingredientes de origen vegetal.
 En consecuencia, el riesgo de exposición a las micotoxinas es mayor, ya que los productos de origen vegetal tienen muchas posibilidades de estar contaminados con micotoxinas. En consecuencia, el riesgo de exposición a las micotoxinas es mayor, ya que los productos de origen vegetal tienen muchas posibilidades de estar contaminados con micotoxinas. |

 Se han detectado muchos tipos de micotoxinas en los piensos para peces12,13.
Se han detectado muchos tipos de micotoxinas en los piensos para peces12,13.
En la mayoría de los casos, más de una micotoxina está presente simultáneamente en cada lote de piensos en niveles y patrones de combinación imprevisibles.
Aunque las micotoxinas estén presentes en un nivel bajo, la ingestión a largo plazo de este tipo de piensos contaminados, puede ser una de las causas de las mortalidades inexplicables que se producen en las piscifactorías.
Es muy difícil identificar la enfermedad, incluso cuando se detectan micotoxinas en el cuerpo de los peces.
La mayor preocupación es que las micotoxinas pueden permanecer en el cuerpo de los peces, por ejemplo, en el hígado, el riñón y los músculos, como residuos y, finalmente, ser ingeridas por los seres humanos14. Por lo tanto, las micotoxinas son un problema emergente y subestimado para la industria de la acuicultura.

Tipos y fuentes de micotoxinas
Se han identificado más de 300 micotoxinas, pero sólo se conocen unas 20 producidas naturalmente por hongos de los géneros Aspergillus, Fusarium y Penicilium3,4.
Las micotoxinas más preocupantes son las aflatoxinas, la ocratoxina A y las toxinas producidas por los mohos Fusarium.
Se pensaba que la aflatoxina era la más común en los piensos para peces15-19. Sin embargo, un reciente y extenso estudio sobre piensos e ingredientes de piensos realizado por Biomin en 2020 mostró que las micotoxinas de Fusarium son las más prevalentes.
El deoxinivalenol (DON) se encontró en el 65% de las muestras, la fumonisina (FUM) en el 64% y la zearalenona (ZEN) en el 48% de las muestras20.
La Tabla 1 muestra los principales tipos de micotoxinas y sus fuentes.
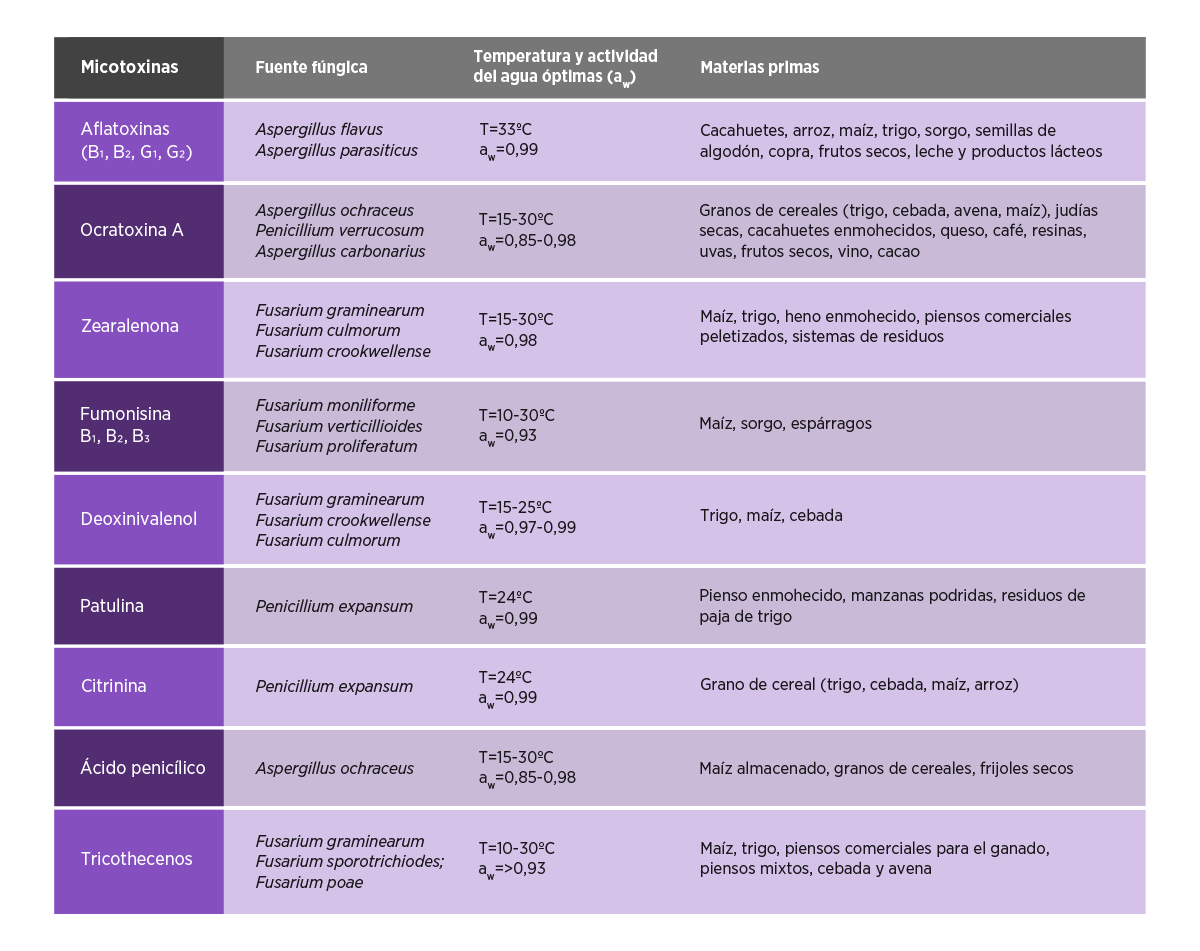
Tabla 1. Micotoxinas, sus fuentes y las materias primas que suelen estar contaminados..
Fuentes21,22,23,24
En función de las fuentes, los hongos pueden dividirse en cuatro grandes categorías:
HONGOS TRANSMITIDOS A TRAVÉS DEL SUELO
La tierra es la principal fuente de hongos. La contaminación de los productos agrícolas o de los ingredientes de los piensos se produce durante el proceso de producción en el campo o durante la manipulación, el transporte y el almacenamiento.
⇰ Los “hongos filamentosos” transmitidos por el suelo son la principal fuente de micotoxinas25,26.
HONGOS TRANSMITIDOS POR SEMILLAS
Muchos cultivos pueden contraer infecciones fúngicas a partir de las semillas si se almacenan en malas condiciones, pudiendo permanecer y crecer los hongos durante largos periodos27.
HONGOS TRANSMITIDOS POR EL AIRE
La mayoría de los hongos se reproducen a través de esporas que son muy ligeras y pueden dispersarse a grandes distancias por el aire o el viento en el campo, infectando las plantas en cualquier etapa.
⇰ Las esporas pueden entrar con los granos en el almacén y permanecer en los recipientes o equipos utilizados para almacenar los granos, los piensos y los ingredientes de los piensos, creciendo cuando se dan las condiciones adecuadas.
HONGOS TRANSMITIDOS POR ANIMALES
Las esporas de los hongos también pueden adherirse al cuerpo de los insectos, las aves y los roedores, lo que les permite ser transportados a largas distancias.
Factores que afectan la aparición de micotoxinas
Los dos factores más importantes (Tabla 1) que afectan al ciclo de vida de los hongos son:
La TEMPERATURA
La ACTIVIDAD DE AGUA
La presencia de diferentes especies de hongos puede variar según las regiones geográ icas, las estaciones y las condiciones climáticas, y la producción de micotoxinas depende de varios factores durante todo el proceso de producción, cosecha, manipulación, transporte y almacenamiento:
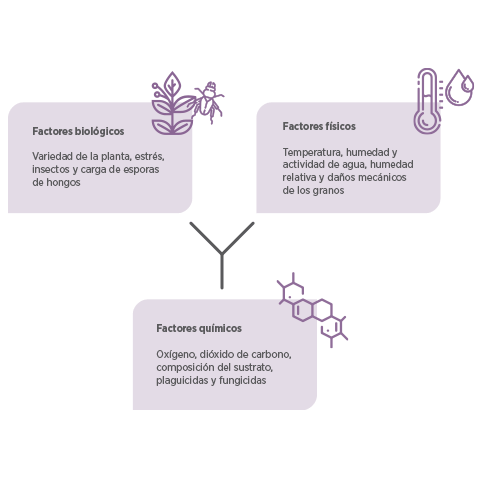
Existen condiciones óptimas para cada tipo de hongo productor de micotoxinas23.
Impacto de las micotoxinas en los peces
Las micotoxinas son peligrosos contaminantes de alimentos o piensos con una alta tasa de absorción. Por ejemplo, los ensayos de biodisponibilidad muestran que los peces pueden absorber el 85% de la AFB128.
La presencia de micotoxinas en los piensos reduce críticamente la productividad y la rentabilidad de la acuicultura al reducir la ingestión de pienso, causar anormalidades y cáncer, dañar las branquias y el hígado, reducir el crecimiento, aumentar el índice de conversión de los piensos, suprimir la inmunidad y aumentar la aparición de enfermedades, causar toxicidad y una elevada mortalidad y reducir la frecuencia de desove y la fecundidad.
El impacto de las micotoxinas depende de varios factores3,29:
- ⇰ Tipo y cantidad de micotoxinas en los piensos
- ⇰ Nivel de alimentación
- ⇰ Duración de la exposición
- ⇰ Especies de peces
- ⇰ Sexo, edad y estado de salud de los peces
- ⇰ Estado nutricional de la especie expuesta
El bagre de canal y la tilapia parecen ser capaces de detoxificar las aflatoxinas de la dieta de forma más eficiente que otras especies11.
De hecho, hasta 275 ppb y 250 ppb de a atoxinas no parecen tener efectos en el bagre y la tilapia, respectivamente. Sin embargo, dosis más altas, es decir, >1.000 ppb (>1ppm) pueden resultar dañinos.
Del mismo modo, para la ocratoxina A (OTA) una dosis de 2-4 ppm es probable que tenga efectos negativos en el bagre, mientras que el DON tiene que estar por encima de 15 ppm en la dieta para ocasionar daños. La toxina T-2, en una dosis superior a 0,625 ppm, se asocia a la reducción de la ganancia de peso.
Además del bagre y la tilapia, se han realizado numerosos estudios en la trucha y el salmón, pero los estudios son limitados en otras especies. Por lo tanto, es necesario seguir investigando.

Efectos de las micotoxinas en el ser humano
Las consecuencias principales y más preocupantes de la contaminación por micotoxinas son sus efectos sobre la salud humana.
Diversos informes han demostrado la presencia de diferentes cantidades de micotoxinas y sus residuos en los músculos, el hígado y el riñón de los peces30-34, siendo el hígado el que contiene las mayores cantidades19,35,36.
Las micotoxinas entran en el cuerpo humano a través de la ingestión de pescado, causando problemas de salud pública debido a sus efectos genotóxicos, cancerígenos, inmunosupresores y disruptores endocrinos26.
- ⇰ La aflatoxina B1 tiene como órgano diana al hígado con efectos genotóxicos y cancerígenos.
- ⇰ La fumonisina B1 perturba el metabolismo de los es ingolípidos.
- ⇰ El deoxinivalenol y la toxina T-2 inhiben la síntesis de proteínas en las células eucariotas.
- ⇰ La zearalenona se asocia a problemas de reproducción.
- ⇰ La ocratoxina A es conocida por sus propiedades nefrotóxicas.
Monitorización de las micotoxinas
Aproximadamente 100 países, que abarcan el 85% de la población mundial, cuentan con normativas específicas o directrices detalladas sobre las micotoxinas en la alimentación humana. Sin embargo, en el caso de los piensos y los ingredientes de los piensos, es posible que no existan normativas y, si existen, pueden no ser estrictas.
 A pesar de contar con políticas y reglamentos, la mayoría de los países carecen de un control de las micotoxinas en los alimentos y productos agrícolas. Muchas personas y animales enferman o mueren por enfermedades desconocidas que pueden estar asociadas a la presencia de micotoxinas en los alimentos o piensos. A pesar de contar con políticas y reglamentos, la mayoría de los países carecen de un control de las micotoxinas en los alimentos y productos agrícolas. Muchas personas y animales enferman o mueren por enfermedades desconocidas que pueden estar asociadas a la presencia de micotoxinas en los alimentos o piensos.
|
La soja, el arroz, el maíz, el trigo y sus subproductos, se utilizan mucho en la alimentación de los peces, y las micotoxinas pueden aparecer durante su producción, procesamiento y almacenamiento.
 Los animales acuáticos corren un alto riesgo de exposición a las micotoxinas si se utilizan ingredientes vegetales de baja calidad en los piensos.
Los animales acuáticos corren un alto riesgo de exposición a las micotoxinas si se utilizan ingredientes vegetales de baja calidad en los piensos.
Por lo tanto, es necesario realizar un monitoreo y evaluación de los productos en las diferentes etapas de la cadena de producción. Sin embargo, es difícil hacer un seguimiento continuo en muchos puntos.
Un test portátil para detectar la presencia de micotoxinas, ha demostrado ser una herramienta útil que permite realizar pruebas en cualquier lugar37,38.
En última instancia, es necesario realizar pruebas frecuentes para controlar a los animales de producción, especialmente cuando la probabilidad de exposición a los hongos y a las micotoxinas es alta.
 Se ha sugerido una combinación de inmunohistoquímica con ensayos de genotoxicidad como una atractiva herramienta de biomonitorización en la acuicultura16.
Se ha sugerido una combinación de inmunohistoquímica con ensayos de genotoxicidad como una atractiva herramienta de biomonitorización en la acuicultura16.
Otras líneas de investigación se centran en un método que consiste en la aplicación de biosensores electroquímicos basados en nanomateriales que podría conducir al desarrollo de una técnica de detección altamente sensible, fiable, sofisticada, rápida y rentable para controlar los productos en tiempo real39.
Así mismo, se ha desarrollado una nanoherramienta de pinzas de ADN dual, para la detección simultánea en un solo paso de AFB1 y OTA en muestras de alimentos40.
Cualquier herramienta para evaluar el riesgo de exposición a las micotoxinas será sin duda útil, ya que hay muchos residuos debido a la inclusión de ingredientes terrestres en los piensos. El riesgo se calcula mediante modelos bayesianos que determinan las concentraciones críticas del 5% (CC5) para diferentes micotoxinas.
⇰ Según el análisis de 97 piensos comerciales para acuicultura, las micotoxinas más predominantes en los piensos para peces son el deoxinivalenol, la zearalenona, las fumonisinas y las enniatinas27.

En los Estados Unidos, la Administración de Alimentos y Medicamentos (FDA) ha establecido niveles de referencia para otras micotoxinas (por ejemplo, DON y fumonisinas) para la industria de los piensos (Tabla 2) con los niveles que se consideran adecuados para proteger la salud humana y animal.
Cada producto agrícola tiene su propio límite máximo, y el Servicio de Comercialización Agrícola del Departamento de Agricultura de los Estados Unidos (USDA-MS) y el Servicio Federal de Inspección de Granos (FGIS) han proporcionado los nombres de los kits de prueba verificados.
Sus fabricantes, métodos de detección, rango y la lista de productos básicos para aflatoxinas, fumonisinas, deoxinivalenol, zearalenona y ocratoxinas están disponibles en FGIS42.
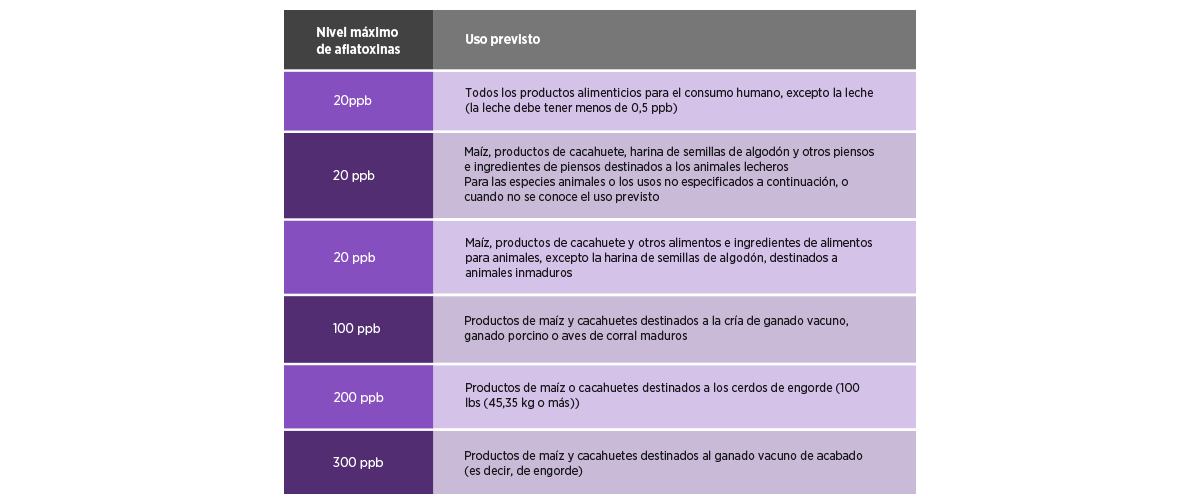
Tabla 2. Información relativa a los límites de la Administración de Alimentos y Medicamentos (FDA) para los niveles de aflatoxinas permisibles para los alimentos humanos y los piensos41.
 ¿CÓMO PODEMOS ESTIMAR EL NIVEL DE MICOTOXINAS EN LOS PIENSOS?
¿CÓMO PODEMOS ESTIMAR EL NIVEL DE MICOTOXINAS EN LOS PIENSOS?
Cuando los fabricantes de piensos compran los ingredientes, también deben pedir los resultados de las pruebas.
INFORMACIÓN DISPONIBLE
Si se dispone de la información de cada ingrediente, se puede estimar la cantidad total de micotoxinas aportada a la dieta total, multiplicando la cantidad de micotoxinas en el pienso por la proporción del mismo (%) en la dieta total:

INFORMACIÓN NO DISPONIBLE
Si la información sobre los niveles de micotoxinas en los ingredientes no está disponible por parte de los proveedores, entonces los fabricantes de piensos deben organizarse para realizar las pruebas de manera que puedan analizar tanto los ingredientes como los piensos.
La Tabla 3 indica el nivel máximo de micotoxinas en los piensos para diferentes animales.
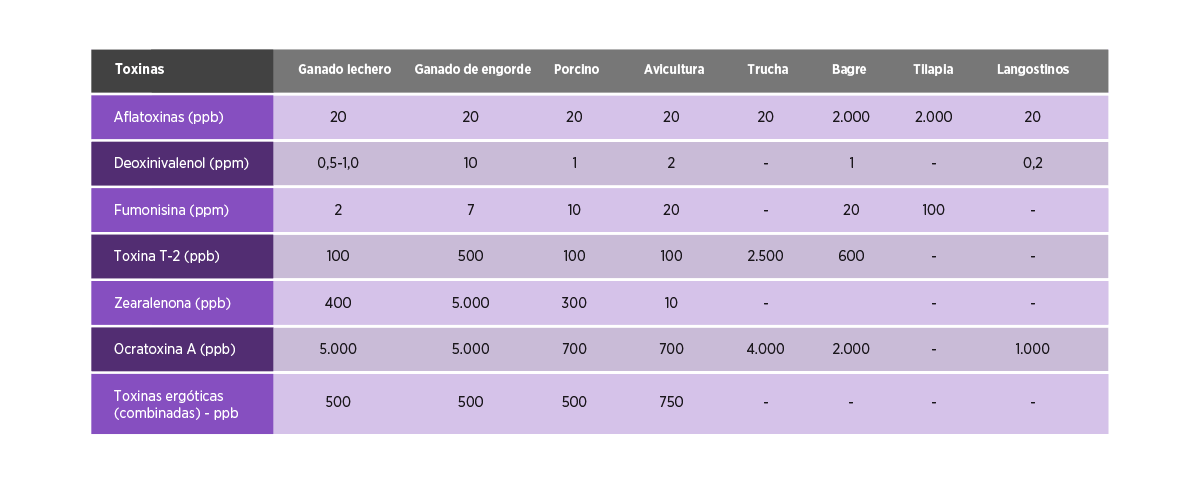
Tabla 3. Límites dietéticos potencialmente perjudiciales para las micotoxinas en la dieta total en base a la materia seca11,41,43. Nota – las celdas vacías significan que los datos no están disponibles.
La legislación de la Comisión Europea también estipula los niveles máximos admisibles de micotoxinas.
Estos niveles se definen en la versión válida del Reglamento (CE) nº1881/2006 de la Comisión, de 19 de diciembre de 200644, por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios, y en la Directiva 2002/32/CE del Parlamento Europeo y del Consejo, de 7 de mayo de 2002, sobre sustancias indeseables en la alimentación animal.
Además, se han establecido niveles máximos para la citrinina en los complementos alimenticios a base de arroz fermentado con la levadura roja, Monascus purpureaus45.
La Comisión Europea también cuenta con la Recomendación 2012/154/ UE, de 15 de marzo de 2012, para el control de la presencia de alcaloides ergóticos en piensos y alimentos.
En el sector de los piensos, los niveles máximos se definen solo para la aflatoxina B1 y los ergóticos indirectamente a través del cornezuelo, lo que indica que se necesita más.

Muestreo
Para el análisis de micotoxinas, el muestreo y la preparación de las muestras son claves.
Las muestras tomadas de un gran volumen de granos/ ingredientes de piensos o muestras de piensos deben representar la totalidad de las existencias/lote, y suele ser necesario un muestreo en varias etapas.
⇰ El tamaño de la muestra, el volumen mínimo y los pasos para el muestreo se describen en el Manual de micotoxinas41.
Una vez tomadas las muestras, deben manipularse correctamente para que la humedad nunca supere el 20%.
Al mismo tiempo, la UE también cuenta con sus propios métodos de muestreo y análisis, para el control o icial del nivel de micotoxinas en los productos alimenticios en virtud del Reglamento (CE) nº 401/2006 de la Comisión, de 23 de febrero de 200644.
⇰ Los protocolos de muestreo también están disponibles en la norma del Codex Alimentarius CODEX STAN 193-199546.

Prevención de la ocurrencia de micotoxinas
La prevención de la aparición de micotoxinas requiere la aplicación cuidadosa de protocolos durante toda la cadena de valor, incluyendo la producción del cultivo, la cosecha, el transporte, la distribución, el procesamiento y el almacenamiento, como se resume en la Tabla 4.
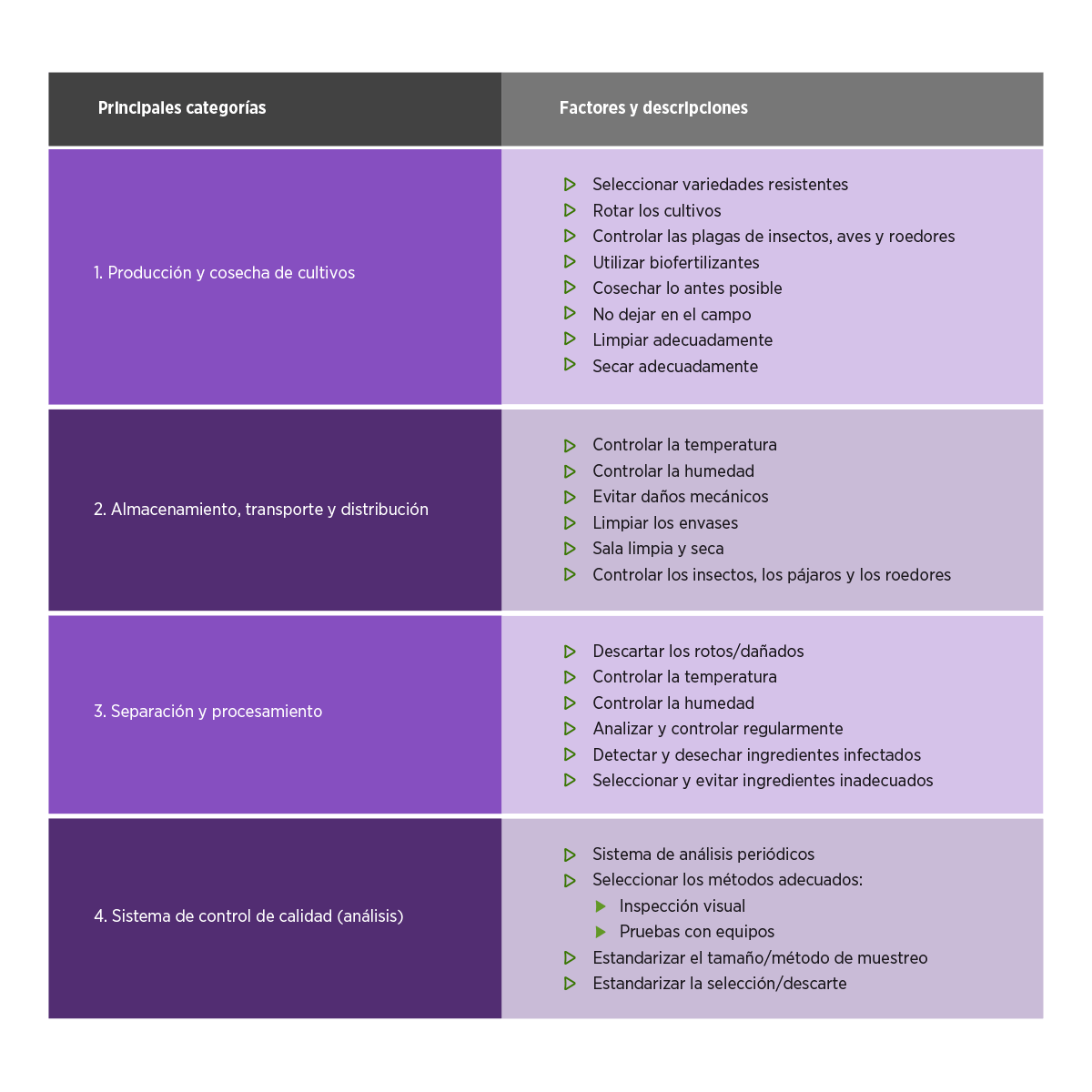
Tabla 4. Método de exclusión de la presencia de micotoxinas en la cadena de valor de los alimentos/piensos (Modificado de47 y mycotoxinsite.com).
Algunas variedades de plantas son naturalmente resistentes a los hongos. Identificar y seleccionar estas variedades puede ser una buena opción para evitar la aparición de micotoxinas.
Por ejemplo, en EE.UU. existen variedades de maíz mejoradas que son resistentes al Aspergillus flavus. Identificar esas variedades e hibridarlas puede ser útil.
 Además, la selección de los genes o loci de ADN responsables de la resistencia a determinados hongos y su inserción en variedades de alto rendimiento deberían ser futuras líneas de investigación48.
Además, la selección de los genes o loci de ADN responsables de la resistencia a determinados hongos y su inserción en variedades de alto rendimiento deberían ser futuras líneas de investigación48.
La tecnología Bt (Bacillus thuringiensis) se ha aplicado en algunos cultivos para controlar las plagas de insectos, de modo que las posibilidades de producción y propagación de hongos se reducen considerablemente, por ejemplo, en el maíz o el algodón Bt11.
Como se muestra en la Tabla 4, las buenas prácticas agrícolas, como la rotación de cultivos, el laboreo del suelo y el control químico y biológico de las enfermedades de las plantas, son esenciales para minimizar el crecimiento de los hongos.
 Cosechar los productos lo antes posible, evitar el secado en el campo, trasladarlos a mejores instalaciones lo antes posible y secarlos en plataformas elevadas sobre el suelo, puede evitar la aparición de micotoxinas.
Cosechar los productos lo antes posible, evitar el secado en el campo, trasladarlos a mejores instalaciones lo antes posible y secarlos en plataformas elevadas sobre el suelo, puede evitar la aparición de micotoxinas.
Los proveedores de materias primas deben aplicar métodos para realizar pruebas rápidas que permitan detectar la presencia de micotoxinas en los productos de cereales, para poder aceptar o rechazar un lote.
Lamentablemente, estas pruebas rápidas sólo pueden detectar unas pocas micotoxinas y los límites reglamentarios varían entre los distintos países. Por lo tanto, la responsabilidad de la gestión de las micotoxinas en los alimentos para acuicultura recae en los productores de piensos.
Tratamientos potenciales
Se han probado y utilizado varias formas y sustancias para reducir el crecimiento de los hongos o adherir las micotoxinas para que no puedan ser absorbidas por el tracto intestinal.
Hay algunos productos de detoxificación disponibles en el mercado y las enzimas parecen tener una alta selectividad para transformar las micotoxinas en formas menos tóxicas. Sin embargo, esta estrategia sólo es eficaz cuando los alimentos para acuicultura contienen un único tipo de micotoxina, pero, como se ha mencionado anteriormente, es probable que haya una mezcla de micotoxinas en los piensos, lo que hace inviable añadir una enzima para cada toxina potencial.

CONCLUSIONES Y RECOMENDACIONES
|
Entre las más de 300 micotoxinas conocidas, sólo se ha demostrado que unas 20 son perjudiciales para los animales y el ser humano. Sin embargo, es necesario investigar más sobre las micotoxinas. Los productores de cultivos, los profesionales de la acuicultura, los fabricantes de piensos, los piscicultores, los investigadores y los responsables políticos no han interiorizado del todo las consecuencias negativas asociadas a las micotoxinas. Es necesario crear más consciencia y hacer que la gente entienda la magnitud del problema. Deberían organizarse más cursos de formación, talleres y diálogos políticos entre las partes interesadas para transferir los conocimientos y las técnicas seguras de las prácticas de producción de cultivos, transporte, procesamiento, almacenamiento y manipulación. Además, se necesitan políticas claras sobre las micotoxinas, más instalaciones de laboratorio para realizar pruebas, más recursos humanos capacitados y directrices claras para el control regular en cada país o estado.
|
Bibliografía
1. Bene, C., Barange, M., Subasinghe, R., Pinstrup-Andersen, P., Merino, G., Hemre, G-I, Williams, M. 2015. Feeding 9 billion by 2050 – putting fish back on the menu. Food Security, 7(2): 261-274.
2. FAO, 2020. Food outlook – Biannual Report on Global Food Markets. FAO, Rome. http://www.fao.org/3/ca9509en/CA9509EN.pdf
3. Anater, A., Manyes, L., Meca, G., Ferrer, E., Luciano, F.B., Pimp√£o, C.T., Font, G. (2016). Mycotoxins and their consequences in aquaculture: A review. Aquaculture, 451, pp. 1-10. DOI:10.1016/j.aquaculture.2015.08.022.
4. Pokrzywa, P., Cie≈õlik, E., Surma, M. (2021). Effect of cereal products supplementation with american blueberries, cranberries and cinnamon on the formation of type A and B trichothecenes group. Annals of agricultural and environmental medicine: AAEM, 28 (1), pp.72-80. DOI: 10.26444/aaem/116903.
5. Eskola, M., Kos, G., Elliott, C.T., Sultan Mayar, J.H., Krska, R., 2020. Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’ of 25%. Critical Reviews in Food Science and Nutrition 60 (16): 2773-2789. https://doi.org/10.10 80/10408398.2019.1658570
6. Smith, J.S., Williams, W.P., Windham, G.L. 2019. Aflatoxin in maize: a review of the early literature from “moldy-corn toxicosis” to the genetics of aflatoxin accumulation resistance. Mycotoxin Research, 35: 111-128.
7. Joffe AZ (1965) Toxin production by cereal fungi causing toxic alimentary aleukia in man. In: Wogan GN (ed) Mycotoxins in foodstuffs. Proceedings of a Symposium held at the Massachusetts Institute of Technology. Cambridge, MA. 18-19 March, 1964. MIT Press. p. 77-85.
8. Mayer CF (1953) Endemic panmyelotoxicosis in the Russian Grain Belt. I. The clinical aspects of alimentary toxic aleukia (ATA): a comprehensive review. Mil Surg 113:173–189
9. Sargeant K, Sheridan A, O’Kelly J (1961c) Toxicity associated with certain samples of groundnuts. Nature 192:1096–1097.
10. Blount WP (1961) Turkey BX^ disease. Turkeys 9:52–77.
11. Banrie, 2013. Mycotoxins in aquaculture feeds. The Fishsite. https://thefishsite.com/ articles/mycotoxins-in-aquaculture-feeds
12. Gonçalves R.A., Schatzmayr, D., Hofstetter, U., Santos, G.A. (2017). Occurrence of mycotoxins in aquaculture: Preliminary overview of Asian and European plant ingredients and finished feeds. World Mycotoxin Journal, 10 (2), pp. 183-194. DOI: 10.3920/WMJ2016.2111
13. Gonçalves, R.A., Naehrer, K., Santos, G.A. (2018). Occurrence of mycotoxins in commercial aquafeeds in Asia and Europe: a real risk to aquaculture? Reviews in Aquaculture, 10 (2), pp. 263-280. DOI: 10.1111/raq.12159.
14. Rokvic, N., Aksentijevic, K., Kureljušic, J., Vasiljevic, M., Todorovic, N., Zdravkovic, N., Stojanac, N. (2020). Occurrence and transfer of mycotoxins from ingredients to fish feed and fish meat of common carp (Cyprinus carpio) in Serbia. World Mycotoxin Journal, 13 (4), pp. 545-552. DOI: 10.3920/WMJ2020.2580.
15. Barbosa, T., Pereyra, C., Soleiro, C., Dias, E., Oliveira, A., Keller, K. (2013). Mycobiota and mycotoxins present in finished fish feeds from farms in the Rio de Janeiro State, Brazil. International Aquatic Research, 5: 3.
16. Hashimoto, E.H., Kamogae, M., Vanzella, T.P., Cólus, I.M.S., Bracarense, A.P.F.R.L., Bittencourt-Oliveira, M.C., Itano, E., Kuroda, E.K., Kato, H., Nagata, S., Ueno, Y., Harada, K.-I., Hirooka, E.Y. (2012) Biomonitoring of microcystin and aflatoxin co-occurrence in aquaculture using immunohistochemistry and genotoxicity assays. Brazilian Archives of Biology and Technology, 55 (1), pp. 151-159. DOI: 10.1590/S1516-89132012000100019.
17. Fraga, M.E., Curvello, F., Gatti, M.J.A., Cavaglieri, L., Dalcero, A.M., & Roch, R.C. (2007). Potential Aflatoxin and Ochratoxin A Production by Aspergillus Species in Poultry Feed Processing. Veterinary research communications. 31, 343-353. https://doi.org/10.1007/ s11259-006-3434-x.
18. Chen, H.Y., Rawlings, R. (2008). The truth of mycotoxin contamination of feed in Asia region. China Poult. 30 (16), 33–35.
19. Deng, S-X., Tian, L-X., Liu, F-J., Jin, S-J., Lian,g G-Y., Yang, H-J. (2010). Toxic effects and residue of aflatoxin B1 in tilapia (Oreochromis niloticus & O. aureus) during long-term dietary exposure. Aquaculture, 307, 233–240.
20. AquaFeed, 2021. Biomin’s 2020 World Mycotoxin Survey. https://www.aquafeed.com/ af-article/10374/Biomin’s-2020-World-Mycotoxin-Survey/
21. Dohlman, E. 2003. Mycotoxin Hazards and Regulations: Impacts on Food and Animal Feed Crop Trade. Chapter 6 in International Trade and Food Safety: Economic Theory and Case Studies. J. Buzby (ed.). USDA, Econ. Res. Serv., AER-828, Nov. 2003. www.ers.usda.gov/publications/aer828/
22. Shephard, G.S. (2008). Determination of mycotoxins in human foods. Chem. Soc. Rev., 37, 2468–2477. DOI: 10.1039/b713084h.
23. Ksenija, N. 2018. Mycotoxins – climate impact and steps to prevention based on prediction. Acta Veterinaria-Beograd 2018, 68 (1), 1-15. DOI: 10.2478/acve-2018-0001.
24. IFST, 2018. Mycotoxins. https://www.ifst.org/resources/information-statements/ mycotoxins
25. Paterson, R.R.M., Lima, N. (2011). Further mycotoxin effects from climate change. Food Research International, 44, 2555–2566.
26. Oliveira and Vasconcelos, (2020). Occurrence of mycotoxins in fish feed and its effects: A review. Toxins, 12 (3), art. no. 160. DOI: 10.3390/toxins12030160.
27. Pietsch, C., Kersten, S., Burkhardt-Holm, P., Valenta, H., Danicke, S. (2013). Occurrence of deoxynivalenol and zearalenone in commercial fish feed: an initial study. Toxins, 5, 184.
28. Nogueira, W.V., de Oliveira, F.K., Marimón Sibaja, K.V., Garcia, S.D.O., Kupski, L., Souza, M.M.D., Tesser, M.B., Garda-Buffon, J. (2020). Occurrence and bioacessibility of mycotoxins in fish feed.Food Additives and Contaminants: Part B Surveillance, pp. 1-8. DOI:10.1080/19393210.2020.1766577.
29. Rodrigues, K., Naehrer. (2012). A three-year survey on the worldwide occurrence of mycotoxins in feedstuffs and feed. Toxins, 4, 663-675.
30. Hussain, M., Gabal, M.A., Wilson, T., Summerfelt, R.C. (1993). Effect of aflatoxin contaminated feed on morbidity and residues in walleye fish. Veterinary and Human Toxicology, 35, 396–398.
31. Leeman, W.R., Van Den Berg, K.J., Houben, G.F. (2007) Transfer of chemicals from feed to animal products: the use of transfer factors in risk assessment. Food Additive Contaminants, 24, 1– 13.
32. El-Sayed Y.S, Khalil R.H (2009) Toxicity, biochemical effects and residue of aflatoxin B1 in marine water-reared sea bass (Dicentrarchus labrax L.). Food and Chemical Toxicology, 47, 1606–1609.
33. Ayyat, D.M., Abd Rhman, G.A., El-Marakby, H.I., Mahmoud, H.K., Hessan, A. A. (2013). Issued by the Egyptian society of nutrition and feeds reduction the aflatoxin toxicity in Nile tilapia fish. Egyptian Journal of Nutrition and Feeds, 16, 469–479.
34. Selim, K.M., El-hofy, H., Khalil, R.H. (2014). The efficacy of three mycotoxin adsorbents to alleviate aflatoxin B1-induced toxicity in Oreochromis niloticus. Aquaculture International, 22 (2), pp. 523-540. DOI: 10.1007/s10499-013-9661-6.
35. Bintvihok, A., Ponpornpisit, A., Tangtrongpiros, J., Panichkriangkrai, W., Rattanapanee, R., Doi, K. (2003). Aflatoxin contamination in shrimp feed and effects of aflatoxin addition to feed on shrimp production. Journal Food Protein, 66, 882–885.
36. Nomura, H., Ogiso, M., Yamashita, M., Takaku, H., Kimura, A., Chikasou, M., Nakamura, Y., Fujii, S., Watai, M., Yamada, H., 2011. Uptake by dietary exposure and elimination of aflatoxins in muscle and liver of rainbow trout (Oncorhynchus mykiss). J. Agric. Food Chem. 59, 5150–5158.
37. Sarver, R.W., Almy, D.J., Bergeron, E.R., Strong, B.F., Steiner, B.A., Donofrio, R., Lupo, A.J., Gray, R.L., Sperry, A.K. (2021). Overview of Portable Assays for the Detection of Mycotoxins, Allergens, and Sanitation Monitoring. Journal of AOAC International, 104 (1), pp. 39-48. DOI: 10.1093/jaoacint/qsaa113.
38. Carvalho Gonçalves-Nunes, E.M., Gomes-Pereira, M.M., Raposo-Costa, A.P., da Rocha-Rosa, C.A., Pereyra, C.M., Calvet, R.M., Alves-Marques, A.L., Cardoso-Filho, F., Sanches-Muratori, M.C. (2015). Screening of aflatoxin B1 and mycobiota related to raw materials and finished feed destined for fish [Monitoreo de aflatoxina B1 y micobiota relacionada a materias primas y alimentos terminados destinados a peces]. Latin American Journal of Aquatic Research, 43 (3), pp. 595-600. DOI: 10.3856/vol43-issue3-fulltext-22.
39. Gupta, R., Raza, N., Bhardwaj, S.K., Vikrant, K., Kim, K.-H., Bhardwaj, N. (2021). Advances in nanomaterial-based electrochemical biosensors for the detection of microbial toxins, pathogenic bacteria in food matrices. Journal of Hazardous Materials, 401, art. no. 123379. DOI: 10.1016/j.jhazmat.2020.123379.
40. Xiong, Z., Wang, Q., Xie, Y., Li, N., Yun, W., Yang, L. (2021). Simultaneous detection of aflatoxin B1 and ochratoxin A in food samples by dual DNA tweezers nanomachine. Food Chemistry, 338, art. no. 128122. DOI: 10.1016/j.foodchem.2020.128122.
41. FGIS, 2015a. Mycotoxin Handbook. USDA, Agricultural Marketing Service, Federal Grain Inspection Service (FGIS), Washington, D.C., USA. https://www.ams.usda.gov/sites/default/ files/media/MycotoxinHB.pdf
42. FGIS, 2015b. Mycotoxin rapid test kits: USDA, Agricultural Marketing Service, Federal Grain Inspection Service (FGIS), Washington, D.C., USA.
43. Goeser, J. 2015. Mycotoxin guidelines and dietary limits. Rock River Laboratory, Inc.
44. European Commission, (2006a), by Commission Regulation (EC) No 1881/2006 of 19 December 2006 setting maximum levels for manycontaminants in foodstuffs. https:// eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02006R188120140701&from=EN
45. European Commission, (2006b), Commission Regulation (EC) No 401/2006 of 23 February 2006: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX: 02006R0401-20140701&from=EN
46. CAC (Codex Alimentarius Commission) (2016) Code of Practice for the Prevention and Reduction of mycotoxins contamination in cereals. CAC/RCP 51-2003, revised 2016.
47. CAST (2003). Mycotoxins: risks in plant, animal and human systems. In: C. f. A. S. a. Technology (ed). Task Force Report, Ames, IA.
48. Goddard, R., Steed, A., Scheeren, P.L., Maciel, J.L.N., Caier√£o, E., Torres, G.A.M., Consoli, L., Santana, F.M., Fernandes, J.M.C., Simmonds, J., Uauy, C., Cockram, J. Nicholson, P. (2021). Identification of Fusarium head blight resistance loci in two Brazilian wheat mapping populations. PLoS ONE, 16 (3 March), art. no. e0248184. DOI: 10.1371/journal.pone.0248184.
49. Phillips, T.D., Wang, M., Elmore, S.E., Hearon, S., Wang, J.-S. (2019). NovaSil Clay for the Protection of Humans and Animals from Aflatoxins and Other Contaminants. Clays and Clay Minerals, 67 (1), pp. 99-110. DOI: 10.1007/s42860-019-0008-x.
50. Imani, A., Salimi Bani, M., Noori, F., Farzaneh, M., Moghanlou, K.S. (2017). The effect of bentonite and yeast cell wall along with cinnamon oil on aflatoxicosis in rainbow trout (Oncorhynchus mykiss): Digestive enzymes, growth indices, nutritional performance and proximate body composition. Aquaculture, 476, pp. 160-167. DOI: 10.1016/j. aquaculture.2017.04.023.
51. Hussain, D. (2018) Effect of aflatoxins in aquaculture: Use of bentonite clays as promising remedy. Turkish Journal of Fisheries and Aquatic Sciences, 18 (8), pp. 1009 1016. DOI: 10.4194/1303-2712-v18_8_10.
52. Demissie, Z.A., Witte, T., Robinson, K.A., Sproule, A., Foote, S.J., Johnston, A., Harris, L.J., Overy, D.P., Loewen, M.C. (2020). Transcriptomic and Exometabolomic Profiling Reveals Antagonistic and Defensive Modes of Clonostachys rosea Action against Fusarium graminearum. Molecular Plant-Microbe Interactions, 33 (6), pp. 842-858. DOI: 10.1094/MPMI-11-19-0310-R.
53. Kagot, V., Okoth, S., De Boevre, M., De Saeger, S. (2019). Biocontrol of aspergillus and fusarium mycotoxins in Africa: Benefits and limitations. Toxins, 11 (2), art. no. 109. DOI: 10.3390/toxins11020109.
54. Ren, Y., Yao, M., Chang, P., Sun, Y., Li, R., Meng, D., Xia, X., Wang, Y. (2021). Isolation and characterization of a Pseudomonas poae JSU-Y1 with patulin degradation ability and biocontrol potential against Penicillium expansum. Toxicon, 195, pp. 1-6. DOI: 10.1016/j. toxicon.2021.02.014.
55. Biomin (2021): https://www.biomin.net/science-hub/world-mycotoxin-survey-impact-2021/
56. Patent Co. (2021). Products: Supplements: Min-a-Zel Minazel Plus®. http://www.patent-co.com/en/supplements
57. De Oliveira, F.K., Santos, L.O., Buffon, J.G. (2021). Mechanism of action, sources, and application of peroxidases Food Research International, 143, art. no. 110266. DOI: 10.1016/j.foodres.2021.110266
58. Jorge-Escudero, G., Pérez, C.A., Friberg, H., Söderlund, S., Vero, S., Garmendia, G., Lagerlöf, J. (2021). Contribution of anecic and epigeic earthworms to biological control of Fusarium graminearum in wheat straw Applied Soil Ecology, 166, art. no. 103997. DOI: 10.1016/j.apsoil.2021.103997.
59. Murugesan, P., Brunda, D.K., Moses, J.A., Anandharamakrishnan, C. (2021). Photolytic and photocatalytic detoxification of mycotoxins in foods. Food Control, 123, art. no. 107748. DOI: 10.1016/j.foodcont.2020.107748.
60. Gupta, S., Verma, S.K, Kumar, S. 2019. Assessment and Containment of Aflatoxin Impact on the Health by Solar Drying. Journal of the Institute of Engineering October 2019, Vol 15 (No. 3): 141-145.
61. Roshan, A.B., Venkatesh, H.N., Mohana, D.C. (2021). Chemical Characterization of Schefflera actinophylla (Endl.) Harms Essential Oil: Antifungal and Antimycotoxin Activities for Safe Storage of Food Grains. Journal of Biologically Active Products from Nature, 11 (1), pp. 60-69. DOI: 10.1080/22311866.2021.1886989.
62. Malekinezhad, P., Ellestad, L.E., Afzali, N., Farhangfar, S.H., Omidi, A., Mohammadi, A. (2021). Evaluation of berberine efficacy in reducing the effects of aflatoxin B1 and ochratoxin A added to male broiler rations. Poultry Science, 100 (2), pp. 797-809. DOI: 10.1016/j.psj.2020.10.040.
63. Vujčić, I. and Mašić, S.(2021). Preservation of hemp flour using high-energy ionizingradiation: The effect of gamma radiation on aflatoxin inactivation, microbiological properties, and nutritional values. Journal of Food Processing and Preservation. DOI: 10.1111/jfpp.15314.
64. Martínez, M.P., Pereyra, M.L.G., Juri, M.G.F., Poloni, V., Cavaglieri, L. (2018). Probiotic characteristics and aflatoxin B1 binding ability of Debaryomyces hansenii and Kazaschtania exigua from rainbow trout environment. Aquaculture Research, 49 (4), 1588-1597. https://doi.org/10.1111/are.13614.
65. Zhou, H. (2016) Mixture of palygorskite and montmorillonite (Paly-Mont) and its adsorptive application for mycotoxins. Applied Clay Science, 131, pp. 140-143. DOI: 10.1016/j.clay.2016.03.012.
66. Abdelhamid, A.M., Salem, M.F.I., El-Shebly, A.A., Sultan, A.S.I. (2019). Is it possible to detoxify aflatoxic aquafeed? Egyptian Journal of Aquatic Biology and Fisheries, 23 (1), art. no. 5, pp. 47-63. DOI: 10.21608/ejabf.2019.25916.
67. El-Samawaty, A.E.-R.M.A., El-Wakil, D.A., Alamery, S., Mahmoud, M.M.H. (2021). Potency of plant extracts against Penicillium species isolated from different seeds and fruits in Saudi Arabia. Saudi Journal of Biological Sciences. DOI: 10.1016/j.sjbs.2021.02.074.
68. Avantaggiato, G., Solfrizzo, M., Visconti, A. 2005. ecent advances on the use of adsorbent materials for detoxification of Fusarium mycotoxins. Food Additives and Contaminants 22(4):379-88. DOI: 10.1080/02652030500058312.
69. García‐Pérez, O.D., Tapia‐Salazar, M., Nieto‐López, M.G. (2019). Effects of conjugated linoleic acid and curcumin on growth performance and oxidative stress enzymes in juvenile Pacific white shrimp (Litopenaeus vannamei) feed with aflatoxins. Aquac Res. 51, 1051– 1060. https://doi.org/10.1111/are.14451.




 Prevención de micotoxicosis
Prevención de micotoxicosis