El profesor Simon Jackson, CEO y fundador de Molendotech Ltd., obtuvo su licenciatura y su doctorado en Química/Bioquímica en la Universidad de Cardiff y, tras un periodo como investigador invitado en la Facultad de Medicina de Dartmouth (EE.UU.), desarrolló su carrera investigadora, primero en la Facultad de Medicina de la Universidad de Cardiff y luego como jefe de investigación en la Universidad del Oeste de Inglaterra, en Bristol, antes de ocupar el puesto de jefe de investigación biomédica en la Universidad de Plymouth.
Tiene más de 200 publicaciones en el campo de la infección y la inmunidad y está especializado en las respuestas celulares y moleculares a las moléculas patógenas, como el lipopolisacárido (LPS, endotoxina). Su investigación se ha centrado en las respuestas inmunológicas e inflamatorias a la infección y en el papel clave que desempeñan las moléculas bacterianas, como el LPS, y en el desarrollo y la aplicación de ensayos y modelos celulares pertinentes para estudiar dichas respuestas.
Su investigación condujo a la formación de la empresa spin-out Molendotech en 2018 y, además de dirigir la empresa, sigue participando activamente en la investigación y ha recibido subvenciones de los Consejos de Investigación del Reino Unido, la industria, organizaciones benéficas y organismos gubernamentales.


PROFESOR JACKSON, LOS CAMPOS DE LA QUÍMICA Y LA BIOQUÍMICA SON VASTOS Y EMOCIONANTES. ¿QUÉ LE LLEVÓ A EXPLORAR LAS RESPUESTAS INMUNOLÓGICAS E INFLAMATORIAS A LA INFECCIÓN?
Siempre me han interesado las ciencias de la vida y cómo el cuerpo responde a los estímulos externos. Mi doctorado lo realicé sobre los radicales libres y las respuestas biológicas, lo que me llevó a realizar un estudio postdoctoral en la Facultad de Medicina sobre los radicales libres y los mecanismos de las enfermedades, incluida la sepsis.
Me pareció un área de investigación fascinante, sobre todo porque se sabía poco sobre los mecanismos moleculares concretos de la sepsis y los desencadenantes de los patógenos.
 Esto me llevó a estudiar los desencadenantes patógenos de la inflamación y las endotoxinas (lipopolisacárido; LPS) en particular. Me intrigaba cómo una molécula tan antigua era reconocida por el sistema inmunitario y cómo podía desregularse
Esto me llevó a estudiar los desencadenantes patógenos de la inflamación y las endotoxinas (lipopolisacárido; LPS) en particular. Me intrigaba cómo una molécula tan antigua era reconocida por el sistema inmunitario y cómo podía desregularse

GRAN PARTE DE SU INVESTIGACIÓN SE HA CENTRADO EN LAS ENDOTOXINAS O LIPOPOLISACÁRIDOS BACTERIANOS (LPS). ¿PODRÍA EXPLICAR BREVEMENTE QUÉ SON ESTAS MOLÉCULAS?
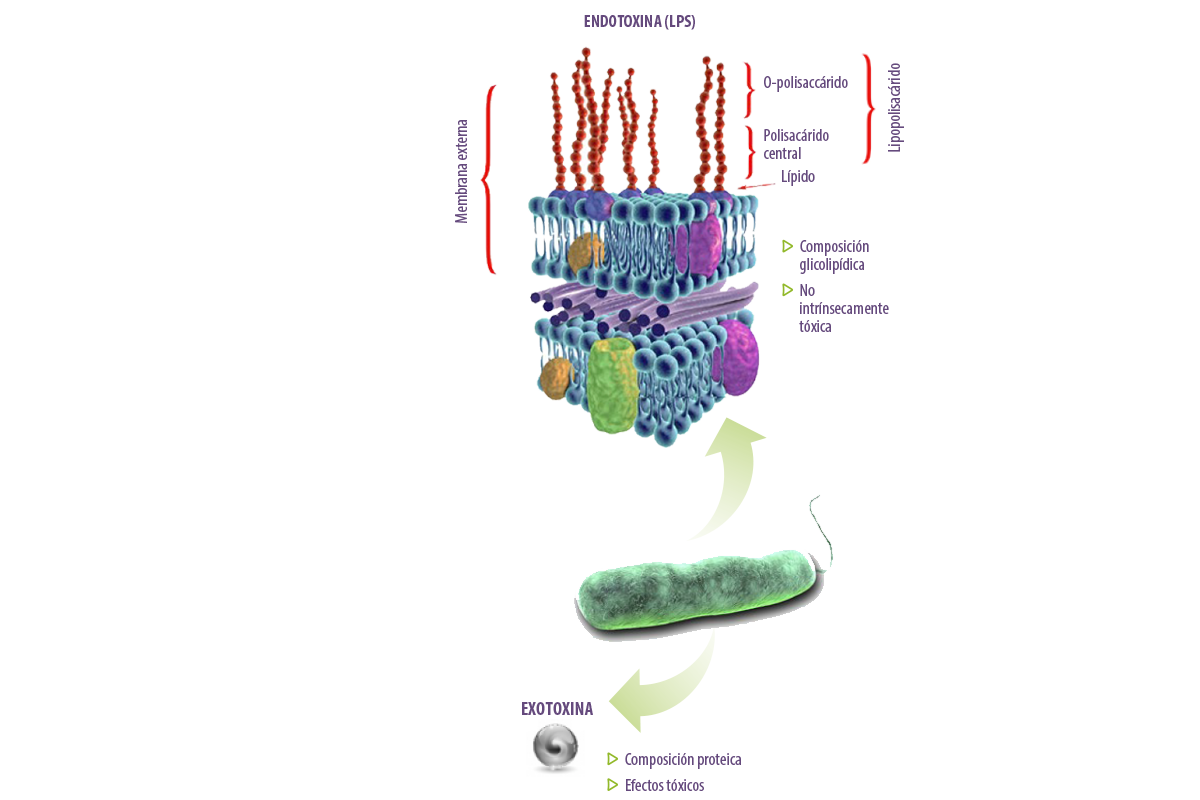
El lipopolisacárido (LPS) es un componente integral de la membrana externa de las bacterias Gram negativas.
 Es un componente estructural que también protege a estos organismos de los factores ambientales, incluidos los que se encuentran en el intestino de los animales y los seres humanos.
Es un componente estructural que también protege a estos organismos de los factores ambientales, incluidos los que se encuentran en el intestino de los animales y los seres humanos.
Por razones históricas, el LPS se describió como “endotoxina” para distinguir la molécula de las “exotoxinas” bacterianas, pero son muy diferentes.
- ⇰ Las exotoxinas suelen ser proteínas y tienen efectos tóxicos sobre las células y los tejidos.
- ⇰ Las endotoxinas están compuestas por glicolípidos y no son intrínsecamente tóxicas. Es la respuesta del hospedador a los LPS la que puede causar daños e incluso puede ser letal.

¿CÓMO SE FORMAN LAS ENDOTOXINAS, CÓMO INTERACTÚAN CON LOS RECEPTORES Y CUÁLES SON LAS CONSECUENCIAS DE SU PRESENCIA EN EL ORGANISMO? ¿ESTÁN LOS EFECTOS DE LAS ENDOTOXINAS RELACIONADOS CON ALGUNA ENFERMEDAD?
Las endotoxinas (LPS) son componentes glicolipídicos de la pared celular de las bacterias y se secretan por desprendimiento durante el crecimiento o la lisis bacteriana.
Los animales han evolucionado para reconocer los LPS como señal de infección, para estimular una respuesta inflamatoria que normalmente es protectora.
 Sin embargo, grandes cantidades de LPS, la presencia de LPS en compartimentos normalmente estériles o la exposición repetida a LPS, pueden provocar respuestas inflamatorias excesivas, dañando los vasos sanguíneos y los órganos, conduciendo a los efectos patológicos asociados a esta molécula.
Sin embargo, grandes cantidades de LPS, la presencia de LPS en compartimentos normalmente estériles o la exposición repetida a LPS, pueden provocar respuestas inflamatorias excesivas, dañando los vasos sanguíneos y los órganos, conduciendo a los efectos patológicos asociados a esta molécula.
El LPS es reconocido o detectado por moléculas receptoras como el receptor Toll-like 4 (TLR4).
 La estimulación del receptor de LPS TLR-4 presente en las células inmunitarias, como los monocitos y los macrófagos, conduce a la activación de genes inflamatorios y a la secreción de citoquinas proinflamatorias críticas, como la interleucina (IL) IL-1β, IL-6, IL-8 y el factor necrótico tumoral (TNF) α y β.
La estimulación del receptor de LPS TLR-4 presente en las células inmunitarias, como los monocitos y los macrófagos, conduce a la activación de genes inflamatorios y a la secreción de citoquinas proinflamatorias críticas, como la interleucina (IL) IL-1β, IL-6, IL-8 y el factor necrótico tumoral (TNF) α y β.El LPS también activa el sistema de complemento de las proteínas plasmáticas, lo que provoca daños en los tejidos y los vasos sanguíneos, además de estimular la expresión del factor tisular (TF) en las células inmunitarias que induce la coagulación de la sangre.
 La activación excesiva del sistema de coagulación, unida a la supresión de los mecanismos anticoagulantes inducida por el LPS, puede dar lugar a una coagulación intravascular diseminada (CID) potencialmente mortal.
La activación excesiva del sistema de coagulación, unida a la supresión de los mecanismos anticoagulantes inducida por el LPS, puede dar lugar a una coagulación intravascular diseminada (CID) potencialmente mortal.
La activación excesiva de estas respuestas inflamatorias provoca daños en los vasos sanguíneos, los órganos y los tejidos, lo que puede dar lugar a un fallo orgánico y a la muerte. Este es el sello distintivo de la sepsis.
⇰ Una vez desencadenados, estos mecanismos son muy difíciles de detener y, por tanto, la sepsis es difícil de tratar.
Los animales neonatos (y los seres humanos) son especialmente vulnerables al LPS, por lo que es importante limitar la exposición al mismo.
En los seres humanos, la elevada morbilidad y mortalidad vinculada a infecciones como la enfermedad meningocócica se deben a la liberación de LPS por parte de la bacteria.

ENTRE LAS INVESTIGACIONES LLEVADAS A CABO POR SU EQUIPO, HAN PODIDO IDENTIFICAR LOS VÍNCULOS ENTRE LAS ENZIMAS MODIFICADORAS DE LÍPIDOS QUE CONTROLAN LA COMPOSICIÓN DE LA MEMBRANA CELULAR Y LAS RESPUESTAS DE SEÑALIZACIÓN DE LOS LEUCOCITOS AL LPS Y A OTROS LIGANDOS DE LOS RECEPTORES TOLL-LIKE. ¿CUÁLES SON LAS PRINCIPALES CONCLUSIONES QUE PUEDEN EXTRAERSE DE ESTA LÍNEA DE INVESTIGACIÓN? ¿PODRÍAN ESTAS ENZIMAS TENER POSIBLES OBJETIVOS TERAPÉUTICOS Y DE DIAGNÓSTICO?
Como se ha señalado anteriormente, una vez desencadenados, los mecanismos de las respuestas inflamatorias al LPS son difíciles de controlar e implican la expresión de muchas moléculas y mediadores inflamatorios.
La investigación se ha centrado en detener estas reacciones, pero todas las terapias dirigidas a inhibir las moléculas inflamatorias han tenido poco efecto en los ensayos clínicos. Por lo tanto, hay que explorar nuevos enfoques terapéuticos y reevaluar los mecanismos de las respuestas al LPS.
 Mi equipo se ha interesado por entender cómo los fosfolípidos de membrana, podrían alterar el mecanismo de señalización que controla las respuestas a moléculas bacterianas como el LPS.
Mi equipo se ha interesado por entender cómo los fosfolípidos de membrana, podrían alterar el mecanismo de señalización que controla las respuestas a moléculas bacterianas como el LPS.
En particular, la composición y el equilibrio entre ciertas moléculas de fosfolípidos podrían ser importantes para controlar las vías de señalización que activan los genes en las respuestas a la sepsis.
Hemos estado estudiando las enzimas que controlan estas proporciones y composiciones de lípidos con la esperanza de que puedan conducir a novedosos objetivos para nuevas terapias contra la sepsis.
Nuestras investigaciones con células que tienen estas enzimas silenciadas o potenciadas parecen respaldar nuestro planteamiento. Además, los niveles de algunas de las enzimas con las que trabajamos pueden estar aumentados en la sepsis, algo que podría abrir un nuevo enfoque diagnóstico.


EN CUANTO A LOS LPS, USTED HA ESTUDIADO SU RELACIÓN CON LA SEÑALIZACIÓN DE LAS ESPECIES REACTIVAS DEL OXÍGENO (ROS). ¿CUÁLES SON LOS HALLAZGOS MÁS RELEVANTES DE ESTA INVESTIGACIÓN?
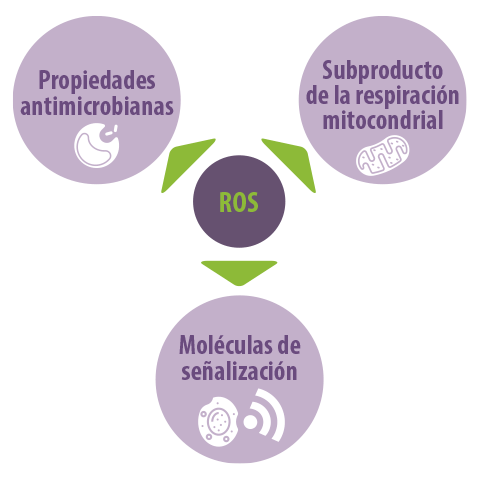
Las especies reactivas de oxígeno (ROS), como el superóxido y el peróxido de hidrógeno, son generadas por las enzimas de células como los macrófagos para eliminar los patógenos ingeridos. También son subproductos formados como consecuencia de la respiración mitocondrial normal. Las ROS también son utilizadas por las células como moléculas de señalización.
Hemos demostrado que una respuesta muy temprana al LPS consiste en la generación de ROS, lo que puede activar los mecanismos efectores posteriores.
⇰ Estos hallazgos pueden conducir al desarrollo de enfoques antioxidantes específicos para controlar dicha señalización.
Ahora se sabe que la activación de los macrófagos requiere un cambio en su metabolismo hacia la glucólisis, que produce energía rápida para estas células.
⇰ Este cambio metabólico aumenta la producción de ROS y proporciona un nuevo enfoque para entender las respuestas inmunitarias e inflamatorias.

HABLANDO DE LA RELACIÓN ENTRE LPS Y ROS, USTED HA ESTADO EXPLORANDO LA APLICABILIDAD DE NOVEDOSOS DISPOSITIVOS DE NANOELECTRODOS- CELULARES PARA IDENTIFICAR EVENTOS DE SEÑALIZACIÓN DE OXÍGENO REACTIVO (ROS) DE ALTA RESOLUCIÓN ESPACIAL Y TEMPORAL EN RESPUESTA A LPS EN CÉLULAS INDIVIDUALES. ¿EN QUÉ CONSISTEN ESTOS DISPOSITIVOS Y CÓMO FUNCIONAN? ¿CUÁL ES LA IMPORTANCIA DE COMPRENDER LA RELACIÓN ENTRE LOS EVENTOS DE SEÑALIZACIÓN DE ROS Y LA EXPOSICIÓN A LPS?
La capacidad de monitorizar eventos intracelulares en tiempo real es fundamental para avanzar en la ciencia biológica y clínica fundamental.
En colaboración con electroquímicos de la Universidad de Nottingham, hemos desarrollado nanotubos de carbono de pared simple alineados verticalmente (VASWCNTs) que se insertan en el citoplasma de las células eucariotas.
 Añadiendo grupos funcionales a estos nanotubos, podemos detectar y controlar las reacciones en el interior de las células en tiempo real.
Añadiendo grupos funcionales a estos nanotubos, podemos detectar y controlar las reacciones en el interior de las células en tiempo real.
Los nanotubos de carbono funcionalizados con un electrocatalizador de osmio, permitieron la detección sin precedentes de un “pulso” intracelular local de ROS en una breve escala de segundos en respuesta a la estimulación de la endotoxina bacteriana (lipopolisacárido-LPS) en los macrófagos.


OTRA FASCINANTE ÁREA DE INVESTIGACIÓN EN LA QUE ESTÁ INMERSO SU EQUIPO, ES EL DESARROLLO DE NOVEDOSOS SISTEMAS DE DETECCIÓN DE ENDOTOXINAS PARA USO CLÍNICO Y MEDIOAMBIENTAL. ¿QUÉ PUEDE DECIRNOS SOBRE ESTOS SISTEMAS? ¿PODEMOS ESPERAR VER SUS APLICACIONES PRÁCTICAS EN UN FUTURO PRÓXIMO?
Las moléculas bacterianas, como los LPS, pueden causar una enfermedad inflamatoria grave si entran en lugares estériles del cuerpo. Esto puede ocurrir a través de dispositivos médicos o de la inyección de fármacos. Para limitar la exposición a los LPS, los dispositivos médicos y los fármacos deben someterse a pruebas de detección de LPS, mediante tests sensibles basados en el sistema de lisado de amebocitos de Limulus (LAL).
⇰ Estos tests pueden detectar cantidades muy pequeñas (pg) de LPS.
Hemos desarrollado pruebas basadas en este sistema de detección para su uso con muestras ambientales.
⇰ La prueba que hemos desarrollado puede utilizarse para examinar rápidamente el agua u otras muestras in situ en busca de contaminación por bacterias Gram negativas. Es especialmente útil para detectar la contaminación por LPS, por ejemplo, en los piensos para alimentación animal.
También hemos desarrollado pruebas específicas para patógenos en una variedad de entornos, incluida la industria alimentaria. La investigación actual se centra en el desarrollo de nuestros ensayos para aplicaciones sanitarias.

SU EQUIPO HA ESTADO TRABAJANDO EN EL DESARROLLO DE CULTIVOS CELULARES EN 3D (ESFEROIDES) COMO NUEVOS MODELOS DE INFECCIÓN E INFLAMACIÓN Y COMO SUSTITUTOS DE LOS ANIMALES EN LA INVESTIGACIÓN DE INFECCIONES Y CRIBADO AMBIENTAL. ¿CÓMO FUNCIONAN ESTOS ESFEROIDES Y CÓMO SE HAN PROBADO EN EL CASO DE LAS ENDOTOXINAS? ¿CUÁLES HAN SIDO LOS RESULTADOS HASTA AHORA?
La necesidad de sustituir a los animales en la investigación médica es muy importante. Los sistemas celulares actuales, aunque útiles, carecen de la organización y la arquitectura de las células y los tejidos in vivo, lo que limita la traslación de sus resultados a la práctica clínica.
Hemos desarrollado agregados celulares en 3D, conocidos como esferoides, que conservan el contacto célula-célula y se comportan como mini-órganos (“organoides”).
⇰ Estos sistemas celulares en 3D son útiles para investigar la toxicidad de los fármacos y explorar los mecanismos de desarrollo de las enfermedades.
Estamos utilizando cultivos celulares en 3D, para determinar el mecanismo por el que el LPS puede inducir respuestas de sepsis en los órganos, mediante el uso de sistemas de co-cultivo de diferentes tipos de células.
Estas investigaciones han permitido identificar nuevas respuestas al LPS por parte de células que en cultivos 2D no responden a esta molécula. Además, también hemos desarrollado estos sistemas de co-cultivo a partir de células pulmonares, para detectar y analizar las respuestas tóxicas e inflamatorias a los patógenos y contaminantes del aire.
| En combinación con los análisis proteómicos, estamos desarrollando un sistema de detección que indicará qué contaminantes o patógenos pueden estar presentes en el aire. |

¿CUÁL ES SU MENSAJE PARA NUESTROS LECTORES SOBRE LAS ENDOTOXINAS Y SU IMPACTO EN LA SALUD HUMANA Y ANIMAL?
Las endotoxinas o LPS, son moléculas bacterianas intrínsecas que el sistema inmunitario reconoce como “señales de peligro” de infección. Inician potentes respuestas inmunitarias innatas para proteger al hospedador. Sin embargo, esta respuesta puede llegar a ser excesiva y causar daños en los tejidos y órganos del huésped, lo que da lugar a enfermedades graves como la sepsis.
No existe un tratamiento específico para la sepsis y la morbilidad y mortalidad son elevadas. Los muy jóvenes y los ancianos son especialmente vulnerables a desarrollar sepsis (tanto en humanos como en animales).
El intestino contiene enormes cantidades de bacterias y LPS que, si entran en la circulación, pueden provocar rápidamente respuestas mortales.
 Cualquier toxina o compuesto que dañe el endotelio intestinal puede aumentar la penetración del LPS y puede inducir la sepsis.
Cualquier toxina o compuesto que dañe el endotelio intestinal puede aumentar la penetración del LPS y puede inducir la sepsis.




 Prevención de micotoxicosis
Prevención de micotoxicosis