Profesor Carlos Augusto Fernandes de Oliveira
Departamento de Ingeniería de los Alimentos, Facultad de Zootecnia e Ingeniería de los Alimentos, Universidad de São Paulo, Pirassununga, São Paulo, Brasil.
 En este artículo, repasaremos los principales biomarcadores empleados para la biomonitorización de la exposición de los animales a una o varias micotoxinas, así como las aplicaciones potenciales de estos biomarcadores con fines diagnósticos y para la evaluación de la eficacia de las medidas de prevención, tales como los adsorbentes minerales.
En este artículo, repasaremos los principales biomarcadores empleados para la biomonitorización de la exposición de los animales a una o varias micotoxinas, así como las aplicaciones potenciales de estos biomarcadores con fines diagnósticos y para la evaluación de la eficacia de las medidas de prevención, tales como los adsorbentes minerales.

Micotoxinas & Micotoxicosis

Las micotoxicosis son enfermedades relacionadas con la exposición a las micotoxinas a través de la dieta, manifestándose con inmunosupresión y toxicidad en los órganos diana, con lesiones en hígado, riñones, tejido epitelial (piel y membranas mucosas) y sistema nervioso central, principalmente, dependiendo del tipo de toxina involucrado.
Los principales grupos de hongos toxigénicos y sus respectivas micotoxinas pertenecen a los géneros:
- Aspergillus:
- ⇰ A. flavus, A. parasiticus y A. nomius: aflatoxinas
- ⇰ Fusarium: fumonisinas, tricotecenos, moniliforminas y zearalenona
- ⇰ Aspergillus ochraceus
- Penicillium: ocratoxinas
Es importante recordar que, aunque los alimentos puedan contener micotoxinas individuales, la contaminación de estos productos con varias micotoxinas es muy común, algo que es cada vez más importante desde la perspectiva de la salud humana y animal, debido a los posibles efectos combinados de diferentes micotoxinas.
La toxicidad de algunas micotoxinas puede verse incrementada debido a interacciones sinérgicas, aditivas o antagonistas cuando aparecen de forma concomitante y son ingeridas por las distintas especies animales.

 AFLATOXINAS
AFLATOXINAS
Entre las micotoxinas que afectan al ganado, las aflatoxinas se consideran compuestos hepatotóxicos, teratógenos y genotóxicos, también clasificados como carcinogénicos para los seres humanos (Grupo 1) por la Agencia Internacional de Investigaciones sobre el Cáncer.
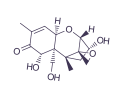
Las aflatoxinas fueron identificadas en 1961, siendo la aflatoxina B1 (AFB1) el principal tipo de toxina producida por Aspergillus en condiciones naturales.
 OCRATOXINA A
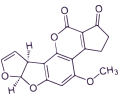
OCRATOXINA A
La ocratoxina A (OTA) es una importante micotoxina nefrotóxica con efectos inmunotóxicos, teratógenos, carcinogénicos y, posiblemente, neurotóxicos, provocando cáncer hepático y renal en muchas especies.
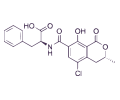
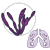 FUMONISINAS
FUMONISINAS
Se han aislado e identificado hasta 28 fumonisinas estructuralmente relacionadas, aunque la fumonisina B1 (FB1) es la forma más predominante y tóxica producida por los hongos.
La FB1 ha demostrado ser hepatotóxica, nefrotóxica y carcinogénica en varios estudios con animales, provocando también enfermedades especificas en determinadas especies, como edema pulmonar porcino y leucoencefalomalacia equina.
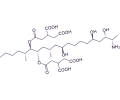
 ZEARALENONA
ZEARALENONA
La zearalenona (ZEA) es una micotoxina que se une de manera competitiva a los receptores de estrógenos, conduciendo a anomalías estrogénicas y síndromes degenerativos, especialmente en porcino.
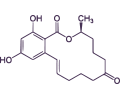
 DEOXINIVALENOL
DEOXINIVALENOL
El deoxinivalenol (DON), también conocido como vomitoxina debido a sus efectos eméticos tras la ingestión, es otra micotoxina producida por especies de Fusarium. Pertenece al grupo de los tricotecenos clase B y, a menudo, aparecen junto con la ZEN en ingredientes como el maíz, la avena, la cebada y el trigo.
La exposición aguda a DON también provoca dolor abdominal, salivación, diarrea, leucocitosis y hemorragia gastrointestinal (Oliveira et al., 2014).
El reto del diagnóstico de las micotoxicosis
Desde el descubrimiento de las aflatoxinas a principios de los años 60, la evaluación de los efectos negativos de las micotoxinas en los animales de producción se ha basado en la observación de signos y síntomas de intoxicación, incluyendo el empeoramiento de los parámetros productivos, junto con la información sobre la contaminación por micotoxinas del pienso y/o alimentos.
A pesar de la existencia de varios criterios de diagnóstico de la micotoxicosis, el enfoque clásico conlleva importantes limitaciones debido a la variabilidad en la susceptibilidad individual a las micotoxinas y a su distribución heterogénea en el pienso
BIOMARCADORES DE EXPOSICIÓN
Los biomarcadores de exposición se basan en la cuantificación de un compuesto específico, sus metabolitos o los productos de su interacción con un compartimento o fluido corporal, que sea indicativo de su presencia y la magnitud de la exposición al agente.El primer biomarcador de micotoxinas empleado en la producción animal fue la aflatoxina M1 (AFM1) en leche de animales en lactación alimentados con raciones contaminadas por aflatoxina B1 (AFB1), tal y como se muestra en la Figura 1.
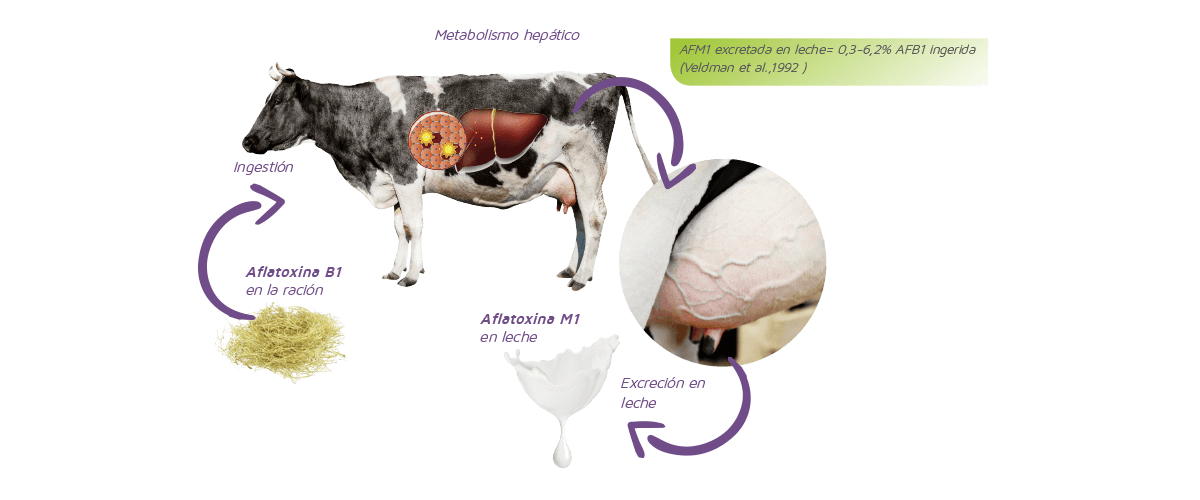
Figura 1. Ruta metabólica de la conversión de aflatoxina B1 conversión en aflatoxina M1 en vacas lecheras.
La información disponible sobre la toxicocinética de las micotoxinas en varios modelos animales sugiere que la exposición a las micotoxinas puede estimarse con precisión mediante biomarcadores presentes en varias muestras biológicas, especialmente en suero.
![]() La presencia del aducto aflatoxina B1-lisina (AFB1-lys) en suero, un producto de la digestión del complejo AFB1-albumina empleado en la biomonitorización de la exposición a aflatoxinas, ha demostrado ser un biomarcador específico de aflatoxicosis en broilers y lechones (Di Gregorio et al., 2017).
La presencia del aducto aflatoxina B1-lisina (AFB1-lys) en suero, un producto de la digestión del complejo AFB1-albumina empleado en la biomonitorización de la exposición a aflatoxinas, ha demostrado ser un biomarcador específico de aflatoxicosis en broilers y lechones (Di Gregorio et al., 2017).
![]() En el caso de la fumonisina B1 (FB1), los estudios experimentales indican que la FB1 en plasma y orina son buenos biomarcadores de exposición de cerdos a bajos niveles de FB1 en la dieta, aunque se recomiendan los niveles plasmáticos para evaluar la exposición prolongada (>14 días) (Souto et al., 2017).
En el caso de la fumonisina B1 (FB1), los estudios experimentales indican que la FB1 en plasma y orina son buenos biomarcadores de exposición de cerdos a bajos niveles de FB1 en la dieta, aunque se recomiendan los niveles plasmáticos para evaluar la exposición prolongada (>14 días) (Souto et al., 2017).
 CROMATOGRAFÍA LÍQUIDA ACOPLADA A ESPECTOMETRÍA DE MASAS TÁNDEM (LC-MS/MS)
CROMATOGRAFÍA LÍQUIDA ACOPLADA A ESPECTOMETRÍA DE MASAS TÁNDEM (LC-MS/MS)
En los últimos años, la cromatografía líquida acoplada a espectrometría de masas en tándem (LC-MS/MS) basado en el enfoque de análisis múltiple se ha introducido con éxito en el campo del análisis de micotoxinas, abriendo nuevas posibilidades para la evaluación de marcadores adecuados para las combinaciones de micotoxinas.

Biomarcadores para la evaluación de la exposición a micotoxinas en animales de producción
Un biomarcador ideal debe ser:
- ⇰ Especifico
- ⇰ Cuantificable
- ⇰ Detectable a bajos niveles
- ⇰ Obtenido mediante técnicas no invasivas y económicas

Estos atributos deberían determinarse para cada toxina potencial en base a sus características toxicocinéticas, lo que implica el estudio de la absorción, distribución, metabolismo/ biotransformación y excreción (ADME) de la toxina a lo largo del tiempo.
En función del perfil toxicocinético de una determinada micotoxina tras la ingestión, algunos biomarcadores pueden emplearse para estimar la magnitud y el nivel de exposición a través de la dieta mediante la cuantificación de sus metabolitos o los productos de interacción en los fluidos corporales.
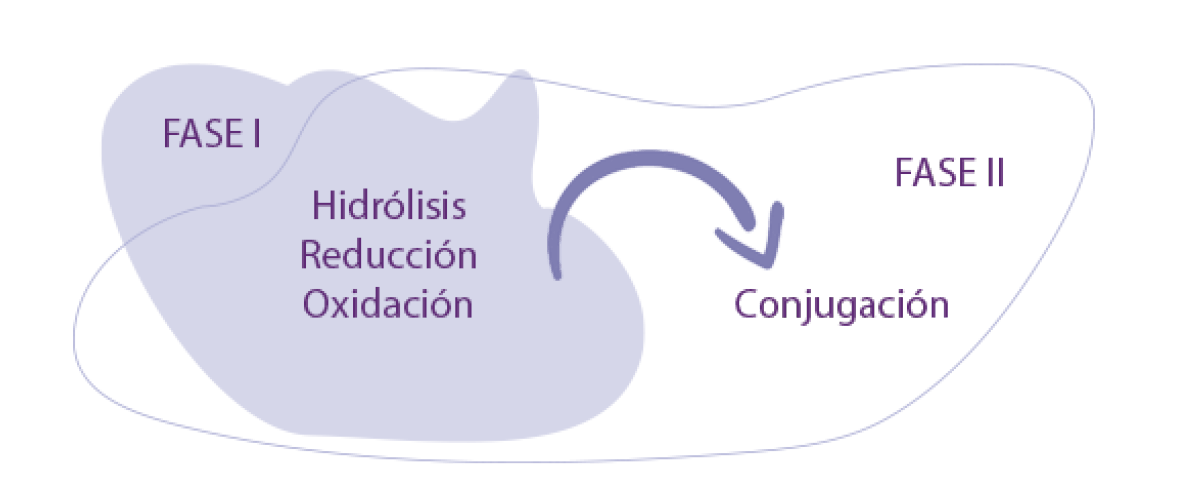
FASES DE LA BIOTRANSFORMACIÓN
En todas las especies, la biotransformación ocurre en dos fases:
- ⇰ Fase I, basada principalmente en reacciones de hidrólisis, reducción y oxidación.
- ⇰ Fase II, que incluye la conjugación de los productos formados en la Fase I.
PERFIL TOXICOCINÉTICO DE AFLATOXINA B1
En el caso de la AFB1, los metabolitos resultantes de la Fase I incluyen:
 Productos hidroxilados: AFM1 y aflatoxina Q1
Productos hidroxilados: AFM1 y aflatoxina Q1 Productos desmetilados: aflatoxina P1
Productos desmetilados: aflatoxina P1 Producto de la reducción mediante enzimas citoplasmáticas: aflatoxicol
Producto de la reducción mediante enzimas citoplasmáticas: aflatoxicol
Todos estos compuestos pueden excretarse en orina, bilis y heces (Oliveira et al., 2014). La tasa de excreción de AFM1 en leche de vaca oscila entre el 0,3% y el 6,2% de la AFB1 ingerida, en función de la fase de la lactación y el volumen de leche producido. En aves de corral, los principales productos de la biotransformación de la AFB1 son AFM1 y aflatoxicol, que pueden encontrarse en huevos.
Los enzimas del citocromo P450 del hígado también transforman la AFB1 en AFB1-8,9-epóxido, su forma procarcinógena que se encuentra unida covalentemente a los ácidos nucleicos, principalmente ADN (dando lugar al aducto AFB1- N7-guanina), y a la albúmina sérica -produciendo el aducto AFB1-lisina) (Di Gregorio et al., 2017).
En este contexto, la AFB1, sus aductos en suero sanguíneo (AFB1-lisina) y orina (AFB1- N7-guanina), así como el metabolito AFM1 en orina y leche, pueden considerarse como biomarcadores validos de exposición a AFB1.

PERFIL TOXICOCINÉTICO DE FUMONISINAS
Las fumonisinas son el grupo de micotoxinas descubierto más recientemente. Desde su aislamiento en 1988, se han asociado a enfermedades como la encefalomalacia equina y el edema pulmonar porcino.

La biodisponibilidad de la FB1 tras su ingestión normalmente es inferior al 6% en varias especies. Además, la FB1 tiene una corta vida media (<24 h), recuperándose menos el 2% en orina.
Sin embargo, se pueden encontrar residuos de FB1 en plasma y orina de cerdos que han recibido una dosis oral de 3,1-9,0 mg FB1/kg pienso, observándose una buena correlación entre los la FB1 ingerida y los niveles residuales en plasma u orina (Souto et al., 2017).
PERFIL TOXICOCINÉTICO DE ZEARALENONA
La zearalenona es un compuesto estrogénico derivado del ácido resorcílico, producido para especies de Fusarium, tales como F. roseum (F. graminearum), F. culmorum y F. equisetum, entre otros.
En los mamíferos, la zearalenona puede reducirse a sus análogos estereoisómeros hidroxi, α-zearalenol y β-zearalenol (α- y β-ZOL). También se puede formar un conjugado de ácido glucurónico, preferiblemente en el grupo 14-hidroxil fenólico.
PERFIL TOXICOCINÉTICO DE DON
Los tricotecenos, incluyendo el DON, se absorbe fácil y rápidamente a través del tracto gastrointestinal tras la exposición. Los estudios realizados en varias especies revelan una disponibilidad del DON del 50- 60%, lo que implica una absorción eficiente.
Un importante metabolito del DON es el deepoxi deoxinivalenol (DOM-I), producido por microorganismos del tracto intestinal de varias especies, especialmente en rumiantes. Además, el DON puede ser sulfonado o conjugado con acido glucurónico, dando lugar a deoxinivalenol glucurónido (DON-GlcA), y excretado en orina.
PERFIL TOXICOCINÉTICO DE OCRATOXINA
El grupo de las ocratoxinas incluye 7 toxinas relacionadas, aunque solamente se ha descrito la OTA como contaminante natural de los granos.
 Tras su ingestión, la OTA puede permanecer en el suero unido a proteínas, llegando a los riñones, los músculos y el hígado.
Tras su ingestión, la OTA puede permanecer en el suero unido a proteínas, llegando a los riñones, los músculos y el hígado. Tiene una alta capacidad de unión a proteínas plasmáticas (hasta el 99%), con una vida media plasmática estimada de 35 días (Dietrich et al., 2005).
Tiene una alta capacidad de unión a proteínas plasmáticas (hasta el 99%), con una vida media plasmática estimada de 35 días (Dietrich et al., 2005). También sufre una biotransformación por enzimas del citocromo P450 para dar metabolitos hidroxiocratoxina A, principalmente ocratoxina alfa (OTα).
También sufre una biotransformación por enzimas del citocromo P450 para dar metabolitos hidroxiocratoxina A, principalmente ocratoxina alfa (OTα).
Aplicación de biomarcadores de micotoxinas en producción animal
 DIAGNÓSTICO DIFERENCIAL DE MICOTOXICOSIS
DIAGNÓSTICO DIFERENCIAL DE MICOTOXICOSIS
En animales de producción, la primera aplicación importante de los biomarcadores de exposición a las micotoxinas es el diagnóstico diferencial de las micotoxicosis, ya que los signos y los síntomas de las distintas micotoxinas no son muy evidentes o característicos.
En condiciones ideales, el diagnóstico preliminar de una posible micotoxicosis podría confirmarse en base al nivel de metabolitos detectados en plasma u orina de los animales afectados.
Sin embargo, hasta la fecha se han llevado a cabo pocos estudios para determinar las curvas dosisrespuesta que relacionen los síntomas de las micotoxinas en los animales de producción con las concentraciones del biomarcador.
Por otro lado, el coste del análisis es un importante obstáculo para la aplicación rutinaria de los biomarcadores para confirmar el diagnóstico de la micotoxicosis, ya que requiere de equipos de laboratorio específicos y personal altamente cualificado para poder obtener resultados fiables.
 EVALUACIÓN DE LA EFICIENCA DE ADSORBENTES DE MICOTOXINAS
EVALUACIÓN DE LA EFICIENCA DE ADSORBENTES DE MICOTOXINAS
Una posible aplicación más atractiva de los biomarcadores de exposición a las micotoxinas en los animales de producción, y que podría tener una buena relación coste-beneficio, es la evaluación de la eficiencia de los adsorbentes empleados a gran escala para prevenir los efectos tóxicos de las micotoxinas.
El criterio más importante para la evaluación de un adsorbente es la estabilidad de la unión adsorbente-toxina en un amplio rango de pH, tal y como se espera que ocurra a lo largo del tracto gastrointestinal.
Dado que los adsorbentes varían ampliamente en cuanto a su composición y propiedades físicoquímicas, es necesario evaluar su eficacia mediante estudios in vitro e in vivo (Di Gregorio et al., 2014).
Sin embargo, los protocolos in vivo suelen ser costosos y laboriosos, ya que requieren la administración de distintos niveles de toxinas, con y sin el adsorbente, para poder evaluar su efecto sobre la productividad.
Además, estos estudios requieren la recopilación de datos histopatológicos y clínicos, entre otros problemas, lo que aumenta el coste y el trabajo involucrado (European Food Safety Authority, 2010).
EMPLEO DE AFM1 PARA EVALUAR LA EFICIENCIA DE ADSORBENTES
El primer biomarcador empleado para evaluar la eficiencia de los adsorbentes probablemente fue la AFM1 en leche de vaca.
![]() Un buen ejemplo de este tipo de enfoque fue el estudio realizado por Diaz et al. (2004) en el que la concentración de AFM1 en leche de vacas alimentadas con cuatro tipos diferentes de adsorbentes comerciales y 55 μg/kg AFB1 se redujo en un 31-65%.
Un buen ejemplo de este tipo de enfoque fue el estudio realizado por Diaz et al. (2004) en el que la concentración de AFM1 en leche de vacas alimentadas con cuatro tipos diferentes de adsorbentes comerciales y 55 μg/kg AFB1 se redujo en un 31-65%.
![]() Edrington et al. (1996) emplearon tres tipos de adsorbentes (Silicato de aluminio calcio y sodio hidratado -HSCAS-, carbón activado y HSCAS ácido) en el pienso de pavos colostomizados e intoxicados con 0,75 mg/ kg de AFB1. Se observó una reducción de la excreción urinaria de AFM1 en un 52-72% 48 horas después de la ingestión del pienso contaminado.
Edrington et al. (1996) emplearon tres tipos de adsorbentes (Silicato de aluminio calcio y sodio hidratado -HSCAS-, carbón activado y HSCAS ácido) en el pienso de pavos colostomizados e intoxicados con 0,75 mg/ kg de AFB1. Se observó una reducción de la excreción urinaria de AFM1 en un 52-72% 48 horas después de la ingestión del pienso contaminado.
EMPLEO DE AFB1-LISINA PARA EVALUAR LA EFICACIA DE ADSORBENTES
Carão (2016) y Di Gregorio et al. (2017) evaluaron la eficiencia de adsorbentes comerciales basados en HSCAS, empleando como biomarcador el aducto AFB1-lisina en el suero de broilers y cerdos alimentados con dietas con 500 y 1.100 μg/kg de AFB1.
![]() En cerdos, el HSCAS redujo los niveles de AFB1-lisina en un 53-72% entre los días 7 y 21 de exposición continua a pienso contaminado (Di Gregorio et al., 2017).
En cerdos, el HSCAS redujo los niveles de AFB1-lisina en un 53-72% entre los días 7 y 21 de exposición continua a pienso contaminado (Di Gregorio et al., 2017).
![]() Sin embargo, el mismo adsorbente comercial empleado en broilers no produjo resultados satisfactorios en la reducción de los efectos tóxicos de la AFB1 (Carão, 2016), ya que no hubo una reducción en la concentración de AFB1-lisina en el suero de las aves intoxicadas.
Sin embargo, el mismo adsorbente comercial empleado en broilers no produjo resultados satisfactorios en la reducción de los efectos tóxicos de la AFB1 (Carão, 2016), ya que no hubo una reducción en la concentración de AFB1-lisina en el suero de las aves intoxicadas.
Estos resultados demuestran la potencial utilidad de la AFB1-lisina como biomarcador específico de AFB1 para la evaluación de la eficacia de las intervenciones químicas de protección en cerdos y broilers.
VENTAJAS DEL USO DE LA AFB1-LISINA EN SUERO PARA LA EVALUACIÓN DE LOS ADSORBENTES DE AFLATOXINAS:
 Mayor precisión gracias a la evaluación de la exposición a nivel individual.
Mayor precisión gracias a la evaluación de la exposición a nivel individual. Menor coste de los estudios in vivo al necesitarse menor número de animales en los análisis de laboratorio.
Menor coste de los estudios in vivo al necesitarse menor número de animales en los análisis de laboratorio. La posibilidad de obtener resultados en con mayor rapidez. (Di Gregorio et al., 2017)
La posibilidad de obtener resultados en con mayor rapidez. (Di Gregorio et al., 2017)
En la Figura 2 se muestra un resumen del procedimiento para la evaluación de la eficiencia de los adsorbentes empleando el aducto AFB1-lisina.
Sin embargo, una importante limitación del análisis rutinario del aducto AFB1-lisina es la necesidad de establecer unos estándares de referencia que aún no están disponibles comercialmente (Jager et al., 2016) pero que podrían ser sintetizados en laboratorios especializados (Sass et al., 2014).
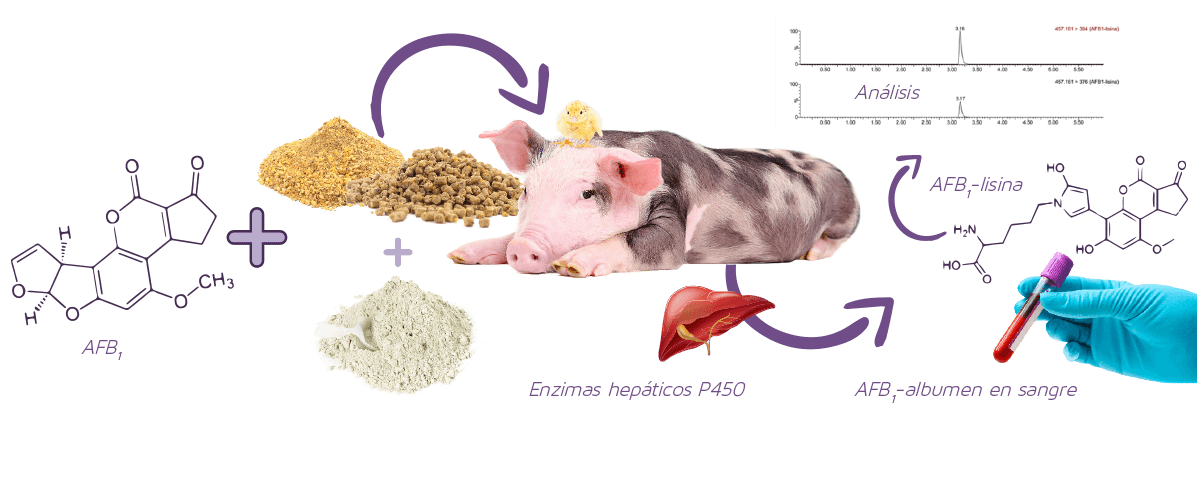 Figura 2. Resumen de los procedimientos implicados en la evaluación de la eficiencia de los adsorbentes mediante la medición del aducto AFB1-lisina en suero de animales de granja
Figura 2. Resumen de los procedimientos implicados en la evaluación de la eficiencia de los adsorbentes mediante la medición del aducto AFB1-lisina en suero de animales de granja
Biomarcadores de exposición a múltiples micotoxinas en la dieta
Recientemente, la cromatografía líquida acoplada a espectrometría de masas en tándem (LC-MS/MS) centrado en el análisis de múltiples analitos se ha implementado en el análisis de micotoxinas, incluyendo la evaluación de biomarcadores adecuados para la determinación de la exposición de las personas.
El desarrollo de nuevas técnicas ha sido importante en lo que respecta a los biomarcadores de múltiples micotoxinas, permitiendo:
- ⇰ La obtención de datos más realistas sobre la exposición, ya que en condiciones reales los individuos son expuestos a una mezcla de micotoxinas.
- ⇰ La posible evaluación de riesgos para un conjunto de micotoxinas y los posibles efectos de su interacción.
No obstante, la preparación de las muestras continúa siendo un reto desde el punto de vista del desarrollo de métodos de análisis de múltiples micotoxinas debido a la existencia del efecto matriz y un amplio rango de propiedades químicas de las micotoxinas y sus metabolitos.
Hoy en día, la cromatografía líquida acoplada a espectrometría de masas en tándem (LC-MS/MS), en combinación con una fuente de ionización en electrospray (ESI) es, sin duda, la herramienta de análisis más eficaz para la determinación cuantitativa y cualitativa de micotoxinas en muestras naturales.
Concretamente, el uso de LC-MS/MS permite aumentar la sensibilidad y selectividad analítica, ya que los métodos basados en MS/MS emplean información sobre el ion molecular de un determinado analito y de sus productos iónicos, ofreciendo un elevado nivel de confianza para la identificación del analito diana.
Los espectrómetros de masas modernos son cada vez más versátiles en lo que respecta a las posibles combinaciones en un único dispositivo, distintas fuentes de ionización y diferentes analizadores. La mayor ventaja de los equipos existentes es que permite refinar los métodos de análisis, posibilitando el análisis de un rango más amplio de moléculas en un único dispositivo.
En este contexto, se han desarrollado métodos analíticos para la determinación de varias micotoxinas en plasma de cerdo (Devreese et al. 2012). Sin embargo, la influencia del efecto matriz es el mayor reto a la hora de desarrollar métodos cuantitativos multianalitos. Por ello, se están invirtiendo grandes esfuerzos para obtener resultados precisos, especialmente la inclusión de un paso de limpieza de la muestra (p. ej., empleando QuEChERS) y la compensación de la supresión/ potenciación de la señal mediante el uso de estándares ajustados a la matriz.
Los biomarcadores son una herramienta útil para la evaluación de la exposición a micotoxinas, ya que permiten confirmar el diagnóstico de las micotoxicosis y la identificación individual de animales que están en riesgo pero que no muestran signos de intoxicación.
El empleo de biomarcadores séricos para la estimación de la biodisponibilidad de micotoxinas en estudios in vivo de la eficacia de adsorbentes parece prometedor, al reducir el coste de los ensayos, especialmente en el caso de la AFB1 y FB1, y posiblemente para DON.
Sin embargo, será necesario realizar más estudios de validación que proporcionen información de base fisiológica en animales de producción sobre la toxicocinética de los biomarcadores séricos de micotoxinas combinadas.
 REFERENCIAS
REFERENCIAS
Carão, A. C. P. Determinação de biomarcadores de aflatoxina B1e aplicabilidade na avaliação de adsorventes em frangos de corte. 2016.145 f. Tese (Doutorado) – Faculdade de Medicina Veterinária e Zootecnia, Universidade de São Paulo, Pirassununga, 2016.
Devreese, M., De Baere, S., De Backer, P., Croubels, S., 2012. Quantitative determination of several toxicological important mycotoxins in pig plasma using multi-mycotoxin and analyte-specific high performance liquid chromatography-tandem mass spectrometric methods. J. Chromatogr. 1257, 74-80.
Diaz D. E. et al. Aflatoxin binders II: reduction of aflatoxin M1 in milk by sequestering agents of cows consuming aflatoxin in feed . Mycopathologia, n. 157, p. 233-241, 2004.
Dietrich, D.R., Heussner, A.H., and O’Brien, E. (2005). Ochratoxin A: comparative pharmacokinetics and toxicological implications (experimental and domestic animals and humans). Food Additives and Contaminants, 22, 45–52.
Di Gregorio, M.C.; Jager, A.V.; Souto, P.C.M.C.; Costa, A.A.; Rottinghaus, G.E.; Passarelli, D.; Budiño, F.H.L.; Corassin, C.H.; Oliveira, C.A.F. (2017) Determination of serum aflatoxin B1-lysine to evaluate the efficacy of an aflatoxin adsorbing feed additive in pigs fed an aflatoxin B1-contaminated diet. Mycotoxin Research, 33:93-102.
Di Gregorio, M.C.; Neeff, D.V.; Jager, A.V.; Corassin, C.H.; Carão, A.C.P.; Albuquerque, R.; Azevedo, A.C.; Oliveira, C.A.F. (2014) Mineral adsorbents for prevention of mycotoxins in animal feeds. Toxin Reviews, 33:1-11.
Edrington, T. S. et al. Hydrated sodium calcium aluminosilicate (HSCAS), acidic HSCAS, and activated charcoal reduce urinary excretion of aflatoxin M, in turkey poults. Lack of effect by activated charcoal on aflatoxicosis. Toxicology Letters, n. 89, p. 115-122, 1996.
European Food Safety Authority (2010) Statement on the establishment of guidelines for the assessment of additives from the functional group “substances for reduction of the contamination of feed by mycotoxins”. EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA J 8:1–8.
Gambacorta, M.S, Visconti, M., Powers, S., Cossalter, A.M, Pinton, P., Oswald, I.P., 2013. Validation study on urinary biomarkers of exposure for aflatoxins B1, ochratoxin A, fumonisin B1, deoxynivalenol and zearalenone in piglets. World Mycotoxin J. 6, 299-308.
Gonçalves, B.L.; Gonçalves, J.L.; Rosim, R.E.; Cappato, L.P.; Cruz, A.G.; Oliveira, C.A.F.; Corassin C.H. (2017) Effects of different sources of Saccaromyces cerevisae biomass on milk production, composition, and aflatoxin M1 excretion in milk from dairy cows fed aflatoxin B1. Journal of Dairy Science, 11:5701-5708.
Jager, A. V., Tonin, F. G., Baptista, G. Z., Souto, P. C., & Oliveira, C. A. (2016). Assessment of aflatoxin exposure using serum and urinary biomarkers in São Paulo, Brazil: a pilot study. International Journal of Hygiene and Environmental Health, 219, 294-300.
Nagl, V.; Schatzmayr, G. (2015). Deoxynivalenol and its masked forms in food and feed. Curr. Opin. Food Sci., 5, 43–49.
Oliveira, C.A.F.; Corassin, C.H.; Corrêa, B.; Oswald, I.P. (2014) Animal Health: Mycotoxins. In: Encyclopedia of Agriculture and Food Systems, 2nd Edition. Oxford, UK: Elsevier Limited, pp. 358-377.
Queiroz, O. C. M. et al. Effect of adding a mycotoxin-sequestering agent on milk aflatoxin M1 concentration and the performance and immune response of dairy cattle fed an aflatoxin B1-contaminated diet. Journal of Dairy Science, n. 95 , p. 5901-8, 2012.
Sass, D.C.; Jager, A.V.; Tonin, F.G.; Rosim, R.E.; Constantino, M.G.; Oliveira, C.A.F. (2015) Synthesis and purification of the aflatoxin B1-lysine adduct. Toxin Reviews, 34:53-59.
Souto, P.C.M.C.; Jager, A.V.; Tonin, F.G.; Petta, T.; Di Gregorio, M.C.; Cossalter, A.M.; Pinton, P.; Oswald, I.O.; Rottinghaus, G.E.; Oliveira, C.A.F. (2017) Determination of fumonisin B1 levels in body fluids and hair from piglets fed fumonisin B1–contaminated diets. Food and Chemical Toxicology, 108:1-9.
Xiong, J. L. et al. Transfer of dietary aflatoxin B1 to milk aflatoxin M1 and effect of inclusion of adsorbent in the diet of dairy cows. J Dairy Sci, n. 98, p. 2545-2554, 2015. 13




 Prevención de micotoxicosis
Prevención de micotoxicosis