L. Gámiz-Gracia1, N. Arroyo-Manzanares2, V. Rodríguez-Estévez3 y A.M. García-Campaña1
1Departamento de Química Analítica, Facultad de Ciencias, Universidad de Granada.
2Departamento de Química Analítica, Facultad de Química, Universidad de Murcia.
3Departamento de Producción Animal, Facultad de Veterinaria, Universidad de Córdoba.
Las micotoxinas son toxinas fúngicas producidas por varios centenares de especies de mohos que pueden crecer sobre las cosechas o alimentos en determinadas condiciones. Las más importantes son las producidas por mohos de los géneros Aspergillus, Fusarium y Penicillium.

 Las micotoxinas se han convertido en uno de los contaminantes más reportados a nivel mundial, hecho que aparece reflejado en los últimos informes del Sistema de Alertas Rápidas de la UE (Rapid Alert System for Food and Feed, RASFF)1. Las micotoxinas se han convertido en uno de los contaminantes más reportados a nivel mundial, hecho que aparece reflejado en los últimos informes del Sistema de Alertas Rápidas de la UE (Rapid Alert System for Food and Feed, RASFF)1. |
⇰ Cabe destacar que, a pesar de los conocimientos actuales y de las mejoras en las prácticas de producción y almacenamiento, no se ha podido erradicar el desarrollo de los hongos y mohos, por tanto, se encuentran micotoxinas en gran cantidad de alimentos.
Según la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), se estima que el 25% de la producción de cereales y el 20% de la de plantas a nivel mundial están afectadas por micotoxinas, aunque recientes estudios consideran que esta cifra podría estar subestimada2.
 ⇰ Además, los efectos del cambio climático hacen prever un aumento de la producción de hongos toxigénicos en los próximos años3.
⇰ Además, los efectos del cambio climático hacen prever un aumento de la producción de hongos toxigénicos en los próximos años3.
A pesar de la gran variedad de micotoxinas conocidas con diversos efectos toxicológicos, la UE ha fijado niveles máximos permitidos o recomendaciones únicamente para 14 de ellas (aflatoxinas B1, B2, G1, G2 y M1, ocratoxina A, patulina, deoxinivalenol, zearalenona, fumonisinas B1 y B2, toxinas T-2 y HT-2, citrinina), así como para los esclerocios de cornezuelo de centeno, en diversos alimentos destinados para consumo humano4,5.
⇰ En el caso de alimentación animal, el número de micotoxinas con niveles máximos permitidos o recomendados es aún menor, limitándose a la aflatoxina B1, ocratoxina A, deoxinivalenol, zearalenona, fumonisinas B1 y B2, toxinas T-2 y HT-2, y los esclerocios de cornezuelo de centeno6,7.


 Entre los animales de granja, el cerdo es considerado como una de las especies más vulnerables a los efectos de las micotoxinas. Entre los animales de granja, el cerdo es considerado como una de las especies más vulnerables a los efectos de las micotoxinas. |
⇰ Dichos efectos pueden abarcar cambios en la respuesta inmunitaria (dando como resultado una reducción en la eficacia de la vacunación), pérdida de apetito, abortos, agalactia, etc.
En la Tabla 1 se presenta un resumen de las micotoxinas reguladas en la legislación europea en alimentos para cerdos, sus límites permitidos o recomendados, así como sus efectos en la salud más comunes.
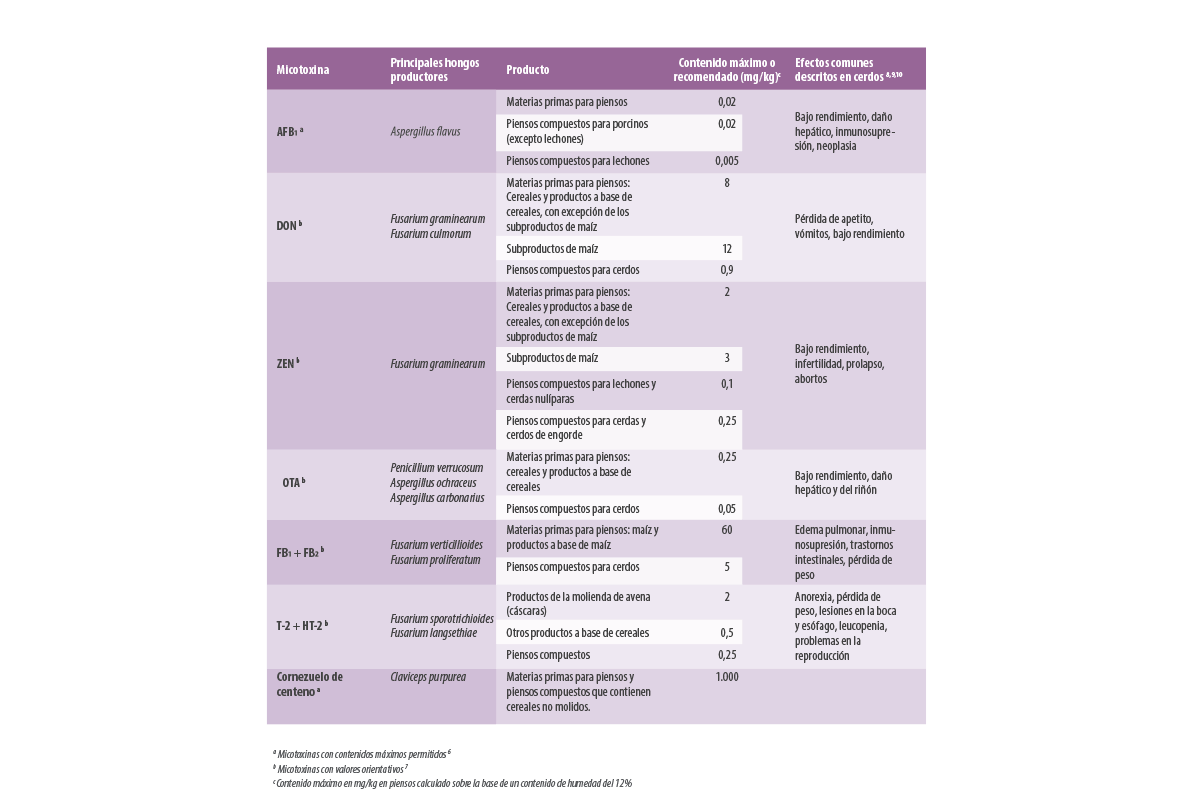
Tabla 1. Valores máximos permitidos o recomendados en alimentación para ganado porcino.
Los alcaloides ergóticos, conocidos desde la antigüedad por sus efectos tóxicos, no están incluidos en legislación (únicamente hay un contenido máximo para el cornezuelo de centeno, recogido en la Tabla 1), aunque también suponen un riesgo para el ganado y se prevé que en un futuro próximo se establezcan contenidos máximos para estos compuestos.
La mirada puesta en las micotoxinas emergentes
Además de las micotoxinas incluidas en la Tabla 1, existen otras micotoxinas que actualmente se encuentran bajo estudio por ser potencialmente tóxicas y para las que aún no se han establecido niveles máximos permitidos.
Son las llamadas “micotoxinas emergentes”, entre las que se incluyen algunas producidas por hongos del género Fusarium, como eniatinas y beauvericina, que colonizan sobre todo cereales y que se pueden acumular en el grano11.
En los siguientes apartados se profundiza sobre estos grupos de micotoxinas.

ALCALOIDES ERGÓTICOS
Los alcaloides ergóticos, o alcaloides del cornezuelo del centeno, llamados así por el espolón o “cuerno” que produce el hongo en el grano al crecer, son producidos por diferentes hongos de los órdenes Hypocreales y Eurotiales, siendo Claviceps purpurea el más extendido en Europa.
⇰ Este hongo infecta a granos de diversos cereales como centeno, trigo, cebada, mijo y avena, frecuentemente empleados en alimentación animal.
La toxicidad de los alcaloides ergóticos se conoce desde la Edad Media, ya que generó las epidemias conocidas como “fuego de San Antonio” o ergotismo y, aunque se considera una enfermedad erradicada en humanos, en las últimas décadas se han descrito brotes esporádicos de ergotismo en ganado12,13.
Esta enfermedad puede generar síntomas distintos que dependen de la especie en cuestión. Así, en los cerdos los alcaloides ergóticos pueden provocar bajo rendimiento, pérdida de apetito, agalactia, problemas reproductivos, mortalidad neonatal, daños en el hígado y gangrena13-16. Esta gran variedad de síntomas dificulta la identificación del problema.


Hasta la fecha se han descrito más de 50 alcaloides ergóticos diferentes que presentan como estructura común el anillo de ergolina (Figura 1).
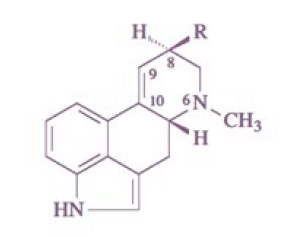
Figura 1. Anillo de ergolina de la estructura básica de los alcaloides ergóticos.
Se recomienda la monitorización de seis alcaloides ergóticos por ser los más comunes (ergometrina, ergotamina, ergosina, ergocristina, ergocriptina, ergocornina) y sus correspondientes epímeros (ergometrinina, ergotaminina, ergosinina, ergocristinina, ergocriptinina, ergocorninina).
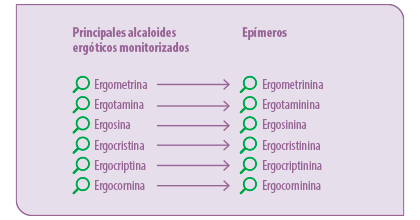
Mientras que los isómeros C8-(R) son biológicamente activos, los epímeros C8-(S) se consideran con escasa o nula actividad.
|
|

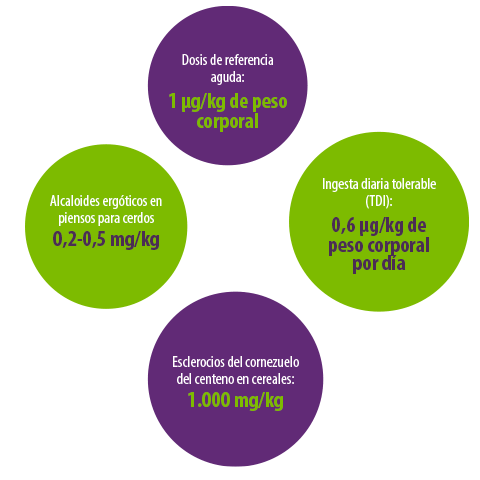
Actualmente los niveles máximos permitidos para los alcaloides ergóticos están bajo estudio, aunque la industria recomienda niveles máximos en piensos para cerdos entre 0,2-0,5 mg/kg20.
⇰ No obstante, algunos estudios sugieren que valores inferiores consumidos durante periodos prolongados de tiempo podrían provocar daños intestinales y hepáticos21.
 La Autoridad Europea de Seguridad Alimentaria (EFSA) ha señalado recientemente la necesidad de recopilar más información sobre la presencia de estos alcaloides y de desarrollar métodos analíticos para su control.
La Autoridad Europea de Seguridad Alimentaria (EFSA) ha señalado recientemente la necesidad de recopilar más información sobre la presencia de estos alcaloides y de desarrollar métodos analíticos para su control.
Mientras tanto, basándose en los datos disponibles y para evitar los efectos vasoconstrictores de los alcaloides ergóticos en el ganado, se ha estimado una dosis de referencia aguda de 1 μg/kg de peso corporal y una ingesta diaria tolerable (TDI) de 0,6 μg/kg de peso corporal por día22. Además, y como medida de precaución, la UE ha establecido un nivel máximo para los esclerocios del cornezuelo del centeno en cereales de 1.000 mg/kg6.
ENIATINAS Y BEAUVERICINA
ENIATINAS
Las eniatinas son producidas por hongos del género Fusarium, como F. avenaceum, F. oxysporum, F. poae o F. tricinctum, y presentan estructura de hexadepsipeptidos cíclicos que alternan ácidos D-α- hidroxiisovaléricos y N- metil-L-aminoácidos.
⇰ Los residuos de aminoácidos de las eniatinas de tipo A y B, son N-metil-valina alifática o N-metilisoleucina, o mezclas de estos aminoácidos.
Se conocen hasta 29 eniatinas diferentes, siendo las eniatinas A, A1, B y B1 las más estudiadas, especialmente en cereales y productos derivados.
BEAUVERICINA
La beauvericina es producida por Fusarium proliferatum, F. subglutinanos, F. verticillioides y F. oxysporum, y presenta una estructura relacionada con la de las eniatinas, aunque a diferencia de estas, los tres residuos de aminoácidos son N-metil-fenilalaninas aromáticas.
La estructura de las principales eniatinas y de la beauvericina se muestra en la Figura 2.
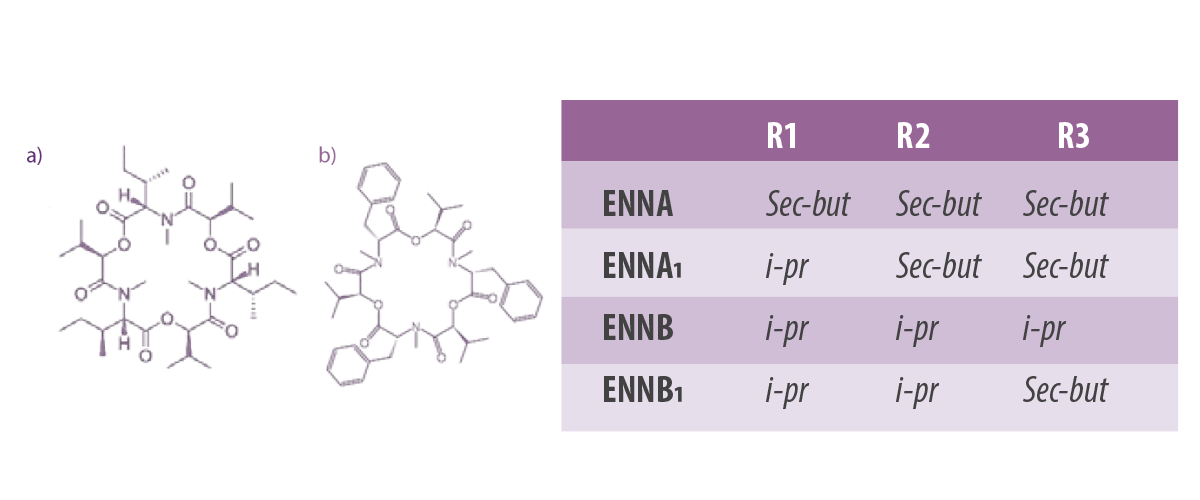
Figura 2. Estructura química de las principales eniatinas (ENN) (a) y beauvericina (b).

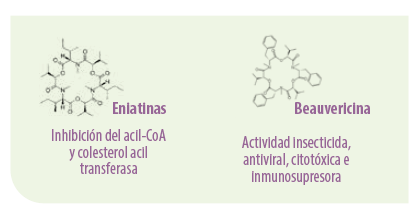
Las eniatinas actúan como inhibidores del enzima acil-CoA y colesterol acil transferasa11,23.
Al igual que las eniatinas, la beauvericina facilita el transporte de cationes mono o divalentes a través de la membrana celular, alterando las concentraciones fisiológicas normales de estos iones.
⇰ Así, la beauvericina tiene propiedades insecticidas capaces de inducir apoptosis en células de mamíferos. Además, presenta actividad antiviral, citotóxica e inmunosupresora23-25.
| A pesar de que los estudios in vitro han evidenciado la toxicidad de estas micotoxinas (mostrando sus posibles efectos genotóxicos y sobre el sistema reproductivo), aún no existen suficientes evidencias de su toxicidad in vivo26.
Por ello, la EFSA emitió una opinión científica sobre la necesidad de recolectar más datos toxicológicos producidos por la exposición crónica a estos compuestos, concluyendo además que es necesario contar con más datos sobre la presencia simultánea de eniatinas y beauvericina con otras toxinas de Fusarium, así como estudiar sus posibles efectos combinados27. Algunos estudios recientes han demostrado la citotoxicidad de estos compuestos en estudios in vitro, empleando la línea celular epitelial intestinal porcina IPEC-J2, siendo la beauvericina la micotoxina con una mayor biodisponibilidad28. La presencia de eniatinas y beauvericina en cereales ha sido ampliamente documentada a través de diversos estudios que han revelado la gran incidencia de estos compuestos, en ocasiones en concentraciones del orden de los mg/kg29-32. |
Caso de estudio
Presencia de 31 micotoxinas en alimentos para cerdos
Nuestro grupo de investigación llevó a cabo el análisis de 228 muestras de alimento para cerdos para determinar la presencia de 31 micotoxinas:
 Micotoxinas con límites permitidos o recomendados: aflatoxinas B1, B2, G1 y G2, ocratoxina A, deoxinivalenol, zearalenona, fumonisinas B1 y B2, y toxinas T-2 y HT-2
Micotoxinas con límites permitidos o recomendados: aflatoxinas B1, B2, G1 y G2, ocratoxina A, deoxinivalenol, zearalenona, fumonisinas B1 y B2, y toxinas T-2 y HT-2 Eniatinas (B, B1, A y A1)
Eniatinas (B, B1, A y A1) Beauvericina
Beauvericina 12 alcaloides ergóticos más comunes
12 alcaloides ergóticos más comunes Otras micotoxinas consideradas de interés: citrinina, fusarenon X y esterigmatocistina
Otras micotoxinas consideradas de interés: citrinina, fusarenon X y esterigmatocistina
Los resultados fueron publicados en dos artículos de investigación33,34.

Las muestras (2 muestras de maíz en grano y 226 muestras de pienso, de las cuales 183 eran harinas y 43 pellet) fueron obtenidas en granjas y fábricas de toda España entre febrero y agosto de 2017 e incluían:
|
 Las micotoxinas fueron extraídas de la matriz mediante extracción sólido-líquido, mientras que para el análisis se empleó la cromatografía de líquidos con un detector de fluorescencia (LC-FLD) para las aflatoxinas, y cromatografía de líquidos acoplada a espectrometría de masas en tándem (LC-MS/ MS) para el resto de micotoxinas.
Las micotoxinas fueron extraídas de la matriz mediante extracción sólido-líquido, mientras que para el análisis se empleó la cromatografía de líquidos con un detector de fluorescencia (LC-FLD) para las aflatoxinas, y cromatografía de líquidos acoplada a espectrometría de masas en tándem (LC-MS/ MS) para el resto de micotoxinas.
| Cabe mencionar que la LC-MS/ MS permite la determinación de un número elevado de compuestos con buena sensibilidad, selectividad y un poder de confirmación que la han convertido en una herramienta imprescindible para la determinación multi-micotoxinas35. |
En la Figura 3 y la Tabla 2 se presenta un resumen de los datos obtenidos.
Las micotoxinas más frecuentes fueron:
- ⇰ Eniatina B (100% de las muestras)
- ⇰ Eniatina B1 (83,3% de las muestras)
- ⇰ Eniatina A1 (73,2% de las muestras)
- ⇰ Beauvericina (98,2% de las muestras)
- ⇰ Fumonisina B1 (66,2% de las muestras)
Por el contrario, la aflatoxina G2 y los alcaloides ergóticos: ergotaminina, ergocorninina, ergocristina, ergocriptina y ergocriptinina no fueron detectados en ninguna muestra.
En cuanto a los niveles encontrados, las concentraciones más altas se registraron para la zearalenona (7.681 μg/kg), fumonisina B1 (3.959 μg/ kg) y eniatina B (1.222 μg/kg).
 Todas las muestras cumplían con los requisitos sobre niveles máximos permitidos o recomendados para la aflatoxina B1, ocratoxina A, fumonisinas B1+B2, toxinas T-2 y HT-2, deoxinivalenol y suma de los doce alcaloides ergóticos. Todas las muestras cumplían con los requisitos sobre niveles máximos permitidos o recomendados para la aflatoxina B1, ocratoxina A, fumonisinas B1+B2, toxinas T-2 y HT-2, deoxinivalenol y suma de los doce alcaloides ergóticos. |
Sin embargo, algunas muestras (3,1%) presentaron concentraciones de zearalenona por encima del nivel recomendado:
- ⇰ 1 muestra de maíz (7.681 μg/kg)
- ⇰ 5 muestras de pienso para lechones (concentraciones entre 125 y 956 μg/kg)
- ⇰ 1 pienso para cerdos de engorde (290 μg/kg)
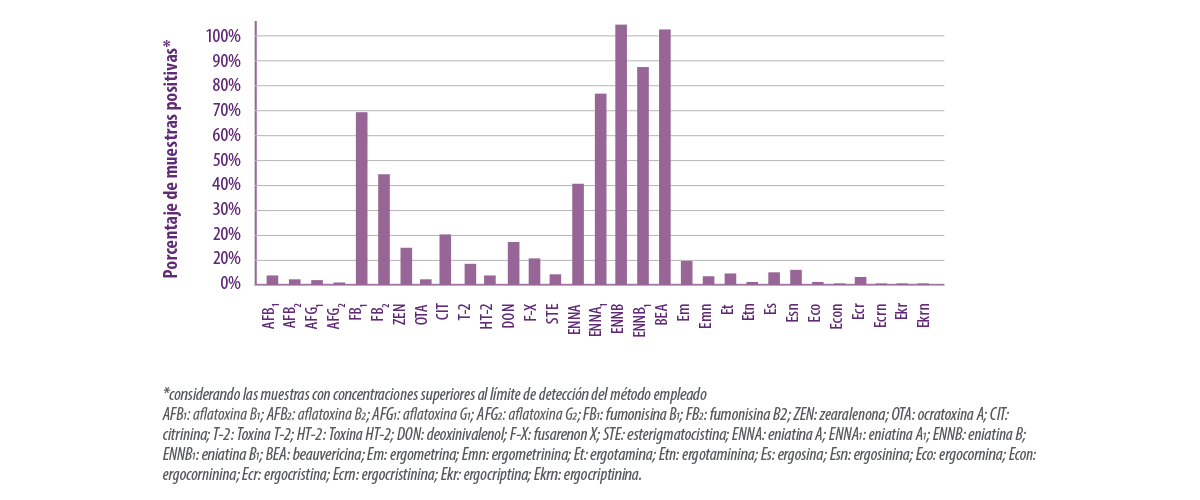
Figura 3. Incidencia de las micotoxinas encontradas en 228 muestras de alimento para cerdos.
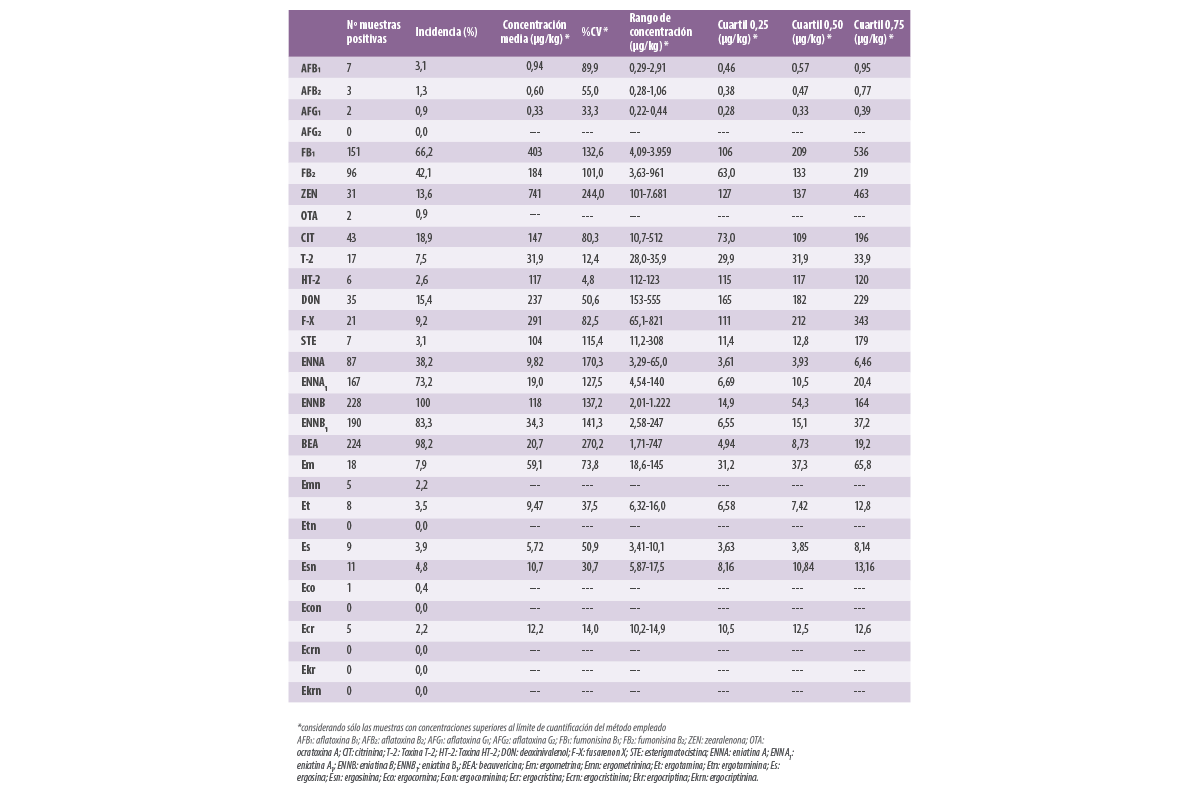
Tabla 2. Resumen de los resultados obtenidos en la determinación de 31 micotoxinas en 228 muestras de alimento para cerdos.
CO-OCURRENCIA DE MICOTOXINAS
En cuanto a la presencia de varias micotoxinas en la misma muestra (considerando únicamente aquellas micotoxinas presentes a concentraciones superiores al límite de detección del método), se puede resumir en:
 2-3 micotoxinas: 9,2%
2-3 micotoxinas: 9,2% 4 micotoxinas: 16,7%
4 micotoxinas: 16,7% 5 micotoxinas: 16,7%
5 micotoxinas: 16,7% 6 micotoxinas: 16,2%
6 micotoxinas: 16,2% 7 micotoxinas: 18,9%
7 micotoxinas: 18,9% 8 micotoxinas: 13,2%
8 micotoxinas: 13,2% 9-13 micotoxinas: 9,2%
9-13 micotoxinas: 9,2%
En la Figura 4 se representan los resultados obtenidos.
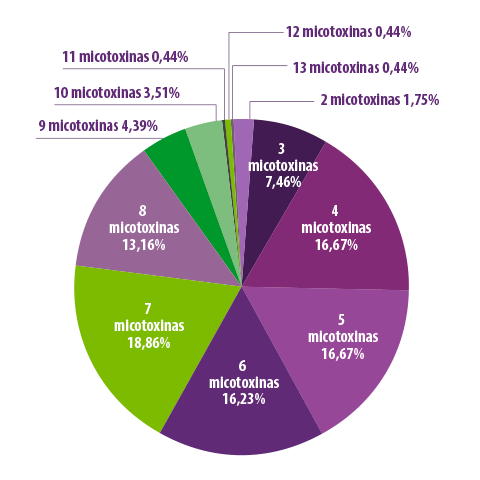
Figura 4. Presencia de varias micotoxinas en una misma muestra de alimento para cerdos.
CONCLUSIONES
De las 228 muestras analizadas, sólo 7 presentaron niveles por encima de los permitidos para zearalenona.
Igualmente, hay que destacar la baja incidencia de alcaloides ergóticos, que podría explicarse por estar muchos de los piensos elaborados a base de maíz, cereal poco susceptible a la contaminación por Claviceps purpurea.
 Por otro lado, también hay que destacar la elevada incidencia de micotoxinas emergentes, en particular de eniatina B (100% de las muestras), eniatina B1 (83,3%), eniatina A1 (73,2%) y beauvericina (98,2%), no incluidas en la legislación actualmente, pero con evidencias de toxicidad para cerdos.
Por otro lado, también hay que destacar la elevada incidencia de micotoxinas emergentes, en particular de eniatina B (100% de las muestras), eniatina B1 (83,3%), eniatina A1 (73,2%) y beauvericina (98,2%), no incluidas en la legislación actualmente, pero con evidencias de toxicidad para cerdos.
| Un aspecto importante a tener en cuenta es la presencia simultánea de distintas micotoxinas en una misma muestra (hasta 13 micotoxinas), dada la posible interrelación entre las distintas micotoxinas consumidas conjuntamente, que pueden presentar efectos aditivos, sinérgicos, potenciados o antagonistas sobre la salud. |
Estos efectos no se pueden predecir a partir de los efectos individuales de las micotoxinas. Además, hay dependencia de la dosis, especie y toxina, e incluso de los propios factores ligados a la metodología experimental empleada en su estudio.
No obstante, dada la importancia de este tema y, teniendo en cuenta que, en el análisis de riesgos, los niveles máximos permitidos o recomendados y TDI se fijan de acuerdo a los efectos individuales de cada micotoxina, estos valores deberían revisarse teniendo en cuenta estos posibles efectos y el riesgo potencial a una exposición crónica a múltiples micotoxinas, incluso si se encuentran a niveles inferiores a los permitidos36,37,38.
REFERENCIAS
1. Rapid Alert System for Food and Feed (RASFF). https://ec.europa.eu/food/safety/rasff/portal_en
2. Eskola M, Kos G, Elliott CT, Hajšlová J, Mayar S, Krskay R. Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’ of 25%. Crit. Rev. Food Sci. Nutr. 60 (2020) 2773-2789. Doi:10.1080/10408398.2019.1658570
3. Moretti A, Pascale M, Logrieco AF. Mycotoxin risks under a climate change scenario in Europe. Trends Food Sci. Technol. 84 (2019) 38-40. Doi:10.1016/j.tifs.2018.03.008
4. Reglamento (CE) nº 1881/2006 de la Comisión, de 19 de diciembre de 2006, por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios. DOUE nº L364/5 del 21/12/2006
5. Recomendación de la Comisión de 27 de marzo de 2013 sobre la presencia de las toxinas T-2 y HT-2 en los cereales y los productos a base de cereales. DOUE nº L91/12 del 03/04/2013
6. Directiva 2002/32/CE del Parlamento Europeo y del Consejo, de 7 de mayo de 2002, sobre sustancias indeseables en la alimentación animal. DOUE nº L 140 del 30/04/2002
7. Recomendación de la Comisión de 17 de agosto de 2006 sobre la presencia de deoxinivalenol, zearalenona, ocratoxina A, toxinas T-2 y HT-2 y fumonisinas en productos destinados a la alimentación animal. DOUE nº L229 del 23/08/2006
8. Muratori Holanda D, Woo Kim S. Mycotoxin occurrence, toxicity, and detoxifying agents in pig production with an emphasis on deoxinivalenol. Toxins 12 (2021) 171. Doi:10.3390/toxins13020171
9. Yanga C, Songa G, Lim W. Effects of mycotoxin-contaminated feed on farm animals. Journal of Hazardous Materials 389 (2020) 122087. Doi:10.1016/j.jhazmat.2020.122087
10. Bertero A, Moretti A, Spicer LJ, Caloni F. Fusarium molds and mycotoxins: potential species-specific effects. Toxins 10 (2018) 244. Doi:10.3390/toxins10060244
11. Gruber-Dorninger C, Novak, B, Nagl V, Berthiller F. Emerging mycotoxins: Beyond traditionally determined food contaminants. J Agric Food Chem 65 (2017) 7052–7070. Doi:10.1021/acs.jafc.6b03413
12. Craig AM, Klotz JL, Duringer JM. Cases of ergotism in livestock and associated ergot alkaloid concentrations in feed. Front Chem 3 (2015) 1-6. Doi:10.3389/fchem.2015.00008
13. Waret-Szkuta A, Larraillet L, Oswald IP, Legrand X, Guerre P, Martineau GP. Unusual acute neonatal mortality and sow agalactia linked with ergot alkaloid contamination of feed. Porc Health Manag 5 (2019) 24. Doi:10.1186/s40813-019-0131-z
14. Coufal-Majewski S, Stanford K, McAllister T, Blakley B, McKinnon J, Vieira Chaves A, Wang Y. Impacts of cereal ergot in food animal production. Front Vet Sci 3 (2016) 15. Doi:10.3389/fvets.2016.00015
15. Dänicke S, Diers S. Effects of ergot alkaloids in feed on performance and liver function of piglets as evaluated by the 13C-methacetin breath test. Arch Anim Nutr 67 (2013) 15-36. Doi:10.1080/1745039X.2012.736279
16. Krska R, Crews C. Significance, chemistry and determination of ergot alkaloids: A review. Food Add Contam 25 (2008) 722-31. Doi: 10.1080/02652030701765756
17. Komarova E, Tolkachev O. The chemistry of peptide ergot alkaloids. Part 1: Classification and chemistry of ergot peptides. Pharmaceutical Chemistry J 35 (2001) 504-513. Doi:10.1023/A:1014050926916
18. Diana Di Mavungu J, Malysheva S, Sanders M, Larionova D, Robbens J, Dubruel P, Van Peteghem C, De Saeger S. Development and validation of a new LC-MS/MS method for the simultaneous determination of six major ergot alkaloids and their corresponding epimers. Application to some food and feed commodities. Food Chem 135 (2012) 292-303. Doi:10.1016/j.foodchem.2012.04.098
19. Crews C. Analysis of ergot alkaloids. Toxins 7 (2015) 2024. Doi:10.3390/toxins7062024
20. Alltech Canada (2015) Practical limits for mycotoxins in animal feeds to reduce negative effects on health and performance. (Disponible en: https://www.knowmycotoxins.com/wp-content/uploads/2019/01/37-Practical-Limits-Flyer-April-2018-GLOBAL.pdf)
21. Mayumi Maruo V, Bracarense AP, Metayer JP, Vilarino M, Oswald IP, Pinton P. Ergot alkaloids at doses close to EU regulatory limits induce alterations of the liver and intestine. Toxins 10 (2018) 183. Doi:10.3390/toxins10050183
22. EFSA Panel on Contaminants in the Food Chain (CONTAM); Scientific Opinion on ergot alkaloids in food and feed. EFSA Journal 10 (2012) 2798. Doi:10.2903/j.efsa.2012.2798.
23. Escrivá L, Font G, Manyes L. In vivo toxicity studies of Fusarium mycotoxins in the last decade: A review. Food Chem Toxicol 78 (2015) 185-206. Doi: 10.1016/j.fct.2015.02.005
24. Ruiz MJ, Franzova P, Juan-Garcia A, Font G. Toxicological interactions between the mycotoxins beauvericin, deoxynivalenol and T-2 toxin in CHO-K1 cells in vitro. Toxicon 58 (2011) 315-326. Doi: 10.1016/j.toxicon.2011.07.015
25. Stanciu O, Juan C, Miere D, Loghin F, Mañes J. Analysis of enniatins and beauvericin by LC-MS/MS in wheat- based products. CyTA-Journal of Food 15 (2017) 433-440. Doi: 10.1080/19476337.2017.1288661
26. Fraeyman S, Croubels S, Devreese M, Antonissen G. Emerging Fusarium and Alternaria mycotoxins: Occurrence, toxicity and toxicokinetics. Toxins 9 (2017) 228. Doi: 10.3390/toxins9070228
27. EFSA Panel on Contaminants in the Food Chain (CONTAM), “Scientific Opinion on the risks to human and animal health related to the presence of beauvericin and enniatins in food and feed”, EFSA Journal 12 (2014) 3802. (Disponible en: https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2014.3802)
28. Novak B, Rainer V, Sulyok M, Haltrich D, Schatzmayr G, Mayer E. Twenty-eight fungal secondary metabolites detected in pig feed samples: their occurrence, relevance and cytotoxic effects in vitro. Toxins 11 (2019) 537. Doi:10.3390/toxins11090537
29. Stanciu O, Juan C, Miere D, Loghin F, Mañes J. Presence of enniatins and beauvericin in Romanian wheat samples: from raw material to products for direct human consumption. Toxins 9 (2017) 189. Doi: 10.3390/toxins9060189
30. Covarelli L, Beccari G, Prodi A, Generotti S, Etruschi F, Meca G, Juan C, Mañes J. Biosynthesis of beauvericin and enniatins in vitro by wheat Fusarium species and natural grain contamination in an area of central Italy. Food Microbiol 46 (2015) 618-626. Doi:10.1016/j.fm.2014.09.009
31. Svingen T, Lund Hansen N, Taxvig C, Vinggaard AM, Jensen U, Rasmussen PH. Enniatin B and beauvericin are common in Danish cereals and show high hepatotoxicity on a high-content imaging platform. Environ Toxicol 32 (2017) 1658-1664. Doi: 10.1002/tox.22367
32. Kovalsky P, Kos G, Nährer K, Schwab C, Jenkins T, Schatzmayr G, Sulyok M, Krska R. Co-occurrence of regulated, masked and emerging mycotoxins and secondary metabolites in finished feed and maize-An extensive survey. Toxins 8 (2016) 363. Doi: 10.3390/toxins8120363
33. Arroyo-Manzanares N, Rodríguez-Estévez V, Arenas-Fernández P, García-Campaña AM, Gámiz-Gracia L. Occurrence of mycotoxins in swine feeding from Spain. Toxins 11 (2019) 342. Doi: 10.3390/toxins11060342
34. Arroyo-Manzanares N, Rodríguez-Estévez V, García-Campaña AM, Castellón-Rendón E, Gámiz-Gracia L. Determination of principal ergot alkaloids in swine feeding. J Sci Food Agric. 101 (2021) 5214-5224. (2021) https://doi.org/10.1002/jsfa.11169
35. Malachová A, Stránská M, Václavíková M, Elliott CT, Black C, Meneely J, Hajšlová J, Ezekiel CN, Schuhmacher R, Krska R. Advanced LC–MS-based methods to study the co-occurrence and metabolization of multiple mycotoxins in cereals and cereal-based food. Anal Bioanal Chem 410 (2018) 801-825. Doi: 10.1007/s00216-017-0750-7
36. Lee HJ, Ryu D. Worldwide occurrence of mycotoxins in cereals and cereal-derived food products: Public health perspectives of their co-occurrence. J Agric Food Chem 65 (2017) 7034-7051. Doi: 10.1021/acs.jafc.6b04847
37. Miller JD. Significance of grain mycotoxins for health and nutrition. In: Champ BR, Highley E, Hocking AD, Pitt JI (eds.), Fungi and mycotoxins in stored products. ACIAR Proceedings No. 36, Canberra, Australia, 1991, pp. 126-135.
38. BIOMIN, “Encuesta mundial de micotoxinas. La amenaza mundial. Enero-junio 2019”. (Disponible en: https://www.biomin.net/es/articulos/ resultados-de-la-encuesta-mundial-de-micotoxinas-biomin-1er-semestre-2019/)




 Prevención de micotoxicosis
Prevención de micotoxicosis