N. Deepa y M.Y. Sreenivasa
Laboratorio de micotoxicología molecular, Departamento de Estudios de Microbiología, Universidad de Mysore, Manasagangotri, Mysore- 570 006, Karnataka, India.
Correspondencia: [email protected]; [email protected]
Los piensos son sustancias o productos, incluidos los aditivos, procesados, sin procesar o semiprocesados, que se utilizan para alimentar a los animales (Comisión Europea, 2011).
|
Se pueden clasificar en cuatro tipos:
(EFSA 2016) |
La alimentación del ganado se diseña principalmente con combinaciones adaptadas a las necesidades nutricionales de los animales con unos costes mínimos (Pereira et al., 2019).
Los cereales y los productos a base de cereales son uno de los principales componentes de la alimentación animal y aportan enormes cantidades de nutrientes al ganado (Deepthi y Sreenivasa, 2020).

En muchos países desarrollados, casi el 70% de los cereales cosechados se destinan a la alimentación diaria de los animales, mientras que en los países en desarrollo son consumidos principalmente por los seres humanos (Dass et al., 2007).

A nivel mundial, las industrias de piensos incluyen cereales como el trigo, el maíz, el sorgo, la cebada y la avena. Entre ellos, el trigo y el maíz son los productos básicos clave en la agricultura para la alimentación animal y avícola (FAO, 2009).

Según un estudio mundial, se espera que la demanda de productos agrícolas experimente un crecimiento del 84% entre 2000 y 2050 (FAO y OMS, 2007).

De acuerdo con la Directiva 2002/32/CE, la seguridad de los piensos para aves de corral y animales debe ocupar un lugar destacado, tanto para los gobiernos como para los productores, ya que el consumo de piensos puede suponer ciertos riesgos para la salud de los animales, con consecuencias peligrosas para la cadena alimentaria humana y la industria de producción ganadera (FAO 2009; Comisión Europea, 2015).
Debido a las malas prácticas agrícolas durante las etapas de precosecha, cosecha, postcosecha y almacenamiento, un alto nivel de contaminantes fúngicos productores de micotoxinas se asocia principalmente con los cereales que sirven como ingrediente principal de la fabricación de piensos (Deepa y Sreenivasa, 2017a, Deepa y Sreenivasa, 2017b) (Figura 1).
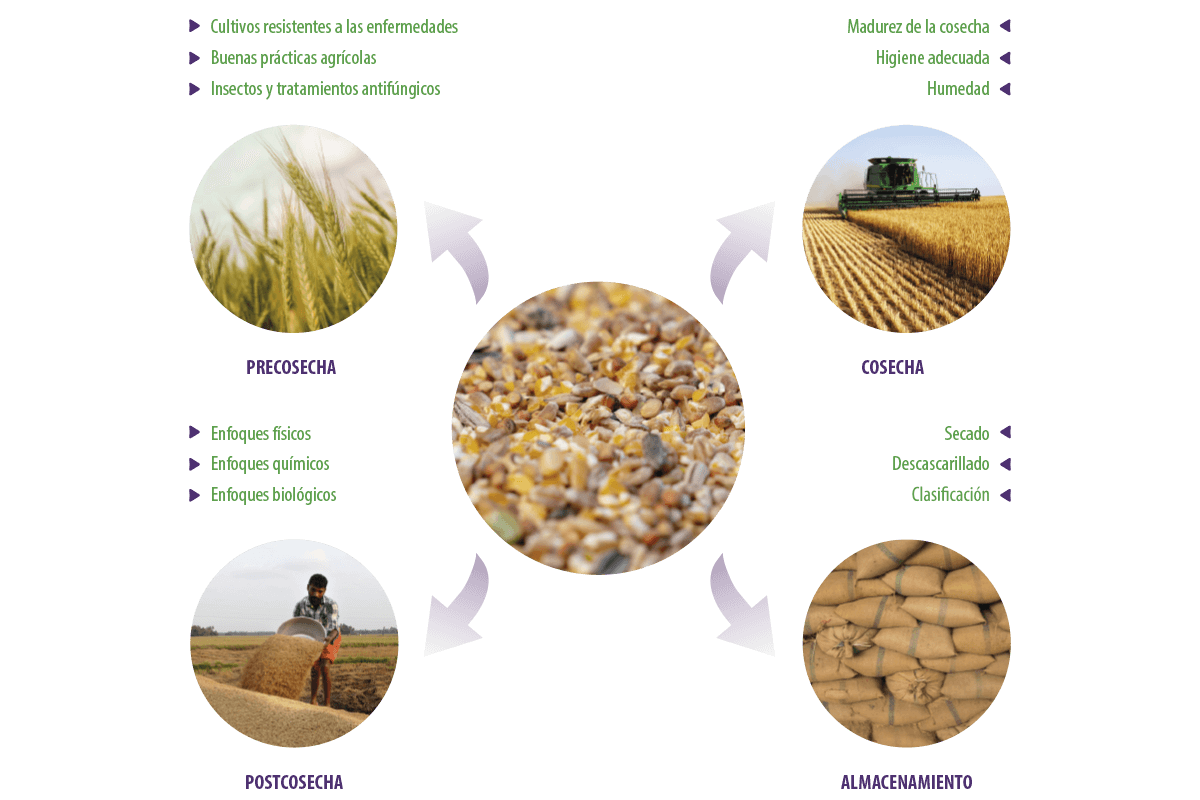
Figura 1. Procesamiento de las materias primas para piensos.

El riesgo de las micotoxinas
Las micotoxinas son producidas naturalmente por hongos filamentosos de los géneros Fusarium, Aspergillus, Penicillium, Alternaria, Stachybotrys y Claviceps. Hasta la fecha se han reportado aproximadamente 450 micotoxinas (CAST, 2003).
Debido a su presencia en los piensos y a sus consecuencias para la salud del ganado, algunos grupos de micotoxinas, como las aflatoxinas (AF), las fumonisinas (FB), las ocratoxinas (OTA), los tricotecenos (TRC), la zearalenona (ZEN) y el deoxinivalenol (DON) han sido objeto de estrategias de gestión en la práctica (Smith et al., 2016).
⇰ Las especies de Aspergillus producen principalmente AF y OTA, mientras que las especies de Penicillium producen patulina (PAT) y las fumonisinas, ZEN, DON y tricotecenos son producidos por las especies de Fusarium (Iqbal et al., 2015).
La presencia de hongos micotoxigénicos en los piensos se ha convertido en un problema importante (Kovalsky et al., 2016), ya que el consumo de las micotoxinas presentes en los piensos tiene efectos negativos para la salud que van desde los crónicos hasta los agudos y, en ocasiones, incluso la muerte, además de afectar al rendimiento de los animales, lo que repercute indirectamente en la rentabilidad (CAST, 2003) (Tabla 1).
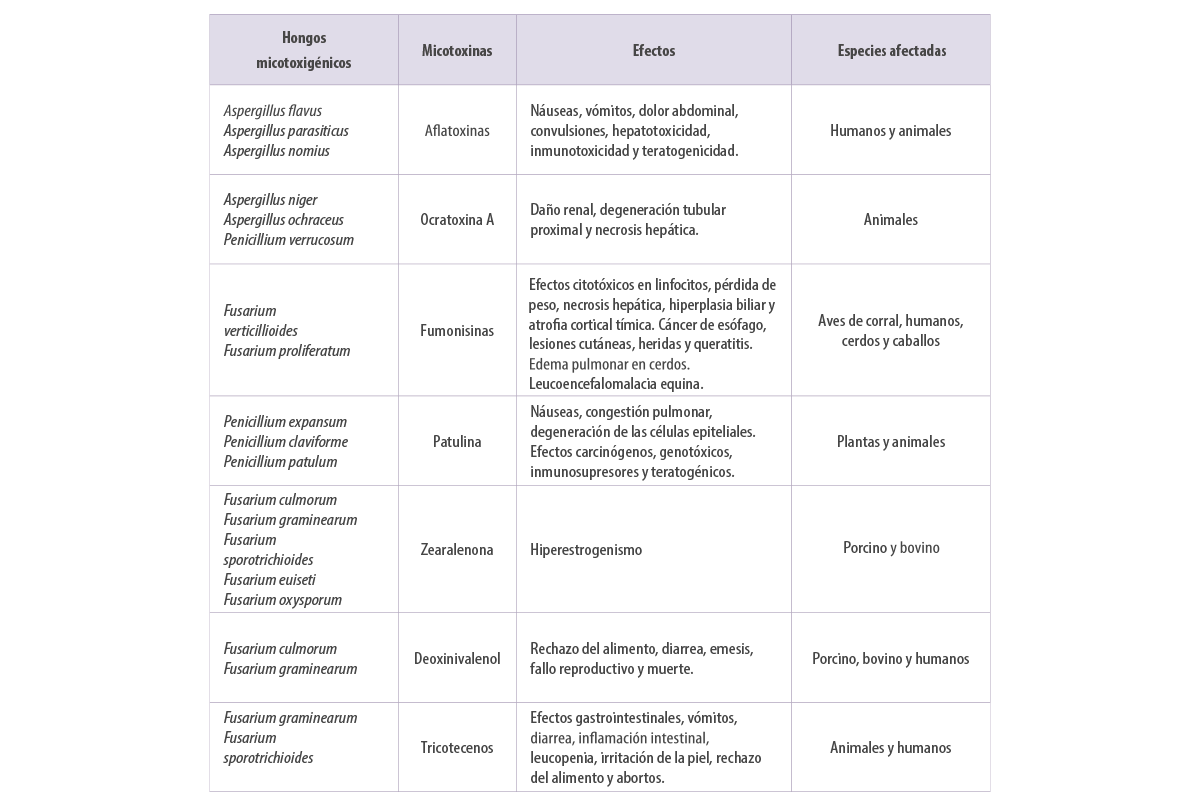
Tabla 1. Principales hongos productores de micotoxinas y sus efectos en la salud humana y animal.
Organizaciones e instituciones de todo el mundo han restringido el nivel de aceptación de micotoxinas en los piensos para aves de corral y animales, ya que se considera imposible garantizar la ausencia de micotoxinas en los piensos (Smith et al., 2016).
La legislación ha establecido ciertos límites estándar sobre el nivel de contaminación por micotoxinas, que varían en cada país, ya que en las sesiones de toma de decisiones intervienen muchas cuestiones económicas, científicas y políticas.
Por ejemplo, el contenido máximo de AFB1 en los piensos se ha fijado en 0,02-0,05 ppm y, basándose en estudios, se han recomendado límites para el deoxinivalenol, las fumonisinas, la zearalenona y la ocratoxina A en los piensos (Comisión Europea 2015; Comisión Europea, 2006).


La importancia de la detección de micotoxinas
La presencia de hongos en los piensos no se correlaciona directamente con la aparición de su micotoxina.
Los métodos clásicos basados en el cultivo, utilizados en la detección e identificación de los hongos productores de micotoxinas tienen varias limitaciones:
- ⇰ Requieren mucha mano de obra, dependen del medio ambiente y consumen mucho tiempo.
- ⇰ Tienen una escasa fiabilidad de los resultados y dificultades para la estandarización, entre otros aspectos.
En la actualidad, existe una gran demanda de tecnologías moleculares para detectar hongos micotoxigénicos en los piensos que entran en la cadena alimentaria en las primeras fases (Figura 2).
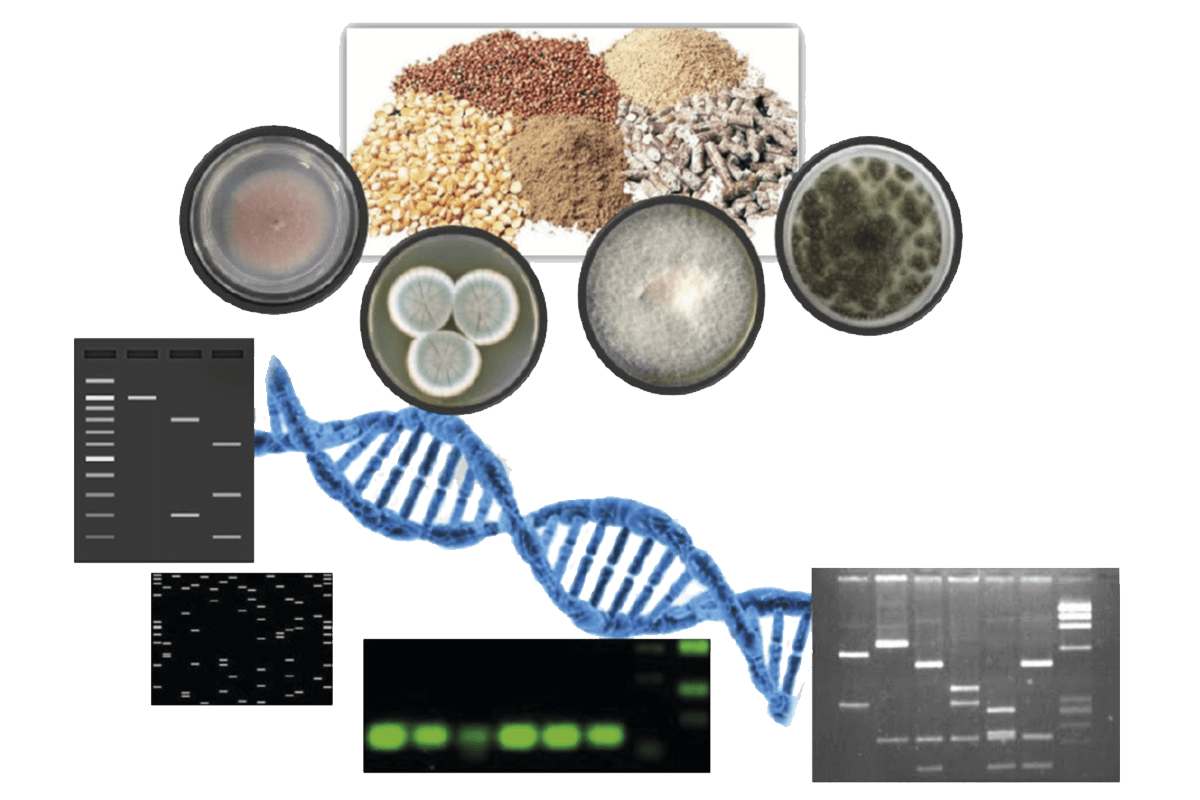
Figura 2. Representación esquemática de la detección de la contaminación fúngica en piensos y matrices de piensos mediante métodos moleculares.
Los investigadores han incrementado el uso de diversas técnicas moleculares en las industrias de piensos para la detección temprana de hongos micotoxigénicos, como la reacción en cadena de la polimerasa (PCR), la PCR anidada, la PCR cuantitativa (qPCR), la PCR en tiempo real, la PCR de hibridación de captura magnética (MCH-PCR), la PCR de inmunocaptura la PCR in situ, el polimorfismo de longitud de fragmentos de restricción (PCR-RFLP), droplet digilet PCR, la PCR cooperativa, la PCR multiplex, la PCR de transcriptasa inversa (RT-PCR), la amplificación isotérmica mediada por bucle (LAMP), los microarrays de ADN y la hibridación fluorescente in situ (FISH) (Deepa et al., 2021; Deepa et al, 2018) (Figura 3).
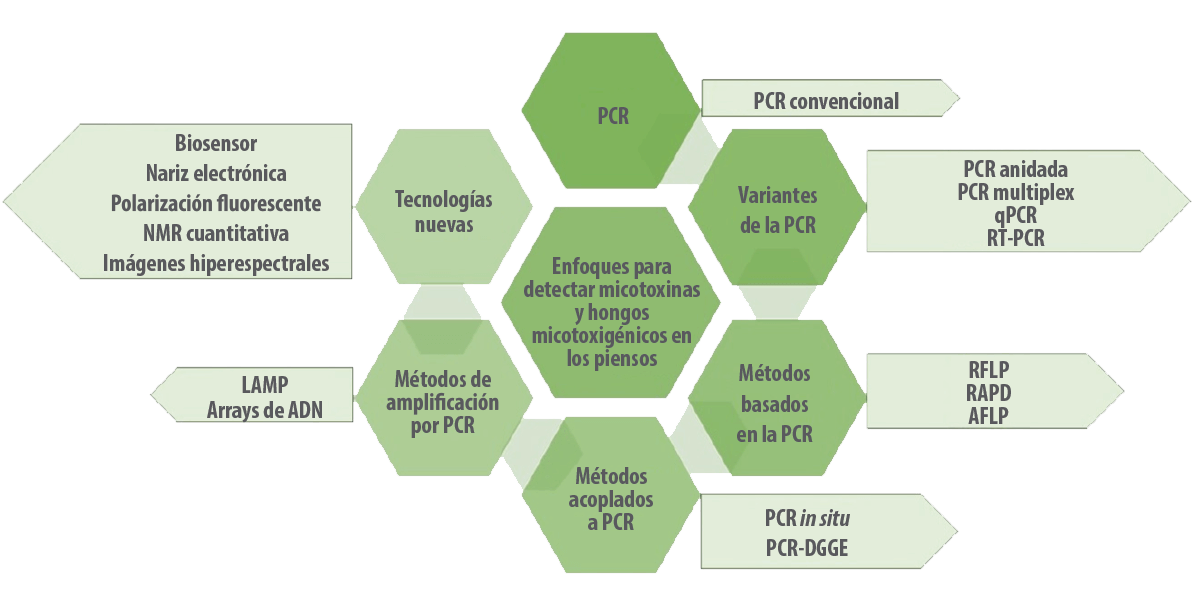
Figura 3. Enfoques moleculares para detectar micotoxinas y hongos micotoxigénicos en los piensos y en la matriz de los piensos.
Diferentes técnicas moleculares utilizadas para la detección y diferenciación de hongos micotoxigénicos
Reacción en cadena de la polimerasa (PCR) y sus variantes
PCR
METODOLOGÍA
La técnica PCR se utiliza para detectar la contaminación con hongos micotoxigénicos en matrices de piensos y para definir el riesgo potencial para la salud humana y animal.
⇰ Implica una única ronda de PCR con un determinado conjunto de primers, reactivos de PCR y la muestra de ADN, seguida de un sistema de documentación en gel.
APLICACIÓN
Esta técnica se emplea principalmente para la identificación de hongos y la detección de genes específicos.
 Fusarium poae productor de nivalenol (NIV) se detectó mediante un ensayo de PCR que representa la presencia del gen tri7 (Dinolfo et al., 2012).
Fusarium poae productor de nivalenol (NIV) se detectó mediante un ensayo de PCR que representa la presencia del gen tri7 (Dinolfo et al., 2012). La implicación de la contaminación por F. verticillioides en 51 matrices de piensos se confirmó mediante PCR convencional y 69 muestras se asociaron con especies de Fusarium (Deepa et al., 2016a).
La implicación de la contaminación por F. verticillioides en 51 matrices de piensos se confirmó mediante PCR convencional y 69 muestras se asociaron con especies de Fusarium (Deepa et al., 2016a). Las muestras de cereales para piensos estaban infectadas con 103 aislados de Fusarium y 64 F. verticillioides productores de fumonisina estaban asociados con el sorgo (Sreenivasa et al., 2007; 2008).
Las muestras de cereales para piensos estaban infectadas con 103 aislados de Fusarium y 64 F. verticillioides productores de fumonisina estaban asociados con el sorgo (Sreenivasa et al., 2007; 2008). Entre 108 muestras de piensos, el 45,37% de las mezclas de piensos estaban contaminadas con especies de Fusarium, lo que se confirmó mediante un método de PCR convencional (Deepthi et al., 2017).
Entre 108 muestras de piensos, el 45,37% de las mezclas de piensos estaban contaminadas con especies de Fusarium, lo que se confirmó mediante un método de PCR convencional (Deepthi et al., 2017).
 Dass et al. (2009) analizaron 80 mezclas de piensos para aves de corral y 114 piensos para animales en busca de contaminación por Fusarium, informando de 374 especies de Fusarium con cebadores y 244 aislados para cepas específicas de fumonisina con el conjunto de cebadores FUM1.
Dass et al. (2009) analizaron 80 mezclas de piensos para aves de corral y 114 piensos para animales en busca de contaminación por Fusarium, informando de 374 especies de Fusarium con cebadores y 244 aislados para cepas específicas de fumonisina con el conjunto de cebadores FUM1.

| Ventajas | Desventajas |
| El método es preciso y ofrece resultados rápidos. | Requiere mucha mano de obra y tecnología eficiente. |
PCR MULTIPLEX
METODOLOGÍA
En un solo tubo de PCR, permite la combinación de varios cebadores específicos de la especie utilizados simultáneamente para detectar una variedad de hongos micotoxigénicos. Los productos amplificados se analizan mediante electroforesis en gel.
⇰ Con esta técnica, una sola corrida de PCR es suficiente para la identificación de más de un gen a la vez.
APLICACIÓN
 En Brasil se analizaron muestras de maíz asociadas a la contaminación por F. verticillioides y F. subglutinans mediante el desarrollo del gen gaoB que codifica la galactosa oxidasa (Faria et al., 2012).
En Brasil se analizaron muestras de maíz asociadas a la contaminación por F. verticillioides y F. subglutinans mediante el desarrollo del gen gaoB que codifica la galactosa oxidasa (Faria et al., 2012). Se utilizaron un cebador directo y dos inversos para detectar F. verticillioides productor de fumonisina mediante mPCR (Deepa et al., 2016c).
Se utilizaron un cebador directo y dos inversos para detectar F. verticillioides productor de fumonisina mediante mPCR (Deepa et al., 2016c). Se detectaron especies de Aspergillus productoras y no productoras de aflatoxinas en meju, utilizándose dos conjuntos de cebadores para amplificar los genes (omtB, omtA, aflR, ver-1), conjunto I (omtB-1,2, aflR-1,2 y omtA-1,2) y conjunto II (aflR-1,2, ver-1-F-R y omtA-1,2) (Kim et al., 2011). Simultáneamente, cinco genes principales, pks (ocratoxina A), pks13 (zearalenona), aflr (aflatoxina), tri5 (tricoteceno) y fum13 (fumonisina) producidos por Aspergillus, Fusarium y Penicillium fueron detectados utilizando un ensayo de PCR multiplex para matrices de piensos (Priyanka et al., 2015).
Se detectaron especies de Aspergillus productoras y no productoras de aflatoxinas en meju, utilizándose dos conjuntos de cebadores para amplificar los genes (omtB, omtA, aflR, ver-1), conjunto I (omtB-1,2, aflR-1,2 y omtA-1,2) y conjunto II (aflR-1,2, ver-1-F-R y omtA-1,2) (Kim et al., 2011). Simultáneamente, cinco genes principales, pks (ocratoxina A), pks13 (zearalenona), aflr (aflatoxina), tri5 (tricoteceno) y fum13 (fumonisina) producidos por Aspergillus, Fusarium y Penicillium fueron detectados utilizando un ensayo de PCR multiplex para matrices de piensos (Priyanka et al., 2015). Cuatro genes importantes relacionados con las micotoxinas, fum13 (fumonisina), nor1 (aflatoxina), Tri6 (tricoteceno) y otanps (ocratoxina A) se detectaron simultáneamente en una sola prueba mediante un método de PCR múltiplex específico y sensible (Rashmi et al., 2013).
Cuatro genes importantes relacionados con las micotoxinas, fum13 (fumonisina), nor1 (aflatoxina), Tri6 (tricoteceno) y otanps (ocratoxina A) se detectaron simultáneamente en una sola prueba mediante un método de PCR múltiplex específico y sensible (Rashmi et al., 2013).
 Se detectaron las fumonisinas (FUM1, FUM13), y los tricotecenos (tri5, tri6) en matrices de piensos utilizando mPCR (Ramana et al., 2011).
Se detectaron las fumonisinas (FUM1, FUM13), y los tricotecenos (tri5, tri6) en matrices de piensos utilizando mPCR (Ramana et al., 2011).
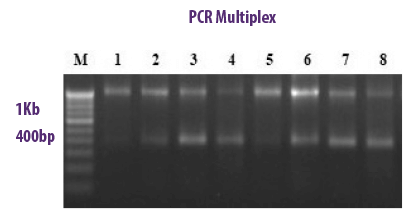
| Ventajas | Desventajas |
| El método es preciso, rentable y ahorra tiempo. | Sensible |
PCR ANIDADA
METODOLOGÍA
Este método implica dos reacciones consecutivas en un solo tubo cerrado, en el que el par de cebadores externos amplifica un gran amplicón utilizado como plantilla para el cebador interno que requiere una temperatura más alta que el cebador externo y donde el cebador interno no se unirá (Porter-Jordan et al., 1990).
El método es rentable y 100 veces más sensible que otros métodos. Aunque el riesgo de contaminación puede ser mayor debido a los dos ciclos de amplificación, esta técnica aumenta el rendimiento y la especificidad de la amplificación del ADN objetivo (Rahman et al., 2013).
⇰ El método de PCR anidada es una prueba de doble confirmación, ya que, si el primer cebador se une y amplifica una secuencia de ADN no deseada, el segundo conjunto de cebadores también se unirá dentro de la región no deseada.
APLICACIÓN
 Klemsdal y Elen (2006) detectaron Fusarium culmorum en matrices de piensos de cultivos de cereales donde el par de cebadores externos (FculAF, FculAR) se diluyó 10.000 veces en comparación con el par de cebadores internos (FculBF, FculBR) con un límite de detección de 5-50fg de ADN objetivo.
Klemsdal y Elen (2006) detectaron Fusarium culmorum en matrices de piensos de cultivos de cereales donde el par de cebadores externos (FculAF, FculAR) se diluyó 10.000 veces en comparación con el par de cebadores internos (FculBF, FculBR) con un límite de detección de 5-50fg de ADN objetivo. F. verticillioides productor de fumonisina asociado a cereales de matriz alimentaria se detectó utilizando un cebador directo (VERF-1) y dos inversos (VERTR y VERTF-2) (Deepa et al., 2016b).
F. verticillioides productor de fumonisina asociado a cereales de matriz alimentaria se detectó utilizando un cebador directo (VERF-1) y dos inversos (VERTR y VERTF-2) (Deepa et al., 2016b).
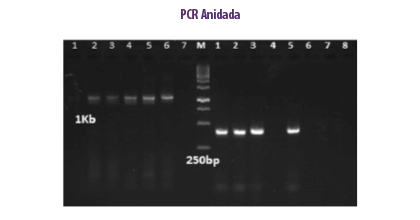
| Ventajas | Desventajas |
| Método que requiere menos tiempo y que evita el aislamiento frecuente del ADN, para cada prueba con una amplificación precisa con menos concentración. | Mayor riesgo de contaminación. |
PCR EN TIEMPO REAL (qPCR)
METODOLOGÍA
Este método detecta los amplicones de las moléculas de ADN objetivo basándose en la emisión de señales fluorescentes, lo que elimina los pasos de post-amplificación necesarios en el método de PCR convencional, lo que reduce el tiempo invertido. Detecta pequeñas concentraciones y es útil incluso para identificar en infecciones asintomáticas.
APLICACIÓN
 Aunque puede ayudar a detectar infecciones asintomáticas, la tecnología qPCR no es eficaz cuando se aplica a los piensos (Ginzinger, 2002).
Aunque puede ayudar a detectar infecciones asintomáticas, la tecnología qPCR no es eficaz cuando se aplica a los piensos (Ginzinger, 2002).
| Ventajas | Desventajas |
| Método eficaz en cuanto al tiempo, sensible y específico. | Equipos caros y necesidad de reactivos costosos y experiencia para manejar los instrumentos. |
RT-PCR
METODOLOGÍA
Esta técnica se desarrolló para distinguir los hongos vivos de los muertos, ya que el ARNm se degrada rápidamente en las células muertas. Durante el proceso, el ARNm se transcribe de forma inversa para producir ADNc como plantilla mediante una enzima transcriptasa inversa (Brown et al., 2011).
APLICACIÓN
 Se detectó F. graminearum mediante el método RT-PCR en una matriz de piensos. El método es específico y altamente sensible para detectar hongos micotoxigénicos en los piensos. Sin embargo, también es más caro y laborioso que cualquier otro método (Guo et al., 2005).
Se detectó F. graminearum mediante el método RT-PCR en una matriz de piensos. El método es específico y altamente sensible para detectar hongos micotoxigénicos en los piensos. Sin embargo, también es más caro y laborioso que cualquier otro método (Guo et al., 2005).
| Ventajas | Desventajas |
| Es un método rápido y sencillo que no requiere gel de agarosa y permite obtener datos cualitativos y cuantitativos. | La técnica requiere de una mayor experiencia en el manejo de los instrumentos y es extremadamente sensible con un mayor riesgo de contaminación. |
Métodos basados en la PCR
PCR-RFLP
METODOLOGÍA
Este método es útil para discriminar a nivel de especie con precisión, sensibilidad y especificidad.
⇰ El RFLP registra la variabilidad genética entre las distintas y mismas especies mostrando una diferenciación genética que se corresponde con los perfiles patógenos y micotoxicológicos.
APLICACIÓN
 Se detectaron especies de Aspergillus productoras de aflatoxinas, como A. flavus y A. parasiticus, en matrices complejas de alimentos y piensos (Ahmad et al., 2014).
Se detectaron especies de Aspergillus productoras de aflatoxinas, como A. flavus y A. parasiticus, en matrices complejas de alimentos y piensos (Ahmad et al., 2014). Se describió la diferenciación por ITS-RFLP entre F. verticillioides y F. proliferatum (Visenti et al., 2012).
Se describió la diferenciación por ITS-RFLP entre F. verticillioides y F. proliferatum (Visenti et al., 2012). El método PCR-RFLP se aplicó para detectar variaciones entre 33 cepas de F. verticillioides productoras de fumonisina procedentes de matrices de piensos (Patino et al., 2006).
El método PCR-RFLP se aplicó para detectar variaciones entre 33 cepas de F. verticillioides productoras de fumonisina procedentes de matrices de piensos (Patino et al., 2006). Se estudiaron las variaciones genéticas entre diez cepas de F. verticillioides utilizando seis enzimas diferentes (EcoRI, Xho I, Hae III, Kpn I, Hinf I, Hind III) aisladas de muestras de cereales (Deepa et al., 2018).
Se estudiaron las variaciones genéticas entre diez cepas de F. verticillioides utilizando seis enzimas diferentes (EcoRI, Xho I, Hae III, Kpn I, Hinf I, Hind III) aisladas de muestras de cereales (Deepa et al., 2018).
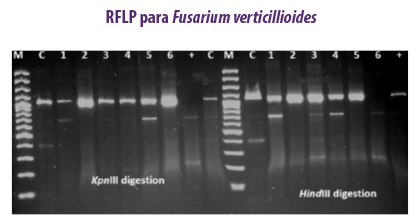
| Ventajas | Desventajas |
| Método sencillo, reproducible, rápido y estable que es preciso en la identificación de las poblaciones. | Laborioso y necesita de isótopos radioeléctricos. |
PCR-AFLP
METODOLOGÍA
El polimorfismo de longitud de fragmento amplificado-PCR es una técnica diseñada para detectar polimorfismos de ADN.
⇰ La caracterización micotoxicológica y de patógenos fúngicos puede complementarse con el fingerprinting. El método es altamente reproducible, sensible y tiene la capacidad de amplificar 100 fragmentos a la vez.
APLICACIÓN
El método se aplicó para estudiar la variabilidad genética entre 3.840 granos de maíz en Brasil y FUM1 y FUM8 fueron los genes esenciales responsables de la biosíntesis de fumonisina entre las especies de F. verticillioides (Silva et al., 2017).
| Ventajas | Desventajas |
| Alta reproducibilidad y posibilidad de analizar diferentes partes del genoma. | Protocolo complejo y largo. |
PCR-RAPD
METODOLOGÍA
El ADN polimórfico amplificado al azar identifica las diferencias genotípicas utilizando cebadores de oligonucleótidos cortos para distinguir las especies de hongos micotoxigénicos y las variaciones dentro de la especie (Zhang et al., 2018).
⇰ Aunque el método se utiliza como herramienta de diagnóstico en los laboratorios, no se usa mucho en la práctica ya que carece de reproducibilidad (Blackwell et al., 1999).
APLICACIÓN
 Se identificaron F. subglutinans y F. verticillioides en granos de maíz basándose en las secuencias RAPD de los fragmentos (Moller et al., 1999).
Se identificaron F. subglutinans y F. verticillioides en granos de maíz basándose en las secuencias RAPD de los fragmentos (Moller et al., 1999). El método RAPD-PCR se aplicó en diez cepas de F. verticillioides asociadas a muestras de cereales para estudiar la variación genética entre ellas (Deepa et al., 2018).
El método RAPD-PCR se aplicó en diez cepas de F. verticillioides asociadas a muestras de cereales para estudiar la variación genética entre ellas (Deepa et al., 2018).
| Ventajas | Desventajas |
| Método sencillo, eficaz y rápido que no requiere sondas. | Falta de reproducibilidad y posibles desajustes. |
Métodos acoplados a PCR
PCR in situ
METODOLOGÍA
Esta técnica es una combinación de PCR e hibridación in situ para detectar hongos micotoxigénicos en tejidos o células (Long, 1998) que se ha convertido en algo común para analizar la expresión de genes e identificar ADN o ARN en las células (Chu et al., 2019). Por lo general, la amplificación del ADN de las materias primas conduce a una interpretación errónea si el material contiene más de una especie.
| Ventajas | Desventajas |
| Se pueden aprovechar al máximo los tejidos pequeños, extensamente utilizados gracias a la microscopía optica. | Método que requiere mucho tiempo y es difícil de realizar con un número menor de copias de ADN/ ARN. |
PCR-DGGE
METODOLOGÍA
Técnica que detecta comunidades fúngicas mediante la amplificación del ADN diana, inicialmente mediante PCR, y posteriormente sometida a electroforesis, pero que no sirve para describir las especies presentes en la muestra (Laforgue et al., 2009).
APLICACIÓN
 Con este método se detectaron esporas de Trichoderma harzianum procedentes de matrices de alimentos. El método se aplica principalmente en estudios de diversidad y para detectar hongos patógenos, aunque es una técnica que requiere mucho tiempo y es poco reproducible (Rytkonen et al., 2011).
Con este método se detectaron esporas de Trichoderma harzianum procedentes de matrices de alimentos. El método se aplica principalmente en estudios de diversidad y para detectar hongos patógenos, aunque es una técnica que requiere mucho tiempo y es poco reproducible (Rytkonen et al., 2011).
| Ventajas | Desventajas |
| Útil en los estudios de diversidad. | Falta de reproducibilidad. |

Métodos de postamplificación
LAMP
METODOLOGÍA
La amplificación isotérmica mediada por bucle (Loop-mediated isothermal amplification) es una técnica altamente sensible y exitosa que se aplica directamente in situ para garantizar la calidad y la seguridad de los alimentos, amplificando el ADN objetivo en menos de una hora a una temperatura constante mediante el uso de cuatro cebadores para identificar seis regiones en el ADN diana con especial atención en el paso de recocido (Tomita et al., 2008).
APLICACIÓN
 Se detectó rápidamente Penicillium nordicum productor de ocratoxina directamente in situ en cadenas de producción de alimentos y piensos (Ferrara et al., 2015).
Se detectó rápidamente Penicillium nordicum productor de ocratoxina directamente in situ en cadenas de producción de alimentos y piensos (Ferrara et al., 2015).
| Ventajas | Desventajas |
| Método rápido y muy específico. | Alto riesgo de contaminación. |
ARRAYS DE ADN
METODOLOGÍA
La tecnología de arrays de ADN se desarrolló para detectar un gran número de organismos a la vez. Incluye las técnicas de microarrays y macroarrays, en las que se fijan secuencias detectoras específicas de cada especie, colocadas de forma diferenciada, en filtros de nailon o en un portaobjetos de cristal. Este método se aplica principalmente en los estudios de expresión génica.
⇰ Los microarrays consisten en un chip de ADN para analizar miles de ARNm simultáneamente, se utilizan principalmente para estudios de expresión génica y se aplican para la identificación de especies de Aspergillus (Singh y Kumar, 2013).
⇰ Los macroarrays implican una técnica de hibridación de ADN y se utilizan principalmente para la identificación de A. alternata, F. solani y A. fumigatus en matrices de alimentos (Singh y Kumar, 2013).
APLICACIÓN
 Kristensen et al. (2007) aplicaron la tecnología de microarrays para la detección de especies de Fusarium, lo que parece ser fácil, seguro, rápido y rentable en matrices de piensos y alimentos. La detección de especies de Fusarium que producen 14 tricotecenos y moniliformina se determinó mediante un microarray de ADN.
Kristensen et al. (2007) aplicaron la tecnología de microarrays para la detección de especies de Fusarium, lo que parece ser fácil, seguro, rápido y rentable en matrices de piensos y alimentos. La detección de especies de Fusarium que producen 14 tricotecenos y moniliformina se determinó mediante un microarray de ADN.
| Ventajas | Desventajas |
| Análisis rápido, fácil y a granel que no requiere una gran cantidad de muestra de ADN. | Técnica cara que requiere más tiempo y más cantidad de ARNm. |
Nuevas tecnologías emergentes para la detección de micotoxinas
Además de los métodos cromatográficos (cromatografía en capa fina, cromatografía de gases y cromatografía líquida) y de los métodos basados en inmunoensayos (membranas de flujo, ELISA, tiras reactivas, inmunoensayo de polarización de fluorescencia (FPI) e inmunoensayo de flujo lateral (LFA)) (Agriopoulou et al., 2020), se pueden aplicar muchas otras técnicas emergentes para la detección de micotoxinas en los piensos.
BIOSENSORES
METODOLOGÍA
Este método de ensayo in situ, rápido, fácil, reproducible, estable, preciso y barato, requiere transductores (ópticos, piezoeléctricos o electroquímicos) para la detección de micotoxinas (Schulz et al., 2019).

APLICACIÓN
 Oliveria et al. (2019) reportaron el uso de biosensores para la detección de micotoxinas producidas por hongos micotoxigénicos en piensos y alimentos.
Oliveria et al. (2019) reportaron el uso de biosensores para la detección de micotoxinas producidas por hongos micotoxigénicos en piensos y alimentos. El método detectó AFB1, OTA, AFM1, PAT, ZEN, FB1, T-2 y DON en polvo de maíz, maíz, cebada, trigo, maíz y productos de maíz (Hossain et al., 2019).
El método detectó AFB1, OTA, AFM1, PAT, ZEN, FB1, T-2 y DON en polvo de maíz, maíz, cebada, trigo, maíz y productos de maíz (Hossain et al., 2019). Los sensores impedimétricos detectaron hongos micotoxigénicos productores de AFB1, AFM1, OTA y PAT en alimentos y piensos (Khan et al., 2019).
Los sensores impedimétricos detectaron hongos micotoxigénicos productores de AFB1, AFM1, OTA y PAT en alimentos y piensos (Khan et al., 2019). Se utilizaron sensores fotométricos con un sistema de dos o tres electrodos para analizar con éxito la AFB1 y el ZEN en el polvo de maíz y el maíz, respectivamente (He et al., 2019).
Se utilizaron sensores fotométricos con un sistema de dos o tres electrodos para analizar con éxito la AFB1 y el ZEN en el polvo de maíz y el maíz, respectivamente (He et al., 2019). También se han utilizado sensores amperométricos basados en un sistema de dos o tres electrodos para detectar el ZEN en el maíz y los productos a base de maíz (He et al., 2019).
También se han utilizado sensores amperométricos basados en un sistema de dos o tres electrodos para detectar el ZEN en el maíz y los productos a base de maíz (He et al., 2019). Los sensores de resonancia de plasmón superficial son sensibles y rentables con una alta especificidad para detectar DON, ZEN y la toxina T-2 en el trigo (Hossain et al., 2019).
Los sensores de resonancia de plasmón superficial son sensibles y rentables con una alta especificidad para detectar DON, ZEN y la toxina T-2 en el trigo (Hossain et al., 2019). Los sensores de microbalanza de cristal de cuarzo detectaron AFB1 en arroz y trigo (Gu et al., 2019).
Los sensores de microbalanza de cristal de cuarzo detectaron AFB1 en arroz y trigo (Gu et al., 2019).
| Ventajas | Desventajas |
| Técnica fácil de usar, in situ, con buena sensibilidad y selectividad. | Alta rentabilidad. |
NARIZ ELECTRONICA
METODOLOGÍA
La nariz electrónica incluye detectores no específicos que capturan compuestos orgánicos volátiles (VOCs) y detectan huellas volátiles cualitativas asociadas a los hongos toxigénicos.
⇰ El olor es la información preliminar para detectar los metabolitos producidos en la identificación de VOCs específicos relacionados con los hongos en las matrices de los piensos.
APLICACIÓN
 El método detecta las micotoxinas producidas por hongos micotoxigénicos, como las aflatoxinas, las fumonisinas en el maíz y el DON en el salvado de trigo, que es el principal ingrediente de los piensos (Ottoboni et al., 2018).
El método detecta las micotoxinas producidas por hongos micotoxigénicos, como las aflatoxinas, las fumonisinas en el maíz y el DON en el salvado de trigo, que es el principal ingrediente de los piensos (Ottoboni et al., 2018).
| Ventajas | Desventajas |
| Se puede detectar un bajo nivel de micotoxinas si se optimiza. | La naturaleza no volátil de las micotoxinas es problemática para la detección a través de una nariz electrónica. |
POLARIZACIÓN FLUORESCENTE (FP)
METODOLOGÍA
La PF trabaja con el analito y el trazador en el sitio de unión del anticuerpo. La unión del trazador al anticuerpo in luye en la rotación de la molécula del trazador aumentando el valor de la PF.
⇰ La cantidad de trazador es inversamente proporcional al analito libre en la muestra, lo que resulta en un valor de polarización inversamente proporcional a la concentración de analito.
APLICACIÓN
 El método detecta las especies de Fusarium que producen ZEN en el maíz y DON en los productos a base de trigo, así como las especies de Aspergillus que producen AFB1 en el maíz, y OTA en el arroz (Huang et al., 2020).
El método detecta las especies de Fusarium que producen ZEN en el maíz y DON en los productos a base de trigo, así como las especies de Aspergillus que producen AFB1 en el maíz, y OTA en el arroz (Huang et al., 2020). El método es preciso en comparación con el HPLC con una sensibilidad limitada (Zhang et al., 2018).
El método es preciso en comparación con el HPLC con una sensibilidad limitada (Zhang et al., 2018).
| Ventajas | Desventajas |
| Técnica rápida y precisa sin pasos preanalíticos. | Sensibilidad limitada y se requiere experiencia para manejar el instrumental. |
RMN CUANTITATIVA E IMÁGENES HIPERESPECTRALES
METODOLOGÍA
La espectroscopia de resonancia magnética nuclear (RMN) se utiliza para la identificación de compuestos orgánicos y la metabolómica. Recientemente, se ha aplicado la RMN 2D y multidimensional.
La imagen hiperespectral es una técnica para la evaluación de micotoxinas fúngicas que funciona con menos costes sin destruir la muestra, siendo rápida y operando en la localización de datos espectrales.
APLICACIÓN
 La metabolómica basada en la RMN se ha utilizado para dilucidar el mecanismo de reordenación de la micotoxina de Fusarium, Fusarina C, en los piensos debido a su alto rendimiento de las muestras y a la metabolómica con rica información estructural (López-Ruiz et al., 2019).
La metabolómica basada en la RMN se ha utilizado para dilucidar el mecanismo de reordenación de la micotoxina de Fusarium, Fusarina C, en los piensos debido a su alto rendimiento de las muestras y a la metabolómica con rica información estructural (López-Ruiz et al., 2019). Las imágenes hiperespectrales se han utilizado principalmente para detectar la contaminación por DON y patógenos de Fusarium en los granos de trigo a granel (Femenias et al., 2020).
Las imágenes hiperespectrales se han utilizado principalmente para detectar la contaminación por DON y patógenos de Fusarium en los granos de trigo a granel (Femenias et al., 2020).
| Ventajas | Desventajas |
| Los compuestos se pueden dilucidar sin estándares y se requiere una mínima preparación de la muestra. | Límite de detección más bajo, baja sensibilidad y mayores requisitos de experiencia. |

CONCLUSIONES
Algunas materias primas agrícolas, como el trigo, el maíz, la soja, el mijo perla, el sorgo y el arroz, se utilizan principalmente para la fabricación de piensos, que son los más demandados por las industrias ganaderas.
Por ello, la seguridad de los piensos es fundamental, ya que su consumo es una vía potencial de entrada de sustancias químicas peligrosas en la cadena alimentaria humana, incluidas las micotoxinas.
Debido a la amenaza que suponen las micotoxinas para la salud animal y humana, en la UE se han aplicado determinadas legislaciones a los productos basados en piensos destinados al ganado con el establecimiento de criterios de limitación verificados, así como el desarrollo de métodos sensibles y coherentes para detectar las micotoxinas.
Para detectar las micotoxinas y los hongos micotoxigénicos se aplican tecnologías basadas en la PCR y técnicas analíticas novedosas.
En la actualidad, existen muchos más métodos moleculares, como NASBA, FISH, SAGE, Northern blotting, método basado en sondas de ADN/ARN, PCR-ELISA, MCH-PCR, PCR de próxima generación, PCR cooperativa, ARN de interferencia. Sin embargo, aún no se han aplicado para la detección de hongos micotoxigénicos asociados a matrices de alimentos y piensos.
REFERENCIAS
1. Agriopoulou, S., Stamatelopoulou, E., Varzakas, T. 2020. Advances in analytical and detection of major mycotoxins in foods. Foods, 9, 518.
2. Ahmad M.M., Ahmad M., Ali A., Hamid R., Javed S., Abdin M.Z., 2014. Detection of Aspergillus flavus and Aspergillus parasiticus from aflatoxin-contaminated peanuts and their differentiation using PCR RFLP. Annals of Microbiology 64: 1597-1605.
3. Bindslev L., Oliver R.P., Johansen, B., 2002. In situ PCR for detection and identification of fungal species. Mycological Research 106: 277-279.
4. Blackwell B.A., Gilliam J.T., Savardm M.E., Miller D., Duvick J.P. 1999. Oxidative deamination of hydrolysed fumonisin B1 (AP1) by cultures of Exophiala spinifera. Natural Toxins. 7: 31–38.
5. Brown N.A., Bass C., Baldwin T.K., Chen H., Massot F., Carion P.W., Urban M., Van De Meene A.M., Hammond-Kosack K.E. 2011. Characterisation of the Fusarium graminearum in wheat and floral interaction. Journal of Pathogens.
6. CAST. 2003. Mycotoxins: Risks in Plant, Animal, and Human Systems; CAST: Ames, IA, USA.
7. Chu Y.H., Hardin, H., Zhang, R., Guo, Z. and Lloyd, R.V., in press. In situ hybridization: introduction to techniques, applications and pitfalls in the performance and interpretation of assays. Seminars in Diagnostic Pathology. 36: 336-341.
8. Dass R.S., Sreenivasa M.Y., Janardhana G.R. 2007. High incidence of Fusarium verticillioides in Animal and Poultry feed mixtures produced in Karnataka, India. Plant Pathology Journal. 6:174-178.
9. Dass R.S., Sreenivasa M.Y., Charith Raj A.P., Janardhana G.R. 2009. PCR-based assay for the rapid detection of fumonisin-producing Fusarium species in maize-based animal and poultry feeds in Karnataka, India. Arhieves of Phytopathology and plant protection. 42:8, 796-804
10. Deepa N., Charith Raj Adkar-Purushothama., Sreenivasa M.Y. 2016b. Nested PCR method for early detection of fumonisin producing Fusarium verticillioides in pure cultures, cereal samples and plant parts. Food Biotechnology 30: 18-29.
11. Deepa N., Charith Raj Adkar-Purushothama., Sreenivasa M.Y. 2016c. Multiplex PCR for the early detection of fumonisin producing Fusarium verticillioides. Food Bioscience. 13: 84-88.
12. Deepa N., Nagaraja H., Sreenivasa, M.Y. 2016a. Prevalence of fumonisin producing Fusarium verticillioides associated with cereals grown in Karnataka (India). Food Science and Human Wellness, 5(3), 156-158.
13. Deepa N., Rakesh S and Sreenivasa M.Y. 2018. “Morphological, pathological and mycotoxicological variations among Fusarium verticillioides isolated from cereals”. 3 biotech. 8:105.
14. Deepa N., Sreenivasa M.Y. 2017b. “Fusarium verticillioides, a globally important pathogen of Agriculture and Livestock: A review”. Journal of Veterinary Medicine and Research. 4(4): 1084.
15. Deepa, N., Charith Raj Adkar-Purushothama, Sreenivasa, M.Y. 2021. Chapter 6: “Molecular technologies for the early detection of fungal phytopathogens associated with cereal crops”. Microbial genomic technologies to combat the problems of farming lands. Microbes in land use change management. Elsevier. 137-154.
16. Deepa, N., Sreenivasa, M.Y. 2017a. “Fumonisins: A review on its Global Occurrence, Epidemiology, Toxicity and Detection”. Journal of Veterinary Medicine and Research. 4(6): 1093.
17. Deepthi, B.V., Gnanaprakash, A.P., Sreenivasa M.Y. 2017. Effet of γ irradiation on fumonisin producing Fusarium associated with animal and poultry feed mixtures. 3 Biotech. 7:57.
18. Deepthi, B.V., Sreenivasa M.Y. 2020. Fumonisins – The underrated mycotoxins in poultry, livestock and humans. mycotoxinsite. Com
19. Dinolfo, M., Barros, G. and Stenglein, S., 2012. Development of a PCR assay to detect the potential production of nivalenol in Fusarium poae. FEMS Microbiology Letters 332: 99-104.
20. EU Commission. 2015. The European Parliament and The Council of the European Union Directive 2002/32/EC of 22 the European Parliament and of the Council of 7 May 2002 on undesirable substances in animal feed. Official Journal of the European Union. 32, 1–30.
21. European Commission. Comission recomendation of 14 January 2011 establishing guidelines for the distinction between feed materials, feed additives, biocidal products and veterinary medicinal products. 2011. Official Journal of the European Union. 75–79.
22. FAO & WHO. 2007. Animal Feed Impact on Food Safety; FAO: Rome, Itlay, 23. FAO. 2009. The State of Food and Agriculture; FAO: Rome, Italy. ISBN 9789251062159.
24. Faria C.B., Abe C.A.L., Novais da- silva C., Tessmann D.J., Barbosa Tesmann L.P. 2012. New PCR assays for the identification of Fusarium verticillioides, F. subglutinans, and other species of the Gibberella fujikuroi complex. International Journal of Molecular Sciences. 13: 115-132.
25. Femenias, A., Gatius, F., Ramos, A.J., Sanchis, V., Marín, S. 2020. Use of hyperspectral imaging as a tool for Fusarium and deoxynivalenol risk management in cereals: A review. Food Control. 108, 106819.
26. Ferrara M., Perrone G., Gallo A., Epifani F., Visconti A., Susca A., 2015. Development of loop-mediated isothermal amplification (LAMP) assay for the rapid detection of Penicillium nordicum in dry- cured meat products. International Journal of Food Microbiology. 202: 42-47.
27. Food Standards Agency Food.gov.uk. Available online: https://www.food.gov.uk/business-industry/farmingfood/animalfeed/what-farmanimals-eat (accessed on 4 December 2016).
28. Ginzinger D.G. 2002. Gene quantification using real-time quantitative PCR: An emerging technology hits the mainstream. Experimental Hematology. 30: 503-512.
29. Gu, Y., Wang, Y., Wu, X., Pan, M., Hu, N., Wang, J., Wang, S. 2019. Quartz crystal microbalance sensor based on covalent organic framework composite and molecularly imprinted polymer of poly(o-aminothiophenol) with gold nanoparticles for the determination of aflatoxin B1. Sensors and Actuators B Chemistry. 291, 293–297.
30. Guo J.R., Schnieder F., Beyer M., Verreet, J.A., 2005. Rapid detection of Mycosphaerella graminicola in wheat using reverse transcription- PCR assay. Journal of Phytopathology 153: 674-679.
31. He, B., Yan, X. 2019. An amperometric zearalenone aptasensor based on signal amplification by using a composite prepared from porous platinum nanotubes, gold nanoparticles and thionine-labelled graphene oxide. Microchimica Acta 2019, 186, 383.
32. Hossain, Z., Busman, M., Maragos, C.M. 2019. Immunoassay utilizing imaging surface plasmon resonance for the detection of cyclopiazonic acid (CPA) in maize and cheese. Analytical and Bioanalytical Chemistry. 411, 3543–3552.
33. Huang, X., Tang, X., Jallow, A., Qi, X., Zhang, W., Jiang, J., Li, H., Zhang, Q., Li, P. 2020. Development of an Ultrasensitive and Rapid Fluorescence Polarization Immunoassay for Ochratoxin A in Rice. Toxins. 12, 682.
34. Khan, R., Ben Aissa, S., Sherazi, T.A., Catanante, G., Hayat, A., Marty, J.L. 2019. Development of an Impedimetric Aptasensor for Label Free Detection of Patulin in Apple Juice. Molecules. 24, 1017.
35. Kim S.W., Li Z., Moore P.S., Monaghan A.P., Chang Y., Nichols M., John B. 2010. A sensitive non-radioactive northern blot method to detect small RNAs. Nucleic Acids Research. 38: 98-110.
36. Klemsdal S.S., Elen O. 2006. Development of a highly sensitive nested PCR method using a single closed tube for detection of Fusarium culmorum in cereal samples. Letters in Applied microbiology. 42: 544-548.
37. Kristensen R., Gauthier G., Berdal K.G., Hamels S., Remacle J., Holst Jensen A., 2007. DNA microarray to detect and identify trichotheceneand moniliformin-producing Fusarium species. Journal of Applied Microbiology 102: 1060-1070.
38. Laforgue R., Guérin L., Pernelle J.J., Monnet C., Dupont J., Bouix M., 2009. Evaluation of PCR-DGGE methodology to monitor fungal communities on grapes. Journal of Applied Microbiology 107: 1208-1218.
39. Long A.A. 1998. In situ polymerase chain reaction: foundation of the technology and today’s options. European Journal of Histochemistry 42: 101-109.
40. López-Ruiz, R., Romero-González, R., Frenich, A.G. 2019. Metabolomics approaches for the determination of multiple contaminants in food. Current Opinion in Food Science. 28, 49–57.
41. Moeller E.M., Chelkowski J., Geiger H.H. 1999. Species-specific PCR assays for the fungal pathogens Fusarium moniliforme and Fusarium subglutinans and their application to diagnose maize ear rot. Journal of Phytopathology. 147: 497-508.
42. Oliveira, I.S., Junior, A.G.D.S., De Andrade, C.A.S., Oliveira, M.D.L. 2019. Biosensors for early detection of fungi spoilage and toxigenic and mycotoxins in food. Current Opinion in Food Science. 29, 64–79.
43. Ottoboni, M., Pinotti, L., Tretola, M., Giromini, C., Fusi, E., Rebucci, R., Grillo, M., Tassoni, L., Foresta, S., Gastaldello, S. et al. 2018. Combining E-Nose and Lateral Flow Immunoassays (LFIAs) for Rapid Occurrence/Co-Occurrence Aflatoxin and Fumonisin Detection in Maize. Toxins. 10, 416.
44. Pereira, C.S., Cunha S.C., Fernandes, J.O. 2019. Prevalent mycotoxins in animal feed: occurrence and analytical methods. Toxins. 11, 290.
45. Porter-Jordan, K., Rosenberg, E.I., Keiser, J.F., Gross, J.D., Ross, A.M., Nasim, S. and Garrett, C.T., 1990. Nested polymerase chain reaction assay for the detection of cytomegalovirus overcomes false positives caused by contamination with fragmented DNA. Journal of Medical Virology 30: 85-91.
46. Priyanka S.R., Mudili D.V., Balakrishna K.S., Murali H., Batra H., 2015. Development and evaluation of a multiplex PCR assay for simultaneous detection of major mycotoxigenic fungi from cereals. Journal of Food Science and Technology 52: 486-492.
47. Rahman H, Ur., Yue X., Yu Q., Zhang W., Zhang Q., Li P. 2020. Current PCR-based methods for the detection of mycotoxigenic fungi in complex food and feed matrices. World Mycotoxin Journal, 13 (2): 139-150.
48. Ramana M.V., Balakrishna K., Murali H.C.S., Batra H.V. 2011. Multiplex PCR based strategy to detect contamination with mycotoxigenic Fusarium species in rice and finger millet collected from southern India. Journal of the Science of Food and Agriculture. 91: 1666-1673.
49. Rashmi R., Ramana M.V., Shylaja R., Uppalapati S.R., Murali H.S., Batra H.V., 2013. Evaluation of a multiplex PCR assay for concurrent detection of four major mycotoxigenic fungi from foods. Journal of Applied Microbiology 114: 819-827.
50. Rytkönen K.T., Williams T.A., Renshaw G.M., Primmer C.R., Nikinmaa M. 2011. Molecular evolution of the metazoan PHD-HIF oxygen-sensing system. Molecular Biology and Evolution. 28: 1913–1926
51. Schulz, K., Pöhlmann, C., Dietrich, R., Märtlbauer, E., Elßner, T. 2019. Electrochemical Biochip Assays Based on Anti-idiotypic Antibodies for Rapid and Automated On-Site Detection of Low Molecular Weight Toxins. Frontiers in Chemistry. 7, 31.
52. Silva J.J., Viaro H.P., Ferranti L.S., Oliveira A.L.M., Ferreira J.M., Ruas C.F., Ono E.Y.S., Fungaro M.H.P. 2017. Genetic structure of Fusarium verticillioides populations and occurrence of fumonisins in maize grown in southern Brazil. Crop Protection. 99: 160-167.
53. Singh A., Kumar N., 2013. A review on DNA microarray technology. International Journal of Current Research and Reviews. 5: 01–05.
54. Smith M.C., Madec S., Coton E., Hymery N. 2016. Natural Co-occurrence of mycotoxins in foods and feeds and their in vitro combined toxicological effects. Toxins. 8, 94.
55. Sreenivasa M.Y., Dass R.S., Charithraj A.P., Janardhana G.R., 2007. PCR method for the detection of genus Fusarium and fuonisin producing isolates from freshly harvested sorghum grains grown in Karnataka, India. J food saf. 28, 236-247.
56. Sreenivasa M.Y., Gonzalez Jaen M.T., Dass R.S., Charithraj A.P., Janrdhana G.R., 2008. A PCR based assay for the detetction and differentiation of potential fumonisin producing Fusarium verticillioides isolated from maize kernels. Food biotechnol. 22, 160-170.
57. Tomita N., Mori Y., Kanda H., Notomi T., 2008. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products. Nature Protocols 3: 877-882.
58. Visentin I., Montis V., Doll K., Alabouvette C., Tamietti G., Karlovsky P., Cardinale F. 2012. Transcription of genes in biosynthetic pathway for fumonisin mycotoxins is epigenetically and differentially regulated in the fungal maize pathogen Fusarium verticillioides. Eukaryotic cell. 11: 252-259.
59. Zhang, X., Tang, Q., Mi, T., Zhao, S., Wen, K., Guo, L., Mi, J., Zhang, S., Shi, W., Shen, J., et al. 2018. Dual-wavelength fluorescenc polarization immunoassay to increase information content per screen: Applications for simultaneous detection of total aflatoxin and family zearalenones in maize. Food Control. 87, 100–108.
60. Zhao Y., Liu N., Niu, J.X. 2009. A study of the distribution of apple stem pitting virus in tissues of pear tree using in situ hybridization and in situ RT-PCR. Agricultural Sciences in China 8: 1351-1359.




 Prevención de micotoxicosis
Prevención de micotoxicosis