Prof. Adjunto Panagiotis Tassis
Profesor Adjunto de Medicina y Reproducción Porcina, Clínica de Animales de Granja, Facultad de Medicina Veterinaria, Universidad Aristóteles de Tesalónica, Grecia
Los programas de vacunación en las granjas porcinas son una herramienta preventiva fundamental frente a una amplia gama de enfermedades y síndromes que afectan a los cerdos. Tienen una importancia colosal en términos de salud y productividad del grupo, así como desde el punto de vista financiero.
Por lo tanto, la selección apropiada de vacunas y su aplicación correcta son la base para la construcción de una inmunidad de grupo que contrarrestará la presión antigénica durante las diferentes etapas productivas.
Como ya se ha señalado en la literatura correspondiente, las micotoxinas parecen desempeñar un papel importante en la obstaculización de esta importante herramienta preventiva1.
En nuestro anterior artículo técnico sobre los efectos de las principales micotoxinas sobre el sistema inmunitario de los cerdos y los mecanismos celulares y moleculares involucrados, se señalaba que el impacto sanitario y económico de las micotoxinas sobre el sistema de defensa inmunitario porcino es significativo.
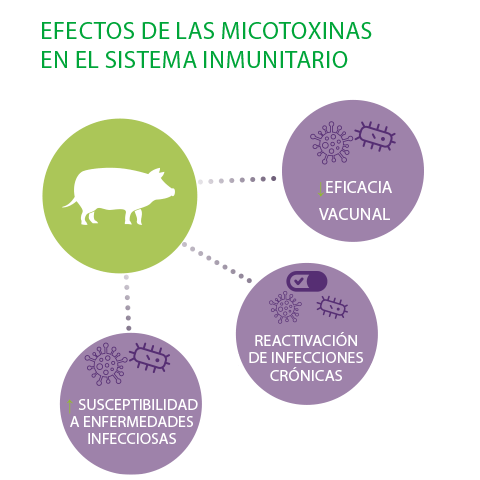
Se han descrito tres consecuencias importantes de estos efectos sobre el sistema inmunitario de los cerdos, la salud del grupo y la productividad2:
- ⇰ Aumento de la susceptibilidad a las enfermedades infecciosas
- ⇰ Reactivación de las infecciones crónicas
- ⇰ Disminución de la eficacia de la vacunación
Se presentarán los conocimientos actuales sobre los efectos de las aflatoxinas (AF), las fumonisinas (FB, principalmente, FB1), el deoxinivalenol (DON), la zearalenona (ZEN), la ocratoxina A (OTA) y la toxina T-2, sobre la respuesta inmunitaria tras la sensibilización o la vacunación en el cerdo.
Vacunas para cerdos e inmunidad vacunal
La aplicación de vacunas de uso veterinario en la producción porcina es un instrumento de prevención de enfermedades que se viene utilizando ampliamente por los productores de todo el mundo en una gran variedad de sistemas de producción.
Aunque se aplica en todos los sistemas convencionales de producción porcina. En las últimas décadas, los hechos en el campo de la producción de nuevas vacunas han cambiado rápidamente.
El desarrollo de vacunas porcinas es un campo de investigación e innovación que evoluciona rápidamente.
Entre las principales enfermedades porcinas que pueden prevenirse o controlarse a nivel de campo mediante el uso de las vacunas disponibles en el mercado, como parte de un programa sanitario veterinario, figuran:
- ✔ Síndrome Reproductivo y Respiratorio Porcino (PRRS)
- ✔ Enfermedades asociadas al Circovirus porcino tipo 2 (PCV2-AD)
- ✔ Enfermedad de Aujeszky (PRV)
- ✔ Infeccion por Parvovirus (PPV)
- ✔ Influenza Porcina (SIV)
- ✔ Neumonía Enzoótica (Mycoplasma hyopneumoniae)
- ✔ Pleuroneumonçia (App – Actinobacillus Pleuropneumoniae)
- ✔ Enfermedad de Glasser (Haemophilus parasuis)
- ✔ Rinitis atrófica (Pasteurella multocida ± Bordetella bronchiseptica)
- ✔ Erisipela (Erysipelothrix rhusiopathiae)
- ✔ Leptospirosis (Leptospira spp.)
- ✔ Infecciones por Escherichia coli
- ✔ Infecciones por Clostridium spp.
- ✔ Ileitis (Lawsonia intracellularis)
- ✔ Peste Porcina Clásica
- ✔ Salmonella spp. y otros
 En casos como el de la Peste Porcina Africana recientemente introducida en la región europea, no hay vacunas comerciales disponibles hasta el momento. Sin embargo, se están llevando a cabo actividades de investigación y desarrollo4.
En casos como el de la Peste Porcina Africana recientemente introducida en la región europea, no hay vacunas comerciales disponibles hasta el momento. Sin embargo, se están llevando a cabo actividades de investigación y desarrollo4.
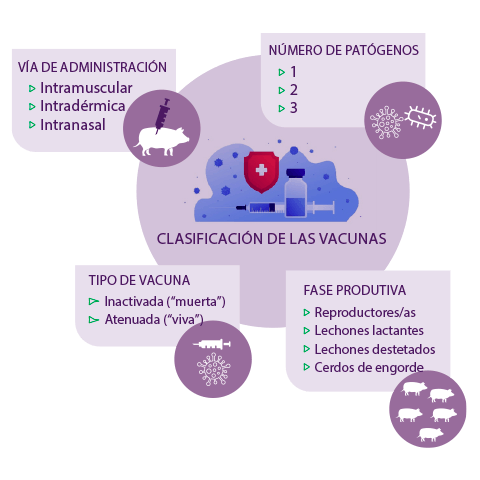
Aparte de la típica vacunación intramuscular frente a un patógeno, las innovaciones tecnológicas en materia de vacunas de las últimas décadas han dado lugar a la producción de vacunas intradérmicas, vacunas intranasales, así como vacunas frente a más de un patógeno, llegando hasta tres patógenos porcinos en una sola vacuna en la actualidad.
Las vacunas para cerdos suelen estar “muertas” (inactivadas) o “vivas” (atenuadas) y pueden utilizarse en diferentes etapas de la producción porcina, desde reproductores/as hasta lechones lactantes, destetados o cerdos de engorde, según la vacuna, su patógeno objetivo y el programa de administración recomendado.
 El éxito de la vacunación se traducirá en una respuesta humoral adecuada y oportuna para neutralizar al patógeno específico en la población y etapa de producción más susceptible en un grado aceptable.
El éxito de la vacunación se traducirá en una respuesta humoral adecuada y oportuna para neutralizar al patógeno específico en la población y etapa de producción más susceptible en un grado aceptable.El éxito de la vacuna incluye:
- ✔ Reducción del número de animales infectados y susceptibilidad a la infección frente a un patógeno específico
- ✔ Reducción del número de animales portadores de patógenos (reducción de la propagación de patógenos en términos de tiempo y carga microbiana)
- ✔ Mejora los niveles de inmunidad de grupo
El fracaso de las vacunas es un tema de gran preocupación debido a los graves efectos que tiene en la salud y la productividad de las granjas. Hasta el momento se han descrito muchas razones para tal fracaso, incluyendo causas ambientales y de manejo, tales como:
- ✘ Almacenamiento, manipulación y administración inadecuados de las vacunas
- ✘ Momento incorrecto de la vacunación y otras

 Sin embargo, se ha prestado poca atención al impacto de los piensos contaminados con micotoxinas como motivo del fracaso de las vacunas en las condiciones de campo.
Sin embargo, se ha prestado poca atención al impacto de los piensos contaminados con micotoxinas como motivo del fracaso de las vacunas en las condiciones de campo.
No obstante, los resultados de investigaciones recientes demuestran la capacidad de varias micotoxinas para afectar la respuesta humoral inducida por las vacunas, lo que tiene un impacto significativo en los resultados de salud y productividad.
Efectos de los tricotecenos en la inmunidad vacunal
DON
 Los efectos inmunoestimulantes o inmunosupresores
Los efectos inmunoestimulantes o inmunosupresores
del DON dependen de la dosis, frecuencia y duración de la exposición5.
Se ha sugerido que las dosis elevadas de DON (superiores a 10 μM), causan apoptosis de linfocitos, lo que resulta en inmunosupresión, mayor susceptibilidad a las infecciones, reactivación de infecciones latentes y reducción de la eficacia vacunal6.
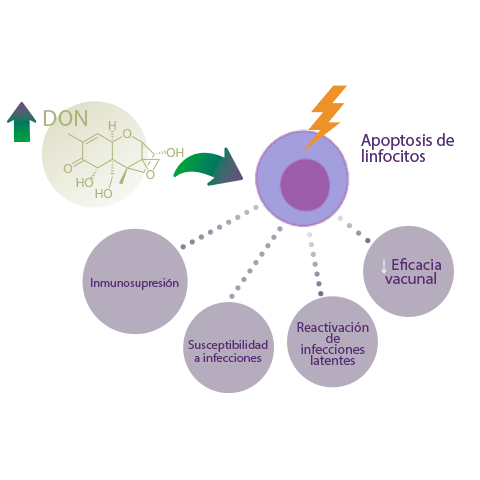
 Según una revisión anterior7, los tricotecenos pueden generar un ambiente de “evasión inmunitaria” que permite a los patógenos escapar de las defensas inmunitarias del huésped y de la vacuna.
Según una revisión anterior7, los tricotecenos pueden generar un ambiente de “evasión inmunitaria” que permite a los patógenos escapar de las defensas inmunitarias del huésped y de la vacuna.Tras la exposición a DON, se ha demostrado la inhibición de la respuesta inmunitaria tras la vacunación frente a parvovirus porcino en ratas8.
Otros tres estudios en los que se utilizó la inmunización con ovoalbúmina (OVA) sugirieron que el DON afecta a la respuesta de las inmunoglobulinas anti-OVA9-11.
1. En el primer estudio (2,2-2,5 mg DON/kg de alimento, cerdos destetados durante 9 semanas), el DON aumentó las IgA e IgG específicas de OVA, mientras que se observó un efecto bifásico de la toxina sobre la proliferación de linfocitos tras la estimulación de antígenos (aumento en día 21 post-exposición y disminución entre los días 35 y 49 post-exposición), junto con una menor expresión de ARNm de TGF-β e IFN-β.
2. En un segundo estudio, se evidenciaron niveles 3,5 veces mayores los títulos de IgG anti-OVA en comparación con los animales control (3,5 mg de DON/kg de alimento durante 42 días) dos semanas después de la primera inmunización frente a OVA (día 7 del estudio).
3. En este último estudio, siete días después de una segunda inmunización frente a OVA (día 21 del estudio) los niveles de IgG anti-OVA fueron similares entre los grupos (animales alimentados con DON vs. animales control).
⇰ Los niveles de IgA anti-OVA en ese estudio fueron similares entre los dos grupos experimentales hasta una semana antes del final del período de estudio, y luego se redujeron en los animales tratados con DON10.
Según un estudio reciente11 en el que se inmunizó a los cerdos con vacunas frente a OVA, PRV, Peste Porcina y circovirus porcinos, la ingestión de piensos contaminados con 1,0 y 3,0 mg de DON /kg de pienso redujo el título de anticuerpos frente a circovirus porcinos en el suero de los cerdos, mientras que los niveles de título de anticuerpos séricos frente OVA no se vieron afectados.
⇰ No obstante, cabe resaltar que la inhibición de la expresión del IFN-γ (como se ha sugerido anteriormente) y de los receptores Toll-like (TLR), ayuda a los patógenos a escapar de la defensa inmunitarias del hospedador y de la vacuna12.

En un ensayo de alimentación de 28 días con 0,15, 1,5 o 3 mg DON/kg de alimento13 y la subsiguiente inmunización con glóbulos rojos de oveja, se observaron picos de títulos retardados (una semana más tarde) en animales alimentados con DON, en comparación con los animales control.
⇰ Además, tras la administración de 1,8 o 4,7 mg de DON/kg de pienso (cerdos de más de 25,3 kg de peso corporal al comienzo del ensayo) se observó una reducción dosis-dependiente significativa de la respuesta de los anticuerpos secundarios al toxoide tetánico en comparación con el grupo control14.
⇰ Además, después administrar alimento contaminado con una mezcla de 1,0 mg DON/kg y 250μg ZEN/kg y la doble vacunación frente a PRV, los títulos de anticuerpos de PRV disminuyeron significativamente 14 días después de la vacunación de refuerzo15.
De manera bastante similar, en el estudio de Gutzwiller et al.16, se alimentó a los cerdos con 3,2 mg de DON y 0,06 mg de ZEN o 2,1 mg de DON y 0,25 mg de ZEN/ kg de dieta y se les administró la vacuna frente a VPP (una décima parte de la dosis recomendada).
⇰ En ese estudio, la exposición a las micotoxinas no afectó la producción de anticuerpos, probablemente debido a la administración de una dosis baja de vacuna y al corto intervalo de tiempo entre la vacunación y la determinación del nivel de anticuerpos.
DON vs VACUNACIÓN FRENTE A PRRS & PCV2
Según una serie de estudios sobre los efectos de DON en la respuesta inmunitaria frente a los virus PRRS y PCV2, se han presentado hallazgos muy interesantes17-20.
⇰ Los principales hallazgos incluyen que la ingestión de alimentos contaminados con DON puede disminuir la respuesta inmunitaria frente al PRRSV e influir en el curso de la infección de PRRS en los cerdos.
En el estudio de Savard et al.17, los lechones recibieron dietas contaminadas de forma natural con DON (2,5 y 3,5 mg/kg) y luego fueron inoculados con PRRSV.
⇰ Los efectos in vivo de la ingestión de DON corroboraron un efecto negativo de la toxina en las respuestas humorales específicas frente a PRRSV (la ingestión de DON a 2,5 mg/kg disminuyó significativamente las respuestas humorales específicas frente a PRRSV), así como la amplificación de los efectos negativos atribuidos al PRRS, como los relativos al aumento de peso, las lesiones pulmonares y la mortalidad.
⇰ Sin embargo, ese efecto no se asoció con un aumento significativo de la replicación viral, ya que la ingestión de DON dio lugar a una disminución de la replicación del PPRSV.
En un estudio in vitro (las células permisivas infectadas con PRRSV fueron tratadas con 140-280 ng/ml de DON) realizado por el mismo grupo de investigación18, se observó algo similar, es decir, que la replicación del PRRSV se inhibió significativamente.
Además, se ha demostrado que DON puede disminuir la replicación de la cepa vacunal atenuada del PRRSV en cerdos vacunados y su respuesta de anticuerpos a la vacuna19.
⇰ Esta conclusión significativa concuerda con los resultados de un estudio realizado con ratones expuestos a DON y vacunados con PPV inactivado en el que se demostró la interrupción de la respuesta inmunitaria a la vacuna mediante la modulación de citoquinas y quimioquinas específicas22.
Además, en otro estudio con cerdos, DON aumentó la gravedad de la infección viral en presencia del virus del circovirus porcino tipo 2 (PCV2)20.
⇰ Los resultados mostraron que la viremia y la carga viral pulmonar tendían a ser más altas en los animales que ingirieron una dieta contaminada con DON de 2,5 mg/kg (a los cerdos se les inoculó el virus PCV2b).
⇰ Sin embargo, el DON no tuvo un efecto significativo en la manifestación clínica de PCV2-AD.
Los autores de este último estudio señalaron que el DON no tiene efectos potenciadores claros, ni in vitro ni in vivo, en el desarrollo de la infección por PCV2, a pesar del ligero aumento de la replicación viral.
No obstante, se puede concluir que la exposición al DON puede obstaculizar el desarrollo de respuestas inmunitarias protectoras inducidas por las vacunas.
TOXINA T-2
 Se ha señalado que la toxina T-2 es inmunotóxica, por sus atributos citotóxicos, apoptóticos o inmunosupresores23.
Se ha señalado que la toxina T-2 es inmunotóxica, por sus atributos citotóxicos, apoptóticos o inmunosupresores23.
Un estudio sobre la vacunación frente a enteritis necrótica B (NEB) en cerdos que recibieron 5 mg de T-2/ kg de pienso dio como resultado una reducción significativa de los niveles de anticuerpos frente a NEB en los animales expuestos a T-224.
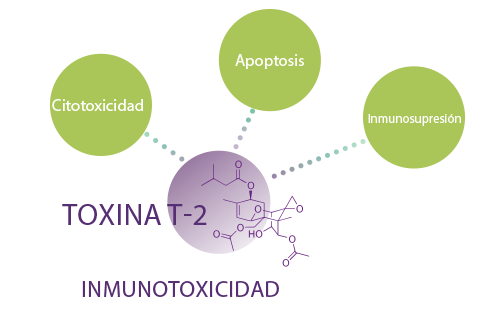
La inmunosupresión ocasionada por la T-2 también se ha observado en otro estudio de alimentación con cerdos (0,5-3,0 mg de T-2/kg de pienso), en el que se inmunizó a los animales con globulina de caballo.
⇰ Los resultados indicaron una reducción de la síntesis de anticuerpos anti-globulina de caballo, mientras que también se observó una disminución, dosis- dependiente de los elementos linfoides en el timo y el bazo25.
Tras la inmunización frente a OVA, las dosis subclínicas de toxina T-2 indujeron un aumento temprano y transitorio de la concentración plasmática total de IgA, pero una disminución de los títulos de IgG anti-OVA.
⇰ Los cerdos alimentados con 1,324 o 2,102 mg de toxina T-2/kg exhibieron una producción reducida de anticuerpos anti-OVA el día 21 sin alteración significativa de la proliferación de linfocitos específicos26.
Efectos de las Fumonisinas en la inmunidad vacunal
Las FBs inhiben competitivamente las ceramidas sintasas (CerS), un grupo de enzimas clave en la biosíntesis de la ceramida y los esfingolípidos más complejos, lo que resulta en la alteración del metabolismo de los esfingolípidos, mientras que también se han relacionado con la alteración de la respuesta inmunitaria innata y adquirida, incluida la reducción de la respuesta de anticuerpos específicos durante la vacunación27,28.
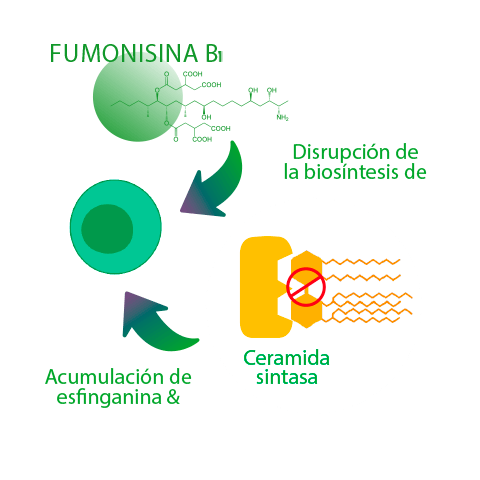
Estudios anteriores han demostrado que la FB1 modifica el equilibrio de las citoquinas Th1/Th2 (T-helper 1/T-helper 2) en los cerdos de manera similar a una respuesta humoral alterada27,29.
La exposición in vivo (28 días) de lechones destetados a pienso contaminado con 8 mg de FB1/ kg disminuyó significativamente la expresión del ARNm de IL-4 (la IL-4 es una citoquina Th2 implicada en la respuesta humoral) por parte de los glóbulos rojos porcinos y disminuyó el título de anticuerpos específicos tras la vacunación frente a Mycoplasma agalactiae27.
[/column]
En un estudio bastante similar con FB1 (8 mg de FB1/kg de alimento), se observaron, en relación con el sexo, niveles significativamente menores de anticuerpos específicos tras la vacunación frente a Mycoplasma agalactiae, así como el nivel de expresión de ARNm de IL-10, lo que demuestra los efectos inmunosupresores de la toxina.
Tales diferencias en la respuesta inmunitaria específica se observaron en los cerdos machos, pero no en las hembras29.
[/container]
En un estudio realizado por Grenier et al.30, los cerdos recibieron una dieta contaminada con DON (3 mg/kg) o FB (6 mg/kg) o ambas toxinas y fueron inmunizados dos veces con OVA.
⇰ La ingestión de dietas contaminadas con DON o FB individualmente o en combinación alteró la producción de inmunoglobulinas tras la inmunización frente a OVA y redujo la concentración plasmática de IgG anti-OVA.
⇰ Se observó un aumento de IgA específico en los animales que recibían una dieta contaminada con DON, pero no en los que recibían DON y FB combinados, posiblemente debido a la interferencia del FB a nivel intestinal por su acción sobre los esfingolípidos.
⇰ Al mismo tiempo, se demostró una reducción de la proliferación de linfocitos tras la estimulación con OVA en los animales que recibieron cualquiera de las tres dietas contaminadas (DON, FB, o DON y FB combinadas).
La respuesta inmunitaria humoral se vio considerablemente alterada, con una fuerte disminución de los niveles de anticuerpos a los 21 y 35 días tras la vacunación en cerdos expuestos a 0,5 mg de OTA/kg de pienso y/o 10 mg de FB1/kg de pienso durante tres meses, y vacunados frente a la enfermedad de Aujeszky (Herpesvirus Suid 1 [SuHV1])31.
Esa alteración en el nivel de anticuerpos fue detectada en animales alimentados con ambas micotoxinas, ya sea solas o en combinación.
En otro estudio con lechones expuestos a una dosis baja de FB1 por vía oral (1 mg de FB1/kg de peso corporal) durante 10 días, se observó una excreción más prolongada de Escherichia coli enterotoxigénica F4(+) ETEC tras la infección y una menor inducción de la respuesta inmunitaria específica de antígenos tras la inmunización oral32.
⇰ Tanto las células secretoras de anticuerpos IgM e IgA específicos de F4 se redujeron tras la exposición a FB1 y los autores sugirieron que la FB1 podría interferir con la fase de inducción de la respuesta inmunitaria debido a la reducción in vivo de la maduración de las células presentadoras de antígeno.
Por otra parte, pocos estudios particulares han demostrado la ausencia de efectos significativos atribuidos a la FB sobre la respuesta inmunológica tras la vacunación.
La exposición de los lechones a piensos contaminado con FB1 durante un período de hasta 4 meses (1, 5 y 10 mg de FB1/kg de pienso) no afectó significativamente a sus títulos de anticuerpos frente a la enfermedad de Aujeszky33.
De manera bastante similar, los cerdos alimentados con bajos niveles de pienso contaminado con FB (2 mg FB1/kg de material contaminado/día durante 5 semanas) y vacunados con la vacuna frente a PRV mostraron la ausencia de un efecto significativo atribuido a la FB en los títulos de anticuerpos frente a PRV34.

Efectos de la Zearalenona en la inmunidad vacunal
 La ZEN tiene un importante poder estrogénico en los cerdos, pero también se ha sugerido como un compuesto inmunotóxico35.
La ZEN tiene un importante poder estrogénico en los cerdos, pero también se ha sugerido como un compuesto inmunotóxico35.
Pocos estudios han investigado los efectos de la ZEN en la respuesta inmunitaria humoral tras la vacunación con una vacuna comercial u otro tipo de inmunización en cerdos.
⇰ No obstante, el efecto de los estrógenos en el sistema inmunológico ha recibido atención debido a su actividad inmunomoduladora en las respuestas celulares y la producción de anticuerpos35.
Un estudio realizado con ZEN en ratas (micotoxina administrada por sonda a dosis de 0, 1, 5 y 30 mg/kg durante 36 días) y la posterior administración de la vacuna frente a PPV inactivada (por vía intraperitoneal), reveló que la ZEN, con o sin desafío inmunológico, puede disminuir las inmunoglobulinas en el suero y las citoquinas en los órganos linfoides36.
En un estudio con cerdos que recibieron ZEN (niveles dietéticos de 1,1 a 3,2 mg/kg de alimento durante 18 días) y una vacuna viva frente a peste porcina, se demostró que los títulos de anticuerpos específicos en el grupo tratado con ZEN (2,0 y 3,2 mg/kg) eran significativamente más bajos 18 días después de la inmunización en comparación con el grupo de control, de manera dosis-dependiente.
Los niveles de IgM mostraron una tendencia a disminuir linealmente con el aumento de los niveles de ZEN, lo que indica que la ZEN (3,2 mg/kg) inhibía la inmunidad humoral de los lechones, mientras que también se sugirió que la ZEN puede afectar al metabolismo proteico37.
Adicionalmente, se ha señalado que los efectos de la ZEN en la respuesta inmunitaria humoral podrían estar relacionados con efectos específicos sobre los receptores, ya que la ZEN es un agonista de los receptores de estrógeno α (ERα) y un agonista antagonista mixto de ERβ, con un posible antagonismo completo del receptor ERβ expresado en linfocitos B35.

Efectos de las Aflatoxinas en la inmunidad vacunal
 Durante más de medio siglo, se ha reportado el efecto perjudicial de las AFs en la respuesta vacunal.
Durante más de medio siglo, se ha reportado el efecto perjudicial de las AFs en la respuesta vacunal.
Se ha demostrado que la AFB1 interfiere en el desarrollo de la inmunidad adquirida en los cerdos tras la vacunación frente a erisipela con un preparado de bacterias (una suspensión de bacterias muertas) de E. rhusiopathiae y aumenta la gravedad de la infección por E. rhusiopathiae38.
En un estudio anterior que incluyó la ingestión de dosis bajas de AFs (140 y 280 ppb durante 4 semanas) se observó una tendencia a la reducción de la respuesta inmunitaria frente a Mycoplasma agalactiae (grupo tratado con 280-ppb)39.
Estudios previos con cerdos tratados con AFs mostraron resultados contradictorios.
⇰ Joens et al.40 presentaron títulos de hemaglutinación significativamente más bajos frente a Treponema hyodysenteriae (nombre utilizado en la actualidad: Brachyspira hyodysenteriae como agente causante de la disentería porcina), mientras que la ingestión de AFs no alteró la respuesta humoral de los cerdos destetados a los glóbulos rojos de las ovejas41 o a Erysipelothrix rhusiopathiae42 en otros estudios.
Además, tras la inmunización de cerdos frente a OVA y la exposición simultánea a AFB1 (385 μg AFB1/kg de pienso; 867 μg AFB1/kg de pienso o 1807 μg AFB1/kg de pienso) se constató la ausencia de un efecto notable en la inmunidad humoral (concentraciones de IgA, IgG e IgM totales y de IgG específicas anti-OVA), pero se observó un descenso en la activación de los linfocitos43.
⇰ En ese estudio posterior, los autores sostuvieron que la exposición a AFB1 no da lugar a una modulación significativa de la respuesta inmunitaria humoral, aunque puede inducir un aumento de IgA sin llegar a niveles estadísticamente significativos.
Los hallazgos de otra investigación en ratones44 sobre la implicación del AFB1 en la replicación del virus de la gripe porcina (SIV) in vitro e in vivo, demostraron que 10-40μg/kg de AFB1 in vivo favorece la replicación del SIV, inflamación y daño pulmonar al activar la señalización TLR4-NFkB.
Efectos de la Ocratoxina A en la inmunidad vacunal
 La OTA tiene un modo de acción nefrotóxico significativo bien descrito, al tiempo que se ha sugerido como un compuesto que puede afectar la respuesta inmunitaria en los cerdos.
La OTA tiene un modo de acción nefrotóxico significativo bien descrito, al tiempo que se ha sugerido como un compuesto que puede afectar la respuesta inmunitaria en los cerdos.
 Se ha señalado que la inmunosupresión es el primer efecto tóxico manifiesto de la OTA que puede evidenciarse clínicamente antes de la nefropatía45.
Se ha señalado que la inmunosupresión es el primer efecto tóxico manifiesto de la OTA que puede evidenciarse clínicamente antes de la nefropatía45.En un estudio con 1 mg OTA/kg de pienso suministrado a los cerdos durante un máximo de tres semanas, se inmunizó a los animales frente a la diarrea hemorrágica por Salmonella choleraesuis45.
⇰ Los resultados demostraron una inmunosupresión asociada a la OTA (reducción del título medio de anticuerpos en el día 21 postinmunización) y un retraso en la respuesta a la inmunización.
⇰ Además, se observó una mayor susceptibilidad a los agentes
infecciosos (infecciones por Brachyspira hyodysenteriae y Campylobacter coli).
Como se señaló en la sección sobre FB, también se describieron alteraciones en la respuesta inmunitaria humoral en un estudio in vivo con cerdos (500 μg OTA/kg de alimento durante 3 meses con o sin 10 mg de FB1/kg de alimento), en el que se observó una fuerte disminución del título de anticuerpos tras la inmunización frente a la Enfermedad de Aujesky (PRV)31.

Observaciones y conclusiones sobre las condiciones de campo
Tomados en conjunto, numerosos estudios han demostrado los efectos negativos de las micotoxinas antes mencionadas sobre la respuesta humoral tras la sensibilización o la vacunación.
La inmensa mayoría de las micotoxinas importantes para los cerdos han demostrado tener el potencial de inducir un claro efecto negativo en la respuesta inmunitaria frente a varios patógenos porcinos tras la vacunación de los cerdos.
Teniendo en cuenta que un programa de vacunación en la granja tiene una importancia enorme en términos de prevención de enfermedades, deben tenerse en cuenta los efectos de las micotoxinas.
 Sin embargo, es importante recordar que, en condiciones de campo, tales micotoxinas contaminan simultáneamente el alimento de los cerdos. Por tanto, el sistema inmunitario de los cerdos se ve afectado por más de una micotoxina, lo que podría dar lugar a varias interacciones en cuanto a la respuesta inmunitaria a la vacunación.
Sin embargo, es importante recordar que, en condiciones de campo, tales micotoxinas contaminan simultáneamente el alimento de los cerdos. Por tanto, el sistema inmunitario de los cerdos se ve afectado por más de una micotoxina, lo que podría dar lugar a varias interacciones en cuanto a la respuesta inmunitaria a la vacunación.
Cabe destacar que la presencia de micotoxinas en el alimento puede provocar una ruptura de la inmunidad vacunal y la aparición de la enfermedad incluso en lotes debidamente vacunados2.
 REFERENCIAS
REFERENCIAS
1. Oswald, I.P.; Marin, D.E.; Bouhet, S.; Pinton, P.; Taranu, I.; Accensi, F. Immunotoxicological risk of mycotoxins for domestic animals. Food Addit Contam. 2005, 22, 354-60. doi: 10.1080/02652030500058320.
2. Pierron, A.; Alassane-Kpembi, I.; Oswald, I.P. Impact of mycotoxin on immune response and consequences for pig health. Anim. Nutr. 2016, 2, 63-68. doi:10.1016/j.aninu.2016.03.001.
3. Gruber-Dorninger, C.; Jenkins, T.; Schatzmayr, G. Global Mycotoxin Occurrence in Feed: A Ten-Year Survey. Toxins 2019, 11, 375, doi:10.3390/toxins11070375.
4. Barasona, J.A., Gallardo, C., Cadenas-Fernández, E., Jurado, C., Rivera, B., Rodríguez-Bertos, A., Arias, M., Sánchez-Vizcaíno, J.M. First Oral Vaccination of Eurasian Wild Boar Against African Swine Fever Virus Genotype II. Front. Vet. Sci. 2019, 6, 137. doi: 10.3389/ fvets.2019.00137.
5. Pestka JJ, Zhou HR, Moon Y, Chung YJ. Cellular and molecular mechanisms for immune modulation by deoxynivalenol and other trichothecenes: unraveling a paradox. Toxicol. Lett., 2004, 153, 61–73. doi: 10.1016/j.toxlet.2004.04.023.
6. Maresca, M. From the gut to the brain: journey and pathophysiological effects of the food associated trichothecene mycotoxin deoxynivalenol. Toxins, 2013, 5(4), 784–820. doi: 10.3390/toxins5040784.
7. Wu, Q, Wu W, Franca TCC, Jacevic V, Wang X, Kuca K. Immune Evasion, a Potential Mechanism of Trichothecenes: New Insights into Negative Immune Regulations. Int J Mol Sci. 2018, 19, 3307. doi: 10.3390/ijms19113307.
8. Choi, B.K., Cho, J.H., Jeong, S.H., Shin, H.S., Son, S.W., Yeo, Y.K., Kang, H.G. Zearalenone affects immune-related parameters in lymphoid organs and serum of rats vaccinated with porcine parvovirus vaccine. Toxicol Res. 2012, 28, 279-88. doi: 10.5487/TR.2012.28.4.279. PMID: 24278621; PMCID: PMC3834426.
9. Pinton, P.; Accensi, F.; Beauchamp, E.; Cossalter, A-M.; Callu, P.; Grosjean, F.; Oswald, I.P. Ingestion of deoxynivalenol (DON) contaminated feed alters the pig vaccinal immune responses. Toxicol. Lett. 2008, 177, 215-222. doi:10.1016/j.toxlet.2008.01.015.
10. Lessard, M.; Savard, C.; Deschene, K.; Lauzon, K.; Pinilla, V.A.; Gagnon CA.; Lapointe, J.; Guay, F.; Chorfi, Y. Impact of deoxynivalenol (DON) contaminated feed on intestinal integrity and immune response in swine. Food Chem Toxicol. 2015, 80, 7-16.
11. Zhang, L., Ma, R., Zhu, M.-X., Zhang, N.-Y., Liu, X.-L., Wang, Y.-W., Qin, T., Zheng, L.-Y. Liu, Q., Zhang, W.-P., Karrow, N. A., Sun, L.-H. Effect of deoxynivalenol on the porcine acquired immune response and potential remediation by a novel modified HSCAS adsorbent. Food Chem Toxicol, 2020, 138, 11187. https://doi.org/10.1016/j.fct.2020.111187.
12. Wu, Q.H.; Wang, X.; Nepovimova, E.; Miron, A.; Liu, Q.Y.; Wang, Y.; Su, D.X.; Yang, H.L.; Li, L.; Kuca, K. Trichothecenes: Immunomodulatory effects, mechanisms, and anti-cancer potential. Arch. Toxicol. 2017, 91, 3737–3785.
13. Rotter, B.A.; Thompson, B.K.; Lessard, M.; Trenholm, H.L.; Tryphonas, H. Influence of low level exposure to Fusarium mycotoxins on selected immunological and hematological parameters in young swine. Fundam. Appl. Toxicol. 1994, 23, 117–124.
14. Overnes, G.; Matre, T.; Sivertsen, T.; Larsen, H.J.; Langseth, W.; Reitan, L.J.; Jansen, J.H.. Effects of diets with graded levels of naturally deoxynivalenol-contaminated oats on immune response in growing pigs. Zentralbl Veterinarmed A. 1997, 44, 539–550.
15. Cheng YH, Weng CF, Chen BJ, Chang MH. Toxicity of different Fusarium mycotoxins on growth performance, immune responses and efficacy of a mycotoxin degrading enzyme in pigs. Anim Res 2006, 55, 579-90. https://doi.org/10.1051/animres:2006032.
16. Gutzwiller, A.; Czegledi, L.; Stoll, P.; Bruckner, L. Effects of Fusarium toxins on growth, humoral immune response and internal organs in weaner pigs, and the efficacy of apple pomace as an antidote. J. Anim. Physiol. Anim. Nutr. 2007, 91, 432–438.
17. Savard C, Pinilla V, Provost C, Gagnon CA, Chorfi Y. In vivo effect of deoxynivalenol (DON) naturally contaminated feed on porcine reproductive and respiratory syndrome virus (PRRSV) infection. Vet Microbiol 2014a, 174, 419–26. doi:10.1016/j.vetmic.2014.10.019.
18. Savard C, Pinilla V, Provost C, Segura M, Gagnon CA, Chorfi Y. In vitro effect of deoxynivalenol (DON) mycotoxin on porcine reproductive and respiratory syndrome virus replication. Food Chem Toxicol 2014b, 65, 219–26. doi:10.1016/j.fct.2013.12.043.
19. Savard C, Gagnon CA, Chorfi Y. Deoxynivalenol (DON) naturally contaminated feed impairs the immune response induced by porcine reproductive and respiratory syndrome virus (PRRSV) live attenuated vaccine. Vaccine 2015a, 33, 3881–6. doi:10.1016/j. vaccine.2015.06.069.
20. Savard C, Provost C, Alvarez F, Pinilla V, Music N, Jacques M, et al. Effect of deoxynivalenol (DON) mycotoxin on in vivo and in vitro porcine circovirus type 2 infections. Vet Microbiol 2015b, 176, 257–67. doi:10.1016/j.vetmic.2015.02.004.
21. Thomson, B.J. Viruses and apoptosis. Int J Exp Pathol, 2001, 82, 65–76.
22. Choi, B.K., Jeong, S.H., Cho J.H., Shin, H.S., Son, S.W., Yeo, Y.K., Kang, H.G. Effects of oral deoxynivalenol exposure on immune-related parameters in lymphoid organs and serum of mice vaccinated with porcine parvovirus vaccine. Mycotoxin Res 2013, 29:185–192.
23. Bondy, G.S.; Pestka, J.J. Immunomodulation by fungal toxins. J. Toxicol. Environ. Health. B. Crit. Rev. 2000, 3, 109-143.
24. Rafai, P., Tuboly S. Effect of T-2 Toxin on Adrenocortical Function and Immune Response in Growing Pigs. Zbl. Vet. Med. B, 1982, 29, 558-565.
25. Rafai, P.; Tuboly, S.; Bata, A.; Tilly, P.; Vanyi, A.; Papp, Z.; Jakab, L. Tury, E. Effect of various levels of T-2 toxin in the immune system of growing pigs. Vet. Rec. 1995, 136, 511-514.
26. Meissonnier GM, Laffitte J, Raymond I, Benoit E, Cossalter AM, Pinton P, Bertin, G.; Oswald, I.P.; Galtier, P. Subclinical doses of T-2 toxin impair acquired immune response and liver cytochrome P450 in pigs. Toxicol. 2008a, 247, 46-54.
27. Taranu, I.; Marin, D.E.; Bouhet, S.; Pascale, F.; Bailly, J.D.; Miller, J.D.; Pinton, P.; Oswald, I.P. Mycotoxin fumonisin B1 alters the cytokine profile and decreases the vaccinal antibody titer in pigs. Toxicol Sci 2005, 84, 301-7.
28. EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain), Knutsen H-K, Alexander J, Barregard L, Bignami M, et al. Scientific opinion on the risks for animal health related to the presence of fumonisins, their modified forms and hidden forms in feed. EFSA J. 2018, 16, 5242, 144 pp. https://doi.org/10.2903/j.efsa.2018.5242.
29. Marin, D.E.; Taranu, I.; Pascale, F.; Lionide, A.; Burlacu, R.; Bailly, J.-D.; Oswald, I.P. Sex related differences in the immune response of weanling piglets exposed to low doses of fumonisin extract. Br. J. Nutr., 2006, 95, 1185-1192. doi: 10.1079/BJN20061773.
30. Grenier, B.; Loureiro-Bracarense, A.P.; Lucioli, J.; Pacheco, G.D.; Cossalter, A.M.; Moll, W.D.; Schatzmayr, G.; Oswald, I.P. Individual and combined effects of subclinical doses of deoxynivalenol and fumonisins in piglets. Mol Nutr Food Res 2011, 55, 761-71.
31. Stoev, S.D.; Gundasheva, D.; Zarkov, I.; Mircheva, T.; Zapryanova, D.; Denev, S.; Mitev, Y.; Daskalov, H.; Dutton, M.; Mwanza, M.; Schneider, Y.J. Experimental mycotoxic nephropathy in pigs provoked by a mouldy diet containing ochratoxin A and fumonisin B1. Experim. Toxicol. Pathol. 2012, 64, 733–741.
32. Devriendt, B.; Gallois, M.; Verdonck, F.; Wache, Y.; Bimczok, D.; Oswald, I.P.; Goddeeris B.M.; Cox E. The food contaminant fumonisin B1 reduces the maturation of porcine CD11R1+ intestinal antigen presenting cells and antigen-specific immune responses, leading to a prolonged intestinal ETEC infection. Vet. Res. 2009, 40, 40. doi:10.1051/vetres/2009023.
33. Tornyos, G., Kovacs, M., Rusvai, M., Horn, P., Fodor, J., Kovacs, F. Effect of dietary fumonisin B1 on certain immune parameters of weaned pigs. Acta Vet. Hung. 2003, 51, 171–179.
34. Gumprecht, L.A., Peavey, C., Zuckerman, F., Rottinghaus, G., Haschek, W., Wollenberg G. Effects of fumonisin on specific and nonspecific immunity in pigs after pseudorabies vaccination. Vet. Pathol. 1997, 34, 519.
35. Hueza, I.M.; Raspantini, P.C.; Raspantini, L.E.; Latorre, A.O.; Górniak, S.L. Zearalenone, an estrogenic mycotoxin, is an immunotoxic compound. Toxins 2014, 6, 1080-95.
36. Choi, B.K.; Cho, J.H.; Jeong, S.H.; Shin, H.S. Zearalenone affects immune-related parameters in lymphoid organs and serum of rats vaccinated with porcine Parvovirus vaccine. Toxicol. Res. 2012, 28, 279–288.
37. Yang L, Yang W, Feng Q, Huang L, Zhang G, Liu F, Jiang S, Yang Z. Effects of purified zearalenone on selected immunological measurements of blood in post-weaning gilts. Anim Nutr. 2016, 2, 142-148. doi: 10.1016/j.aninu.2016.04.008.
38. Cysewski, S.J.; Wood, R.L.; Pier, A.C.; Baetz, A.L. Effects of aflatoxin on the development of acquired immunity to swine erysipelas. Am J Vet Res 1978, 39, 445-8.
39. Marin, D.E.; Taranu, I.; Bunaciu, P.R.; Pascale, F.; Tudor, D.S.; Avram, N.; Sarca, M.; Cureu, I.; Criste, R.D.; Suta, V.; Oswald, I.P. Changes in performance, blood parameters, humoral and cellular immune response in weanling piglets exposed to low doses of aflatoxin. J Anim. Sci.2002, 80, 1250–1257.
40. Joens, L.A., Pier, A.C., Cutlip, R.C. Effects of aflatoxin consumption on the clinical course of swine dysentery. Am. J. Vet. Res 1981, 42,1170–1172.
41. van Heugten, E., Spears, J.W., Coffey, M.T., Kegley, E.B., Qureshi, M.A. The effect of methionine and aflatoxin on immune function in weanling pigs. J. Anim. Sci. 1994, 72, 658–664.
42. Pananagala, V.S., Giambrone, J.J., Diener, U.L., Davis, N.D., Hoerr, F.J., Mitra, A., Schultz, R.D., Wilt, G.R. Effects of aflatoxin on the growth performance and immune responses of weanling swine. Am. J. Vet. Res. 1986, 47, 2062–2067.
43. Meissonnier, G.M.; Pinton, P.; Laffitte, J.; Cossalter, A.M.; Gong, Y.Y.; Wild, C.P.; Bertin, G.; Galtier, P.; Oswald, I.P. Immunotoxicity of aflatoxin B1: impairment of the cell-mediated response to vaccine antigen and modulation of cytokine expression. Toxicol Appl Pharmacol 2008b, 231, 142-149.
44. Sun, Y.; Su, J.; Liu, Z.; Liu, D.; Gan, F.; Chen, X.; Huang, K. Aflatoxin B1 Promotes Influenza Replication and Increases Virus Related Lung Damage via Activation of TLR4 Signaling. Front Immunol. 2018, 9, 2297. doi: 10.3389/fimmu.2018.02297.
45. Stoev, S.D.; Goundasheva, D.; Mirtcheva, T.; Mantle, P.G. Susceptibility to secondary bacterial infections in growing pigs as an early response in ochratoxicosis. Experim. Toxicol. Pathol. 2000, 52, 287-296. doi: 10.1016/s0940-2993(00)80049-4.



 Prevención de micotoxicosis
Prevención de micotoxicosis