Milad Manafi
Departamento de Ciencia Animal, Facultad de Ciencias Agrícolas, Universidad de Malayer, Malayer, Irán.
[email protected]
La carne de pollo es saludable y puede producirse en cualquier lugar. Se encuentra entre las proteínas de origen animal relativamente más baratas y no está sujeta a ningún tipo de restricciones religiosas (Manafi et al., 2019).
Hay que adoptar medidas de seguridad e inocuidad de los alimentos dentro de la cadena alimentaria, desde los piensos hasta la alimentación humana.
⇰ La producción de una cantidad adecuada y asequible de piensos seguros son factores importantes a tener en cuenta, de lo contrario, esto puede llevar a la inseguridad alimentaria y a la malnutrición (Manafi et al., 2018a).

La contaminación con micotoxinas es un peligro potencial oculto que tiene una variedad de impactos adversos para la salud (Manafi y Khosravinia, 2013).
Para ser más precisos, las micotoxinas son los metabolitos secundarios producidos por diferentes especies de hongos (mohos) que se encuentran en alimentos ricos en hidratos de carbono como el cacahuete, la semilla de algodón, el maíz, el sorgo y los granos de cereales (Manafi et al., 2014a).
 Hay una serie de hongos que pueden producir diferentes micotoxinas cuando se juntan en situaciones favorables de condiciones de calor, falta de secado y aireación inadecuada (Manafi et al., 2012a). Hay una serie de hongos que pueden producir diferentes micotoxinas cuando se juntan en situaciones favorables de condiciones de calor, falta de secado y aireación inadecuada (Manafi et al., 2012a). |
Tal y como ha señalado la FAO, casi el 25% de los cultivos alimentarios y cereales producidos anualmente en el mundo están contaminados con micotoxinas, aunque esta cifra subestima en gran medida la presencia por encima de los niveles detectables (hasta el 60-80%) (Eskola et al., 2020).

Ello pone de manifiesto la importancia de la producción y distribución mundial de cereales desde dos puntos de vista diferentes:
- El rendimiento de la producción
- La calidad del producto
Se ha constatado que la contaminación de los piensos con aflatoxinas oscila entre 1 y 900μg/kg en ingredientes de uso común, así como en muestras de piensos mixtos, en los países en desarrollo (Mohanamba et al., 2007).
Los diferentes países han establecido sus niveles permitidos estándar para la importación y o el suministro de las materias primas para alimentar a sus animales de granja.
⇰ Esto es crucial saberlo, ya que la contaminación por micotoxinas comienza ya en la fase de producción y continúa durante la cosecha, el transporte y el almacenamiento, antes de llegar al cliente final en todos los rincones del mundo.
Los países en desarrollo tienen normas muy estrictas en esta materia, pero en algunos países, especialmente en África, la escasez de suministro de materias primas está afectando al nivel permitido (EUR-Lex., 2021).
 Como expertos, hay que conocer la variedad y los niveles de contenido de micotoxinas en el pienso que reciben. Una vez conocidos, los nutricionistas de la granja pueden pensar en cómo minimizar esos efectos adversos. Como expertos, hay que conocer la variedad y los niveles de contenido de micotoxinas en el pienso que reciben. Una vez conocidos, los nutricionistas de la granja pueden pensar en cómo minimizar esos efectos adversos. |
Se considera que, además de la intoxicación aguda y de los daños y lesiones hepáticas graves, estos metabolitos podrían ser la causa de un aumento de las deficiencias inmunitarias y del riesgo de cáncer en el ganado y, posteriormente, se transmitirían a los humanos, dando lugar a mutaciones genéticas cuando las micotoxinas están disponibles en los alimentos a largo plazo (Manafi et al., 2009).
En lo que respecta a las aves de corral, actualmente se considera que las aflatoxinas, las ocratoxinas y las toxinas T-2 son las micotoxinas más peligrosas (Tabla 1) desde el punto de vista de la seguridad alimentaria y regulatorio, además de afectar negativamente a los parámetros de producción avícola (Eskola et al., 2018).
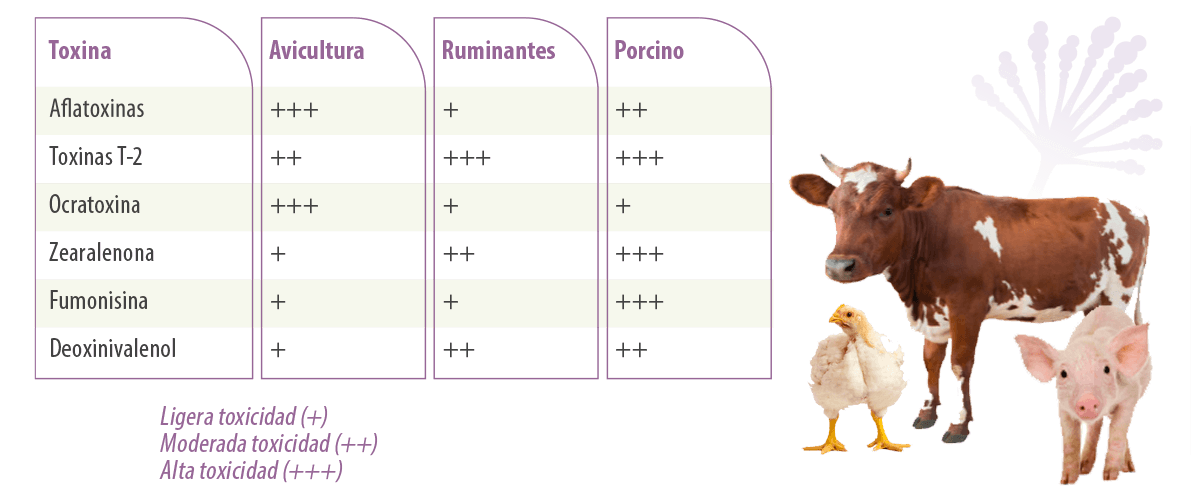
Tabla 1. Toxicidad relativa de diferentes micotoxinas en diferentes especies de ganado.

Aflatoxinas 
Entre los diversos tipos de micotoxinas, las aflatoxinas son altamente tóxicas, cancerígenas y causan una grave contaminación (Manafi, 2012).
Se han descrito aproximadamente 15 tipos de aflatoxinas, entre las cuales las familias «B» y «G» (aflatoxinas B1, B2, G1 y G2) son especialmente peligrosas para la producción animal, ya que se han encontrado en todos los principales cultivos alimentarios, cereales y sus productos derivados utilizados para la alimentación de animales y aves de corral.
⇰ Estos compuestos de origen natural son producidos principalmente por los hongos Aspergillus flavus, Aspergillus parasiticus y Aspergillus nomius, acarreando graves consecuencias para la salud a través de la contaminación de una amplia variedad de alimentos como el maíz que puede ser utilizado en la alimentación animal/avícola (Manafi et al., 2018b).
 Entre todas las aflatoxinas, la aflatoxina B1 (AFB1) es una toxina clave que está estrictamente regulada y controlada en cantidades muy pequeñas (a niveles menores de pbb) en los productos agrícolas que van a ser utilizados por el animal (EUR-Lex., 2021).
Entre todas las aflatoxinas, la aflatoxina B1 (AFB1) es una toxina clave que está estrictamente regulada y controlada en cantidades muy pequeñas (a niveles menores de pbb) en los productos agrícolas que van a ser utilizados por el animal (EUR-Lex., 2021).La aflatoxicosis, enfermedad asociada a grandes dosis de aflatoxinas provocando una intoxicación aguda, pone en peligro la vida, generalmente debido a daños en el hígado. Otros efectos adversos de las aflatoxinas son:
 Bajo rendimiento
Bajo rendimiento Inmunosupresión y mayor susceptibilidad a las infecciones
Inmunosupresión y mayor susceptibilidad a las infecciones Aumento de la susceptibilidad a otras enfermedades y aumento de la mortalidad
Aumento de la susceptibilidad a otras enfermedades y aumento de la mortalidad Disminución de la producción de huevos y del peso de los mismos
Disminución de la producción de huevos y del peso de los mismos Disminución de la incubabilidad y del peso de los pollitos
Disminución de la incubabilidad y del peso de los pollitos Aumento de la grasa hepática y disminución de la actividad de varias enzimas hepáticas
Aumento de la grasa hepática y disminución de la actividad de varias enzimas hepáticas Cambios en el peso de los órganos
Cambios en el peso de los órganos Reducción de los niveles de proteínas séricas
Reducción de los niveles de proteínas séricas Hematomas en las carcasas y mala pigmentación
Hematomas en las carcasas y mala pigmentación
(Manafi et al., 2009; Manafi et al., 2012b; Manafi et al., 2012c; Manafi et al., 2012d; Manafi et al., 2012e; Manafi et al., 2014a; Hedayati et al., 2014a; Manafi et al., 2014b; Hedayati et al., 2014b; Manafi et al., 2014c; Manafi et al., 2015a; Manafi et al., 2016; Manafi et al., 2018b; Manafi et al., 2018c; Manafi, 2018; Eskola et al., 2020).
Aunque el nivel de concentración, el periodo de exposición en la dieta, el sexo, la especie, la edad, la estirpe y el estado de salud de los animales son diferentes factores que afectan al nivel de toxicidad en las aves de corral, todas las especies de aves, especialmente las más jóvenes (pichones de pollitos, patitos y pavos) son más susceptibles a la toxicidad de la AFB1 (Manafi et al., 2012b; Manafi et al., 2014d).
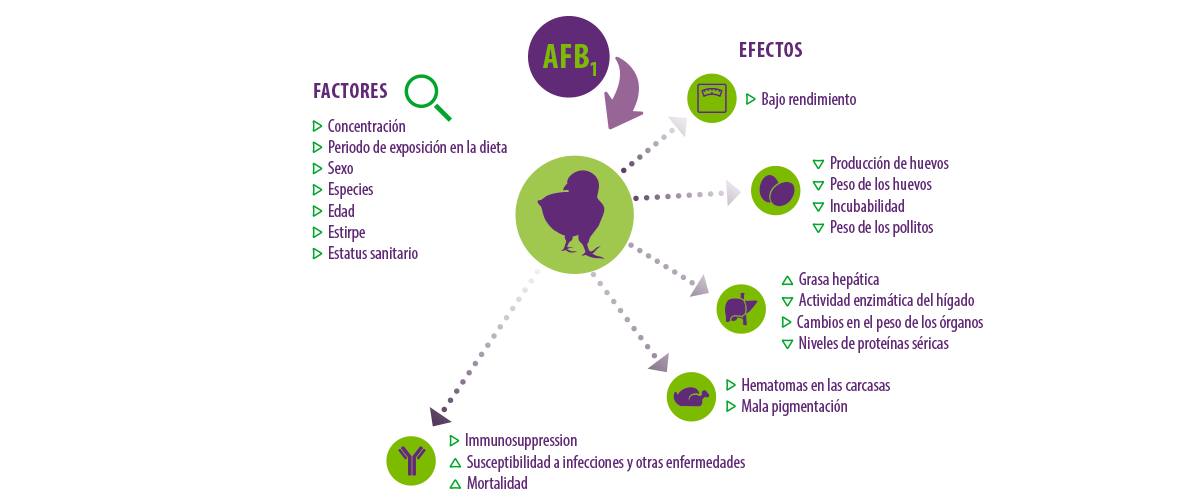
Figura 1. Factores y efectos asociados a la exposición a las aflatoxinas en las aves de corral.
Ocratoxinas 
Las ocratoxinas son un grupo de micotoxinas que se transmiten de forma natural a través de los alimentos y que se encuentran en una gran variedad de productos agrícolas en todo el mundo, incluidos los cultivos de alimentos básicos, los granos de cereales, los frutos secos y las nueces.
⇰ Son producidos por algunas especies de Aspergillus (principalmente A. ochraceus, A. carbonarius y A. niger) y algunas especies de Penicillium, especialmente P. verrucosum (Manafi et al., 2011).
Las ocratoxinas representan tres formas de metabolitos secundarios (A, B y C), entre las cuales la ocratoxina A es la toxina fúngica más prevalente de su familia.
Se sabe que la ocratoxina A tiene efectos nefrotóxicos, teratogénicos, inmunosupresores y hepatotóxicos en muchas especies animales.
⇰ Los científicos también señalan sus posibles efectos cancerígenos en los seres humanos, que podrían deberse al consumo de las toxinas acumuladas en la carne animal (Scudamore, 1996).
La ocratoxina A también inhibe la síntesis de proteínas y la peroxidación lipídica. Esta última podría estar relacionada con el daño oxidativo que perjudica la calidad y la seguridad general de los animales (Stander et al., 2000).
El consumo de ocratoxina A por parte de las aves de corral puede provocar:
 Disminución del rendimiento productivo de la granja
Disminución del rendimiento productivo de la granja Hemorragia subcutánea
Hemorragia subcutánea Inmunosupresión
Inmunosupresión Aumento de las lesiones patológicas asociadas a la edad
Aumento de las lesiones patológicas asociadas a la edad Aumento del peso relativo del hígado, riñón, bazo, páncreas, proventrículo, molleja, corazón
Aumento del peso relativo del hígado, riñón, bazo, páncreas, proventrículo, molleja, corazón Aumento de la mortalidad
Aumento de la mortalidad Baja eficiencia de conversión alimentaria
Baja eficiencia de conversión alimentaria Reducción del peso relativo de la bolsa de Fabricio
Reducción del peso relativo de la bolsa de Fabricio
(Giambrone et al., 1985; Gibson et al., 1989; Scudamore, 2005; Martins et al., 2008; Manafi et al., 2009; Manafi et al., 2011)
Se ha comprobado que los efectos de la ocratoxina A en las aves de corral son bastante pronunciados en los animales más jóvenes (Dortant et al., 2001).
En las aves, el riñón es el principal órgano afectado, y también se ha señalado una marcada disminución del porcentaje de linfocitos circulantes y un aumento significativo del porcentaje de células inflamatorias (monocitos y heterófilos) (Moura et al., 2004).
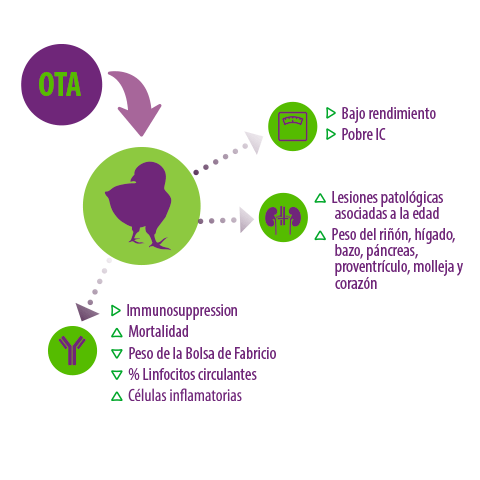
Figura 2. Efectos asociados a la ocratoxina en las aves de corral.
Toxina T-2 
Los tricotecenos, de los que se tiene constancia en muchas partes del mundo, son producidos como metabolitos secundarios (la toxina T-2 es la primera que se ha investigado y se encuentra entre los miembros más tóxicos de esta familia), principalmente por hongos del género Fusarium, de los cuales las especies más importantes son F. sporotrichioides, F. langsethiae, F. acuminatum y F. poae, que se encuentran comúnmente en varios cultivos de cereales (trigo, maíz, cebada, avena, centeno, etc.), pero también en la harina de soja (Manafi et al., 2015b).
⇰ Rutinariamente, la cromatografía líquida de alta presión (HPLC) se utiliza para detectar la toxina T-2 en una amplia gama de piensos y alimentos.
Estos compuestos son generalmente muy estables y no se degradan durante el almacenamiento/molienda y las altas temperaturas de cocción/ procesamiento de los alimentos.
La toxicidad y los efectos nocivos de la toxina T-2 varían en función de numerosos factores, como la vía de administración, el tiempo de exposición, la dosis administrada y la edad, el sexo y la salud general del animal (Hossam et al., 2013).
Se cree que la toxina T-2 aumenta la producción de radicales de oxígeno, lo que provoca una lesión celular directa (Manafi et al., 2012f).

Los estudios que indican que la ingestión de toxina T-2 en dosis elevadas por parte de las aves de corral a través del grano, el heno y la paja contaminados provoca:
 Peroxidación lipídica
Peroxidación lipídica Fiebre alta
Fiebre alta Necrosis muscular y cutánea, así como infecciones bacterianas de los tejidos necróticos
Necrosis muscular y cutánea, así como infecciones bacterianas de los tejidos necróticos Agrandamiento de los ganglios linfáticos
Agrandamiento de los ganglios linfáticos Retraso en la ovulación
Retraso en la ovulación Disminución de la motilidad espermática y aumento de las anomalías morfológicas de los espermatozoides
Disminución de la motilidad espermática y aumento de las anomalías morfológicas de los espermatozoides Inhibición de la síntesis de proteínas, ADN y ARN
Inhibición de la síntesis de proteínas, ADN y ARN Citotoxicidad
Citotoxicidad Inmunomodulación
Inmunomodulación Lesiones en el tracto digestivo, los órganos y la piel
Lesiones en el tracto digestivo, los órganos y la piel Alteraciones neuronales y trastornos nerviosos
Alteraciones neuronales y trastornos nerviosos Disminución del rendimiento y de los parámetros de producción debido al rechazo de alimento
Disminución del rendimiento y de los parámetros de producción debido al rechazo de alimento Diarrea sanguinolenta, médula ósea, lesiones bucales, inflamación serohemorrágica
Diarrea sanguinolenta, médula ósea, lesiones bucales, inflamación serohemorrágica Distrofia en hígado, riñón, corazón, cerebro y ganglios periféricos del sistema nervioso vegetativo
Distrofia en hígado, riñón, corazón, cerebro y ganglios periféricos del sistema nervioso vegetativo
(Kalantari et al., 1989; Zian et al., 2011; Kachuei et al., 2014; Krska et al., 2014; Drakulic et al., 2016; Yuan et al., 2016)
En principio, el hígado es uno de los primeros órganos diana donde las enzimas ayudan a metabolizar los fármacos que pasan por el hígado. La disminución de su actividad podría conducir a un aumento de los fármacos no metabolizados en el plasma, lo que puede suponer un riesgo peligroso para la salud del animal (Goossens et al., 2013).
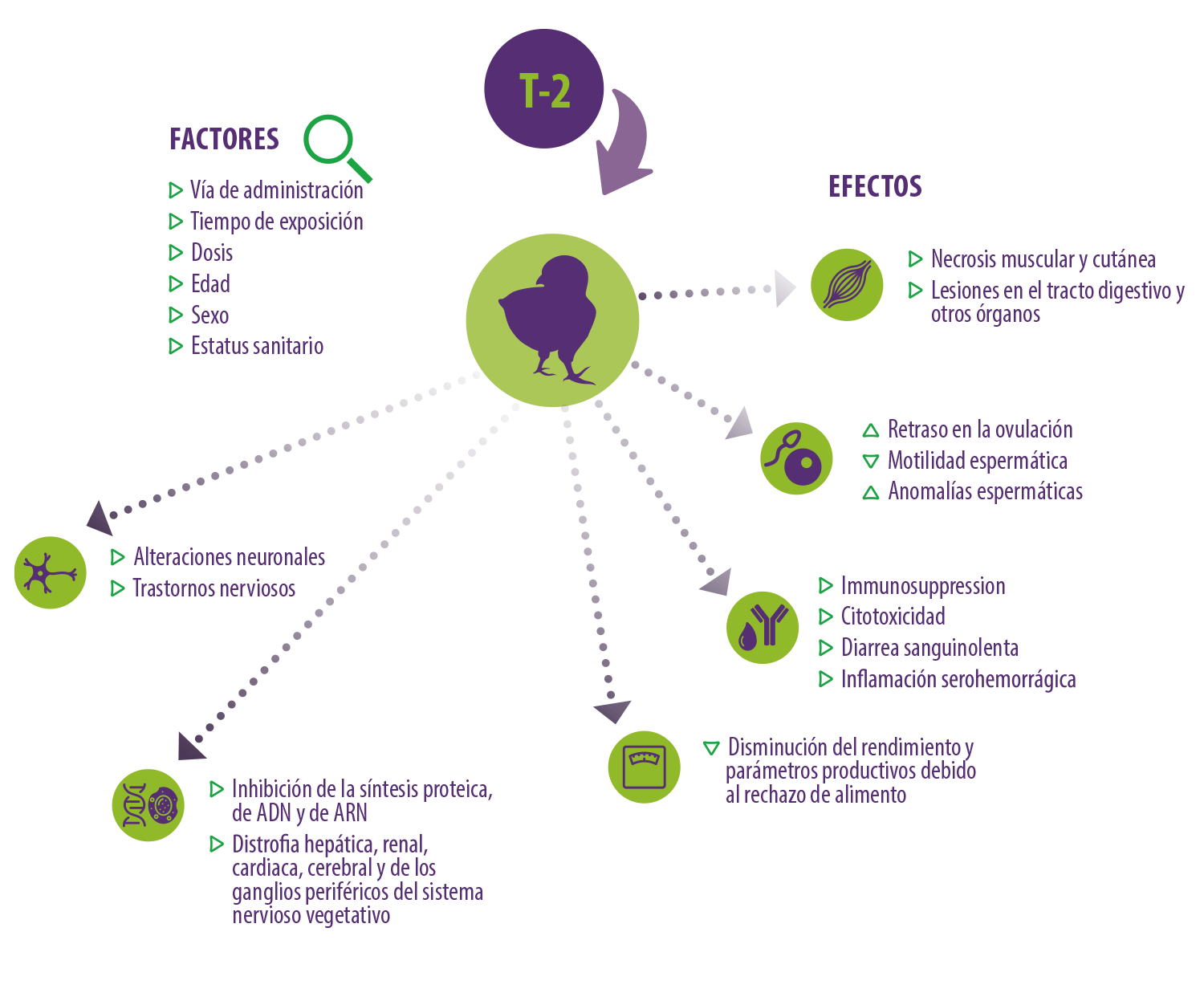
Figura 3. Factores y efectos asociados a la exposición a la toxina T-2 en aves de corral.
CONCLUSIONES
Las concentraciones de micotoxinas en el pienso suelen ser bajas y sus efectos inmunosupresores e infecciones secundarias suelen dificultar el diagnóstico.
 Como expertos, hay que conocer la variedad y los niveles de contenido de micotoxinas en el pienso que reciben. Una vez conocidos, los nutricionistas de la granja pueden pensar en cómo minimizar esos efectos adversos. Como expertos, hay que conocer la variedad y los niveles de contenido de micotoxinas en el pienso que reciben. Una vez conocidos, los nutricionistas de la granja pueden pensar en cómo minimizar esos efectos adversos. |
Aunque es difícil predecir el efecto de múltiples toxinas, algunos estudios confirman que la presencia de micotoxinas combinadas en los piensos tiene un impacto más severo en la salud y la productividad del ganado.

BIBLIOGRAFÍA
Dortant PM, Peters-Volleberg GWM, Van Louverem H, Marquardt RR, Speijers GJA. (2001). Age-related differences in the toxicity of ochratoxin A in female rats. Food and Chemical Toxicology, 39:55-56.
Drakulic J, Ajigboye O, Swarup R, Bruce T, Ray RV. (2016). Aphid Infestation Increases Fusarium langsethiae and T-2 and HT-2 Mycotoxins in Wheat. Appl Environ Microbiol. 22:6548–6556.
Eskola, M. K. Gregor, T. Christopher, J.H. Elliott, M. Sultan and K. Rudolf (2020) Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’ of 25%, Critical Reviews in Food Science and Nutrition, 60:16, 2773-2789.
Eskola, M., A. Altieri, and J. Galobart. 2018. Overview of the activities of the European Food Safety Authority on mycotoxins in food and feed. World Mycotoxin Journal 11 (2):277–89.
EUR-Lex. 2021. An official website of European Union law and other public documents of the European Union. Access to European Union law. Accessed Feb 1, 2021. https://eur-lex.europa.eu/homepage.html.
Giambrone JJ, Diener UL, Davis ND, Panagula VS, Horff FJ (1985). Effects of aflatoxin on young turkeys and broiler chickens. Poultry Science; 64(3):1678-1684.
Gibson RM, Bailey CA, Kubena LF, Huff WE, Harvey RB (1989). Ochratoxin A and dietary protein. Effects on body weight, feed conversion, relative organ weight, and mortality in three-week-old broilers. Poultry Science. 68(12):1658-63.
Goossens, J.; De Bock, L.; Osselaere, A.; Verbrugghe, E.; Devreese, M.; Boussery, K.; Van Bocxlaer, J.; De Backer, P.; Croubels, S. (2013). The mycotoxin T-2 inhibits hepatic cytochrome P4503A activity in pigs. Food and Chemical Toxicology 57, 54-6.
Hedayati M., M. Manafi, M. Yari and S.V. Mousavipour (2014a). Commercial Broilers Exposed to Aflatoxin B1: Efficacy of a Commercial Mycotoxin Binder on Internal Organ Weights, Biochemical Traits and Mortality. International Journal of Agriculture and Forestry, 4(5): 351-358.
Hedayati M., Manafi, M. and M. Yari (2014b). Aflatoxicosis in Broilers: Efficacy of a Commercial Mycotoxin Binder on Performance and Immunity Parameters. International Journal of Ecosystem, 4(4): 176-183.
Hossam E.D.M.O. (2013). Mycotoxins-Induced Oxidative Stress and Disease, Mycotoxin and Food Safety in Developing Countries. Makun, H.A. InTech, Croatia. 63‒92.
Kachuei R, Rezaie S, Yadegari MH, Safaie N, Allameh AA, Aref-poor MA, Fooladi AAI, Riazipour M, Abadi HMM. (2014). Determination of T-2 Mycotoxin in Fusarium strains by HPLC with fluorescence detector. J Appl Biotech Rep. 1:38–43.
Kalantari H, Zong MS, Chang IM. (1989). Assay of T-2 toxin contamination in domestic and imported agricultural products in Korea. Proc Jpn Assoc Mycotoxicol. 30: 32–34.
Krska R, Malachova A, Berthiller F, Egmond HPV. (2014). Determination of T-2 and HT-2 toxins in food and feed: An update. World Mycotoxin J. 7:131–142.
Manafi, M., B. Umakantha, H. D. Narayana Swamy and K. Mohan (2009). Evaluation of High-Grade Sodium Bentonite on Performance and Immune Status of Broilers, Fed Ochratoxin and Aflatoxin. World Mycotoxin Journal. 2(4): 435-440.
Manafi, M., K. Mohan, and M. Noor Ali (2011). Effect of Ochratoxin A on Coccidiosis-Challenged Broiler Chicks. World Mycotoxin Journal. 4(2): 177-181.
Manafi, M. (2012). Counteracting Effect of High Grade Sodium Bentonite during Aflatoxicosis in Broilers. Journal of Agricultural Science and Technology. 14: 539-547.
Manafi, M., H.N.N. Murthy and H.D. Narayana Swamy (2012a). Evaluation of Different Mycotoxin Binders on Broiler Breeders Induced With Aflatoxin B1: Effects on Visceral Organ Weight and Organ Lesions Parameters. American-Eurasian Journal of Agricultural & Environmental Sciences. 12 (5):574-578.
Manafi, M., H.N.N. Murthy, N. Pirany and H.D. Narayana Swamy (2012b). Comparative Study of Several Mycotoxin Binders during Aflatoxicosis in Body Weight, Feed Consumption, Feed Efficiency and Egg Production Parameters of Broiler Breeders. Global Veterinaria. 8(5): 484-490.
Manafi, M., H.N.N. Murthy, K. Mohan and H.D. Narayana Swamy (2012c). Evaluation of Different Mycotoxin Binders on Broiler Breeders Induced with Aflatoxin B1: Effects on Fertility, Hatchability, Embryonic Mortality, Residues in Egg and Semen Quality. Global Veterinaria. 8(6): 642-648.
Manafi, M., H.N.N. Murthy and H.D. Narayana Swamy (2012d). Evaluation of Different Mycotoxin Binders on Aflatoxicosis in Broiler Breeders Induced with Aflatoxin B1: Effects on Biochemical and Immunological Parameters. American-Eurasian Journal of Agricultural & Environmental Sciences. 12(4): 429-433.
Manafi, M., H.N.N. Murthy, M. Noor Ali and H.D. Narayana Swamy (2012e). Evaluation of Different Mycotoxin Binders on Broiler Breeders Induced with Aflatoxin B1 : Effects on Egg Quality Parameters. World Applied Sciences Journal. 17(3): 271-277.
Manafi, M., B. Umakantha, K. Mohan and H.D. Narayana Swamy (2012f). Synergistic Effects of Two Commonly Contaminating Mycotoxins (Aflatoxin and T-2 Toxin) on Biochemical Parameters and Immune Status of Broiler Chickens. World Applied Sciences Journal. 17(3): 364-367.
Manafi, M. and H. Khosravinia (2013). Effects of Aflatoxin on the Performance of Broiler Breeders and Its Alleviation by Herbal Mycotoxin Binder. Journal of Agricultural Science and Technology. 15: 55-63.
Manafi, M., M. Hedayati and M. Yari (2014a). Aflatoxicosis and Herbal Detoxification: The Effectiveness of Thyme Essence on Performance Parameters and Antibody Titers of Commercial Broilers Fed Aflatoxin B1. Research in Zoology, 4(2): 43-50.
Manafi, M., M. Hedayati and M. Yari (2014b). The Efficacy of Thyme Essence on Internal Organ Weights, Biochemical Traits and Mortality of Broilers Fed Aflatoxin B1. International Journal of Agriculture and Forestry, 4(4): 286-292.
Manafi, M., M. Hedayati and M. Yari (2014c). Application of Rosemary (Rosmarinus officinalis L.) Essence on Chicks Fed Aflatoxin B1: Impacts on Internal Organ Weights, Biochemical Traits and Mortality. Research in Zoology, 4(1): 13-19.
Manafi, M., M. Hedayati and M. Yari (2014d). Effectiveness of Rosemary (Rosmarinus officinalis L.) Essence on Performance and Immune Parameters of Broilers during Aflatoxicosis. Advances in Life Sciences, 4(3): 166-173.
Manafi, M., H. Arak and Hedayati, M. 2015a. The effects of inclusion of various levels of aflatoxin B1 on performance, relative weights of internal organs and blood parameters of Japanese quail during the growing period (1-28 days). Animal Science Journal, 107: 33-40.
Manafi, M., N. Pirany, M. Noor Ali, M. Hedayati, S. Khalaji, and M. Yari (2015b). Experimental pathology of T-2 toxicosis and mycoplasma infection on performance and hepatic functions of broiler chickens. Poultry Science, 94(7): 1483-1492.doi:10.3382/ps/pev115.
Manafi, M. and M. Hedayati (2016). Combinational Effects of Thyme and Rosemary Ethanolic Extractions in Reducing the Effects of Aflatoxin B1 in Broilers. Animal Science Journal, 112: 105-116.
Manafi, M., (2018). Toxicity of aflatoxin B1 on laying Japanese quails (Coturnix coturnix japonica). Journal of Applied Animal Research. 46(1): 953-959.
Manafi, M., M. Hedayati and S. Mirzaie (2018a). Probiotic Bacillus Species and Saccharomyces boulardii improve performance, gut history and immunity in broiler chickens. South African Journal of Animal Science. 48(2): 379-389.
Manafi, M., (2018b). Impact of Application of Natural Toxin Binder on Performance, Humoral Imumune Response, Cecal Microbial population and Changes in Small Intestine Morphology of Broilers Fed with Diet Contaminated with Aflatoxin B1. Journal of Veterinary Research. 73(3): 273-282.
Manafi, M., M Hedayati, and H. Arak (2018c). The effect of concomitant use of ethanolic mixtures extractions of Thyme and Oregano on performance and morphology of grastrointestinal tracts in broilers fed contaminated feed with Aflatoxin B1. Animal Science Researches. 28(3): 1-16.
Manafi, M., M. Hedayati, N. Pirany and Omede Apeh Akwu (2019). Comparison of performance and feed digestibility of the non-antibiotic feed supplement (Novacid) and an antibiotic growth promoter in broiler chickens. Poultry Science. 98(2): 904-911.
Martins, H.M., M. Marques, I. Almeida, M. M. Guerra and F. Bernardo (2008). Mycotoxins in feedstuffs in Portugal: an overview. Mycotoxin Res. 24(1): 19-23.
Mohanamba, T., Rao, M. R. and Habibi, S.M.M., 2007. Aflatoxin contamination in animal feeds. Indian Veterinary Journal, 84: 416.
Moura, MA, Machado, CH, Porfírio, LC, and Freire, RB. (2004). Effects of ochratoxin a on broiler leukocytes. Brazilian Journal of Poultry Science, 6(3), 187-190.
Scudamore KA (1996). Ochratoxin A in animal feed–effects of processing. Food Addit Contam. 13 Suppl: 39-42.
Scudamore KA (2005). Prevention of ochratoxin A in commodities and likely effects of processing fractionation and animal feeds. Food Addit Contam. 22 Suppl 1:17-25.
Stander MA, Bornscheneuer UT, Henke E, Steyr PS (2000). Screening of commercial hydrolases for degradation of Ochratoxin A. Journal of Agriculture and Food Chemists 48:5736-5739.
Yuan Z, Matias FB, Yi JE, Wu J. (2016). T-2 toxin-induced cytotoxicity and damage on TM3 Leydig cells. Comp Biochem Physiol C Toxicol Pharmacol. 181–182. 47–54.
Zain M.E. (2011). Impact of mycotoxins on humans and animals. J Saudi Chem Soc. 15:129–144.




 Prevención de micotoxicosis
Prevención de micotoxicosis