Al-Zahraa Mamdouh1† y Eman Zahran2*†
1Departamento de Enfermedades de los Peces, Instituto Nacional de Oceanografía y Pesca (NIOF), Egipto
2Departamento de Medicina de Animales Acuáticos, Facultad de Veterinaria, Universidad de Mansoura, Mansoura 35516, Egipto
†Estos autores comparten la primera autoría
*Autor correspondiente: [email protected]
ORCID: 0000-0003-2212-3688
La disponibilidad limitada y el aumento de los costes de la harina de pescado son algunos de los mayores retos a los que se enfrenta el sector de la cría de langostinos.
⇰ Para hacer frente a esta situación, el uso de ingredientes de origen vegetal en lugar de harina de pescado en los piensos para langostinos ha ido en aumento.
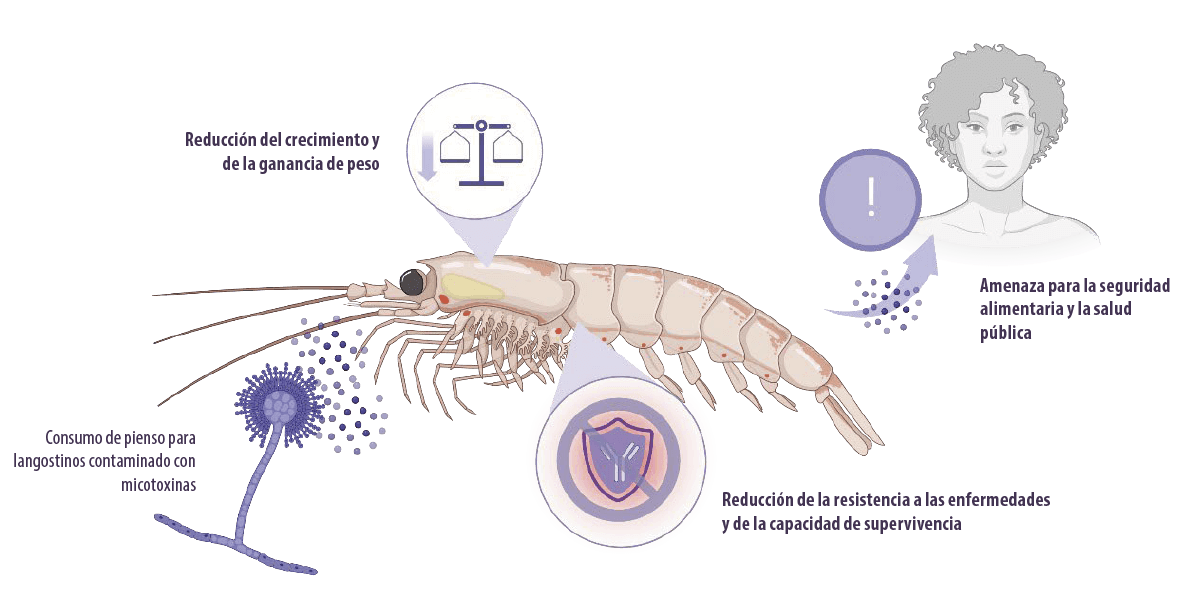
![]() Sin embargo, el uso de cultivos en los piensos aumenta el riesgo de contaminación con hongos y micotoxinas, así como la incidencia de micotoxicosis en los langostinos.
Sin embargo, el uso de cultivos en los piensos aumenta el riesgo de contaminación con hongos y micotoxinas, así como la incidencia de micotoxicosis en los langostinos.
La micotoxicosis influye negativamente en el peso corporal, el crecimiento, la resistencia a las enfermedades y la capacidad de supervivencia de los langostinos, lo que reduce la productividad de la acuicultura.
La bioacumulación de micotoxinas puede suponer un riesgo para los seres humanos a través del consumo de langostinos, lo que significa que es una amenaza para la seguridad alimentaria y la salud pública.
Además, las micotoxinas son genotoxicas, carcinógenas e inmunosupresoras.

Aunque desde los años sesenta se viene investigando sobre las micotoxinas, aún falta información sobre la micotoxicosis en los langostinos.
![]() Por ello, hay que esforzarse por vigilar su nivel de contaminación con hongos micotoxigénicos y micotoxinas.
Por ello, hay que esforzarse por vigilar su nivel de contaminación con hongos micotoxigénicos y micotoxinas.

Micotoxinas en los piensos para camarones
Fuentes de contaminación
Las micotoxinas son metabolitos secundarios producidos por hongos filamentosos que contaminan una amplia variedad de alimentos y piensos en todo el mundo (Marroquín-Cardona et al., 2014).
Se conocen cientos de micotoxinas. Entre ellas, las aflatoxinas (AF), la citrinina, la patulina, el ácido penicílico, la ocratoxina A (OTA), el deoxinivalenol (DON), las fumonisinas (FUMS) y la zearalenona (ZEN) son los contaminantes más comunes en los granos de cereales, y la mayoría de ellos son producidos por los tres géneros de hongos, Aspergillus, Penicillium y Fusarium (Ismaiel y Papenbrock, 2015).
⇰ Estos hongos pueden infectar una variedad de cultivos y productos agrícolas, incluyendo trigo, arroz, maíz, nueces, maíz, soja y sorgo, afectando a muchos productos agrícolas antes y después de la cosecha, así como a piensos acabados (Pleadin et al., 2019).
Según la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), en 2010 la producción mundial de langostinos de piscifactoría se estimaba en casi 3,78 millones de toneladas, con un aumento de la producción de más del triple desde 1,1 millones de toneladas en 2000, con una tasa media de crecimiento anual del 14,5% desde 1950.
Las especies de langostino más cultivadas son el langostino blanco (Litopenaeus vannamei) y el langostino tigre negro (Penaeus monodon). Otras especies cultivadas de menor importancia son el langostino kuruma (Penaeus japonicus) y el langostino carnoso (Penaeus chinensis), el langostino blanco indio (Penaeus indicus) y el langostino banana (Fenneropenaeus merguiensis) (Tacon et al., 2013).
El langostino blanco (L. vannamei) ocupó en 2010 el primer puesto en la producción total de peces y crustáceos de piscifactoría, con un valor total de 11.230 millones de dólares.
Los langostinos tienen una rápida tasa de crecimiento, un corto periodo de cultivo, un alto valor de exportación y una gran demanda en el mercado. Como resultado, la industria ha crecido rápidamente en todo el mundo.
![]() Sin embargo, la cría de langostinos se enfrenta a muchos retos, como los elevados costes de los programas de alimentación (Ayisi et al., 2017).
Sin embargo, la cría de langostinos se enfrenta a muchos retos, como los elevados costes de los programas de alimentación (Ayisi et al., 2017).

La cría de langostinos requiere principalmente piensos compuestos comerciales que les proporcionen los nutrientes necesarios para el crecimiento y el mantenimiento de su salud (Oliveira y Vasconcelos, 2020).
El 40,0% de todos los peces de cultivo, incluidos los langostinos, requieren una gran cantidad de pienso rico en proteínas (Tacon y Metian, 2008).
Las proteínas son los nutrientes más caros en las dietas para la cría de langostinos (Ayisi et al., 2017).

La harina de pescado es la fuente de proteínas más utilizada en la alimentación comercial del langostino debido a su alta digestibilidad, aminoácidos esenciales y perfil de ácidos grasos (Oujifard et al., 2012).
⇰ En 2008, la industria del langostino consumió el 27,2% de la harina de pescado utilizada en los alimentos acuícolas, lo que la convierte en el mayor consumidor de esta fuente de proteína (Ayisi et al., 2017).
Sin embargo, el aumento de la demanda de producción acuícola ha dado lugar a un aumento de la demanda de harina y aceite de pescado y la consiguiente escasez de peces pelágicos y otras especies de peces utilizados en su producción (Oliveira y Vasconcelos, 2020).
⇰ Por lo tanto, la disponibilidad limitada y el aumento de los costes de la harina de pescado han dado lugar a un mayor uso de proteínas vegetales como alternativas a la harina y el aceite de pescado en los piensos para langostinos y peces (Katya et al., 2016).
En las últimas décadas, se han estudiado diferentes fuentes de proteínas vegetales para sustituir a la harina de pescado en la alimentación de los langostinos, como la harina de soja (Bulbul et al., 2015; Sharawy et al., 2016; Yang et al., 2015), la harina de colza, la harina de cacahuete (Bulbul et al., 2014), la harina de arroz (Macias-Sancho et al., 2014) y la torta de aceite de girasol (Dayal et al., 2011).
Sin embargo, los piensos de origen vegetal para langostinos son susceptibles de contaminación con diversos hongos y micotoxinas.

La presencia de micotoxinas en piensos comerciales para langostinos se ha descrito en diferentes lugares del mundo.
![]() El estudio más antiguo documentado sobre la presencia de micotoxinas se realizó en piensos para langostino tigre negro (P. monodon) en Filipinas (Bautista et al., 1994).
El estudio más antiguo documentado sobre la presencia de micotoxinas se realizó en piensos para langostino tigre negro (P. monodon) en Filipinas (Bautista et al., 1994).
![]() Se detectaron aflatoxinas en piensos comerciales para langostinos en las regiones oriental y meridional de Tailandia (Bintvihok et al., 2003).
Se detectaron aflatoxinas en piensos comerciales para langostinos en las regiones oriental y meridional de Tailandia (Bintvihok et al., 2003).
![]() En Tailandia, las muestras de piensos para langostinos y peces estaban contaminadas con zearalenona y OTA, mientras que, en India, los piensos para langostinos estaban contaminados con AF (Fegan y Spring, 2007).
En Tailandia, las muestras de piensos para langostinos y peces estaban contaminadas con zearalenona y OTA, mientras que, en India, los piensos para langostinos estaban contaminados con AF (Fegan y Spring, 2007).
![]() En 2014, se analizaron muestras de piensos para peces y langostinos de Europa (Croacia y Portugal) y el sudeste asiático (Singapur, India, Tailandia y Myanmar) para la detección de AF, ZEN, DON, FUM y OTA (Gonçalves et al., 2018a), y los resultados mostraron una mayor presencia de FUM en las muestras europeas que en el sudeste asiático.
En 2014, se analizaron muestras de piensos para peces y langostinos de Europa (Croacia y Portugal) y el sudeste asiático (Singapur, India, Tailandia y Myanmar) para la detección de AF, ZEN, DON, FUM y OTA (Gonçalves et al., 2018a), y los resultados mostraron una mayor presencia de FUM en las muestras europeas que en el sudeste asiático.
- ⇰ Las micotoxinas restantes mostraron niveles medios y máximos de aparición similares en Europa y el sudeste asiático, detectándose micotoxinas en todas las muestras analizadas.
- ⇰ Además, en Europa, el 50% de las muestras tenían más de una micotoxina por muestra, y en Asia, el 84% de las muestras estaban contaminadas con más de una micotoxina.
![]() En 2015, las muestras de piensos para peces y langostinos en Europa (Dinamarca, Austria, Países Bajos y Alemania) y el sudeste asiático (Vietnam, Indonesia y Myanmar) mostraron una alta contaminación por DON y un mayor riesgo de coocurrencia en ambas regiones (Gonçalves et al., 2017).
En 2015, las muestras de piensos para peces y langostinos en Europa (Dinamarca, Austria, Países Bajos y Alemania) y el sudeste asiático (Vietnam, Indonesia y Myanmar) mostraron una alta contaminación por DON y un mayor riesgo de coocurrencia en ambas regiones (Gonçalves et al., 2017).
![]() En 2016, los piensos para langostinos de la India y los piensos para peces de Indonesia, Myanmar, Taiwán y Tailandia mostraron contaminación por micotoxinas, y las muestras de piensos para peces mostraron una menor contaminación que los piensos para langostinos y una contaminación relativamente alta de DON en los piensos para langostinos (Gonçalves et al., 2018b).
En 2016, los piensos para langostinos de la India y los piensos para peces de Indonesia, Myanmar, Taiwán y Tailandia mostraron contaminación por micotoxinas, y las muestras de piensos para peces mostraron una menor contaminación que los piensos para langostinos y una contaminación relativamente alta de DON en los piensos para langostinos (Gonçalves et al., 2018b).
Efectos de las micotoxinas en la salud de los langostinos
Aflatoxinas
Mecanismos y efectos en la salud de los langostinos
Las aflatoxinas son las micotoxinas más comúnmente encontradas en los piensos para langostinos, producidas principalmente por Aspergillus flavus y Aspergillus parasiticus, y en menor medida, por Aspergillus nomius y Aspergillus bombycis, Aspergillus pseudotamari y Aspergillus ochraceoroseus (Varga et al., 2011).
Se clasifican según su fluorescencia azul o verde bajo luz ultravioleta en AFB1, AFB2, AFG1 y AFG2 (Dhanasekaran et al., 2011), apareciendo en una gran variedad de alimentos para animales, incluyendo maíz, cacahuetes molidos, semillas de algodón de arroz y sorgo, especias, cereales, soja, cacao y carne (Patriarca y Pinto, 2017; Vila-Donat et al., 2018).

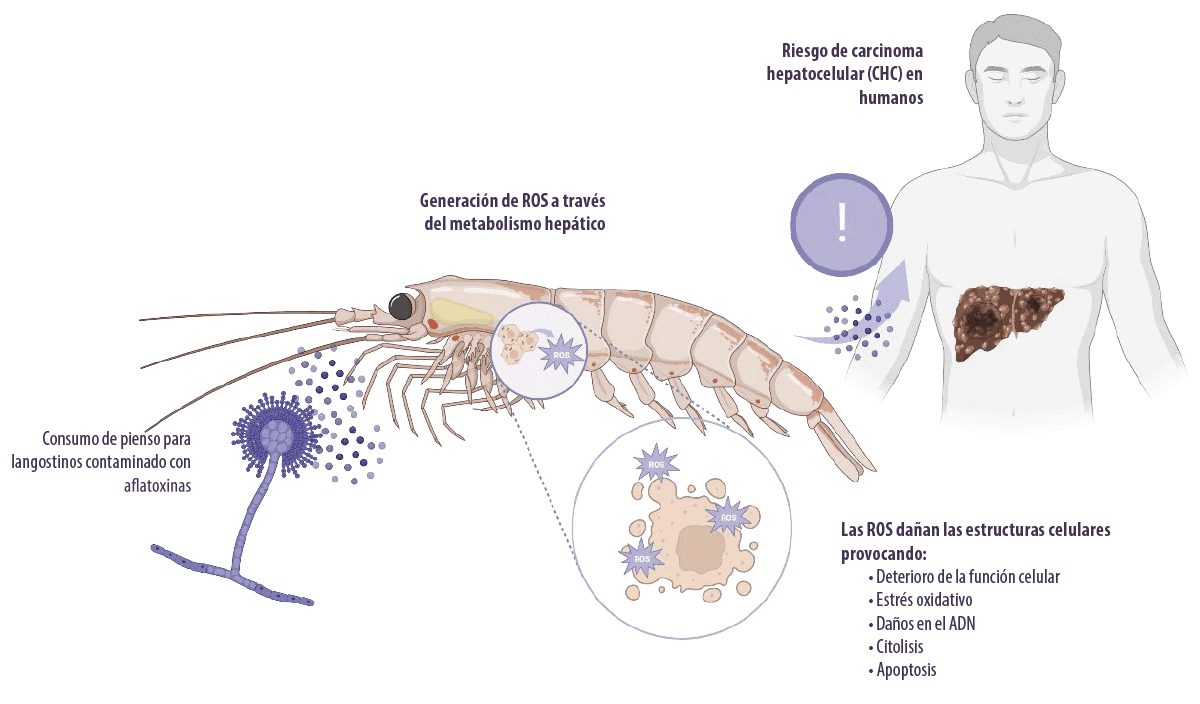
Las aflatoxinas inducen toxicidad al metabolizarse en el hígado por la generación de especies reactivas del oxígeno intracelulares (ROS, por sus siglas en inglés), como aniones superóxido, radicales hidroxilo y peróxido de hidrógeno (H2O2), bajo la acción del citocromo P450.
- ⇰ Estas ROS atacan al ADN celular, al ARN, a las proteínas y a las membranas celulares, lo que provoca un deterioro de la función celular, estrés oxidativo, daños en el ADN, citólisis y apoptosis (Asim et al., 2011; Yang et al., 2016).
- ⇰ También pueden afectar al gen supresor de tumores p53, causante del hepatocarcinoma (Kew, 2013).
El metabolismo de las aflatoxinas se produce principalmente en el hígado bajo la acción del citocromo P450 en epóxidos reactivos electrófilos.
- ⇰ Los metabolitos epóxido se unen al ADN, ARN y macromoléculas celulares en el hígado (Abrar et al., 2013).
AFLATOXICOSIS EN HUMANOS
La AFB1 es el hepatocarcinógeno experimental más potente conocido en humanos (Humans and Cancer, 2002), aunque ningún modelo animal expuesto a la toxina ha desarrollado CHC.
⇰ También representa aproximadamente el 9,2% de todos los nuevos cánceres en el mundo (Ferlay et al., 2010). Otras enfermedades hepáticas, como la cirrosis (Humans, 2014) y la hepatomegalia (Gong et al., 2012), también se han asociado a la toxicidad de las aflatoxinas en humanos.
AFLATOXICOSIS EN PESCADO & LANGOSTINOS
El deterioro de la función hepática y el estrés oxidativo son las consecuencias previstas de la aflatoxicosis en peces y animales de experimentación.
Las aflatoxinas pueden causar graves problemas de salud y reducir el rendimiento de los cultivos de langostinos.
En el langostino, se ha informado ampliamente de que la AFB1 afecta:
- ⇰ Crecimiento
- ⇰ Parámetros sanguíneos
- ⇰ Parámetros histológicos
- ⇰ Actividad enzimática antioxidante
- ⇰ Expresión de genes relacionados con el transcriptoma y el sistema inmunitario en el hepatopáncreas
El hepatopáncreas es el principal órgano afectado por la AFB1 de la dieta, ya que es el principal órgano digestivo y sistema inmunitario de los langostinos (Pérez-Acosta et al., 2016) y sus funciones están relacionadas con la síntesis y secreción de enzimas digestivas y moléculas inmunitarias, absorción de nutrientes, almacenamiento de reservas y excreción (Zhao et al., 2017).
 Además, muchos estudios también han señalado que la AFB1 puede dañar la barrera de la mucosa intestinal e inducir un desequilibrio en las poblaciones microbianas intestinales (Fang et al., 2020; Wang et al., 2018).
Además, muchos estudios también han señalado que la AFB1 puede dañar la barrera de la mucosa intestinal e inducir un desequilibrio en las poblaciones microbianas intestinales (Fang et al., 2020; Wang et al., 2018).

Varios estudios han descrito los efectos de la AFB1 sobre el crecimiento y la respuesta inmunitaria de los langostinos. Por ejemplo:
![]() La exposición de L. vannamei a AFB1 (500 μg/kg AFB1) durante 8 semanas disminuyó significativamente el peso corporal final (PCF), la ganancia de peso (GP, %) y aumentó significativamente la actividad de la óxido nítrico sintasa inducible (iNOS) y los niveles de glutatión (GSH) y malondialdehído (MDA) en el hepatopáncreas (Yu et al., 2018).
La exposición de L. vannamei a AFB1 (500 μg/kg AFB1) durante 8 semanas disminuyó significativamente el peso corporal final (PCF), la ganancia de peso (GP, %) y aumentó significativamente la actividad de la óxido nítrico sintasa inducible (iNOS) y los niveles de glutatión (GSH) y malondialdehído (MDA) en el hepatopáncreas (Yu et al., 2018).
![]() Del mismo modo, los juveniles de L. vannamei alimentados con una dieta que contenía AFB1 durante 42 días presentaron una disminución significativa del peso medio, ingesta de alimentos, tasa de crecimiento y eficiencia de retención de nitrógeno, y un aumento significativo de la actividad enzimática de la fosfatasa alcalina (ALP) y de la glutatión S transferasa (GST) en el hepatopáncreas (Tapia-Salazar et al., 2022).
Del mismo modo, los juveniles de L. vannamei alimentados con una dieta que contenía AFB1 durante 42 días presentaron una disminución significativa del peso medio, ingesta de alimentos, tasa de crecimiento y eficiencia de retención de nitrógeno, y un aumento significativo de la actividad enzimática de la fosfatasa alcalina (ALP) y de la glutatión S transferasa (GST) en el hepatopáncreas (Tapia-Salazar et al., 2022).
![]() En el mismo contexto, la exposición de L. vannamei a AFB1 durante 8 semanas disminuyó significativamente la ganancia de peso (12000 µg AFB1/kg), la capacidad antioxidante total (2000 µg AFB1/kg), GST, superóxido dismutasa (SOD), Na y K ATPasa en hepatopáncreas, y aumentó significativamente GST en la hemolinfa (1600 µg AFB1/kg) (Wang et al., 2012).
En el mismo contexto, la exposición de L. vannamei a AFB1 durante 8 semanas disminuyó significativamente la ganancia de peso (12000 µg AFB1/kg), la capacidad antioxidante total (2000 µg AFB1/kg), GST, superóxido dismutasa (SOD), Na y K ATPasa en hepatopáncreas, y aumentó significativamente GST en la hemolinfa (1600 µg AFB1/kg) (Wang et al., 2012).
![]() Los juveniles de L. vannamei alimentados con dietas que contenían granos contaminados naturalmente con aflatoxinas totales (500, 1000 y 2000 μg/kg durante 28 días) mostraron una disminución significativa de la ganancia de peso y la ingesta de alimento, y un aumento significativo del índice de conversión.
Los juveniles de L. vannamei alimentados con dietas que contenían granos contaminados naturalmente con aflatoxinas totales (500, 1000 y 2000 μg/kg durante 28 días) mostraron una disminución significativa de la ganancia de peso y la ingesta de alimento, y un aumento significativo del índice de conversión.
Además, el análisis histológico del hepatopáncreas reveló que la actividad de las células B y la actividad mitótica celular disminuyeron significativamente, mientras que el almacenamiento de lípidos, la atrofia epitelial tubular y la descamación de los hepatopancreatocitos aumentaron significativamente (Tapia-Salazar et al., 2012).
![]() F. indicus alimentados con dietas que contenían 1600 ppb de AFB1 durante 8 semanas mostraron una disminución significativa del peso final, la tasa de supervivencia, el recuento total de hemocitos, la proteína plasmática total y la actividad fagocítica y un aumento significativo de la tasa de crecimiento específico.
F. indicus alimentados con dietas que contenían 1600 ppb de AFB1 durante 8 semanas mostraron una disminución significativa del peso final, la tasa de supervivencia, el recuento total de hemocitos, la proteína plasmática total y la actividad fagocítica y un aumento significativo de la tasa de crecimiento específico.
El examen histopatológico del hepatopáncreas mostró células R atrofiadas, necrosis grave y contracción de los túbulos, infiltración de hemocitos y células fibroblásticas que producían un aspecto exterior similar a la fibrosis, degeneración celular y núcleos picnóticos en el lumen, necrosis extendida y destrucción completa de las células B, aislamiento completo del tejido conjuntivo del tejido del hepatopáncreas y en el tejido del intestino medio y separación entre las capas mucosa y submucosa (Ghaednia et al., 2013).

![]() El examen ultraestructural del hepatopáncreas de P. monodon alimentado con una dieta que contenía 1000 y 2000 ppb de AFB1 durante 8 semanas mostró vacuolización y condensación nuclear, aparición de material denso a los electrones, forma irregular del núcleo, pérdida de la membrana nuclear y fragmentación del retículo endoplásmico, así como hinchazón de las mitocondrias, vacuolación y pérdida de orgánulos en algunas zonas, formación de vesículas en el citoplasma, pérdida de microvellosidades, redondeo celular y necrosis extensa (Radhika et al., 2012).
El examen ultraestructural del hepatopáncreas de P. monodon alimentado con una dieta que contenía 1000 y 2000 ppb de AFB1 durante 8 semanas mostró vacuolización y condensación nuclear, aparición de material denso a los electrones, forma irregular del núcleo, pérdida de la membrana nuclear y fragmentación del retículo endoplásmico, así como hinchazón de las mitocondrias, vacuolación y pérdida de orgánulos en algunas zonas, formación de vesículas en el citoplasma, pérdida de microvellosidades, redondeo celular y necrosis extensa (Radhika et al., 2012).
![]() La exposición de juveniles de L. vannamei a 25, 50, 100, 500 y 1000 µg/kg de AFB1 indujo una disminución significativa en la ganancia de peso, la tasa de crecimiento específica, y un aumento significativo en la tasa de supervivencia, los niveles de aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT), y la actividad antioxidante total en suero (Zeng et al., 2016).
La exposición de juveniles de L. vannamei a 25, 50, 100, 500 y 1000 µg/kg de AFB1 indujo una disminución significativa en la ganancia de peso, la tasa de crecimiento específica, y un aumento significativo en la tasa de supervivencia, los niveles de aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT), y la actividad antioxidante total en suero (Zeng et al., 2016).
![]() L. vannamei alimentados con 15 ppm de AFB1 durante 8 días presentaron una disminución significativa de la tasa de supervivencia, un aumento significativo de los niveles de SOD, GST, glutatión peroxidasa (GPx) y catalasa (CAT), y una expresión diferencial de 1024 genes implicados en funciones que incluyen el metabolismo de la peroxidasa, la transducción de señales, el control transcripcional, la apoptosis, la proteólisis, la endocitosis, la adhesión celular y la unión celular.
L. vannamei alimentados con 15 ppm de AFB1 durante 8 días presentaron una disminución significativa de la tasa de supervivencia, un aumento significativo de los niveles de SOD, GST, glutatión peroxidasa (GPx) y catalasa (CAT), y una expresión diferencial de 1024 genes implicados en funciones que incluyen el metabolismo de la peroxidasa, la transducción de señales, el control transcripcional, la apoptosis, la proteólisis, la endocitosis, la adhesión celular y la unión celular.
También indujo graves alteraciones histológicas en el hepatopáncreas de los langostinos, incluyendo la separación entre la capa mioepitelial y el epitelio del hepatopáncreas, exceso de grasa en muchas células vacuoladas, picnosis nuclear, lisis celular y necrosis celular (Zhao et al., 2017).
![]() En un estudio más reciente, la exposición de L. vannamei a 168,3 μg/kg de AFB1 durante 58 días disminuyó significativamente la ganancia de peso, la tasa específica de crecimiento, la tasa de supervivencia, el coeficiente de eficiencia proteica, el valor productivo proteico y los niveles de AST y ALT en el suero y el hepatopáncreas, aumentando significativamente el índice de conversión. También indujo un aumento significativo del nivel sérico de MDA y de las actividades de GST y GPx, mientras que disminuyó significativamente sus actividades en el hepatopáncreas.
En un estudio más reciente, la exposición de L. vannamei a 168,3 μg/kg de AFB1 durante 58 días disminuyó significativamente la ganancia de peso, la tasa específica de crecimiento, la tasa de supervivencia, el coeficiente de eficiencia proteica, el valor productivo proteico y los niveles de AST y ALT en el suero y el hepatopáncreas, aumentando significativamente el índice de conversión. También indujo un aumento significativo del nivel sérico de MDA y de las actividades de GST y GPx, mientras que disminuyó significativamente sus actividades en el hepatopáncreas.
Además, la AFB1 disminuyó significativamente la expresión de genes relacionados con la inmunidad, incluyendo el factor de diferenciación mieloide 88 (MyD88), Dorsal, factor 6 asociado al receptor del factor de necrosis tumoral (TRAF6), Relish, Domeless, citocromo P450 y penaeidina 3a (Chen et al., 2020).
![]() L. vannamei alimentado con dietas contaminadas con 200 μg/kg de AFB1 durante 42 días sufrió una reducción significativa de la ingesta de alimento, la tasa de crecimiento y la eficiencia de retención de nitrógeno y un aumento significativo de la actividad de ALP y GST (García-Pérez et al., 2020).
L. vannamei alimentado con dietas contaminadas con 200 μg/kg de AFB1 durante 42 días sufrió una reducción significativa de la ingesta de alimento, la tasa de crecimiento y la eficiencia de retención de nitrógeno y un aumento significativo de la actividad de ALP y GST (García-Pérez et al., 2020).
![]() La exposición de P. vannamei a 500 μg/kg de AFB1 durante seis semanas disminuyó significativamente las tasas de supervivencia, la ganancia de peso y la expresión de genes relacionados con la inmunidad en el intestino, incluyendo Rab, GST, mucin-like-PM, Dorsal, Relish y Pro-PO.
La exposición de P. vannamei a 500 μg/kg de AFB1 durante seis semanas disminuyó significativamente las tasas de supervivencia, la ganancia de peso y la expresión de genes relacionados con la inmunidad en el intestino, incluyendo Rab, GST, mucin-like-PM, Dorsal, Relish y Pro-PO.

![]() La AFB1 indujo daños en el sistema antioxidante y una desregulación de la microbiota intestinal en L. vannamei alimentado con una dieta que contenía 5 ppm de AFB1 durante 30 días, ya que indujo un aumento significativo seguido de una disminución significativa de las actividades CAT, SOD y GPX y un aumento significativo de MDA en el intestino y el hepatopáncreas.
La AFB1 indujo daños en el sistema antioxidante y una desregulación de la microbiota intestinal en L. vannamei alimentado con una dieta que contenía 5 ppm de AFB1 durante 30 días, ya que indujo un aumento significativo seguido de una disminución significativa de las actividades CAT, SOD y GPX y un aumento significativo de MDA en el intestino y el hepatopáncreas.
Además, se observó un desequilibrio en la microbiota intestinal a nivel de filo, la abundancia relativa de Proteobacterias y Firmicutes aumentó, y la abundancia relativa de Bacteroidetes disminuyó.
A nivel de género, las abundancias relativas de Vibrio y Photobacterium aumentaron significativamente, y las abundancias relativas de Flavobacterium_sp_M y Tenacibaculum disminuyeron (Wang et al., 2018).
![]() La exposición de L. vannamei a 977,11 y 1605,61 μg/kg de AFB1 durante 28 días indujo un aumento significativo de las actividades AST, ALT en la hemolinfa y del valor del índice de alternancia histológica (IHA) del hepatopáncreas, con una disminución significativa de la proteína total y la grasa (triglicéridos y colesterol) en la hemolinfa.
La exposición de L. vannamei a 977,11 y 1605,61 μg/kg de AFB1 durante 28 días indujo un aumento significativo de las actividades AST, ALT en la hemolinfa y del valor del índice de alternancia histológica (IHA) del hepatopáncreas, con una disminución significativa de la proteína total y la grasa (triglicéridos y colesterol) en la hemolinfa.
El examen histopatológico del hepatopáncreas mostró un aspecto irregular y anormal de la estructura tubular del hepatopáncreas, vacuolización de las células tubulares, separación del epitelio y la capa mioepitelial, necrosis de las células hepatopancreáticas y núcleos picnóticos, inflamación hepatopancreática y penetración de hemocitos en el espacio entre los túbulos (Jamshidizadeh et al., 2019).
Toxina T-2
Mecanismos y efectos en la salud de los langostinos
Hay poca información sobre la toxicidad de otras micotoxinas para los invertebrados acuáticos, pero en muchos estudios se ha señalado que la toxina T-2 perjudica el crecimiento y la respuesta inmunitaria de los langostinos.
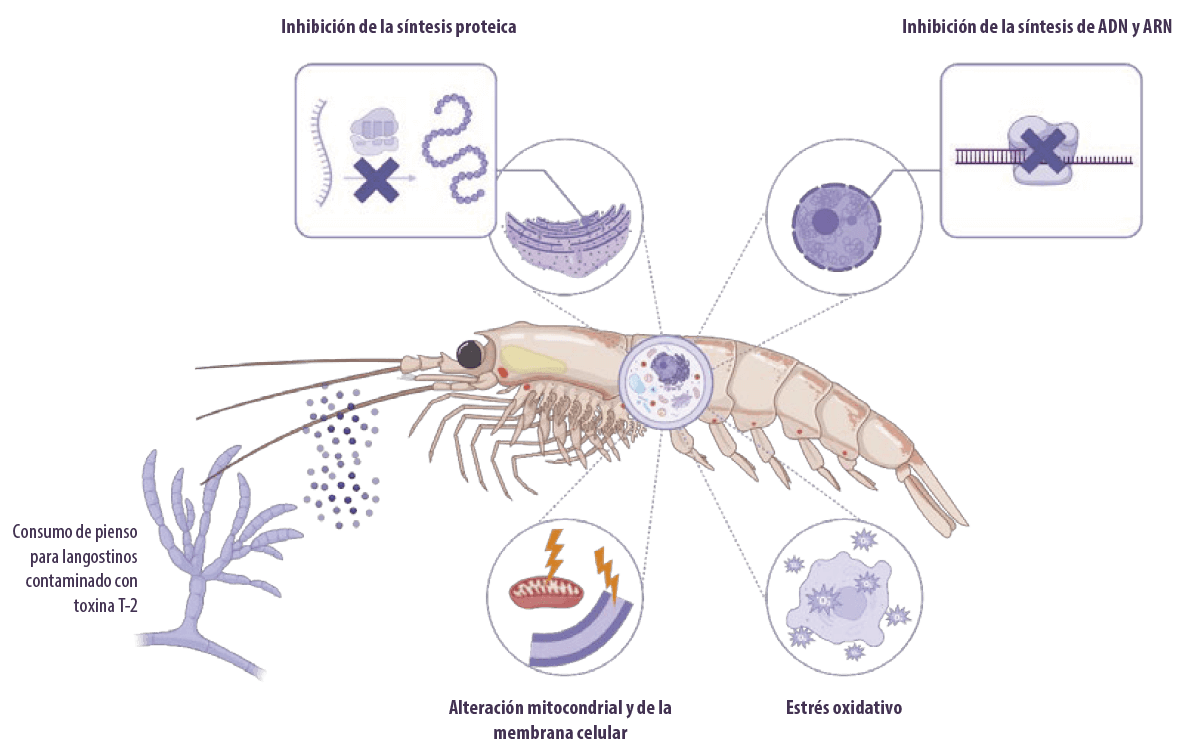
Los tricotecenos (principalmente la toxina T-2) son bien conocidos por su capacidad de inhibir la síntesis de proteínas eucariotas al unirse a la subunidad 60S de los ribosomas eucariotas e inhibir la actividad de la peptidil transferasa.
⇰ Esto conduce a la inhibición de la iniciación, elongación o terminación del paso de elongación de la cadena en la síntesis de proteínas (Arunachalam y Doohan, 2013).
La toxina T-2 también puede:
- ⇰ Inhibir la síntesis de ADN y ARN (Minervini et al., 2004)
- ⇰ Alterar la estructura de la membrana celular (Diesing et al., 2011) y la función mitocondrial
- ⇰ Detener el ciclo celular (Pestka, 2010)
- ⇰ Inducen estrés oxidativo al aumentar la peroxidación lipídica y alterar las defensas antioxidantes, lo que acaba perjudicando la síntesis de proteínas y causando daños en el ADN (Doi and Uetsuka, 2011; Wu et al., 2014)
![]() Se investigaron los efectos de la toxina T-2 sobre el crecimiento, la capacidad antioxidante y los hallazgos histopatológicos en el hepatopáncreas de L. vannamei mediante la exposición dietética a 0,5, 1,2, 2,4, 4,8 y 12,2 mg/kg de toxina T-2 durante 20 días y se informó de que la concentración de mT-2 en el hepatopáncreas aumentó significativamente de forma dependiente de la dosis. Además, las tasas de crecimiento y supervivencia disminuyeron significativamente.
Se investigaron los efectos de la toxina T-2 sobre el crecimiento, la capacidad antioxidante y los hallazgos histopatológicos en el hepatopáncreas de L. vannamei mediante la exposición dietética a 0,5, 1,2, 2,4, 4,8 y 12,2 mg/kg de toxina T-2 durante 20 días y se informó de que la concentración de mT-2 en el hepatopáncreas aumentó significativamente de forma dependiente de la dosis. Además, las tasas de crecimiento y supervivencia disminuyeron significativamente.
Por otra parte, la concentración de MDA aumentó significativamente a una dosis ≥2,4 mg/kg de toxina T-2, mientras que la SOD y la GPx, la capacidad antioxidante total (T-AOC) y el contenido de GSH aumentaron a una dosis de 2,4-4,8 mg/kg de toxina T-2, pero disminuyeron a la dosis de 12,2 mg/kg.
Los cambios histopatológicos en el hepatopáncreas fueron dependientes de la dosis, con autofagia evidente en la dosis de exposición más alta (Deng et al., 2017).
![]() La toxina T-2 indujo efectos tóxicos en la hemolinfa, el sistema inmunitario y el hepatopáncreas de L. vannamei tras una exposición alimentaria a 0,5, 1,2, 2,4 y 4,8 mg/kg durante 20 días, como una reducción significativa del aumento de peso, la tasa específica de crecimiento (en todas las dosis) y la tasa de supervivencia (0,5 y 1,2 mg/kg). Disminuyó significativamente la actividad de la enzima fenoloxidasa (todas las dosis), el recuento de hemocitos (2,4 mg/kg) y la concentración de albúmina (1,2, 2,4 y 4,8 mg/kg). Además, alteró la actividad de las enzimas de la hemolinfa GOT, GPT y ALP de forma dependiente de la dosis.
La toxina T-2 indujo efectos tóxicos en la hemolinfa, el sistema inmunitario y el hepatopáncreas de L. vannamei tras una exposición alimentaria a 0,5, 1,2, 2,4 y 4,8 mg/kg durante 20 días, como una reducción significativa del aumento de peso, la tasa específica de crecimiento (en todas las dosis) y la tasa de supervivencia (0,5 y 1,2 mg/kg). Disminuyó significativamente la actividad de la enzima fenoloxidasa (todas las dosis), el recuento de hemocitos (2,4 mg/kg) y la concentración de albúmina (1,2, 2,4 y 4,8 mg/kg). Además, alteró la actividad de las enzimas de la hemolinfa GOT, GPT y ALP de forma dependiente de la dosis.
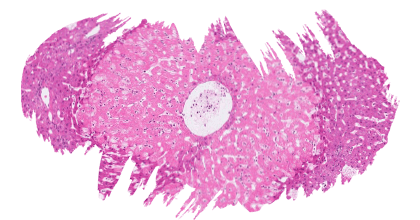
![]() La exposición de L. vannamei a la toxina T-2 a concentraciones de 0,5, 1,2, 2,4, 4,8 y 12,2 mg/kg durante 20 días redujo significativamente el aumento de peso, la tasa específica de crecimiento y la tasa de supervivencia.
La exposición de L. vannamei a la toxina T-2 a concentraciones de 0,5, 1,2, 2,4, 4,8 y 12,2 mg/kg durante 20 días redujo significativamente el aumento de peso, la tasa específica de crecimiento y la tasa de supervivencia.
El examen histopatológico del intestino mostró cambios degenerativos y necróticos dependientes de la concentración, con una inflamación inicial del tejido de la mucosa a 0,5 y 1,2 mg/kg, que progresó hasta la desaparición de las vellosidades intestinales y la degeneración y necrosis de la submucosa a 12,2 mg/kg.
Las enzimas digestivas intestinales proteasa y amilasa disminuyeron significativamente con concentraciones crecientes de toxina T-2, mientras que la actividad de la lipasa aumentó con concentraciones mayores de toxina T-2 (Huang et al., 2019).
![]() Se investigó el efecto de la toxina T-2 sobre las proteínas musculares de L. vannamei mediante la exposición a 1,2, 2,4, 4,8 y 12,2 mg/kg durante 20 días y se observó que la cantidad de proteína miofibrilar, sarcoplásmica y del estroma aumentaba a la baja concentración de 1,2 mg/kg de T2, mientras que las concentraciones más elevadas inducían descensos significativos de forma dependiente de la dosis.
Se investigó el efecto de la toxina T-2 sobre las proteínas musculares de L. vannamei mediante la exposición a 1,2, 2,4, 4,8 y 12,2 mg/kg durante 20 días y se observó que la cantidad de proteína miofibrilar, sarcoplásmica y del estroma aumentaba a la baja concentración de 1,2 mg/kg de T2, mientras que las concentraciones más elevadas inducían descensos significativos de forma dependiente de la dosis.
La toxina T-2 afectó a los ácidos grasos, la distribución del agua y la histopatología muscular de L. vannamei, donde la exposición a 0,5, 1,5, 4,5 y 13,5 mg/kg durante 20 días afectó significativamente a la composición de ácidos grasos musculares con una disminución inicial de ácidos grasos saturados (ΣSFA), ácidos grasos monoinsaturados (ΣMUFA) y ácidos grasos poliinsaturados (ΣPUFA), seguida de un aumento en los grupos de dosis altas.
Además, la toxina T-2 afectó significativamente la distribución del agua en el músculo, donde las dosis altas redujeron el contenido de agua libre, lo que resultó en una reducción de la capacidad de retención de agua y, por lo tanto, cambios en la calidad del músculo del langostino (Bi et al., 2019).

Deoxinivalenol, Fumonisinas y Ocratoxina A
Efectos en la salud de los langostinos
Algunos estudios más han descrito otros efectos de las micotoxinas en los langostinos.
![]() L. vannamei alimentado con dietas contaminadas con 250, 500 y 1000 μg DON/kg durante 5 semanas sufrió una disminución significativa de la ganancia de peso (1000 μg /kg) y un aumento significativo de la actividad GST (500 μg /kg) y SOD (1000 μg /kg), mientras que la expresión génica de SOD y GPx se redujo significativamente en dosis de 500 y 1000 μg/kg DON. Además, la expresión génica relacionada con la respuesta inmune del hepatopáncreas de HSP70, Toll 1 y Dorsal fue mayor a una dosis de 250 μg DON/kg, y la expresión de proPO, LGBP y PPAF fue significativamente mayor a una dosis de 1000 μg DON/kg.
L. vannamei alimentado con dietas contaminadas con 250, 500 y 1000 μg DON/kg durante 5 semanas sufrió una disminución significativa de la ganancia de peso (1000 μg /kg) y un aumento significativo de la actividad GST (500 μg /kg) y SOD (1000 μg /kg), mientras que la expresión génica de SOD y GPx se redujo significativamente en dosis de 500 y 1000 μg/kg DON. Además, la expresión génica relacionada con la respuesta inmune del hepatopáncreas de HSP70, Toll 1 y Dorsal fue mayor a una dosis de 250 μg DON/kg, y la expresión de proPO, LGBP y PPAF fue significativamente mayor a una dosis de 1000 μg DON/kg.
![]() El examen histopatológico reveló que los pliegues de la mucosa intestinal estaban deteriorados por la apoptosis en las células epiteliales intestinales, y el número de células B y los diámetros de los túbulos del hepatopáncreas se vieron afectados por diferentes dosis de DON (Xie et al., 2018).
El examen histopatológico reveló que los pliegues de la mucosa intestinal estaban deteriorados por la apoptosis en las células epiteliales intestinales, y el número de células B y los diámetros de los túbulos del hepatopáncreas se vieron afectados por diferentes dosis de DON (Xie et al., 2018).
![]() L. vannamei expuesto a 0,5, 0,75 y 1,0 µg/g de FB1 durante 18 días mostró una disminución significativa de la fenoloxidasa, el recuento total de hemocitos y la tasa de anión superóxido.
L. vannamei expuesto a 0,5, 0,75 y 1,0 µg/g de FB1 durante 18 días mostró una disminución significativa de la fenoloxidasa, el recuento total de hemocitos y la tasa de anión superóxido.
El hepatopáncreas mostró lesiones histopatológicas, incluyendo deformación de los túbulos del hepatopáncreas con pérdida de la estructura celular normal, presencia de melanización, y los túbulos mostrando vacuolización severa con retracción celular (Mexía-Salazar et al., 2008).
![]() La alimentación de P. monodon con una dieta que contenía DON y OTA durante 8 semanas alteró significativamente el crecimiento y los parámetros inmunitarios.
La alimentación de P. monodon con una dieta que contenía DON y OTA durante 8 semanas alteró significativamente el crecimiento y los parámetros inmunitarios.

Protección de los langostinos frente a las micotoxicosis
Se han desarrollado diversas estrategias para reducir los efectos tóxicos de las micotoxinas en los piensos, como:
- ✓ Descontaminación física (Grenier et al., 2014; Pankaj et al., 2018)
- ✓ Descontaminación química (Čolović et al., 2019)
- ✓ Descontaminación biológica (Shu et al., 2018)
Algunos de los compuestos utilizados en diferentes estudios para mitigar la toxicidad inducida por micotoxinas en los langostinos son los siguientes.

Probióticos
Se ha demostrado que el uso de probióticos mejora significativamente la tasa de supervivencia y el crecimiento de los animales de acuicultura y de cría terrestre (Wang et al., 2019; Zhang et al., 2019).
 En la cría de langostinos, los probióticos mejoran la tasa de digestibilidad y absorción y promueven el crecimiento, una morfología y flora intestinal saludables, una respuesta inmune robusta y la resistencia a las enfermedades (Amoah et al., 2019; Azad et al., 2019; Duan et al., 2018; Zuo et al., 2019).
En la cría de langostinos, los probióticos mejoran la tasa de digestibilidad y absorción y promueven el crecimiento, una morfología y flora intestinal saludables, una respuesta inmune robusta y la resistencia a las enfermedades (Amoah et al., 2019; Azad et al., 2019; Duan et al., 2018; Zuo et al., 2019).
![]() La suplementación de Lactobacillus pentosus HC-2 (5 × 108 UFC/g de alimento) a P. vannamei durante 6 semanas alivió la toxicidad inducida por AFB1 (500 μg/kg) al aumentar la tasa de supervivencia y el porcentaje de ganancia de peso, mejorando la morfología intestinal y la estructura de la comunidad de la microbiota intestinal al aumentar significativamente la abundancia de Proteobacterias y disminuir la abundancia de Firmicutes y Bacteroidetes. También aumentó la expresión de genes inmunes, incluyendo Rab, GST, mucin-like-PM, Dorsal y Pro-PO (Fang et al., 2020).
La suplementación de Lactobacillus pentosus HC-2 (5 × 108 UFC/g de alimento) a P. vannamei durante 6 semanas alivió la toxicidad inducida por AFB1 (500 μg/kg) al aumentar la tasa de supervivencia y el porcentaje de ganancia de peso, mejorando la morfología intestinal y la estructura de la comunidad de la microbiota intestinal al aumentar significativamente la abundancia de Proteobacterias y disminuir la abundancia de Firmicutes y Bacteroidetes. También aumentó la expresión de genes inmunes, incluyendo Rab, GST, mucin-like-PM, Dorsal y Pro-PO (Fang et al., 2020).

Antioxidantes
Otros estudios incluyeron el uso de antioxidantes.
![]() La suplementación con curcumina resultó beneficiosa para proteger a los juveniles de L. vannamei frente a la inmunotoxicidad causada por la AFB1 (200 μg/kg).
La suplementación con curcumina resultó beneficiosa para proteger a los juveniles de L. vannamei frente a la inmunotoxicidad causada por la AFB1 (200 μg/kg).


![]() Los polifenoles del té fueron eficaces en la protección de P. vannamei contra el deterioro de la calidad muscular del camarón inducido por AFB1 (1,2-2,7 mg/kg de alimento), donde inhibió la expansión de los espacios de las fibras musculares y la inflamación e indujo un efecto protector significativo contra la disminución de los nutrientes musculares y los cambios en la composición proteica (Huang et al., 2021).
Los polifenoles del té fueron eficaces en la protección de P. vannamei contra el deterioro de la calidad muscular del camarón inducido por AFB1 (1,2-2,7 mg/kg de alimento), donde inhibió la expansión de los espacios de las fibras musculares y la inflamación e indujo un efecto protector significativo contra la disminución de los nutrientes musculares y los cambios en la composición proteica (Huang et al., 2021).
![]() La quercetina, los polifenoles del té y la rutina son antioxidantes derivados de plantas ampliamente utilizados que poseen propiedades antioxidantes, antiinflamatorias y antitumorales.
La quercetina, los polifenoles del té y la rutina son antioxidantes derivados de plantas ampliamente utilizados que poseen propiedades antioxidantes, antiinflamatorias y antitumorales.
Adsorbentes
![]() La adición de arcilla a la dieta de L. vannamei expuesta a 200 μg/kg de AFB1 durante 42 días en dosis de 4, 5 y 6 g/kg mejoró la retención de nitrógeno y disminuyó la actividad de ALP (6 g/ kg) y GST (4 g /kg) (García-Pérez et al., 2020).
La adición de arcilla a la dieta de L. vannamei expuesta a 200 μg/kg de AFB1 durante 42 días en dosis de 4, 5 y 6 g/kg mejoró la retención de nitrógeno y disminuyó la actividad de ALP (6 g/ kg) y GST (4 g /kg) (García-Pérez et al., 2020).

Detoxificación
Un nuevo enfoque para la detoxificación de micotoxinas en langostinos es el uso de componentes naturales, como los ácidos biliares y el mioinositol.
![]() Los ácidos biliares son moléculas detergentes sintetizadas a partir del colesterol en los vertebrados (Šarenac y Mikov, 2018) y funcionan como moléculas de señalización, regulando la detoxificación y el sistema antioxidante de los mamíferos mediante la activación de los receptores de hormonas nucleares (Baijal et al., 1998; Reschly et al., 2008).
Los ácidos biliares son moléculas detergentes sintetizadas a partir del colesterol en los vertebrados (Šarenac y Mikov, 2018) y funcionan como moléculas de señalización, regulando la detoxificación y el sistema antioxidante de los mamíferos mediante la activación de los receptores de hormonas nucleares (Baijal et al., 1998; Reschly et al., 2008).
![]() El mioinositol es un nutriente esencial de tipo vitamínico que ha demostrado mejorar la capacidad antioxidante enzimática en la carpa. Sin embargo, en las gambas, el mioinositol mitigó ligeramente (pero no de forma significativa) los efectos negativos sobre el crecimiento, las actividades de las enzimas antioxidantes y la expresión de genes relacionados con el sistema inmunitario de L. vannamei causados por la exposición a la AFB1 (Chen et al., 2020).
El mioinositol es un nutriente esencial de tipo vitamínico que ha demostrado mejorar la capacidad antioxidante enzimática en la carpa. Sin embargo, en las gambas, el mioinositol mitigó ligeramente (pero no de forma significativa) los efectos negativos sobre el crecimiento, las actividades de las enzimas antioxidantes y la expresión de genes relacionados con el sistema inmunitario de L. vannamei causados por la exposición a la AFB1 (Chen et al., 2020).


CONCLUSIONES
El aumento de ingredientes de origen vegetal en los piensos para acuicultura se considera uno de los retos de la cría de langostinos, debido a su mayor susceptibilidad a la contaminación fúngica y a la producción de micotoxinas, lo que acaba repercutiendo en la productividad de los langostinos.
Las micotoxinas afectan a la salud de las gambas a través de diversos mecanismos que interfieren en las funciones fisiológicas normales del organismo.
⇰ Se han adoptado diferentes enfoques para proteger contra la micotoxicosis, sin embargo, los estudios adicionales que utilizan nuevas herramientas respetuosas con el medio ambiente para combatir la contaminación por micotoxinas siguen siendo escasos y requieren más investigación.


REFERENCIAS
Abrar, M., Anjum, F.M., Butt, M.S., Pasha, I., Randhawa, M.A., Saeed, F., Waqas, K., 2013. Aflatoxins: biosynthesis, occurrence, toxicity, and remedies. Critical reviews in food science and nutrition 53, 862 874.
Amoah, K., Huang, Q.-C., Tan, B.-P., Zhang, S., Chi, S.-Y., Yang, Q.-H., Liu, H.-Y., Dong, X.-H., 2019. Dietary supplementation of probiotic Bacillus coagulans ATCC 7050, improves the growth performance, intestinal morphology, microflora, immune response, and disease confrontation of Pacific white shrimp, Litopenaeus vannamei. Fish & shellfish immunology 87, 796-808.
Arunachalam, C., Doohan, F.M., 2013. Trichothecene toxicity in eukaryotes: Cellular and molecular mechanisms in plants and animals. Toxicology letters 217, 149-158.
Asim, M., Sarma, M.P., Thayumanavan, L., Kar, P., 2011. Role of aflatoxin B1 as a risk for primary liver cancer in north Indian population. Clinical biochemistry 44, 1235-1240.
Ayisi, C.L., Hua, X., Apraku, A., Afriyie, G., Kyei, B.A., 2017. Recent studies toward the development of practical diets for shrimp and their nutritional requirements. HAYATI Journal of Biosciences 24, 109-117.
Azad, M.A.K., Islam, S.S., Sithi, I.N., Ghosh, A.K., Banu, G.R., Bir, J., Huq, K.A., 2019. Effect of probiotics on immune competence of giant freshwater prawn Macrobrachium rosenbergii. Aquaculture Research 50, 644-657.
Baijal, P., Fitzpatrick, D., Bird, R., 1998. Modulation of colonic xenobiotic metabolizing enzymes by feeding bile acids: comparative effects of cholic, deoxycholic, lithocholic and ursodeoxycholic acids. Food and chemical toxicology 36, 601-607.
Bautista, M.N., Lavilla‐Pitogo, C.R., Subosa, P.F., Begino, E.T., 1994. Aflatoxin B1 contamination of shrimp feeds and its effect on growth and hepatopancreas of pre‐adult Penaeus monodon. Journal of the Science of Food and Agriculture 65, 5-11.
Bi, S., Huang, Z., Wang, Y., Nie, F., Wang, X., Sun, L., Zhu, Z., Gooneratne, R., 2019. Effects of T-2 toxin on histopathology, fatty acid and water distribution of shrimp (Litopenaeus vannamei) muscle. Journal of Environmental Science and Health, Part B 54, 416-423.
Bintvihok, A., Ponpornpisit, A., Tangtrongpiros, J., Panichkriangkrai, W., Rattanapanee, R., Doi, K., Kumagai, S., 2003. Aflatoxin contamination in shrimp feed and effects of aflatoxin addition to feed on shrimp production. Journal of food protection 66, 882-885.
Bosetti, C., Turati, F., La Vecchia, C., 2014. Hepatocellular carcinoma epidemiology. Best practice & research Clinical gastroenterology 28, 753-770.
Bulbul, M., Kader, M.A., Ambak, M.A., Hossain, M.S., Ishikawa, M., Koshio, S., 2015. Effects of crystalline amino acids, phytase and fish soluble supplements in improving nutritive values of high plant protein based diets for kuruma shrimp, Marsupenaeus japonicus. Aquaculture 438, 98-104.
Bulbul, M., Kader, M.A., Koshio, S., Ishikawa, M., Yokoyama, S., 2014. Effect of replacing fishmeal with canola meal on growth and nutrient utilization in kuruma shrimp M arsupenaeus japonicus (Bate). Aquaculture Research 45, 848-858.
Chen, S.-J., Gan, L., Guo, Y.-C., Tian, L.-X., Liu, Y.-J., 2020. Changes in growth performance, aflatoxin B1 residues, immune response and antioxidant status of Litopenaeus vannamei fed with AFB1-contaminated diets and the regulating effect of dietary myo-inositol supplementation. Food chemistry 324, 126888.
Čolović, R., Puvača, N., Cheli, F., Avantaggiato, G., Greco, D., Đuragić, O., Kos, J., Pinotti, L., 2019. Decontamination of mycotoxin-contaminated feedstuffs and compound feed. Toxins 11, 617.
Dayal, J.S., Rajaram, V., Ambasankar, K., Ali, S.A., 2011. Sunflower oil cake as a replacement for fish meal in feeds of Tiger Shrimp, Penaeus monodon reared in tanks and in net cages.
Deng, Y., Wang, Y., Zhang, X., Sun, L., Wu, C., Shi, Q., Wang, R., Sun, X., Bi, S., Gooneratne, R., 2017. Effects of T-2 Toxin on Pacific White Shrimp Litopenaeus vannamei: Growth, and Antioxidant Defenses and Capacity and Histopathology in the Hepatopancreas. Journal of Aquatic Animal Health 29, 15-25.
Dhanasekaran, D., Shanmugapriya, S., Thajuddin, N., Panneerselvam, A., 2011. Aflatoxins and aflatoxicosis in human and animals. Aflatoxins-Biochemistry and Molecular Biology 10, 221-254.
Diesing, A.-K., Nossol, C., Dänicke, S., Walk, N., Post, A., Kahlert, S., Rothkötter, H.-J., Kluess, J., 2011. Vulnerability of polarised intestinal porcine epithelial cells to mycotoxin deoxynivalenol depends on the route of application. PloS one 6, e17472.
Doi, K., Uetsuka, K., 2011. Mechanisms of mycotoxin-induced neurotoxicity through oxidative stress-associated pathways. International journal of molecular sciences 12, 5213-5237.
Duan, Y., Wang, Y., Dong, H., Ding, X., Liu, Q., Li, H., Zhang, J., Xiong, D., 2018. Changes in the intestine microbial, digestive, and immune-related genes of Litopenaeus vannamei in response to dietary probiotic Clostridium butyricum supplementation. Frontiers in Microbiology 9, 2191.
Fang, H., Wang, B., Jiang, K., Liu, M., Wang, L., 2020. Effects of Lactobacillus pentosus HC-2 on the growth performance, intestinal morphology, immune-related genes and intestinal microbiota of Penaeus vannamei affected by aflatoxin B1. Aquaculture 525, 735289.
Fegan, D., Spring, P. 2007. Recognizing the reality of the aquaculture mycotoxin problem: searching for a common and effective solution. In: Nutritional biotechnology in the feed and food industries: Proceedings of Alltech’s 23rd Annual Symposium. The new energy crisis: food, feed or fuel?, 343-354.
Ferlay, J., Shin, H.R., Bray, F., Forman, D., Mathers, C., Parkin, D.M., 2010. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. International journal of cancer 127, 2893-2917.
García‐Pérez, O.D., Tapia‐Salazar, M., Nieto‐López, M.G., Cruz‐Valdez, J.C., Maldonado-Muñiz, M., Guerrero Guerrero, L.M., Cruz‐ Suárez, L.E., Marroquín-Cardona, A.G., 2020. Effects of conjugated linoleic acid and curcumin on growth performance and oxidative stress enzymes in juvenile Pacific white shrimp (Litopenaeus vannamei) feed with aflatoxins. Aquaculture Research 51, 1051-1060.
Ghaednia, B., Bayat, M., Sohrabi Haghdoost, I., Motallebi, A., Sepahdari, A., Mirbakhsh, M., Mehrabi, M., 2013. Effects of aflatoxin B1 on growth performance, health indices, phagocytic activity and histopathological alteration in Fenneropenaeus indicus.
Gonçalves, R., Hofstetter, U., Schatzmayr, D., Jenkins, T., 2018a. Mycotoxins in Southeast Asian aquaculture: plant-based meals and finished feeds. World Mycotoxin Journal 11, 265-275.
Gonçalves, R., Schatzmayr, D., Hofstetter, U., Santos, G., 2017. Occurrence of mycotoxins in aquaculture: Preliminary overview of Asian and European plant ingredients and finished feeds. World Mycotoxin Journal 10, 183-194.
Gonçalves, R.A., Tarasco, M., Schatzmayr, D., Gavaia, P., 2018b. Preliminary evaluation of moniliformin as a potential threat for teleosts. Fishes 3, 4.
Gong, Y.Y., Wilson, S., Mwatha, J.K., Routledge, M.N., Castelino, J.M., Zhao, B., Kimani, G., Kariuki, H.C., Vennervald, B.J., Dunne, D.W., 2012. Aflatoxin exposure may contribute to chronic hepatomegaly in Kenyan school children. Environmental Health Perspectives 120, 893-896.
Grenier, B., Loureiro‐Bracarense, A.P., Leslie, J.F., Oswald, I.P., 2014. Physical and chemical methods for mycotoxin decontamination in maize. Mycotoxin reduction in grain chains, 116-129.
Huang, X., Huang, Z., Sun, L., Qiu, M., Deng, Q., Fang, Z., Wang, Y., 2022. Protective mechanisms of three antioxidants against T‐2 toxin‐induced muscle protein deterioration in shrimp. Journal of the Science of Food and Agriculture 102, 4883-4891.
Huang, Z., Sun, L., Wang, Y., Deng, Q., Fang, Z., Zhao, L., Zhao, J., 2021. Protective mechanism of tea polyphenols against muscle quality deterioration of shrimp (Penaeus vannamei) induced by aflatoxin B1. Aquaculture 532, 736093.
Huang, Z., Wang, Y., Qiu, M., Sun, L., Deng, Y., Wang, X., Bi, S., Gooneratne, R., Zhao, J., 2019. Effects of T-2 toxin on digestive enzyme activity, intestinal histopathology and growth in shrimp Litopenaeus vannamei. Scientific Reports 9, 13175.
Huang, Z., Wang, Y., Sun, L., Wang, X., Lu, P., Liang, G., Pang, H., Wu, Q., Gooneratne, R., Zhao, J., 2020. Effects of T‐2 toxin on the muscle proteins of shrimp (Litopenaeus vannamei)–a proteomics study. Journal of the Science of Food and Agriculture 100, 119-128.
Humans, I.W.G.o.t.E.o.C.R.t., 2014. DIESEL AND GASOLINE ENGINE EXHAUSTS AND SOME NITROARENES. IARC MONOGRAPHS ON THE EVALUATION OF CARCINOGENIC RISKS TO HUMANS. IARC monographs on the evaluation of carcinogenic risks to humans 105, 9.
Humans, I.W.G.o.t.E.o.C.R.t., Cancer, I.A.f.R.o., 2002. Some traditional herbal medicines, some mycotoxins, naphthalene and styrene, Vol 82. World Health Organization.
Ismaiel, A.A., Papenbrock, J., 2015. Mycotoxins: producing fungi and mechanisms of phytotoxicity. Agriculture 5, 492-537. Jamshidizadeh, S., Amrollahi Biuki, N., Yousefzadi, M., Aramideh, A., 2019. Response of Pacific white leg shrimp (Litopenaeus vannamei) on exposure to aflatoxin in feed. Aquaculture Research 50, 1973-1984.
Katya, K., Lee, S., Yun, H., Dagoberto, S., Browdy, C.L., Vazquez-Anon, M., Bai, S.C., 2016. Efficacy of inorganic and chelated trace minerals (Cu, Zn and Mn) premix sources in Pacific white shrimp, Litopenaeus vannamei (Boone) fed plant protein based diets. Aquaculture 459, 117-123.
Kew, M.C., 2013. Aflatoxins as a cause of hepatocellular carcinoma. Journal of Gastrointestinal & Liver Diseases 22. Macias-Sancho, J., Poersch, L.H., Bauer, W., Romano, L.A., Wasielesky, W., Tesser, M.B., 2014. Fishmeal substitution with Arthrospira (Spirulina platensis) in a practical diet for Litopenaeus vannamei: effects on growth and immunological parameters. Aquaculture 426, 120-125.
Marroquín-Cardona, A., Johnson, N., Phillips, T., Hayes, A., 2014. Mycotoxins in a changing global environment–a review. Food and Chemical Toxicology 69, 220-230.
Mexía-Salazar, A.L., Hernández-López, J., Burgos-Hernández, A., Cortez-Rocha, M.O., Castro-Longoria, R., Ezquerra-Brauer, J.M., 2008. Role of fumonisin B1 on the immune system, histopathology, and muscle proteins of white shrimp (Litopenaeus vannamei). Food chemistry 110, 471-479.
Minervini, F., Fornelli, F., Flynn, K., 2004. Toxicity and apoptosis induced by the mycotoxins nivalenol, deoxynivalenol and fumonisin B1 in a human erythroleukemia cell line. Toxicology in Vitro 18, 21-28.
Oliveira, M., Vasconcelos, V., 2020. Occurrence of mycotoxins in fish feed and its effects: A review. Toxins 12, 160.
Oujifard, A., Seyfabadi, J., Kenari, A.A., Rezaei, M., 2012. Growth and apparent digestibility of nutrients, fatty acids and amino acids in Pacific white shrimp, Litopenaeus vannamei, fed diets with rice protein concentrate as total and partial replacement of fish meal. Aquaculture 342, 56-61.
Pankaj, S., Shi, H., Keener, K.M., 2018. A review of novel physical and chemical decontamination technologies for aflatoxin in food. Trends in Food Science & Technology 71, 73-83.
Patriarca, A., Pinto, V.F., 2017. Prevalence of mycotoxins in foods and decontamination. Current Opinion in Food Science 14, 50-60.
Pérez-Acosta, J.A., Burgos-Hernandez, A., Velázquez-Contreras, C.A., Márquez-Ríos, E., Torres-Arreola, W., Arvizu-Flores, A.A., Ezquerra-Brauer, J.M., 2016. An in vitro study of alkaline phosphatase sensitivity to mixture of aflatoxin B 1 and fumonisin B 1 in the hepatopancreas of coastal lagoon wild and farmed shrimp Litopenaeus vannamei. Mycotoxin research 32, 117-125.
Pestka, J.J., 2010. Deoxynivalenol-induced proinflammatory gene expression: mechanisms and pathological sequelae. Toxins 2, 1300-1317.
Pleadin, J., Frece, J., Markov, K., 2019. Mycotoxins in food and feed. Advances in food and nutrition research 89, 297-345.
Qiu, M., Wang, Y., Wang, X., Sun, L., Ye, R., Xu, D., Dai, Z., Liu, Y., Bi, S., Yao, Y., 2016. Effects of T-2 toxin on growth, immune function and hepatopancreas microstructure of shrimp (Litopenaeus vannamei). Aquaculture 462, 35-39.
Radhika, G., Raj, R., George, K., Sanil, N., 2012. Ultrastructural changes in the hepatopancreas of Penaeus monodon Fabricius 1798 given aflatoxin B1 diets. Aquaculture Research 43, 32-43.
Reschly, E.J., Ai, N., Ekins, S., Welsh, W.J., Hagey, L.R., Hofmann, A.F., Krasowski, M.D., 2008. Evolution of the bile salt nuclear receptor FXR in vertebrates* s⃞. Journal of lipid research 49, 1577-1587.
Šarenac, T.M., Mikov, M., 2018. Bile acid synthesis: from nature to the chemical modification and synthesis and their applications as drugs and nutrients. Frontiers in Pharmacology 9, 939.
Sharawy, Z., Goda, A.M.-S., Hassaan, M.S., 2016. Partial or total replacement of fish meal by solid state fermented soybean meal with Saccharomyces cerevisiae in diets for Indian prawn shrimp, Fenneropenaeus indicus, Postlarvae. Animal Feed Science and Technology 212, 90-99.
Shu, X., Wang, Y., Zhou, Q., Li, M., Hu, H., Ma, Y., Chen, X., Ni, J., Zhao, W., Huang, S., 2018. Biological degradation of aflatoxin B1 by cell-free extracts of Bacillus velezensis DY3108 with broad pH stability and excellent thermostability. Toxins 10, 330.
Su, C., Li, J., Pan, L., Zhang, M., Chen, Z., Lu, M., 2023. Immunotoxicity and the mechanisms of aflatoxin B1-induced growth retardation in shrimp and alleviating effects of bile acids. Journal of Hazardous Materials 459, 132266.
Su, C., Lu, Y., Li, J., Wang, Y., Pan, L., Zhang, M., 2022. Effects of bile acids on aflatoxin B1 bioaccumulation, detoxification system, and growth performance of Pacific white shrimp. Food Chemistry 371, 131169.
Supamattaya, K., Sukrakanchana, N., Boonyaratpalin, M., Schatzmayr, D., Chittiwan, V., 2005. Effects of ochratoxin A and deoxynivalenol on growth performance and immuno-physiological parameters in black tiger shrimp (Penaeus monodon).
Songklanakarin Journal of Science and Technology 27, 91-99. Tacon, A.G., Jory, D., Nunes, A., 2013. Shrimp feed management: issues and perspectives. On-farm feeding and feed management in aquaculture 583, 481-488.
Tacon, A.G., Metian, M., 2008. Aquaculture feed and food safety: the role of the food and agriculture organization and the Codex Alimentarius. Annals of the New York Academy of Sciences 1140, 50-59.
Tapia-Salazar, M., García-Pérez, O.D., Nieto-López, M.G., Cruz-Valdez, J.C., Maldonado-Muñiz, M., Cruz-Suárez, L.E., Marroquín-Cardona, A.G., 2022. Growth parameters and activity of xenobiotic-metabolizing enzymes of juvenile Litopenaeus vannamei fed diets containing aflatoxins and an aflatoxin binder. Hidrobiológica 32, 141-148.
Tapia-Salazar, M., García-Pérez, O.D., Velásquez-Soto, R.A., Nieto-López, M.G., Villarreal-Cavazos, D., Ricque-Marie, D., Cruz-Suárez, L.E., 2012. Growth, feed intake, survival, and histological response of white shrimp Litopenaeus vannamei fed diets containing grains naturally contaminated with aflatoxin. Ciencias Marinas 38, 491 504.
Varga, J., Frisvad, J.C., Samson, R., 2011. Two new aflatoxin producing species, and an overview of Aspergillus section Flavi. Studies in mycology 69, 57-80.
Vila-Donat, P., Marín, S., Sanchis, V., Ramos, A., 2018. A review of the mycotoxin adsorbing agents, with an emphasis on their multi-binding capacity, for animal feed decontamination. Food and chemical toxicology 114, 246-259.
Wang, A., Ran, C., Wang, Y., Zhang, Z., Ding, Q., Yang, Y., Olsen, R.E., Ringø, E., Bindelle, J., Zhou, Z., 2019. Use of probiotics in aquaculture of China—a review of the past decade. Fish & shellfish immunology 86, 734-755.
Wang, J., Guo, R., Su, L., Xia, H., Cui, M., 2012. Toxic effects of aflatoxin B1 on growth performance, biochemical and hepatopancreas microstructure of Litopanaeus vannamei. Journal of Fisheries of China 36, 952-957.
Wang, Y., Wang, B., Liu, M., Jiang, K., Wang, M., Wang, L., 2018. Aflatoxin B1 (AFB1) induced dysregulation of intestinal microbiota and damage of antioxidant system in pacific white shrimp (Litopenaeus vannamei). Aquaculture 495, 940-947.
Wu, Q.-H., Wang, X., Yang, W., Nüssler, A.K., Xiong, L.-Y., Kuča, K., Dohnal, V., Zhang, X.-J., Yuan, Z.-H., 2014. Oxidative stress-mediated cytotoxicity and metabolism of T-2 toxin and deoxynivalenol in animals and humans: an update. Archives of toxicology 88, 1309-1326.
Xie, S., Zheng, L., Wan, M., Niu, J., Liu, Y., Tian, L., 2018. Effect of deoxynivalenol on growth performance, histological morphology, anti-oxidative ability and immune response of juvenile Pacific white shrimp, Litopenaeus vannamei. Fish & shellfish immunology 82, 442-452.
Yang, Q., Tan, B., Dong, X., Chi, S., Liu, H., 2015. Effect of replacing fish meal with extruded soybean meal on growth, feed utilization and apparent nutrient digestibility of juvenile white shrimp (Litopenaeus vannamei). Journal of Ocean University of China 14, 865-872.
Yang, X., Lv, Y., Huang, K., Luo, Y., Xu, W., 2016. Zinc inhibits aflatoxin B1-induced cytotoxicity and genotoxicity in human hepatocytes (HepG2 cells). Food and Chemical Toxicology 92, 17-25.
Yu, Y.-Y., Niu, J., Yin, P., Mei, X.-T., Liu, Y.-J., Tian, L.-X., Xu, D.-H., 2018. Detoxification and immunoprotection of Zn(II)-curcumin in juvenile Pacific white shrimp (Litopenaeus vannamei) feed with aflatoxin B1. Fish & Shellfish Immunology 80, 480-486.
Zeng, S., Long, W., Tian, L., Xie, S., Chen, Y., Yang, H., Liang, G., Liu, Y., 2016. Effects of dietary aflatoxin B1 on growth performance, body composition, haematological parameters and histopathology of juvenile Pacific white shrimp (Litopenaeus vannamei). Aquaculture Nutrition 22, 1152-1159.
Zhang, C., Zhang, J., Fan, W., Huang, M., Liu, M., 2019. Effects of dietary Lactobacillus delbrueckii on growth performance, body composition, digestive and absorptive capacity, and gene expression of common carp (Cyprinus carpio Huanghe var). Aquaculture Nutrition 25, 166-175.
Zhao, W., Wang, L., Liu, M., Jiang, K., Wang, M., Yang, G., Qi, C., Wang, B., 2017. Transcriptome, antioxidant enzyme activity and histopathology analysis of hepatopancreas from the white shrimp Litopenaeus vannamei fed with aflatoxin B1 (AFB1). Developmental & Comparative Immunology 74, 69-81.
Zuo, Z.-h., Shang, B.-j., Shao, Y.-c., Li, W.-y., Sun, J.-s., 2019. Screening of intestinal probiotics and the effects of feeding probiotics on the growth, immune, digestive enzyme activity and intestinal flora of Litopenaeus vannamei. Fish & shellfish immunology 86, 160-168.




 Prevención de micotoxicosis
Prevención de micotoxicosis