Prof. Simon Jackson
Molendotech Ltd., Devon, Reino Unido
¿Qué son las las endotoxinas?
Las endotoxinas son componentes mayoritarios de la membrana externa de las bacterias Gram negativas.
⇰ Están compuestas por un lípido de anclaje, denominado lípido A, y una unidad de repetición de polisacáridos. Debido a su estructura, las endotoxinas también se conocen como lipopolisacáridos (LPS) (Figura 1).
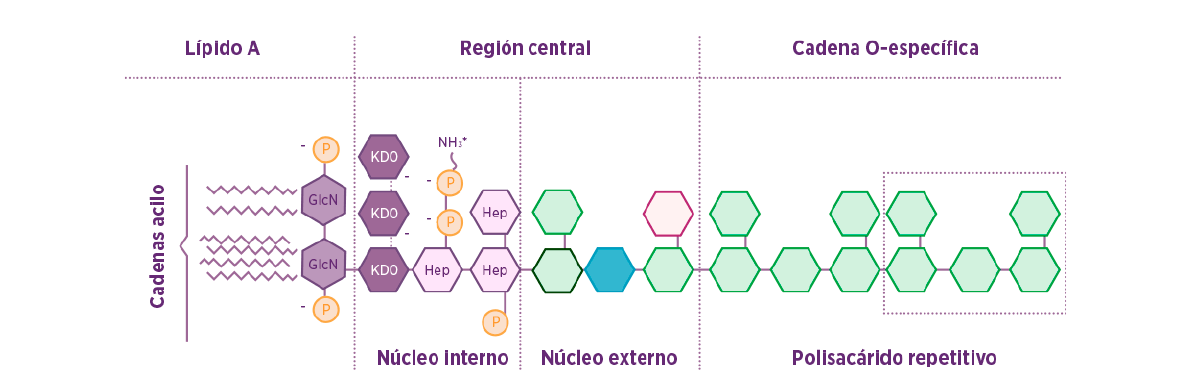
Figura 1. Esquema de la estuctura de la endotoxina de E. coli (adaptado de Abate et.al, Journal of medical microbiology, 2017).
 Las endotoxinas aumentan la carga negativa de la membrana celular y ayudan a estabilizar la estructura general de la membrana formando una barrera de permeabilidad eficaz contra las moléculas pequeñas e hidrofóbicas, lo que hace que las bacterias Gram negativas sean innatamente resistentes a muchos compuestos antimicrobianos.
Las endotoxinas aumentan la carga negativa de la membrana celular y ayudan a estabilizar la estructura general de la membrana formando una barrera de permeabilidad eficaz contra las moléculas pequeñas e hidrofóbicas, lo que hace que las bacterias Gram negativas sean innatamente resistentes a muchos compuestos antimicrobianos.Aunque la estructura general de la endotoxina es similar entre las especies bacterianas Gram negativas, los cambios en la composición de los polisacáridos (cadena específica O o antígeno O) generan una gran variedad, haciéndola diferente para las distintas cepas bacterianas.
De hecho, el antígeno O se utiliza para identificar cepas específicas de bacterias entéricas como E. coli (por ejemplo, E. coli O157), donde la “O” significa antígeno O.
Además de su función en la estabilidad e identificación de las bacterias, las endotoxinas están muy implicadas en las enfermedades humanas y animales, sobre todo en relación con las respuestas inmunitarias e inflamatorias.
¿Cuál es la actividad biológica de las endotoxinas?
La actividad biológica de las endotoxinas está asociada a sus componentes lipídicos y polisacáridos del lipopolisacárido (LPS).
![]() La toxicidad está asociada al lípido A.
La toxicidad está asociada al lípido A.
![]() La inmunogenicidad está asociada a los componentes polisacáridos.
La inmunogenicidad está asociada a los componentes polisacáridos.
El lípido A es un potente modificador de la respuesta biológica que puede estimular el sistema inmunitario de los mamíferos.
⇰ Fija la molécula de endotoxina en la membrana externa de las células bacterianas, ejerciendo sus efectos biológicos cuando la endotoxina es liberada de las mismas, ya sea por desprendimiento natural de las bacterias en crecimiento o cuando las bacterias son lisadas por autolisis, ataque del complemento, fagocitosis o por ciertos antibióticos.
Es importante recordar que las endotoxinas son particularmente estables al calor y no son destruidas por los métodos habituales de autoclave o de inactivación por calor. Además, las endotoxinas, a diferencia de las bacterias, no se ven afectadas por los antibióticos y pueden producir sus efectos tóxicos en ausencia de bacterias viables.
¿Cuál es la diferencia entre endotoxina y exotoxina?
Las endotoxinas, por sí mismas, no son tóxicas como otras toxinas, como las exotoxinas.
EXOTOXINAS
Las exotoxinas son proteínas producidas y secretadas por algunas cepas de bacterias Gram-positivas y Gram-negativas, y suelen tener células diana específicas donde provocan efectos tóxicos, como la alteración del metabolismo y la muerte celular.
Por ejemplo, E. coli enterotoxigénica (ETEC) produce una enterotoxina termoestable (STa) que se une a los receptores de los enterocitos en el intestino, interrumpiendo el transporte de iones y agua, lo que provoca una abundante diarrea (Kopic y Geibel, 2010).
ENDOTOXINAS
Por el contrario, las endotoxinas son liberadas al producirse la lisis bacteriana y no tienen células diana específicas.
 El sistema inmunitario las “detecta” como una señal de infección que desencadena respuestas inmunitarias inflamatorias que pueden dar lugar a enfermedades mortales (sepsis).
El sistema inmunitario las “detecta” como una señal de infección que desencadena respuestas inmunitarias inflamatorias que pueden dar lugar a enfermedades mortales (sepsis).
¿Cómo estimulan las endotoxinas al sistema inmunitario?
La “toxicidad” asociada a las endotoxinas se debe a la respuesta inmunitaria del hospedador. Las endotoxinas son reconocidas por el sistema inmunitario como señales de una infección por bacterias Gram negativas, lo que desencadena una respuesta inmunitaria inflamatoria innata.
En la sangre, que normalmente es estéril, cantidades mínimas de endotoxinas (<1ug) pueden estimular una intensa respuesta inflamatoria.
Las células inmunitarias, como los macrófagos y los monocitos, tienen receptores en la superficie de las células -receptores Toll-like 4 (TLR4)- que reconocen las endotoxinas.
 La unión de la endotoxina al TLR4 desencadena una cascada de señalización celular que da lugar a la expresión de genes y a la producción de proteínas que estimulan una respuesta inflamatoria:
La unión de la endotoxina al TLR4 desencadena una cascada de señalización celular que da lugar a la expresión de genes y a la producción de proteínas que estimulan una respuesta inflamatoria:
Citoquinas: Interleucina 6 (IL-6) y TNFα.
Mediadores inflamatorios: Factor de activación plaquetaria (PAF) e Interleucina 1 (IL-1).
Las endotoxinas también activan el sistema del Complemento y desencadenan el sistema de coagulación de la sangre (Figura 2).
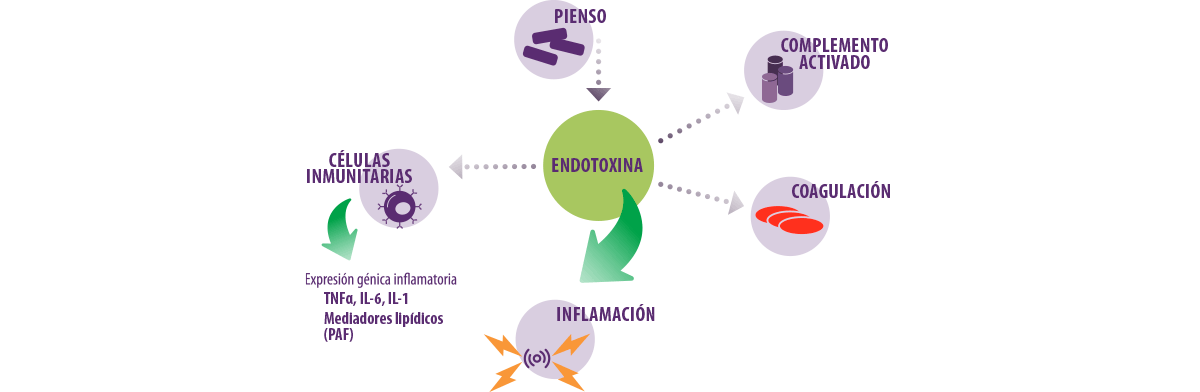
Figura 2. Las endotoxinas presentes en los alimentos para animales pueden activar el sistema inmunitario del hospedador, provocando una respuesta inflamatoria que puede dañar tejidos y órganos y provocar la muerte.
Esto estimula más respuestas inflamatorias, lo que permite una rápida activación del sistema inmunitario innato, para hacer frente a cualquier bacteria antes de que la infección avance demasiado.
 Sin embargo, la potente respuesta inflamatoria tiene que ser cuidadosamente controlada y «apagada» para evitar daños al huésped.
Sin embargo, la potente respuesta inflamatoria tiene que ser cuidadosamente controlada y «apagada» para evitar daños al huésped.
⇰ Esto se consigue mediante la producción de mediadores antiinflamatorios como los antagonistas del receptor de la interleucina 10 y de la interleucina 1 y las proteínas que se unen a las endotoxinas (proteína de unión al LPS (LBP)).
 Asimismo, las células inmunitarias, como los macrófagos y los neutrófilos, pueden ayudar a eliminar las endotoxinas mediante la producción de enzimas que degradan la parte del lípido A de la molécula.
Asimismo, las células inmunitarias, como los macrófagos y los neutrófilos, pueden ayudar a eliminar las endotoxinas mediante la producción de enzimas que degradan la parte del lípido A de la molécula.
![]() El hígado también desempeña un papel importante en este sentido.
El hígado también desempeña un papel importante en este sentido.
| Si una cantidad importante de endotoxinas entra en el torrente sanguíneo o no puede eliminarse rápidamente, la respuesta inflamatoria puede exagerarse con una «tormenta de citoquinas» que escapa al control de los mecanismos antiinflamatorios, dañando los tejidos y órganos del hospedador.
Esta condición se conoce como sepsis y conlleva una alta tasa de mortalidad. Por lo tanto, la presencia de endotoxinas en la sangre puede ser letal y deben minimizarse los mecanismos que permiten su acceso a la circulación sanguínea. |
¿Cómo se detectan las endotoxinas?
La respuesta a las endotoxinas se ha conservado a través de la evolución y, dotando a nuestros ancestros de una ventaja de supervivencia en un mundo lleno de patógenos Gram-negativos.
De hecho, se ha observado una respuesta a las endotoxinas en antiguas criaturas marinas como el cangrejo de herradura (Limulus polyphemus) que han estado en la tierra durante muchos millones de años (Levin y Bang, 1968).

El descubrimiento de una respuesta inmunitaria de coagulación frente a endotoxinas en el cangrejo herradura, condujo al desarrollo de un ensayo muy sensible para las endotoxinas bacterianas utilizando las células sanguíneas (amebocitos) de estos organismos: el test de lisado de amebocitos de Limulus (LAL) (Figura 3).
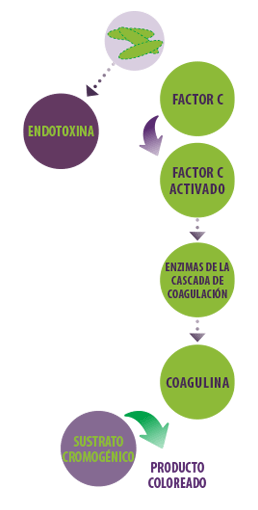
Figura 3. Principio del test LAL para detectar endotoxinas bacterianas. Las endotoxinas, desprendidas de las bacterias Gram negativas, se unen y activan el factor C en los amebocitos de Limulus. Esto desencadena una reacción en cascada de enzimas que culmina en la formación de un coágulo de sangre (coagulina). La adición de un sustrato cromogénico permite que la reacción produzca un producto coloreado.
Este test se utiliza de forma rutinaria en la industria farmacéutica, puesto que se requiere que todos los medicamentos y dispositivos médicos, como marcapasos, catéteres y otros dispositivos invasivos, estén libres de contaminación por endotoxinas, ya que podrían producirse reacciones inmunitarias potencialmente mortales (sepsis) si la endotoxina se administra inadvertidamente al cuerpo humano (Abate et al., 2020).
 Los investigadores de Molendotech Limited han desarrollado una versión del test LAL que puede analizar muestras ambientales para detectar el contenido de endotoxinas como prueba, para la contaminación bacteriana o fecal del agua o los alimentos, incluidos los piensos.
Los investigadores de Molendotech Limited han desarrollado una versión del test LAL que puede analizar muestras ambientales para detectar el contenido de endotoxinas como prueba, para la contaminación bacteriana o fecal del agua o los alimentos, incluidos los piensos.
¿Cómo pueden pasar las endotoxinas a la circulación sanguínea?
El intestino es un enorme reservorio de bacterias Gram negativas y, en consecuencia, contiene grandes cantidades de endotoxinas que pueden entrar en el torrente sanguíneo a través de la absorción intestinal.
El organismo ha desarrollado la compartimentación para evitar que entren altas cantidades de endotoxinas en el torrente sanguíneo.
 Sin embargo, las lesiones intestinales, una dieta rica en lípidos, los tratamientos farmacológicos, las infecciones o la inmadurez (por ejemplo, los neonatos) facilitan la translocación de las endotoxinas a través de la membrana hacia la circulación sistémica.
Sin embargo, las lesiones intestinales, una dieta rica en lípidos, los tratamientos farmacológicos, las infecciones o la inmadurez (por ejemplo, los neonatos) facilitan la translocación de las endotoxinas a través de la membrana hacia la circulación sistémica.
El deterioro de la función de la barrera intestinal también es motivo de preocupación en los animales y se sabe que el estrés en los cerdos o la acidosis ruminal subaguda (ARSA) en el ganado vacuno facilitan la entrada de endotoxinas en la circulación y provocan consecuencias patológicas.
⇰ Se ha demostrado que dosis bajas de endotoxinas inducen los síntomas de ARSA, incluyendo inflamación, disminución del pH ruminal y la alteración de la microbiota (Jing et al., 2014). Por lo tanto, la inhalación o el consumo de endotoxinas puede iniciar una enfermedad grave en animales jóvenes.
Los aditivos para piensos, como los aminoácidos y las vitaminas, son producidos cada vez más mediante tecnología recombinante utilizando bacterias Gram negativas, especialmente E. coli.
| Si las endotoxinas de las bacterias contaminan el aditivo, podría suponer un riesgo para los animales, así como para los trabajadores que manipulan los aditivos y el consumidor. |
Se ha documentado, por ejemplo, que los trabajadores expuestos a endotoxinas inhaladas con el polvo procedente de naves avícolas u otras fuentes presentan síntomas clínicos, incluida la disminución de la función pulmonar (Consejo de Salud de los Países Bajos, 2010).
 Aunque el ganado de granja está continuamente expuesto a las endotoxinas del medio ambiente, incluidos los piensos, las dietas que contienen altas concentraciones de endotoxinas suponen un riesgo, ya que incluso pequeñas dosis que atraviesan la barrera intestinal pueden causar enfermedades graves (Mani et al., 2013).
Aunque el ganado de granja está continuamente expuesto a las endotoxinas del medio ambiente, incluidos los piensos, las dietas que contienen altas concentraciones de endotoxinas suponen un riesgo, ya que incluso pequeñas dosis que atraviesan la barrera intestinal pueden causar enfermedades graves (Mani et al., 2013).
⇰ Por ello, vale la pena limitar los ingredientes de los piensos que contienen endotoxinas, en animales con una función de barrera gastrointestinal alterada (Wallace et al., 2016).
También cabe esperar que los animales reaccionen a las endotoxinas inhaladas presentes en el polvo de las naves y de los piensos, de forma similar a los trabajadores humanos. Sin embargo, hay pocos estudios sobre la exposición de los animales a las endotoxinas inhaladas y los límites de exposición son inciertos.
¿Pueden las MICOTOXINAS influir en la respuesta a las endotoxinas?
Las micotoxinas son toxinas producidas por hongos (mohos) que crecen en los cultivos o en los ingredientes de los piensos durante su almacenamiento. Pueden causar una serie de efectos adversos para la salud y suponen una grave amenaza para la salud de los seres humanos y del ganado.
⇰ Las micotoxinas que se encuentran habitualmente en los piensos son las aflatoxinas, la zearalenona, la toxina T2, el deoxinivalenol y la ocratoxina A.
 Los piensos contaminados resultan en la presencia conjunta de micotoxinas y endotoxinas en el tracto gastrointestinal de los animales de producción y se ha descubierto que tienen efectos adversos sinérgicos en la salud de los animales y el consiguiente impacto económico.
Los piensos contaminados resultan en la presencia conjunta de micotoxinas y endotoxinas en el tracto gastrointestinal de los animales de producción y se ha descubierto que tienen efectos adversos sinérgicos en la salud de los animales y el consiguiente impacto económico.
Como se ha señalado anteriormente, una barrera intestinal intacta es importante para reducir la incorporación de endotoxinas a la circulación sanguínea y evitar sus consecuencias inflamatorias. Además, un sistema inmunitario y un hígado sanos también son importantes para controlar la cantidad de endotoxinas en la sangre.
⇰ Las micotoxinas dañan los epitelios del intestino (barrera), lo que permite que más contenido intestinal, incluidas las endotoxinas, pasen a la circulación sanguínea.
Las micotoxinas también tienen efectos sobre la función de las células inmunitarias y dañan el hígado, lo que provoca un aumento de las respuestas inflamatorias, al tiempo que disminuyen cualquier mecanismo de eliminación de endotoxinas (Figura 4).
Así, las micotoxinas presentes en los piensos actuarán de forma sinérgica con las endotoxinas, ocasionando graves consecuencias para la salud de los animales que ingieran los piensos contaminados. Los animales jóvenes, en fase de destete, serán especialmente vulnerables (Wallace et al., 2016).
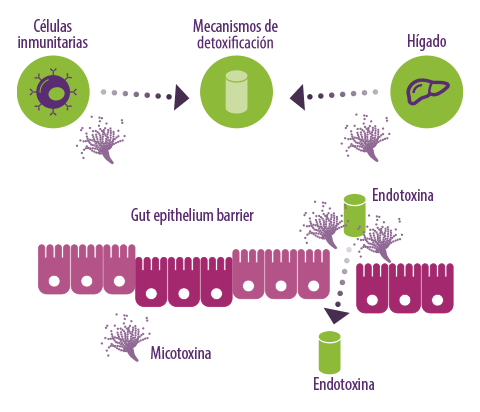
Figura 4. Las micotoxinas afectan a las células inmunitarias y al hígado, impidiendo la producción de enzimas de desintoxicación de endotoxinas y otras moléculas antiinflamatorias. También pueden alterar la barrera epitelial intestinal que normalmente impide la entrada de endotoxinas en la circulación sanguínea.
¿Cómo podemos mitigar los efectos de las endotoxinas y las micotoxinas en los piensos?
Para limitar o prevenir los efectos de las endotoxinas y las micotoxinas en los piensos, éstos deben tratarse con agentes que aglutinen y eliminen estas moléculas (Boyacioglu, 2019) y debe comprobarse su eficacia para eliminar las endotoxinas.
Además, el propio pienso puede someterse a pruebas para determinar el contenido de bacterias Gram negativas y endotoxinas.
Existen pruebas para diferentes micotoxinas, pero son más complejas. El cribado general de la contaminación por hongos (moho) debería ser posible con pruebas que estarán disponibles en breve.

REFERENCIAS
Abate W, Sattar A, Liu J, Conway ME and Jackson SK; J Med Microbiol. 2017 66(7):888-897.
Abate W, Alrammah H, Kiernan M, Tonks AJ, Jackson SK Sci Rep. 2020 Jun 25;10(1):10355.
Boyacioglu H. World Grain ; 2019-12-23
Health Council of the Netherlands. Endotoxins 2010. The Hague: Health Council of the Netherlands; 2010. publicationno. 2010/04OSH
Kopic S. and Geibel J.; Toxins 2010; (8): 2132–2157.
Levin J, Bang FB.; Thromb Diath Haemorrh. 1968 19(1):186-97.
Mani V,et al., : J Anim Sci. 2013; 91:2141–50.
Jing L, Zhang R, Liu Y, Zhu W, Mao S. Br J Nutr. 2014;112:170–82.
Wallace RJ et al., Environmental Health (2016) 15:5




 Prevención de micotoxicosis
Prevención de micotoxicosis