R. K. Asrani y Rakesh Kumar
Departamento de Patología Veterinaria, Colegio de Ciencias Veterinarias y Animales Dr. G C Negi, CSK Universidad Agrícola de Himachal Pradesh, Palampur, Himachal Pradesh, India
Las micotoxinas son metabolitos secundarios nocivos producidos por hongos, que ocasionan importantes efectos perjudiciales para la salud de los seres humanos y los animales1. Son compuestos de bajo peso molecular que se sabe que son perjudiciales incluso en bajas concentraciones2.
 Se estima que aproximadamente el 25% de los cultivos, incluidos los granos de cereales y las nueces, están frecuentemente contaminados con hongos3.
Se estima que aproximadamente el 25% de los cultivos, incluidos los granos de cereales y las nueces, están frecuentemente contaminados con hongos3.
Las micotoxinas nocivas más frecuentes presentes en los alimentos y piensos son la aflatoxina B1 (AFB1), la ocratoxina A (OTA), los tricotecenos, toxinas HT-2 y T-2, la fumonisina B1 (FB1), la citrinina (CTN), la zearalenona (ZEN) y los alcaloides ergóticos.
⇰ Se ha documentado una distribución predominantemente marcada de fumonisinas, zearalenona y deoxinivalenol (DON) a nivel mundial4.
Los cereales pueden contaminarse en el campo o durante la cosecha, en el transporte, en el procesamiento o en el almacenamiento5,6. La tasa de contaminación de los cultivos con hongos se desencadena con mayor frecuencia por la estación de las lluvias7.

Entre los factores que facilitan la producción de micotoxinas en los productos contaminados se incluyen8:
- ⇰ El contenido de humedad (20-25%)
- ⇰ Temperatura ambiental (22-30ºC)
- ⇰ Composición de los alimentos
- ⇰ La humedad relativa del aire (70-90%)
- ⇰ Daños físicos a los cereales por las plagas
- ⇰ pH
- ⇰ Presencia de esporas de moho
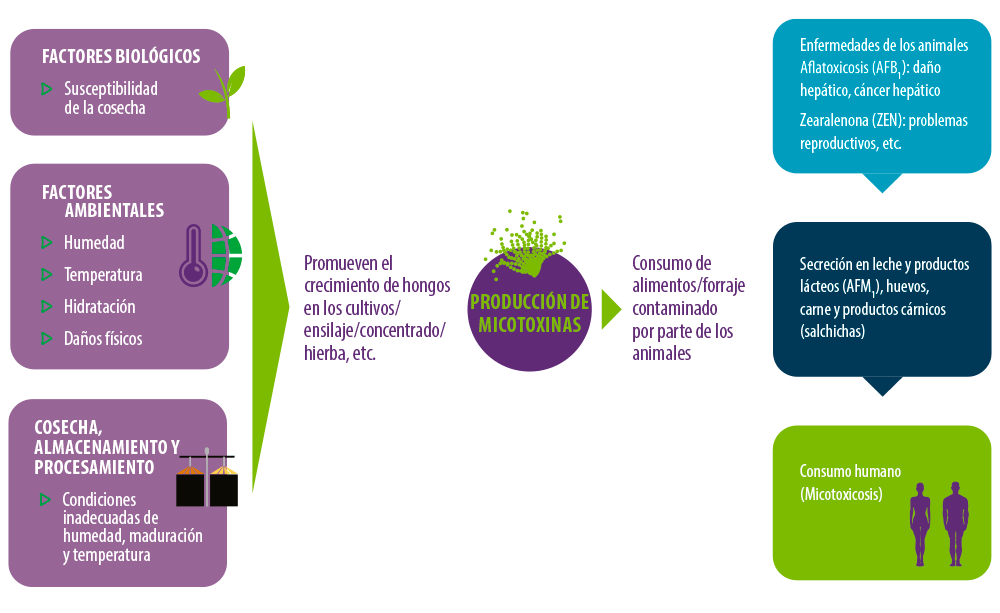
Figura 1. Producción de micotoxinas y su presencia en la cadena alimentaria.
Las rutas comunes de entrada de micotoxinas en el cuerpo son:
⇰ El consumo directo de productos de origen vegetal contaminados (cereales, nueces, pan, etc.) y productos de origen animal (carne y productos cárnicos, leche, despojos, salchichas fermentadas, etc.)9,10.
⇰ El contacto dérmico y la inhalación no son rutas muy comunes, pero pueden actuar como un modo potencial de entrada en el organismo11.
Los efectos tóxicos nocivos de las micotoxinas dependen de11,12:
 El tipo de micotoxina
El tipo de micotoxina La dosis introducida en el organismo
La dosis introducida en el organismo La duración de la exposición a las micotoxinas
La duración de la exposición a las micotoxinas
Las micotoxinas son conocidas por producir varios efectos dañinos en los animales y los seres humanos. La clasificación de estas toxinas puede hacerse en función de su toxicidad13 y de los síntomas clínicos relacionados con los órganos afectados14.
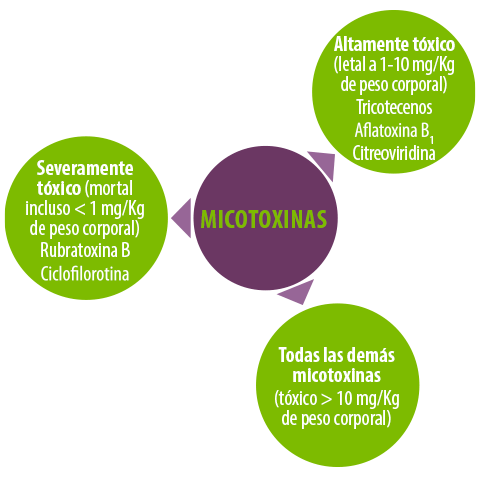
Figura 2. Clasificación de las micotoxinas en función de su toxicidad.
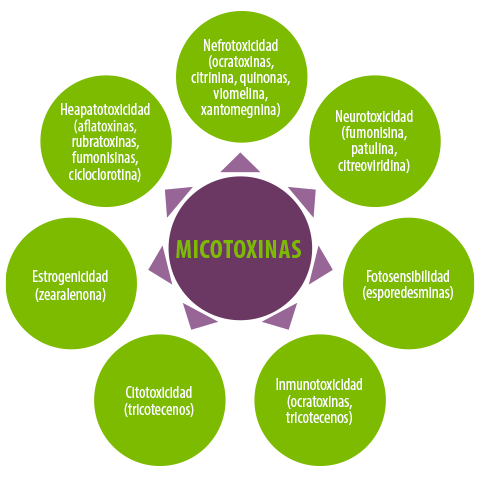
Figura 3. Clasificación de las micotoxinas en base a las manifestaciones clínicas.
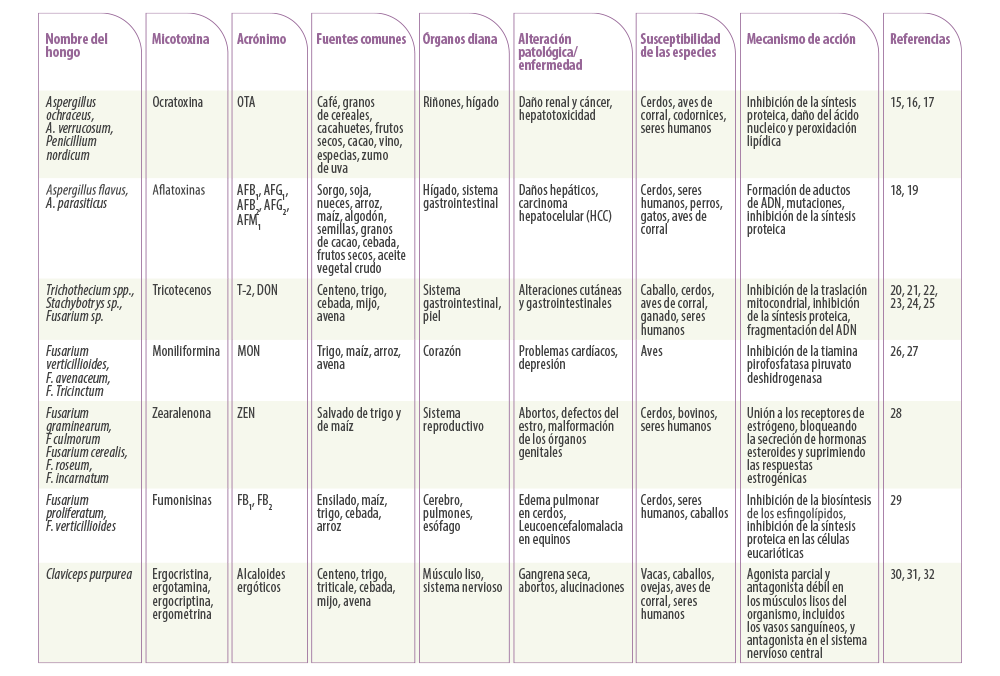
Tabla 1. Resumen de las diferentes micotoxinas y sus efectos tóxicos.
Efectos de la exposición a AFLATOXINAS
Los episodios de aflatoxicosis están asociados a la producción de aflatoxinas por parte de especies fúngicas comunes como Aspergillus flavus y A. parasiticus en productos alimenticios contaminados33.
 En 1960, en el Reino Unido, se notificó el primer informe sobre mortalidad asociada a harina de cacahuete contaminada con aflatoxinas en pavos y aves de corral34.
En 1960, en el Reino Unido, se notificó el primer informe sobre mortalidad asociada a harina de cacahuete contaminada con aflatoxinas en pavos y aves de corral34.
La lista de aflatoxinas producidas por varias especies fúngicas incluye AFB1, AFB2, AFG1, AFG2 y AFM1.
De todas las aflatoxinas conocidas, la AFB1 es la más común y potente35.
 Las aflatoxinas son muy estables y rara vez se destruyen tras el procesamiento36. Además, se sabe que los residuos de aflatoxinas también se excretan en la leche, los productos lácteos, la carne y los huevos33.
Las aflatoxinas son muy estables y rara vez se destruyen tras el procesamiento36. Además, se sabe que los residuos de aflatoxinas también se excretan en la leche, los productos lácteos, la carne y los huevos33.
La AFB1 es reconocida por su potencial hepatotóxico, teratogénico, inmunotóxico y mutagénico, estando clasificada como carcinógeno del grupo 1 por la Agencia Internacional para la Investigación del Cáncer (IARC)37, ya que provoca un carcinoma hepatocelular en los seres humanos.
El orden de gravedad de los efectos mutagénicos, inmunosupresores y cancerígenos de las aflatoxinas es:
AFB1> AFG1> AFB2>AFG233
La AFB1 provoca alteraciones del desarrollo junto con disfunciones del sistema inmunitario38.
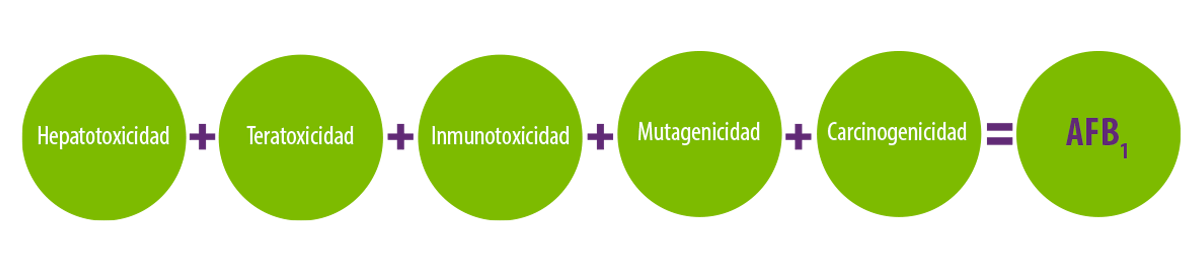
Figura 4. Efectos nocivos de la AFB1.
Susceptibilidad de las especies a las aflatoxinas
Todas las especies animales son sensibles a la aflatoxicosis, pero los brotes suelen presentarse con más frecuencia entre los cerdos, el ganado vacuno y las ovejas39.
Las importantes pérdidas económicas, incluyendo la disminución de la tasa de crecimiento y de la productividad, suelen observarse en los animales de granja, en función de su susceptibilidad individual y de las especies afectadas40,41,42.
 La exposición crónica a AFB1 en animales de granja puede provocar varias enfermedades, como disfunción hepática, función inmunitaria comprometida y susceptibilidad a varias enfermedades43,44,45,46,47,48.
La exposición crónica a AFB1 en animales de granja puede provocar varias enfermedades, como disfunción hepática, función inmunitaria comprometida y susceptibilidad a varias enfermedades43,44,45,46,47,48.
 Algunas especies, como los monos, los pollos y los ratones, han demostrado ser resistentes a la AFB149, mientras que el ganado vacuno, los caballos y las ovejas son bastante propensos a la toxicidad inducida por el AFB1.
Algunas especies, como los monos, los pollos y los ratones, han demostrado ser resistentes a la AFB149, mientras que el ganado vacuno, los caballos y las ovejas son bastante propensos a la toxicidad inducida por el AFB1. Los animales más jóvenes son más susceptibles que los adultos y los animales mayores50.
Los animales más jóvenes son más susceptibles que los adultos y los animales mayores50. Entre los animales acuáticos, se ha observado que la trucha es la más sensible a la toxicidad por AFB151.
Entre los animales acuáticos, se ha observado que la trucha es la más sensible a la toxicidad por AFB151. Entre las aves de corral, el orden de sensibilidad es: patos > pavos> codorniz japonesa> pollos52.
Entre las aves de corral, el orden de sensibilidad es: patos > pavos> codorniz japonesa> pollos52.

Figura 5. Diagrama de flujo que indica el modo de acción de la aflatoxina B1.
|
Se puede observar dolor abdominal, vómitos y edema en las etapas agudas, mientras que el desarrollo del carcinoma hepatocelular es evidente en etapas posteriores56. |

La taoxicidad inducida por AFB1 en ruminates conduce a:
- ⇰ Disminución de la motilidad ruminal
- ⇰ Disminución en la digestión celular y la producción de ácidos grasos
- ⇰ Descenso en la eficiencia alimentaria y secreción en leche a las 12 h de su consumo.
Aflatoxina M1
La aflatoxina M1 (AFM1) es un carcinógeno del grupo 1 (IARC) resultante de la biotransformación microbiana por hidroxilación dependiente de CYP1A2 a partir de AFB1.Se forman aductos nucleares y se secretan en leche y orina.
La concentración de AFM1 en la leche está condicionada por varios factores, como la duración de la lactancia y la producción de leche por parte del animal57.
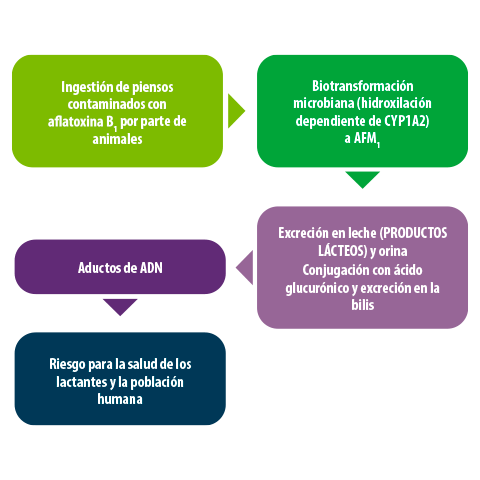
Figura 6. Aflatoxins M1 en la cadena alimentaria.
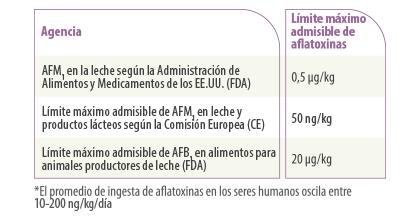
Tabla 2. Límites admisibles de aflatoxinas consumo58,59.

Tabla 3. Efectos clínicos y anatomopatológicos de las aflatoxinas.
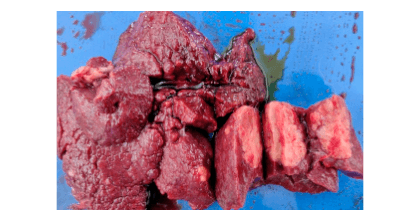
Imagen 1. Alteraciones patológicas graves asociadas a AFB1. Hígado de un conejo que muestra una hepatitis crónica junto con crecimiento tumoral.
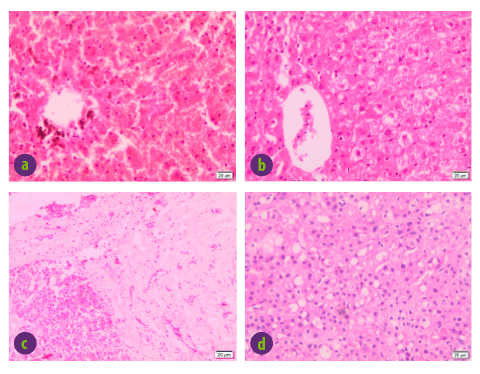
Imagen 2. Microfotografías de alteraciones patológicas asociadas a AFB1 a. Hígado con hemorragias difusas junto con un área necrótica en los hepatocitos junto con deposición de hemosiderina (H&E*66). b. Hígado con hepatocitos hinchados con cambios hidrópicos (H&E*66). c. Hígado con fibrosis portal e hiperplasia del conducto biliar (H&E*33). d. Hígado con desplazamiento periférico del núcleo, dando un aspecto de anillo de sello que indica cambios grasos en los hepatocitos (H&E*66).
Efectos de la exposición a OCRATOXINA A
Aspergillus ochraceus, Auplopus carbonarius y Penicillium verrucosum son las especies fúngicas más comunes asociadas a la producción de ocratoxinas en granos contaminados, alimentos crudos y cocidos y bebidas (café, frijoles y vino).
⇰ Aspergillus ochraceus y Penicillium verrucosum son los hongos más potentes responsables de la producción de ocratoxina A (OTA) en las regiones tropicales y templadas, respectivamente.
Esta micotoxina fue reportada por primera vez en harina de maíz contaminada72 y se considera la micotoxina más común y potente producida por estos hongos73.
La OTA es fácilmente conocida por ser nefrotóxica, cancerígena, inmunosupresora, teratogénica y genotóxica para los animales74,75,76. Además, se ha descubierto que también produce carcinoma hepatocelular, aparte de las propiedades nefrotóxicas, de forma dosis dependiente77.
![]() Los cerdos y las aves de corral son más sensibles a la toxicidad inducida por OTA.
Los cerdos y las aves de corral son más sensibles a la toxicidad inducida por OTA.
![]() Los rumiantes suelen ser resistentes, ya que la OTA es degradada por la microflora ruminal a metabolitos menos tóxicos como la OTAα78.
Los rumiantes suelen ser resistentes, ya que la OTA es degradada por la microflora ruminal a metabolitos menos tóxicos como la OTAα78.
![]() Algunos investigadores han demostrado la secreción de OTA en leche materna, lo que significa que puede suponer una grave amenaza para los recién nacidos a través de la lactancia79.
Algunos investigadores han demostrado la secreción de OTA en leche materna, lo que significa que puede suponer una grave amenaza para los recién nacidos a través de la lactancia79.
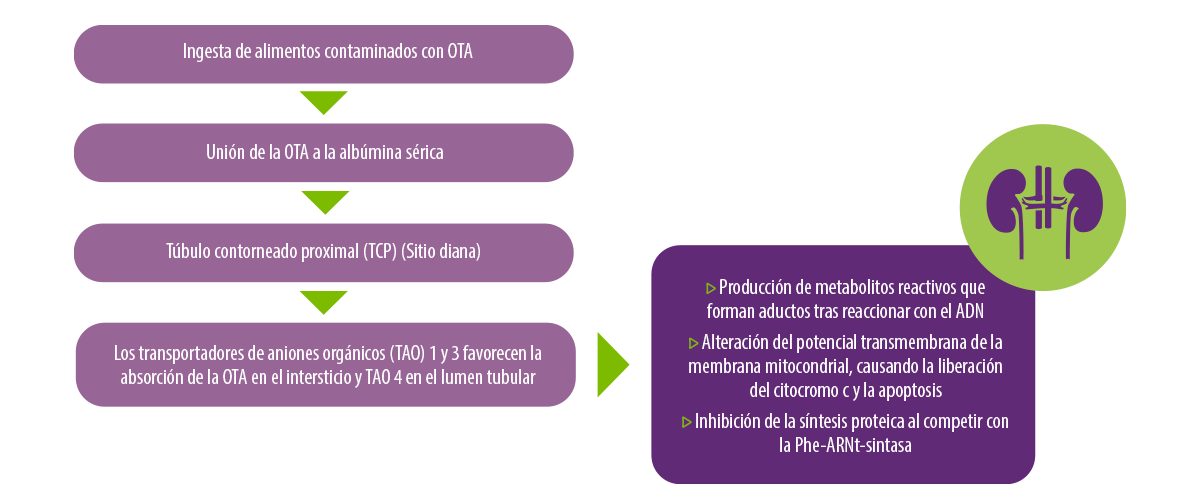
Figura 7. Diagrama de flujo que muestra el mecanismo de acción de la OTA en las células tubulares del riñón80,81,82.

Tabla 4. Límites admisibles de OTA.

Tabla 5. Efectos clínicos y anatomopatológicos de las ocratoxinas.
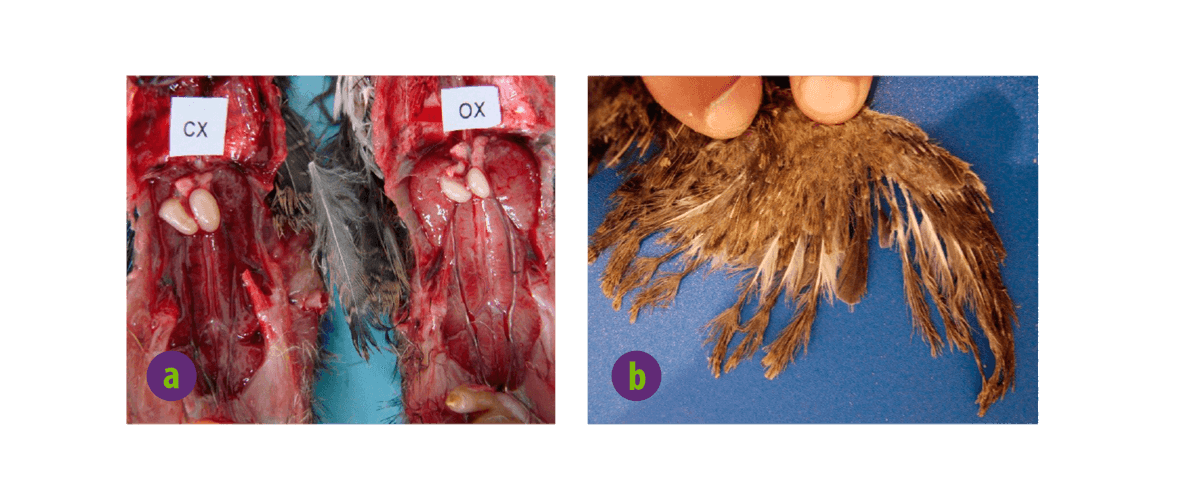
Imagen 3. Alteraciones patológicas graves asociadas a OTA. a. Riñones de codorniz japonesa hinchados y pálidos tras la administración de ocratoxina A en la dieta (derecha) en comparación con los riñones del lado izquierdo. b. Aspecto arrugado de las plumas de una codorniz japonesa tras la administración de la ocratoxina A.
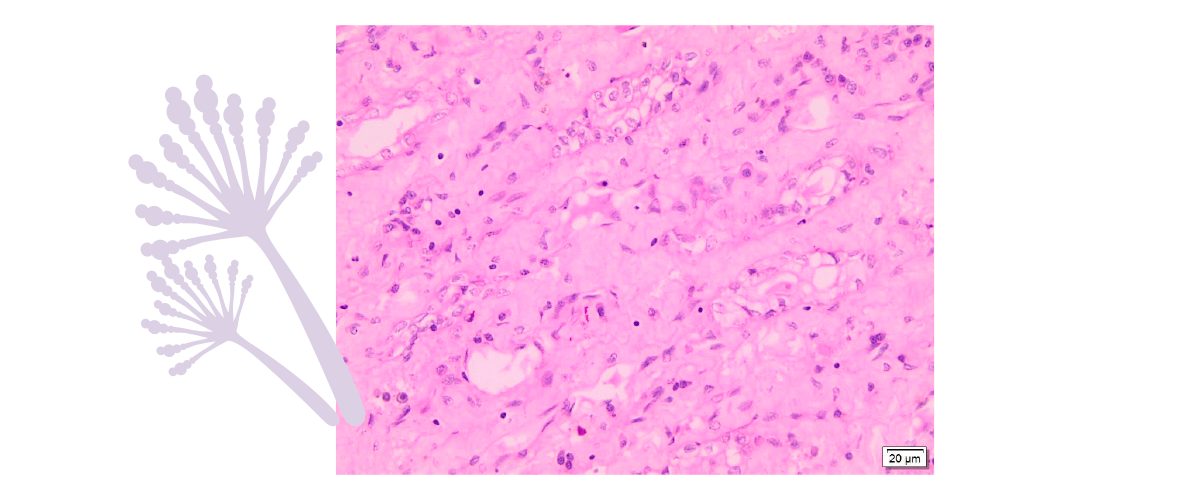
Imagen 4. Microfotografía de las alteraciones patológicas asociadas a la OTA. Riñón con acumulación de tejido fibroso en el tejido intersticial, ocasionando atrofia de los túbulos renales por toxicidad inducida por OTA (H&E*66).
Efectos de la exposición a FUMONISINAS
Las fumonisinas son producidas por especies de hongos como Fusarium verticillioides y F. proliferatum, y con frecuencia se ven en el maíz, dándole un aspecto blanquecino99.
Las variantes más comunes de fumonisinas incluyen la fumonisina A y la fumonisina B (B1, B2, B3 y B1 hidrolizada), y entre ellas la fumonisina B1 es la más común y potente100.
La toxicidad asociada a las fumonisinas se describió por primera vez en 1980 como causa de la leucoencefalomalacia equina (ELEM) y el edema pulmonar porcino (EPP) en los Estados Unidos, y del cáncer de esófago en África.
Estas micotoxinas causan neurotoxicidad, hepatotoxicidad, toxicidad embrionaria y nefrotoxicidad en los animales101,102.
⇰ También se ha señalado que las fumonisinas causan leucoencefalomalacia en caballos, carcinoma hepatocelular en ratas y edema pulmonar en asociación con el hidrotórax en cerdos103, mientras que la IARC también ha documentado el potencial carcinógeno de las fumonisinas en los seres humanos104.
 La producción de esta micotoxina es más probable cuando el contenido de humedad es < 19%.
La producción de esta micotoxina es más probable cuando el contenido de humedad es < 19%.Según JECFA, el límite máximo admisible de FB según el nivel de efecto no observable (NOEL) de 0,2 mg/kg pc/día con un factor de seguridad de 100 es de 2 μg/kg/día105.
Mecanismos de acción de las fumonisinas102:
- ⇰ Inhibición competitiva de la enzima ceramida sintasa
- ⇰ Estrés oxidativo y estrés del retículo endoplasmático
- ⇰ Modulación autofágica
- ⇰ Alteración de la metilación del ADN

Figura 8. Mecanismos de inhibición del metabolismo de los esfingolípidos.
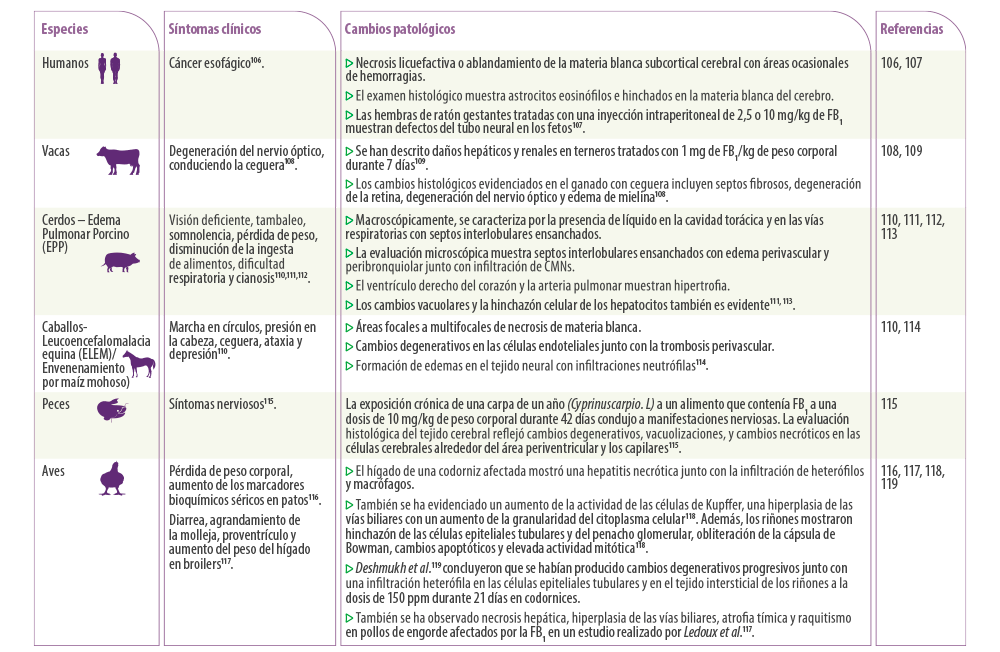
Tabla 6. Efectos clínicos y anatomopatológicos de las fumonisinas.
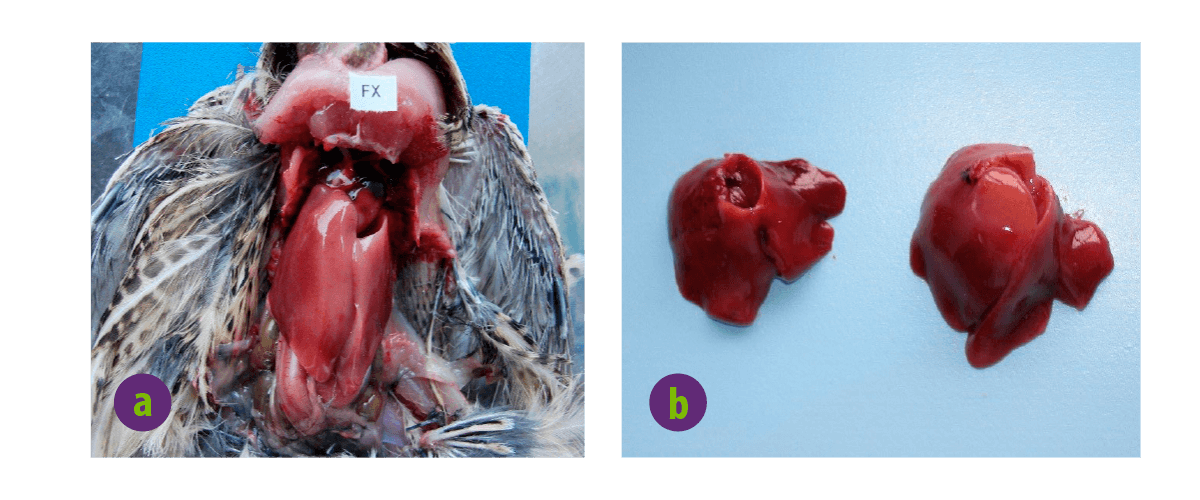
Imagen 5. Alteraciones patológicas macroscópicas asociadas a FB1. a. Agrandamiento del hígado de una codorniz japonesa después de alimentarla con fumonisinas (FB1) durante 3 semanas a una dosis de 300 ppm. b. Agrandamiento del hígado (lado derecho) con la toxicidad por fumonisinas (FB1) en comparación con el hígado normal del lado izquierdo.
Imagen 6. Microfotografía de las alteraciones patológicas asociadas a FB1. Hígado de una codorniz japonesa que refleja los cambios necróticos junto con la infiltración heterófila mezclada con células mononucleares tras la administración de FB1 (H&E*330).
Efectos de la exposición a TRICOTECENOS
Los tricotecenos son metabolitos secundarios tóxicos producidos por Fusarium graminearum, Stachybotrys, Fusarium poae, Fusarium langsethiae, etc., que a menudo se encuentran contaminando el trigo, el maíz, la cebada y la avena mantenidos en condiciones ambientales húmedas.
La producción de estas micotoxinas se ve a menudo favorecida por las temperaturas ambientales (0-32ºC) con condiciones de humedad120, 121.
Las principales micotoxinas pertenecientes al grupo de los tricotecenos incluyen las toxinas tipo A (T-2) y tipo B (DON), y su potencial tóxico se debe a la presencia de un anillo de epóxido122.
Estos metabolitos tóxicos son bastante resistentes al procesamiento y sólo se destruyen a temperaturas superiores a 260ºC durante más de 30 min.

Efectos nocivos y límites admisibles de los tricotecenos
En cerdos, vacas, pollos y ratas, los tricotecenos dañan el hígado y el estómago123.
⇰ Por ello, la toxicidad de los tricotecenos en los animales de granja suele estar asociada a síntomas como vómitos, diarrea, anorexia, pérdida de peso y muerte124,125. Además, la mala absorción inducida por los tricotecenos en cerdos, aves de corral y ratas suele estar asociada con la necrosis de las vellosidades intestinales126,127.
⇰ Según la UE, el límite máximo para la presencia de DON en raciones para vacuno es de 5 mg/kg de ración, mientras que para los terneros es de alrededor de 1 mg/kg de pienso.
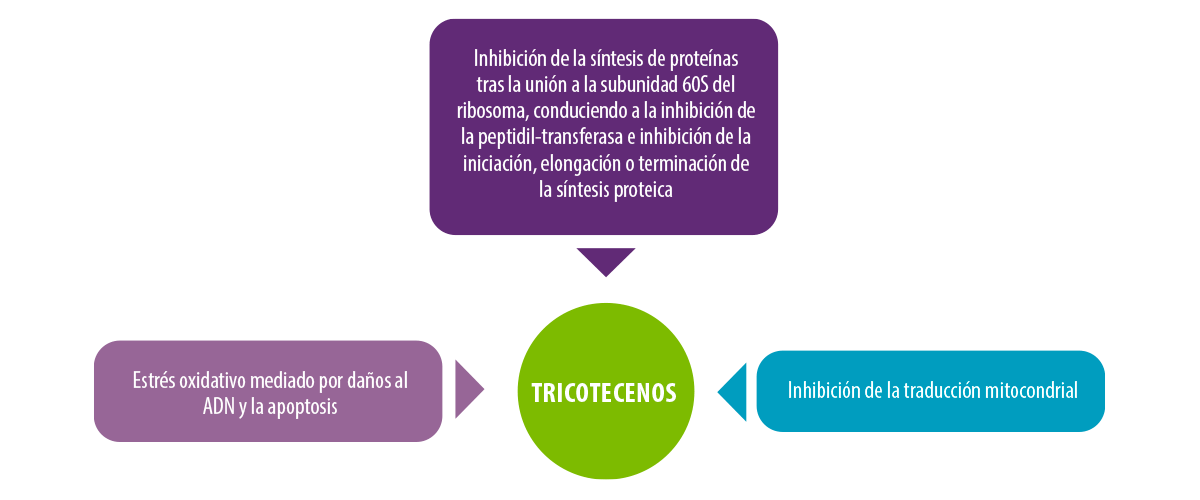
Figura 9. Mecanismos de acción de los tricotecenos20, 21, 22, 23.
En estudios realizados por Ingalls129 y Cote et al.130 no se observó ninguna variación marcada en la producción de leche cuando se administró DON a razón de 14 mg/kg durante 3 semanas y 66 mg/kg durante 5 días, respectivamente.
Basándonos en la presencia de enlaces éster-éter entre el C-4 y el C-15 en el C-12 podemos dividir los tricotecenos en 2 tipos: macrocíclicos y no macrocíclicos. Los tricotecenos no macrocíclicos se enumeran en la Tabla 7.
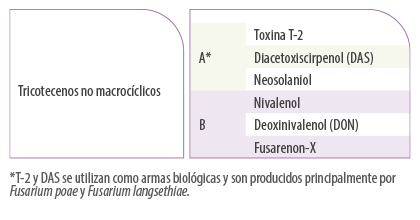
Tabla 7. Clasificación de los tricotecenos.

Tabla 8. Efectos clínicos y anatomopatológicos de los tricotecenos.
Efectos de la exposición a ZEARALENONA
Las especies de hongos más comunes que participan en la producción de zearalenona (ZEN) incluyen Fusarium culmorum, F. cerealis y F. graminearum. Esta micotoxina se encuentra comúnmente en los granos de cereales en regiones templadas con clima cálido144,145 y puede permanecer estable a temperaturas de hasta 150˚C146.
⇰ La producción más alta de ZEN se registra a 25˚C con un 16% de contenido de humedad147.

Los cinco metabolitos principales de la ZEN son α-zearalenona (α-ZEN), β-zearalenona (β-ZEN), α-zearalenol (α-ZAL), β-zearalenol (β-ZAL) y zearalenol (ZON), teniendo la α-ZEN la mayor actividad estrogénica149,150.
La zearalenona es responsable de causar la podredumbre de la mazorca en el maíz y fusariosis de la espiga en trigo y cebada151, con efectos inmunotóxicos, genotóxicos, hepatotóxicos y hematotóxicos en los animales, así como un importante potencial nefrotóxico con capacidad para producir adenomas en la hipófisis152,153, 154, 155. Además, la ZEN está vinculada a trastornos reproductivos en los animales y al síndrome de hiperestrogenismo en los seres humanos156.

Tabla 9. Límites admisibles de zearalenona (ZEN).
Se estima que los cerdos son la especie más sensible a los trastornos reproductivos inducidos por ZEN en comparación con otros animales157.
 Alrededor del 80-85% de la dosis oral de ZEN se absorbe eficientemente en los cerdos158.
Alrededor del 80-85% de la dosis oral de ZEN se absorbe eficientemente en los cerdos158. La concentración de ZEN y α-ZEN en el fluido folicular de los cerdos es de 38,9 y 17,6 pg/ml, respectivamente159.
La concentración de ZEN y α-ZEN en el fluido folicular de los cerdos es de 38,9 y 17,6 pg/ml, respectivamente159. Se han registrado datos muy limitados sobre la foliculogénesis en los ovarios de los animales domésticos160, pero la ZEN muestra afinidad con los receptores de estrógeno en el útero, la glándula mamaria, el cerebro y los huesos, lo que refleja su potencial estrogénico161.
Se han registrado datos muy limitados sobre la foliculogénesis en los ovarios de los animales domésticos160, pero la ZEN muestra afinidad con los receptores de estrógeno en el útero, la glándula mamaria, el cerebro y los huesos, lo que refleja su potencial estrogénico161.
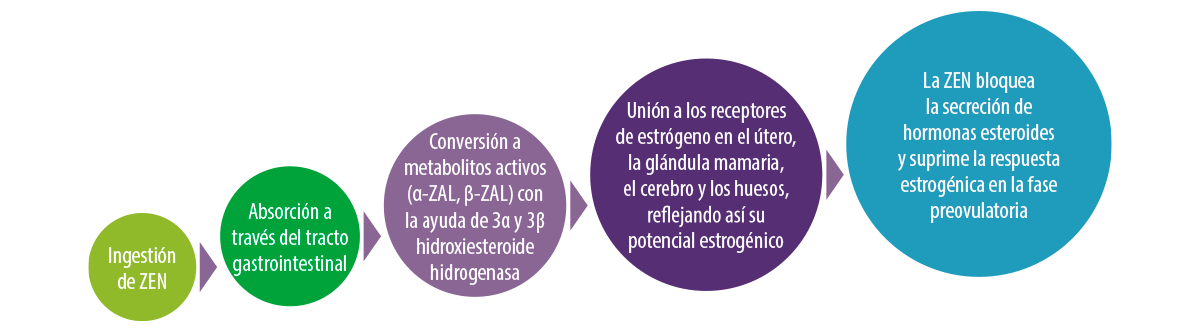
Figura 10. Mecanismo de acción de la ZEN.

Tabla 10. Efectos clínicos y anatomopatológicos de la zearalenona.
Efectos de la exposición a MONILFORMINA
Las fuentes fúngicas que intervienen en la producción de monilformina (MON) son Fusarium moniliforme, F proliferatum, F. avenaceum, F. subglutinans, F. tricinctum y Pencillium melanoconidium177 178,179,180.
Los granos de cereales contaminados y las plantas utilizadas para la preparación de ensilado son la principal fuente de producción de esta micotoxina.
La MON es cardiotóxica y hematotóxica181, con una toxicidad aguda comparable a la toxicidad por tricotecenos (T-2, HT-2)182,183. Se han registrado brotes mortales por MON en animales y estudios experimentales en aves y ratas han demostrado sus posibles efectos patológicos184,185,186.
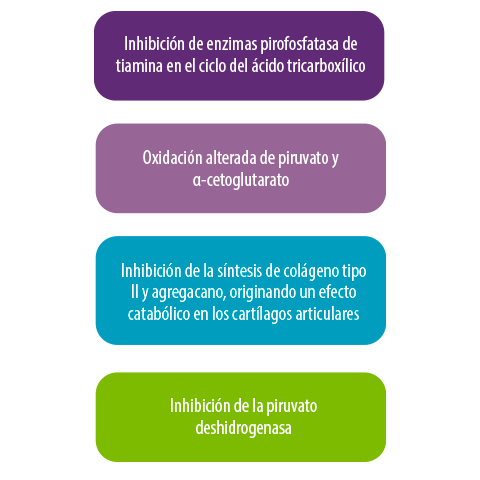
Figura 11. Mecanismos de acción de MON187, 188.
Efectos clínicos y anatomopatológicos de la moniliformina

En aves y roedores de laboratorio se observan hemorragias intestinales en los casos agudos, mientras que las hemorragias cardíacas son lesiones típicas en los casos subagudos y crónicos de toxicidad del MON189.
 En uno de los estudios de toxicidad subaguda realizados por Jonsson et al.190 se pusieron de manifiesto hemorragias intestinales con congestión pulmonar en ratas, sin otras lesiones específicas en otros órganos.
En uno de los estudios de toxicidad subaguda realizados por Jonsson et al.190 se pusieron de manifiesto hemorragias intestinales con congestión pulmonar en ratas, sin otras lesiones específicas en otros órganos. También se ha documentado en estudios anteriores una cardiomiopatía caracterizada por cambios necróticos y degenerativos en el corazón, con hipertrofia de las fibras musculares que provocan paro cardíaco en codornices alimentadas con MON a dosis de 100 ppm191.
También se ha documentado en estudios anteriores una cardiomiopatía caracterizada por cambios necróticos y degenerativos en el corazón, con hipertrofia de las fibras musculares que provocan paro cardíaco en codornices alimentadas con MON a dosis de 100 ppm191.
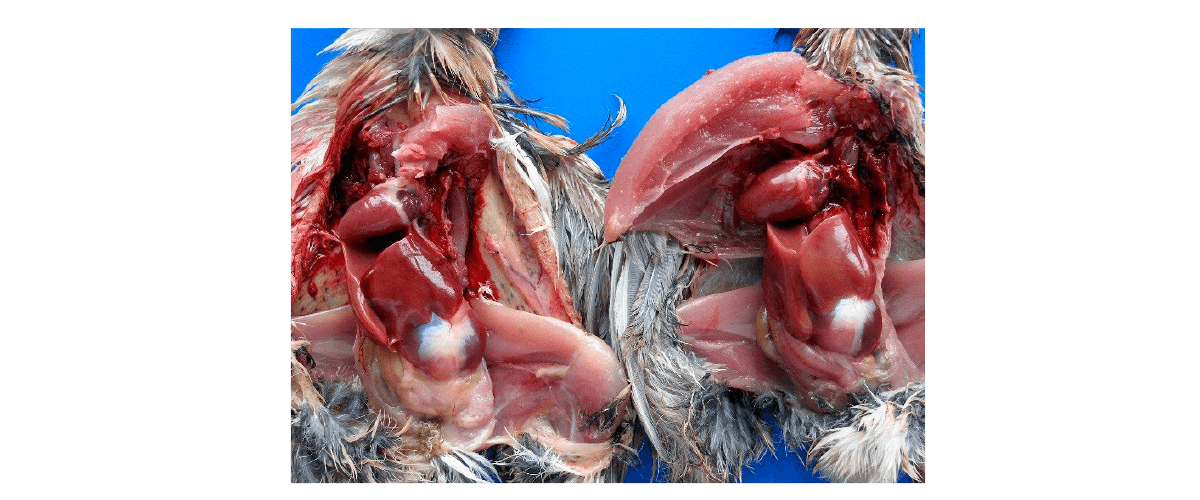
Imagen 7. Alteraciones patológicas graves asociadas a la MON. Codorniz japonesa mostrando redondeo y dilatación del corazón (lado derecho) tras la administración de MON a una dosis de 110 ppm durante 3 semanas; el lado izquierdo muestra un corazón normal.
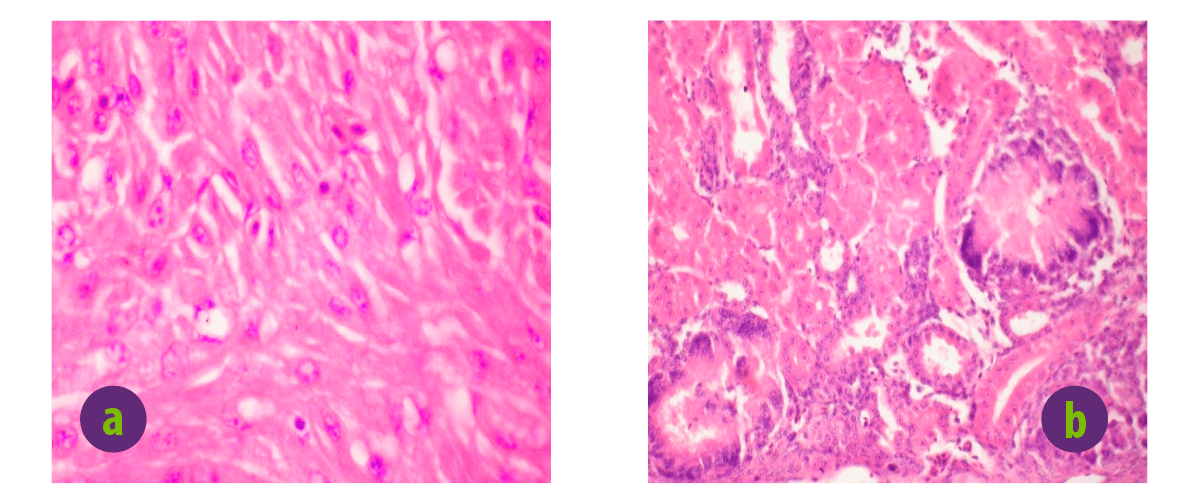
Imagen 8. Microfotografías de alteraciones patológicas asociadas a MON. a. Corazón de una codorniz japonesa que muestra la hipertrofia de las fibras del músculo cardíaco tras la administración de MON (H&E*132). b. Penachos glomerulares ocupados por cristales de ácido úrico en forma de aguja asociados a la toxicidad inducida por MON (H&E*66).
Toxicidad asociada a múltiples
MICOTOXINAS
En condiciones de campo, lo más común es encontrar materias primas contaminadas con una o más micotoxinas, con variaciones en los síntomas asociados a la exposición, ya que la combinación de estas toxinas puede implicar diferentes tipos de interacciones, como efectos sinérgicos, aditivos o antagónicos, como se muestran en la Tabla 11.

Tabla 11. Efectos tóxicos combinados de varias micotoxinas.

CONCLUSIONES
Las micotoxinas son metabolitos muy dañinos conocidos por contaminar los alimentos y están implicadas en varias alteraciones clínicas y patológicas en los seres humanos y los animales.
 Niveles excesivos de micotoxinas pueden resultar peligrosos para la salud de los animales directamente y, a través de los productos animales, para los seres humanos.
Niveles excesivos de micotoxinas pueden resultar peligrosos para la salud de los animales directamente y, a través de los productos animales, para los seres humanos.Aunque en muchos de los países los límites admisibles para diversas micotoxinas están estandarizados, muchas regiones en desarrollo de todo el mundo aún necesitan que se establezcan minuciosamente esas normas con un seguimiento estricto para reducir los niveles de micotoxinas en la cadena alimentaria.
Es de suma importancia prevenir la contaminación fúngica de los productos alimenticios, proporcionando cultivos o productos animales de alta calidad con estrategias controladas de almacenamiento, cosecha y distribución.
El control regular de los alimentos, piensos, etc. mediante la aplicación de pautas y normas de seguridad adecuadas, sin duda, ayudará a limitar la contaminación por hongos.
A fin de limitar la producción de micotoxinas, se proponen varias estrategias que son seguidas constantemente por diversos organismos y órganos reguladores. En el presente escenario, para minimizar la producción de micotoxinas durante la elaboración de materias primas y productos alimenticios finales para uso animal o humano, los principios básicos que deben seguirse incluyen:
- ✔ Buenas prácticas agrícolas (BPA)
- ✔ Buenas Prácticas de Manufactura (BPM)
- ✔ Sistema de Análisis de Peligros y Puntos Críticos de Control (APPCC)
BIBLIOGRAFÍA
1. Haschek, W.M.; Voss, K.A. Mycotoxins. Haschek and Rousseaux’s Handbook of Toxicologic Pathology. Third Edition. University of Illinois, Urbana, IL, USA, 2 USDA Agricultural Research Service, Athens, GA, USA, 2013; 1187-1258. http://dx.doi.org/10.1016/B978-0-12-415759- 0.00039-X
2. Milićević, D.R.; Skrinjar, M.; Baltić, T. Real and perceived risks for mycotoxin contamination in foods and feeds: challenges for food safety control. Toxins 2010, 4, 572-92. doi: 10.3390/toxins2040572.
3. Pandya, J.P.; Arade, P.C. Mycotoxin: a devil of human, animal and crop health. Adv. Life Sci. 2016, 5, 3937–3941.
4. Binder, E.M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology 2007, 133 (1–2), 149-166.
5. Coffey, R. EndaCummins; ShaneWard. xposure assessment of mycotoxins in dairy milk. Food Control 2009, 20 (3), 239-249.
6. Khazaeli, P.; Najafi, M.L.; Bahaabadi, GA.; Shakeri, F.; Naghibzadeh tahami, A. Evaluation of aflatoxin contamination in raw and roasted nuts in consumed Kerman and effect of roasting, packaging and storage conditions. Life Sci. J. 2014, 10, 578–583.
7. Pleadin, J.; Vahcic, N.; Persi.; Sevelj.; Markov, K.; Frece, J. Fusarium mycotoxins’ occurrence in cereals harvested from Croatian fields. Food Control 2013, 32, 49-54
8. Pleadin, J.; Kovačević, D.; Peršia, N. Ochratoxin A contamination of the autochthonous dry-cured meat product “Slavonski Kulen” during a six-month production process. Food Control 2015, 57, 377-384
9. Cavret, S.; Lecoeura, S. Fusariotoxin transfer in animal. Food and Chemical Toxicology 2006, 44(3), 444-453
10. Pleadin, J.; Staver, M.M.; Vahčić, N.; Kovačević, D.; Milone, S.; LaraSaftićb Scortichini, G. Survey of aflatoxin B1 and ochratoxin A occurrence in traditional meat products coming from Croatian households and markets. Food Control 2015, 52, 71-77
11. Creppy, E.E. Update of survey, regulation and toxic effects of mycotoxins in Europe. Toxicol Lett. 2002, 28, 127(1-3), 19-28. doi: 10.1016/ s0378-4274(01)00479-9.
12. Speijers, G.J.; Speijers, M.H. Combined toxic effects of mycotoxins. Toxicol Lett. 2004, 153(1), 91-8. doi: 10.1016/j.toxlet.2004.04.046.
13. Fleurat-Lessard, F. Integrated management of risk of stored grain spoilage by seedborne fungi and contamination by storage mould Mycotoxins: An update. Journal of Stored Products Research 2017, 71, 22: 40.
14. Pleadin, J.; Frece, J.; Markov, K. Mycotoxins in food and feed. Adv Food Nutr Res. 2019, 89, 297-345. doi: 10.1016/bs.afnr.2019.02.007.
15. Ringot, D.; Chango, A.; Schneiderb, Y.J.; Larondelle, Y. Toxicokinetics and toxicodynamics of ochratoxin A, an update. Chemico-Biological Interactions 2006, 159, 18-46
16. Sorrenti, V.; Di Giacomo, C.; Acquaviva, R.; Barbagallo, I.; Bognanno, M.; Galvano, F. Toxicity of ochratoxin A and its modulation by antioxidants: a review. Toxins 2013, 5, 1742-1766.
17. Kuroda, K.; Hibi, D.; Ishii, Y.; Yokoo, Y.; Takasu, S.; Kijima, A.; Matsushita K.; Masumura K.I.; Kodama Y.; Yanai T.; Sakai H.; Nohmi T.; Ogawa, K.; Umemura, T. Role of p53 in the progression from ochratoxin A-induced DNA damage to gene mutations in the kidneys of mice. Toxicological Sciences 2015, 144, 65-76
18. Hamid, A.S.; Tesfamariam, I.G.; Zhang, Y.; Zhang, Z.G. Aflatoxin B1-induced hepatocellular carcinoma in developing countries: geographical distribution, mechanism of action and prevention. Oncology letters 2013, 5, 1087-1092
19. McLean, M.; Dutton, M.F. Cellular interactions and metabolism of aflatoxin: an update. Pharmacology and Therapeutics 1995, 65, 163-192.
20. Carter, C.J.; Cannon, M. Structural requirements for the inhibitory action of 12,13-epoxytrichothecenes on protein synthesis in eukaryotes. Biochemical Journal 1977, 166, 399–409.
21. McLaughlin, C.S.; Vaughan, M.H.; Campbell, I.M.; Wei, C.M.; Stafford, M.E.; Hansen, B.S. 1977. Inhibition of protein synthesis by trichothecenes. In: Rodricks, JV.; Hesseltine, CW.; Mehlman, MA. (Eds.), Mycotoxins in Human and Animal Health. Pathotox Publications, Park Forest South, IL, 1997; 263–273.
22. Yang, L.; Tu, D.; Zhao, Z.; Cui, J. Cytotoxicity and apoptosis induced by mixed mycotoxins (T-2 and HT-2 toxin) on primary hepatocytes of broilers in vitro. Toxicon 2017, 129, 1–10. 10.1016/j.toxicon.2017.01.001
23. Bin-Umer, M.A.; McLaughlin, J.E.; Basu, D.; McCormick, S.; Tumer, N.E. Trichothecene mycotoxins inhibit mitochondrial translation–implication for the mechanism of toxicity. Toxins 2011, 3(12), 1484-501. doi: 10.3390/toxins3121484.
24. Pestka, J.J.; Zhou, H.R.; Moon, Y.; Chung, Y.J. Cellular and molecular mechanisms for immune modulation by deoxynivalenol and other trichothecenes: unraveling a paradox. Toxicology Letters 2004,153, 61-73.
25. Weidner, M.; Welsch, T.; Hübner, F.; Schwerdt, G.; Gekle, M.; Humpf, H.U. Identification and apoptotic potential of T-2 toxin metabolites in human cells. Journal of Agricultural and Food Chemistry 2012, 60, 5676-5684.
26. Thiel, P.G. A molecular mechanism for the toxic action of moniliformin, a mycotoxin produced by Fusarium moniliforme. Biochem Pharmacol. 1978, 27, 483-486.
27. Zhang, A.; Cao, J.L.; Yang, B.; Chen, J.H. Zhang, Z.-T.; Li, S.-Y.; Fu, Q.; Hugnes, C.; Caterson, B. Effects of moniliformin and selenium on human articular cartilage metabolism and their potential relationships to the pathogenesis of Kashin-Beck disease. J. Zhejiang Univ. Sci. B. 2010, 11 (3), 200–208.
28. Wang, Y.; Zheng, W.; Bian, X.; Yuan, Y.; Gu, J.; Liu, X.; Liu, Z.; Bian, J. Zearalenone induces apoptosis and cytoprotective autophagy in primary leydig cells. Toxicology Letters 2014, 226 (2), 182–91.
29. Liu, X.; Fan, L.; Yin, S.; Chen, H.; Hu, H. Molecular mechanisms of fumonisin B1-induced toxicities and its applications in the mechanism-based interventions. Toxicon. 2019, 167, 1-5. doi: 10.1016/j.Toxicon.2019.06.009.
30. Brunton, L.L.; Lazo, J.S.; Parker, K.L.; Goodman and Gilman’s. The Pharmacological Basis of Therapeutics. 11th edition. Ed McGraw-Hill. New York, 2006; 1984.
31. EFSA Panel on Contaminants in the Food Chain (CONTAM); Scientific Opinion on Ergot alkaloids in food and feed. EFSA Journal 2012, 10(7), 2798. [158 pp.] doi:10.2903/j.efsa.2012.2798.
32. Forth, W.; Henschler, D.; Rummel, W. Allgemeine und spezielle Pharmakologie und Toxikologie. Urban & Fischer Verlag, München, Germany, 2009; 10.
33. Bbosa, G.S.; Kitya, D.; Odda, J.; Ogwal-Okang, J. Aflatoxin metabolism, effect of epigenetic mechanisms and their role in carcinogenesis. Health 2013, 5, 14-34
34. Food and Agriculture Organisation/World Health Organization, Safety evaluation of certain contaminants in food. Prepared by the Seventy-Second Meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). WHO Food Additives Series 2011, 63.
35. Muhammad, I.; Sun, X.; Wang, H.; Li, W.; Wang, X.; Cheng, P.; Li, S., Zhang, X., Hamid, S. Curcumin successfully inhibited the computationally identified CYP2A6 enzyme-mediated bioactivation of aflatoxin B1 in arbor acres broiler. Front. Pharmacol 2017, 8, 143. 10.3389/ fphar.2017.00143
36. Nogaim, Q.A. Aflatoxins M1 and M2 in dairy products. J. Appl. Chem. 2014, 2(5), 14-25.
37. IARC IARC monographs on the evaluation of carcinogenic risks to humans. Iarc Monogr. Eval. Carcinog. Risks Hum. 2010, 93, 9–38. doi: 10.1136/jcp.48.7.691-a. [CrossRef] [Google Scholar]
38. Razzaghi-Abyaneh, M.; Saberi, R.; Sharifan, A.; Rezaee, M.B.; Seifili, R.; Hosseini, S.I.; Shams-Ghahfarokhi, M.; Nikkhah, M.; Saberi, I.; Amani, A. Effects of Heracleum persicum ethyl acetate extract on the growth, hyphal ultrastructure and aflatoxin biosynthesis in Aspergillus parasiticus. Mycotoxin Res. 2013, 29(4), 261-9. doi: 10.1007/s12550-013-0171-1. Epub 2013 Jun 19. PMID: 23780853.
39. Radostits, O.M.; Gay C.C.; Hinchcliff, K.W.; Constable, P.D. A Textbook of the Disease of Cattle, Horses, Sheep, Pigs and Goats. Vet. Med. 2007, 1452–1461.
40. Rustemeyer, S.M.; Lamberson, W.R.; Ledoux, D.R.; Wells, K.; Austin, K.J.; Cammack, K.M. Effects of dietary aflatoxin on the hepatic expression of apoptosis genes in growing barrows. J. Anim. Sci. 2011, 89,916–925. doi: 10.2527/jas.2010-3473.
41. Shi, F.; Seng, X.; Tang, H.; Zhao, S.; Deng, Y.; Jin, R.; Li, Y. Effect of low levels of aflatoxin B1 on performance, serum biochemistry, hepatocyte apoptosis and liver histopathological changes of cherry valley ducks. J. Anim. Vet. Adv. 2013,12,1126–1130. doi: 10.3923/javaa.2013.1126.1130.
42. Monson, M.S.; Settlage, R.E.; McMahon, K.W.; Mendoza, K.M.; Rawal, S.; El-Nezami H.S.; Coulombe, R.A.; Reed, K.M. Response of the hepatic transcriptome to aflatoxin b1in domestic turkey (Meleagris gallopavo) PLoS ONE 2014, 9: e100930. doi: 10.1371/journal.pone.0100930.
43. Hasheminya, S.M.; J, Dehghannya. Strategies for decreasing aflatoxin in livestock feed and milk. Int. Res. J. Appl. Basic Sci. 2013, 4, 1506–1510.
44. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans Chemical agents and related occupations. Iarc Monogr. Eval. Carcinog. Risks Hum. 2012, 100, 9–562.
45. Jafari, T.; Fallah, A.A.; Kheiri, S.; Fadaei, A.; Amini, S.A. Aflatoxin M1 in human breast milk in Shahrekord, Iran and association with dietary factors. Food Addit. Contam. Part B Surveill. 2017, 10, 128–136. doi: 10.1080/19393210.2017.1282545.
46. Marchese, S.; Sorice, A.; Ariano, A.; Florio, S.; Budillon, A.; Costantini, S.; Severino, L. Evaluation of Aflatoxin M1 Effects on the Metabolomic and Cytokinomic Profiling of a Hepatoblastoma Cell Line. Toxins 2018, 10, 436. doi: 10.3390/toxins10110436.
47. Shuib, N.S.; Makahleh, A.; Salhimi, S.M.; Saad, B. Natural occurrence of aflatoxin M1 in fresh cow milk and human milk in Penang, Malaysia. Food Control, 2017, 73, 966–970. doi: 10.1016/j.foodcont.2016.10.013.
48. Tahoun, A.; Ahmed, M.; Abou Elez, R.; AbdEllatif, S. Aflatoxin M1 in Milk and some Dairy Products: Level, Effect of Manufature and Public Health Concerns. Zagazig Vet. J. 2017, 45, 188–196. doi: 10.21608/zvjz.2017.7891.
49. Khan, W.A.; Khan, M.Z.; Khan, A.; Hussan, Z.U.; Saleemi, M.K. Potential of amelioration for aflatoxin B1induced immunotoxic effects in progeny of white leghorn breeder hens co-exposed to E. Journal of Immunotoxicol. 2014, 11, 116-125.
50. Williams, J.H.; Phillips, T.D.; Jolly, P.E.; Stiles, J.K.; Jolly, C.M.; Aggarwal, D. Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions. Am J Clin Nutr. 2004, 80(5),1106-22. doi: 10.1093/ajcn/80.5.1106. PMID: 15531656.
51. Monson, M.; Coulombe, R.; Reed, K. Aflatoxicosis: Lessons from Toxicity and Responses to Aflatoxin B1 in Poultry. Agriculture 2015, 5, 742–777. doi: 10.3390/agriculture5030742.
52. Santacroce, M.P.; Conversano, M.C.; Casalino, E.; Lai, O.; Zizzadoro, C.; Centoducati, G.; Crescenzo, G. Aflatoxins in aquatic species: Metabolism, toxicity and perspectives. Rev. Fish Biol. Fish. 2008, 18, 99–130. doi: 10.1007/s11160-007-9064-8.
53. Dohnal, V.; Wu, Q.; Kuča K. Metabolism of aflatoxins: Key enzymes and interindividual as well as interspecies differences. Arch. Toxicol. 2014, 88, 1635–1644. doi: 10.1007/s00204-014-1312-9.
54. Kuilman, M.E.M.; Maas, R.F.M.; Judah, D.J.; Fink-Gremmels, J. Bovine Hepatic Metabolism of Aflatoxin B1. J. Agric. Food Chem. 1998, 46, 2707–2713. doi: 10.1021/jf980062x.
55. Wogan, G.N.; Kensler, T.W.; Groopman, J.D. Present and future directions of translational research on aflatoxin and hepatocellular carcinoma. A review. Food Addit. Contam. Part A. 2012, 29, 249–257. doi: 10.1080/19440049.2011.563370.
56. Mohd-Redzwan, S.; Jamaluddin, R.; Mutalib, A.; Sokhini, M.; Ahmad, Z. A mini review on aflatoxin exposure in Malaysia: past, present and future. Front. Microbiol. 2013, 4, 334. 10.3389/fmicb.2013.00334.
57. Diaz, D.E.; Hagler, J.W.M.; Blackwelder, J.T.; Eve, J.A.; Hopkins, B.A.; Anderson, K.L.; Jones, F.T.; Whitlow, L.W. Aflatoxin binders II: Reduction of aflatoxin M1 in milk by sequestering agents of cows consuming aflatoxin in feed. Mycopathologia 2004, 157, 233–241.
58. European Food Safety Authority (EFSA) Opinion of the scientific panel on contaminants in the food chain on a request from the Commission related to aflatoxin B1 as undesirable substance in animal feed. EFSA J. 2004, 39, 1–27. doi: 10.2903/j.efsa.2004.
59. Kaplan, N.M.; Biff, F.; Palmer Sanjay, G.; Revankar. Clinical Implications of Mycotoxins and Stachybotrys. The American Journal of the Medical Sciences 2003, 325 (5), 262-274.
60. Afsah-Hejri, L.; Jinap, S.; Hajeb, P.; Radu, S.; Shakibazadeh, Sh. A Review on Mycotoxins in Food and Feed: Malaysia Case Study. Comprehensive Reviews in. Food Science and Food Safety 2013, 12. doi: 10.1111/1541-4337.12029
61. Elgioushy, M.M.; Elgaml, S.A.; El-Adl, M.M.; Hegazy, A.M.; Hashish, E.A. Aflatoxicosis in cattle: clinical findings and biochemical alterations. Environ Sci Pollut Res Int. 2020 27(28), 35526-35534. doi: 10.1007/s11356-020-09489-3.
62. McKenzie, R.A.; Blaney, B.J.; Connole, M.D.; Fitzpatrick, LA. Acute aflatoxicosis in calves fed peanut hay. Aust Vet J. 1981, 57(6), 284-6. doi: 10.1111/j.1751-0813.1981.tb05816.x.
63. Vaid, J.; Dawra, R.K.; Sharma, O.P.; Negi, S.S. Chronic aflatoxicosis in cattle. Vet Hum Toxicol. 1981, 23(6), 436-8.
64. Jones, F.T.; Genter, M.B.; Hagler, W.M.; Hansen, J.A.; Mowrey, BA.; Poore, M.H.; Whitlow, L.W. Understanding and Coping with Effects of Mycotoxins in Livestock Feed and Forage. North Carolina Cooperative Extension Service, Carolina, 1994; 1-14.
65. Yalagod, S.G.; Mundas, S.; Rao D.G.K.; Tikare, V.; Shridhar, N.B. Histopathological changes in pigs exposed to aflatoxin B1 during pregnancy.. Indian Journal of Animal research 2013, 47(5), 386-391.
66. Ketterer, P.J.; Blaney, B.J.; Moore, C.J.; McInnes, I.S.; Cook, PW. Field cases of aflatoxicosis in pigs. Aust Vet J. 1982, 59(4), 113-7. doi: 10.1111/j.1751-0813.1982.tb02743.x.
67. Dönmez, N.; Dönmez, H.H.; Keskin, E.; Kısadere, İ. Effects of aflatoxin on some haematological parameters and protective effectiveness of esterified glucomannan in Merino rams. Scientific World Journal 2012, 342468. doi: 10.1100/2012/342468.
68. Colakoglu, F.; Donmez, H.H. Effects of aflatoxin on liver and protective effectiveness of esterified glucomannan in Merino rams. Scientific World Journal 2012, 462925. doi: 10.1100/2012/462925.
69. Smith, E.E.; Kubena, L.F.; Braithwaite, CE.; Harvey, RB.; Phillips, TD.; Reine, AH. Toxicological evaluation of aflatoxin and cyclopiazonic acid in broiler chickens. Poult Sci. 1992, 71(7), 1136-44. doi: 10.3382/ps.0711136.
70. Ahmed, M.A.E.; Ravikanth, K.; Rekhe, D.S. Maini,Histopathological alterations in Aflatoxicity and its amelioration with herbomineral toxin binder in broilers. Veterinary World 2009, 2(10).
71. Kumar, R.; Balachandran C. Histopathological changes in broiler chickens fed afl atoxin and cyclopiazonic acid. Veterinarski Arhiv. 2009, 79 (1), 31-40.
72. Duarte, S.C.; Lino, C.M.; Pena, A. Food safety implications of ochratoxin A in animal-derived food products. Vet J. 2012, 192(3), 286-92. doi: 10.1016/j.tvjl.2011.11.002.
73. Liuzzi, V.C.; Fanelli, F.; Tristezza, M.; Haidukowski, M.; Picardi, E.; Manzari, C.; Lionetti, C.; Grieco, F.; Logrieco, A.F.; Thon, M.R.; Pesole, G.; Mulè G. Transcriptional analysis of Acinetobacter sp. neg1 capable of degrading ochratoxin A. Front. Microbiol. 2017, 7, 2162. 10.3389/ fmicb.2016.02162
74. Ladeira, C.; Frazzoli, C.; Orisakwe, OE. Engaging one health for non-communicable diseases in Africa: perspective for mycotoxins. Front. Public Health 2017, 5, 266. 10.3389/fpubh.2017.00266
75. Russo, P.; Capozzi, V.; Spano, G.; Corbo, M.R.; Sinigaglia, M.; Bevilacqua, A. Metabolites of microbial origin with an impact on health: ochratoxin A and biogenic amines. Front. Microbiol. 2016, 7,482. 10.3389/fmicb.2016.00482
76. EFSA European Food Safety Authority. Opinion of the scientific panel on contaminants in the food chain on a request from the commission related to OTA in food. Question n. efsa-q 2005-154. EFSA J. 2006, 365,1–56.
77. Felizardo, R.J.; Câmara, N.O. Hepatocellular carcinoma and food contamination: aflatoxins and ochratoxin A as a great prompter. World J Gastroenterol. 2013, 19(24), 3723-5. doi: 10.3748/wjg.v19.i24.3723.
78. Fink-Gremmels, J.; Malekinejad, H. Clinical effects and biochemical mechanisms associated with exposure to the mycoestrogen zearalenone. Animal Feed Science and Technology 2007, 137(3-4), 326–41.
79. Biasucci, G.; Calabrese, G.; Di Giuseppe, R.; Carrara, G.; Colombo, F.; Mandelli, B.; Maj, M.; Bertuzzi, T.; Pietri, A.; Rossi, F. The presence of ochratoxin A in cord serum and in human milk and its correspondence with maternal dietary habits. Eur J Nutr. 2010, 50, 211–218
80. Anzai, N.; Jutabha, P.; Endou, H. Molecular mechanism of ochratoxin a transport in the kidney. Toxins (Basel) 2010, 2(6), 1381-98. doi: 10.3390/toxins2061381. Epub 2010 Jun 9. PMID: 22069643; PMCID: PMC3153260.
81. Zlender, V.; Breljak, D.; Ljubojević, M.; Flajs, D.; Balen, D.; Brzica, H.; Domijan, A.M.; Peraica, M.; Fuchs, R.; Anzai, N.; Sabolić, I. Low doses of ochratoxin A upregulate the protein expression of organic anion transporters Oat1, Oat2, Oat3 and Oat5 in rat kidney cortex. Toxicol Appl Pharmacol. 2009, 239(3), 284-96. doi: 10.1016/j.taap.2009.06.008. Epub 2009 Jun 16. PMID: 19538982.
82. Arsani, R.K.; Patial, V.; Thakur, M. Ochratoxin A: Possible Mechanisms of Toxicity. In book: Ochratoxins: Biosynthesis, Detection and Toxicity Publisher: Nova Publishers, New York, pp.57-89.
83. Capei, R.; Pettini, L.; Mandò Tacconi, F. Occurrence of Ochratoxin A in breakfast cereals and sweet snacks in Italy: dietary exposure assessment. Ann Ig. 2019, 31(2), 130-139. doi: 10.7416/ai.2019.2265. PMID: 30714610.
84. el Khoury, A.; Atoui, A. Ochratoxin a: general overview and actual molecular status. Toxins (Basel) 2010, 2(4), 461-93. doi: 10.3390/ toxins2040461. Epub 2010 Mar 29. PMID: 22069596; PMCID: PMC3153212.
85. European Commission. Commission regulation (EC) No. 1881/2006 of 19 December 2006 setting maximum levels for certain contaminants in foodstuffs. Off J Eur Union L. 2006, 364, 5-24.
86. Pavlović, N.M. Balkan endemic nephropathy-current status and future perspectives. Clin Kidney J. 2013, 6(3), 257-65. doi: 10.1093/ckj/ sft049. PMID: 26064484; PMCID: PMC4400492.
87. Reddy, K.R.N.; Salleh, B.; Saad, B.; Abbas, H.K. An overview of mycotoxin contamination in foods and its implications for human health. Toxin Reviews. 2010, 29(1), 3-26
88. Hassen, W.; Abid-Essafi, S.; Achour, A.; Guezzah, N.; Zakhama, A.; Ellouz, F.; Creppy, E.E.; Bacha, H. Karyomegaly of tubular kidney cells in human chronic interstitial nephropathy in Tunisia: respective role of Ochratoxin A and possible genetic predisposition. Hum Exp Toxicol. 2004, 23(7), 339-46. doi: 10.1191/0960327104ht458oa. PMID: 15311851.
89. O’Brien, E.; Dietrich, D.R. Ochratoxin A: the continuing enigma. Crit Rev Toxicol. 2005, 35(1), 33-60. doi: 10.1080/10408440590905948. PMID: 15742902.
90. Yordanova, P.; Wilfried, K.; Tsolova, S.; Dimitrov, P. Ochratoxin A and β2-microglobulin in BEN patients and controls. Toxins (Basel) 2010, 2(4), 780-92. doi: 10.3390/toxins2040780. Epub 2010 Apr 20. PMID: 22069610; PMCID: PMC3153209.
91. Sauvant, C.; Holzinger, H.; Gekle, M. The nephrotoxin ochratoxin A induces key parameters of chronic interstitial nephropathy in renal proximal tubular cells. Cell Physiol Biochem. 2005, 15(1-4), 125-34. doi: 10.1159/000083660. PMID: 15665523.
92. Stoev, S.D.; Hald, B.; Mantle, P. Porcine nephropathy in Bulgaria: a progressive syndrome of complex of uncertain (mycotoxin) etiology. Vet Rec. 1998, 142, 190–194.
93. Perši, N.; Pleadin, J.; Kovačević, D.; Scortichini, G.; Milone, S. Ochratoxin A in raw materials and cooked meat products made from OTA-treated pigs. Meat Sci. 2014, 96(1), 203-10. doi: 10.1016/j.meatsci.2013.07.005. Epub 2013 Jul 12. PMID: 23906754.
94. Gresham, A.; Done, S.; Livesey, C.; MacDonald, S.; Chan, D.; Sayers, R.; Clark, C.; Kemp, P. Survey of pigs’ kidneys with lesions consistent with PMWS and PDNS and ochratoxicosis. Part 2: pathological and histological findings. Vet Rec. 2006, 159(23), 761-8. PMID: 17142623.
95. Cook, W.O.; Osweiler, G.D.; Anderson, T.D.; Richard, JL. Ochratoxicosis in Iowa swine. J Am Vet Med Assoc. 1986, 188(12), 1399-402. PMID: 3744966.
96. Patial, V.; Asrani, R.K.; Patil, R.D.; Ledoux, D.R.; Rottinghaus, G.E. Pathology of ochratoxin A-induced nephrotoxicity in Japanese quail and its protection by sea buckthorn (Hippophae rhamnoides L.). Avian Dis. 2013, 57(4), 767-79. doi: 10.1637/10549-040913-Reg.1. PMID: 24597120.
97. Patial, V.; Asrani, R.K.; Patil, R.D.; Kumar, N. Protective Effect of Sea buckthorn (Hippophae rhamnoides L.) Leaves on Ochratoxin-A Induced Hepatic Injury in Japanese quail. Veterinary Research International 2015, 3(4), 98-108.
98. Patil, R.D.; Dwivedi, P.; Sharma, A.K. Critical period and minimum single oral dose of ochratoxin A for inducing developmental toxicity in pregnant Wistar rats. Reprod Toxicol. 2006, 22(4), 679-87. doi: 10.1016/j.reprotox.2006.04.022. Epub 2006 Jun 14. PMID: 16781114.
99. Mazzoni, E.; Scandolara, A.; Giorni, P.; Pietri, A.; Battilani, P. Field control of Fusarium ear rot, Ostrinia nubilalis (Hübner), and fumonisins in maize kernels. Pest Manag Sci. 2011, 67(4):458-65. doi: 10.1002/ps.2084. Epub 2011 Jan 6. PMID: 21394878.
100. Lerda, D. Fumonisins in foods from Cordoba (Argentina), presence: mini review. Toxicol. 2017, 3, 125 10.4172/2476-2067.1000125
101. Lumsangkul, C.; Chiang, HI.; Lo, NW.; Fan, YK.; Ju, JC. Developmental Toxicity of Mycotoxin Fumonisin B₁ in Animal Embryogenesis: An Overview. Toxins (Basel) 2019, 11(2), 114. doi: 10.3390/toxins11020114. PMID: 30781891; PMCID: PMC6410136.
102. Liu, X.; Fan, L.; Yin, S.; Chen, H.; Hu, H. Molecular mechanisms of fumonisin B1-induced toxicities and its applications in the mechanism-based interventions. Toxicon. 2019, 167, 1-5. doi: 10.1016/j.toxicon.2019.06.009. Epub 2019 Jun 4. PMID: 31173793.
103. da Rocha, M.E.B.; Freire, F.D.C.O.; Maia, F.E.F.; Guedes, M.I.F.; Rondina, D. Mycotoxins and their effects on human and animal health. Food Control 2014, 36, 159–165. 10.1016/j.foodcont.2013.08.021
104. IARC (International Agency for Research on Cancer). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 82. Lyon, International Agency for Research on Cancer, 2002; 82.
105. WHO (World Health Organization). Safety Evaluation of Certain Mycotoxins in Food. WHO Food Additive Series 47, Geneva, 2001.
106. Abnet, C.C.; Borkowf, C.B.; Qiao, Y.L.; Albert, P.S.; Wang, E.; Merrill AH, Jr.; Mark, S.D.; Dong, Z.W.; Taylor, P.R.; Dawsey, S.M. Sphingolipids as biomarkers of fumonisin exposure and risk of esophageal squamous cell carcinoma in china. Cancer Causes Control 2001, 12(9), 821-8. doi: 10.1023/a:1012228000014. PMID: 11714110.
107. Voss, K.A.; Riley, T.R.; Waes Gelineau-van, J. Fumonisin B1 induced neural tube defects were not increased in LM/Bc mice fed folate-deficient diet. Molecular Nutrition & Food Research, 2014, 58(6).
108. Sandmeyer, L.S.; Vujanovic, V.; Petrie, L.; Campbell, J.R.; Bauer, B.S.; Allen, AL.; Grahn, B.H. Optic neuropathy in a herd of beef cattle in Alberta associated with consumption of moldy corn. Can Vet J. 2015, 56(3), 249-56. PMID: 25750444; PMCID: PMC4327135.
109. Mathur, S.; Constable, P.D.; Eppley, R.M.; Waggoner, A.L.; Tumbleson, M.E.; Haschek, W.M. Fumonisin B(1) is hepatotoxic and nephrotoxic in milk-fed calves. Toxicol Sci. 2001, 60(2), 385-96. doi: 10.1093/toxsci/60.2.385. PMID: 11248152.
110. Wilson, T.M.; Ross, P.F.; Rice, L.G.; Osweiler, G.D.; Nelson, H.A.; Owens, D.L.; Plattner, R.D.; Reggiardo, C.; Noon, TH.; Pickrell, JW. Fumonisin B, levels associated with an epizootic of equine leukoencephalomalacia. J Vet Diagn Invest. 1990, 2, 213-6.
111. Haschek, W.M.; Gumprecht, L.A.; Smith, G.; Tumbleson, M.E.; Constable, P.D. Fumonisin toxicosis in swine: an overview of porcine pulmonary edema and current perspectives. Environ Health Perspect. 2001,109 (Suppl 2), 251-7. doi: 10.1289/ehp.01109s2251. PMID: 11359693; PMCID: PMC1240673.
112. Osweiler, G.D.; Ross, P.F.; Wilson, T.M.; Nelson, P.E.; Witte, S.T.; Carson, T.L.; Rice, L.G.; Nelson, H.A. Characterization of an epizootic of pulmonary edema in swine associated with fumonisin in corn screenings. J. Vet. Diagn. Invest. 1992, 4, 53–59.
113. Colvin, B.M.; Cooley, A.J.; Beaver, RW. Fumonisin toxicosis in swine: clinical and pathological findings. J. Vet. Diagn. Invest. 1993, 5, 232–241.
114. Giannitti, F.; Diab, S.; Pacin, A.; Barrandeguy, M.; Larrere, C et al. Equine leukoencephalomalacia due to fumonisins B1 and B2 in Argentina. Pesq Vet Bras. 2011, 31, 407-412.
115. Kovacić, S.; Pepeljnjak, S.; Petrinec, Z.; Klarić, M.S. Fumonisin B1 neurotoxicity in young carp (Cyprinus carpio L.). Arh Hig Rada Toksikol. 2009, 60(4), 419-26. doi: 10.2478/10004-1254-60-2009-1974. PMID: 20061242.
116. Benlasher, E.; Geng, X.; Nguyen, N.T.; Tardieu, D.; Bailly, J.D.; Auvergne, A.; Guerre, P. Comparative effects of fumonisins on sphingolipid metabolism and toxicity in ducks and turkeys. Avian Dis. 2012, 56(1), 120-7. doi: 10.1637/9853-071911-Reg.1. PMID: 22545537.
117. Ledoux, D.R.; Brown, T.P.; Weibking, TS.; Rottinghaus, GE. Fumonisin toxicity in broiler chicks. J Vet Diagn Invest. 1992, 4(3), 330-3. doi: 10.1177/104063879200400317. PMID: 1515495.
118. Deshmukh, S.; Asrani, R.K.; Jindal, N.; Ledoux, D.R.; Rottinghaus, G.E.; Sharma, M.; Singh, S.P. Effects of Fusarium moniliforme culture material containing known levels of fumonisin B1 on progress of Salmonella Gallinarum infection in Japanese quail: clinical signs and hematologic studies. Avian Dis. 2005, 49(2), 274-80. doi: 10.1637/7296-102804R. PMID: 16094834.
119. Deshmukh, S.; Asrani, R.K.; Ledoux, D.R.; Rottinghaus, G.E.; Bermudez, A.J.; Gupta, V.K. Pathologic changes in extrahepatic organs and agglutinin response to Salmonella Gallinarum infection in Japanese quail fed Fusarium verticillioides culture material containing known levels of fumonisin B1. Avian Dis. 2007, 51(3):705-12. doi: 10.1637/0005-2086(2007)51
120. Jaradat, Z.W, T-2 mycotoxin in the diet and its effects on tissues. In: Watson RR and Preedy VR. Reviews in Food and Nutrition Toxicity 2005, 4, 173-212.
121. SCF, Scientific Committee on Food. Opinion of the Scientific Committee on Food on Fusarium Toxins. Part 5: T-2 Toxin and HT-2 Toxin. 2001, SCF/CS/CNTM/MYC/25 Rev 6 Final. http://ec.europa.eu/food/fs/sc/scf/out88_en.pdf.
122. Nathanail, A.V.; Syvähuoko, J.; Malachová, A.; Jestoi, M.; Varga, E.; Michlmayr, H.; Adam, G.; Sieviläinen, E.; Berthiller, F.; Peltonen, K. Simultaneous determination of major type A and B trichothecenes, zearalenone and certain modified metabolites in Finnish cereal grains with a novel liquid chromatography-tandem mass spectrometric method. Anal Bioanal Chem. 2015, 407(16), 4745-55. doi: 10.1007/s00216-015-8676- 4. Epub 2015 May 3. PMID: 25935671; PMCID: PMC4446524.
123. Adhikari, M.; Negi, B.; Kaushik, N.; Adhikari, A.; Al-Khedhairy, A.A.; Kaushik, N.K.; Choi, E.H. T-2 mycotoxin: toxicological effects and decontamination strategies. Oncotarget 2017, 8(20), 33933-33952. doi: 10.18632/oncotarget.15422. PMID: 28430618; PMCID: PMC5464924.
124. Borutova, R.; Faix, S.; Placha, I.; Gresakova, L.; Cobanova, K.; Leng, L. Effects of deoxynivalenol and zearalenone on oxidative stress and blood phagocytic activity in broilers. Arch Anim Nutr. 2008 62(4), 303-12. doi: 10.1080/17450390802190292. PMID: 18763624
125. Eriksen, G.S.; Petterson, H. Toxicological evaluation of trichothecenes in animal feed. Animal Feed Science and Technology 2004, 114, 205–239DOI:10.1016/J.ANIFEEDSCI.2003.08.008 Corpus ID: 85123463
126. Kolf-Clauw, M.; Sassahara, M.; Lucioli, J.; Rubira-Gerez, J.; Alassane-Kpembi, I.; Lyazhri, F.; Borin, C.; Oswald, I.P. The emerging mycotoxin, enniatin B1, down-modulates the gastrointestinal toxicity of T-2 toxin in vitro on intestinal epithelial cells and ex vivo on intestinal explants. Arch Toxicol. 2013, 87(12), 2233-41. doi: 10.1007/s00204-013-1067-8. Epub 2013 May 7. PMID: 23649843.
127. Alizadeh, A.; Braber, S.; Akbari, P.; Garssen, J.; Fink-Gremmels, J. Deoxynivalenol Impairs Weight Gain and Affects Markers of Gut Health after Low-Dose, Short-Term Exposure of Growing Pigs. Toxins (Basel) 2015, 7(6), 2071-95. doi: 10.3390/toxins7062071. PMID: 26067367; PMCID: PMC4488690.
128. Zhu, Y.; Hassan, Y.I.; Shao, S.; Zhou, T. Employing immuno-affinity for the analysis of various microbial metabolites of the mycotoxin deoxynivalenol. J Chromatogr A. 2018, 1556, 81-87. doi: 10.1016/j.chroma.2018.04.067. Epub 2018 May 1. PMID: 29731291.
129. Ingalls, J.R. Influence of deoxynivalenol on feed consumption by dairy cows. Anim. Feed Sci. Technol. 1996, 60, 297-300. ISSN 0377-8401
130. Cote, L. M.; Dahlem, A. M.; Yoshizawa, T.; Swanson, S. P.; Buck, W. B. Excretion of deoxynivalenol and its metabolites in milk, urine, and feces of lactating dairy cows. Journal of Dairy Science 1986, 69, 2416–2423.
131. Hendry, K.M.; Cole, EC. A review of mycotoxins in indoor air. J. Toxicol. Environ. Health Sci. 1993, 38, 183–198. doi: 10.1080/15287399309531711.
132. Weindenborner, M. Natural Mycotoxin Contamination in Humans and Animals. Springer, Switzerland, 2015.
133. Zouagui, Z.; Asrar, M.; Lakhdissi, H.; Abdennebi, E. Prevention of mycotoxin effects in dairy cows by adding an anti-mycotoxin product in feed. J. Mater. Environ. Sci. 2017, 8, 3766–3770. [Google Scholar]
134. Valgaeren, B.; Théron, L.; Croubels, S.; Devreese, M.; De Baere, S.; Van Pamel, E.; Daeseleire, E.; De Boevre, M.; De Saeger, S.; Vidal, A.; Di Mavungu, J.D.; Fruhmann, P.; Adam, G.; Callebaut, A.; Bayrou, C.; Frisée, V.; Rao, A.S.; Knapp, E.; Sartelet, A.; Pardon, B.; Deprez, P.; Antonissen, G. The role of roughage provision on the absorption and disposition of the mycotoxin deoxynivalenol and its acetylated derivatives in calves: from field observations to toxicokinetics. Arch Toxicol. 2019, 93(2), 293-310. doi: 10.1007/s00204-018-2368-8. Epub 2018 Dec 10. PMID: 30535711.
135. Helferich, W.G.; Garrett, WN.; Hsieh, DPH.; Baldwin, RL. Feedlot performance and tissue residues of cattle consuming diets containing aflatoxins. J Anim Sci. 1986, 62, 691–696. pmid:3700268
136. Petrie, L.; Robb, J.; Stewart, A.F. The identification of T-2 toxin and its association with a haemorrhagic syndrome in cattle. Vet Rec. 1977, 101, 326–326. pmid:929903
137. Wannemacher, R.W.; Brunner, D.L.; Neufeld, H.A. Toxicity of trichothecenes and other related mycotoxins in laboratory animals. In: Smith J.E. and Henderson R.S. (Eds.), “Mycotoxins and Animal Foods.” CRC Press, Inc., Boca Raton FL, 1991. pp. 499–552.
138. Serviento, A.M.; Brossard, L.; Renaudeau, D. An acute challenge with a deoxynivalenol-contaminated diet has short- and long-term effects on performance and feeding behavior in finishing pigs. J Anim Sci. 2018, 96(12), 5209-5221. doi: 10.1093/jas/sky378. PMID: 30423126; PMCID: PMC6276570.
139. Bracarense, A.P.F.L.; Lucioli, J.; Grenier, B.; Pacheco, G.D.; Moll, W-D.; Schatzmayr, G.; Oswald, I.P. Chronic ingestion of deoxynivalenol and fumonisin, alone or in interaction, induces morphological and immunological changes in the intestine of piglets. Brit J Nutr. 2012, 107, 1776–1786.
140. Gerez,J.R.; Pinton, P.; Callu, P.; Grosjean, F.; Oswald, IP.; Bracarense, APFL. Deoxynivalenol alone or in combination with nivalenol and zearalenone induce systemic histological changes in pigs. Exp Toxicol Pathol. 2015, 67, 89–98.
141. Gerez, J.R.; Desto, S.S.; Bracarense, A.P.F.R.L. Deoxynivalenol induces toxic effects in the ovaries of pigs: An ex vivo approach. Theriogenology 2017, 90, 94-100. doi: 10.1016/j.theriogenology.2016.10.023. Epub 2016 Nov 9. PMID: 28166994.
142. Ferreras, M.C.; Benavides, J.; García-Pariente, C.; Delgado, L.; Fuertes, M.; Muñoz, M.; García-Marín, J.F.; Pérez, V. Acute and chronic disease associated with naturally occurring T-2 mycotoxicosis in sheep. J Comp Pathol. 2013, 148(2-3):236-42. doi: 10.1016/j.jcpa.2012.05.016. Epub 2012 Jul 20. PMID: 22819015.
143. Nayakwadi, S.; Ramu, R.; Kumar Sharma, A.; Kumar Gupta, V.; Rajukumar, K.; Kumar, V.; Shirahatti, P.S.; Rashmi, L.; Basalingappa, K.M. Toxicopathological studies on the effects of T-2 mycotoxin and their interaction in juvenile goats. PLoS One, 2020, 26, 15(3), e0229463. doi: 10.1371/journal.pone.0229463. PMID: 32214355; PMCID: PMC7098593.
144. Richard, J.L.; Payne, G.A.; Desjardins, AE.; Maragos, C.; Norred, W.; Pestka, J. Mycotoxins: Risks in plant, animal and human systems. CAST Task Force Report 2003,139, 101–3.
145. Bennet, JW.; Klich, M. Mycotoxins. Clinical microbiology review, 2003, 16(3), 497–516. DOI: 10.1128/CMR.16.3.497-516.2003
146. Yumbe-Guevara, B.; Imoto, T.; Yoshizawa, T. Effects of heating procedures on deoxynivalenol, nivalenol and zearalenone levels in naturally contaminated barley and wheat. Food Additives and Contaminants 2003, 20 (12), 1132–40. doi: Crossref.
147. Polak, M.; Paluszewski A.; Rybarczyk, L.; Gajęcki, M. Influence of zearalenone micotoxicosis on selected immunological, haematological and biochemical indexes of blood plasma in bitches. Polish Journal of Veterinary Sciences 2004, 7 (3), 175–80. doi: Crossref
148. Zwierzchowski, W.; Przybyłowicz, M.; Obremski, K.; Zielonka, L.; Skorska-Wyszyńska, E.; Gajecka, M., Polak, M.; Jakimiuk, E.; Jana, B.; Rybarczyk, L et al. Level of zearalenone in blood serum and lesions in ovarian follicles of sexually immature gilts in the course of zearalenone micotoxicosis. Polish Journal of Veterinary Sciences 2005, 8 (3), 209–18.
149. Rai, A.; Das, M.; Tripathi, A. Occurrence and toxicity of a fusarium mycotoxin, zearalenone. Crit Rev Food Sci Nutr. 2020, 60(16), 2710-2729. doi: 10.1080/10408398.2019.1655388. Epub 2019 Aug 26. PMID: 31446772.
150. Wang, Y.; Wong, T.Y.; Chan, F.L.; Chen, S.; Leung, L.K. Assessing the effect of food mycotoxins on aromatase by using a cell-based system. Toxicology in Vitro: An International Journal Published in Association with Bibra 2014, 28 (4), 640–6. doi: Crossref.
151. Kuiper-Goodman, T.; Scott, P.M.; Watanabe, H. Risk assessment of the mycotoxin zearalenone. Regul. Toxicol. Pharmacol. 1987, 7, 253–306. 10.1016/0273-2300(87)90037-7 [PubMed] [CrossRef] [Google Scholar]
152. Abbès, S.; Salah-Abbès, J.B.; Ouanes, Z.; Houas, Z.; Othman, O.; Bacha H.; Abdel-Wahhab, M.A.; Oueslati, R. Preventive role of phyllosilicate clay on the immunological and biochemical toxicity of zearalenone in balb/c mice. International Immunopharmacology 2000, 6 (8), 1251–8. doi: Crossref.
153. Abbès, S.; Ouanes, Z.; Salah-Abbès J.B.; Abdel, W.A.; Oueslati, M.R.; Bacha, H. Preventive role of aluminosilicate clay against induction of micronuclei and chromosome aberrations in bone-marrow cells of balb/c mice treated with zearalenone. Mutation Research/Genetic Toxicology and Environmental Mutagenesis 2007, 631 (2), 85–92. doi: Crossref.
154. Wang, Y.C.; Deng, J.L.; Xu S.W.; Peng, X.; Zuo, Z.C.; Cui, H.M.; Wang, Y.; Ren, Z.H. Effects of zearalenone on IL-2, IL-6, and IFN-γ mRNA levels in the splenic lymphocytes of chickens. Scientific World Journal 2012, 2012, 567327. doi: 10.1100/2012/567327. Epub 2012 May 2. PMID: 22645433; PMCID: PMC3354442.
155. Murata, H.; Sultana, P.; Shimada, N.; Yoshioka, M. Structure-activity relationships among zearalenone and its derivatives based on bovine neutrophil chemiluminescence. Veterinary and Human Toxicology 2003, 45 (1), 18–20.
156. Poor, M.; Kunsagi-Mate, S.; Sali, N.; Koszegi, T.; Szente ,L.; Peles-Lemli, B. Interactions of zearalenone with native and chemically modified cyclodextrins and their potential utilization. J. Photochem. Photobiol. B. 2015, 151, 63–68. 10.1016/j.jphotobiol.2015.07.009 [PubMed] [CrossRef] [Google Scholar]
157. Fink-Gremmels, J.; Malekinejad, H. Clinical effects and biochemical mechanisms associated with exposure to the mycoestrogen zearalenone. Animal Feed Science and Technology 2007, 137 (3–4, 1), 326-341.
158. Biehl, M.; Prelusky, D.; Koritz, G.; Hartin, K.; Buck, W.; Trenholm, H. Biliary excretion and enterohepatic cycling of zearalenone in immature pigs. Toxicology and Applied Pharmacology 1993, 121 (1), 152–9. doi: Crossref.
159. Sambuu, R.; Takagi, M.; Shiga, S.; Uno, S.; Kokushi, E.; Namula, Z et al. Detection of zearalenone and its metabolites in naturally contaminated porcine follicular fluid by using liquid chromatography-tandem mass spectrometry. J. Reprod. Dev. 2011, 57, 303–306. 10.1262/ jrd.10-106M [PubMed] [CrossRef] [Google Scholar]
160. Cortinovis, C.; Pizzo, F.; Spicer, L.J.; Caloni, F. Fusarium mycotoxins: effects on reproductive function in domestic animals–a review. Theriogenology 2013, 80, 557–564. doi: 10.1016/j.theriogenology.2013.06.018
161. Wang, H.W.; Wang, J.Q.; Zheng, B.Q.; Li ,SL.; Zhang, YD.; Li, FD.; Zheng, N. Cytotoxicity induced by ochratoxin A, zearalenone, and α-zearalenol: effects of individual and combined treatment. Food Chem Toxicol. 2014, 71, 217-24. doi: 10.1016/j.fct.2014.05.032. Epub 2014 Jun 18. PMID: 24952310.
162. EFSA Panel on Contaminants in the Food Chain (CONTAM). Scientific Opinion on the risks for animal and public health related to the presence of Alternaria toxins in feed and food, 2011. https://doi.org/10.2903/j.efsa.2011.2407
163. GAIN. China releases standard for maximum levels of mycotoxins in foods (global agriculture information network). (China Food and Drug Administration) CFDA, GAIN report no. CH18026, 2018, 1–10.
164. Massart, F.; Meucci, V.; Saggese, G.; Soldani, G. High growth rate of girls with precocious puberty exposed to estrogenic mycotoxins. J Pediatr. 2008, 152(5), 690-695.e1. doi: 10.1016/j.jpeds.2007.10.020. Epub 2008 Feb 20. PMID: 18410776.
165. Kuciel-Lisieska, G.; Obremski, K.; Stelmachów, J.; Gajecka, M.; Zielonka, Ł.; Jakimiuk, E.; Gajecki, M. Presence of zearalenone in blood plasma in women with neoplastic lesions in the mammary gland. Bulletin of the Veterinary Institute in Pulawy 2008, 52, 671–674.
166. Tomaszewski, J.; Miturski, R.; Semczuk, A.; Kotarski, J.; Jakowicki, J. Tissue zearalenone concentration in normal, hyperplastic and neoplastic human endometrium. Ginekologia Polska. 1998, 69 (5), 363–6.
167. Minervini, F., and Dell0Aquila, M. E. Zearalenone and reproductive function in farm animals. Int. J. Mol. Sci. 2008, 9, 2570–2584. doi: 10.3390/ ijms9122570
168. Zinedine, A.; Soriano, J. M.; Molto, J. C.; and Manes, J. Review on the toxicity, occurrence, metabolism, detoxification, regulations and intake of zearalenone: An oestrogenic mycotoxin. Food and Chemical Toxicology 2007, 45 (1), 1–18
169. Weaver, G.A.; Kurtz, H.J.; Behrens, J.C.; Robison, T.S.; Seguin, B.E.; Bates, F.Y et al. Effect of zearalenone on the fertility of virgin dairy heifers. Am. J. Vet. Res. 1986, 47, 1395–1397
170. Obremski, K.; Gajecki, M.; Zwierzchowski, W.; Zielonka, L.; Otrocka-Domagala, I.; Rotkiewicz, T. et al. Influence of zearalenone on reproductive system cell proliferation in gilts. Pol. J. Vet. Sci. 2003, 6, 239–245.
171. Etienne, M.; Dourmad, J.Y. Effects of zearalenone or glucosinolates in the diet on reproduction in sows: A review. Livest. Prod. Sci. 1994, 40, 99–113. doi: 10.1016/0301-6226(94)90040-X
172. Malekinejad, H.; Maas-Bakker, R.; Fink-Gremmels, J. Species differences in the hepatic biotransformation of zearalenone. Vet J. 2006, 172(1), 96-102. doi: 10.1016/j.tvjl.2005.03.004. PMID: 15907386.
173. Zhang, G.L.; Feng, Y.L.; Song, J.L.; Zhou, X.S. Zearalenone: A Mycotoxin with Different Toxic Effect in Domestic and Laboratory Animals’ Granulosa Cells. Front Genet. 2018, 18, 9:667. doi: 10.3389/fgene.2018.00667. PMID: 30619484; PMCID: PMC6305301.
174. Yang, J.Y.; Wang, G.X.; Liu, JL.; Fan, JJ.; Cui, S. Toxic effects of zearalenone and its derivatives α-zearalenol on male reproductive system in mice. Reproductive Toxicology 2007, 24 (3-4), 381–7. doi: Crossref.
175. Ito, Y.; Ohtsubo, K. Effects of neonatal administration of zearalenone on the reproductive physiology of female mice. J. Vet. Med. Sci. 1994, 56, 1155–1159. doi: 10.1292/jvms.56.1155
176. Teixeira, L.C.; Montiani-Ferreira, F.; Dittrich, R.; Santin, E. Effects of zearalenone in prepubertal gilts. Pesquisa Veterinária Brasileira. 2011, 31(8), 656-662
177. Logrieco, A.; Mule, G.; Moretti, A.; Bottalico, A. Toxigenic Fusarium Species and Mycotoxins Associated with Maize Ear Rot in Europe. Eur J Plant Pathol 2002, 108, 597- 609.
178. Desjardins, A. E.; Maragos, C. M.; Proctor, R. H. Maize Ear Rot and Moniliformin Contamination by Cryptic Species of Fusarium subglutinans. J Agric Food Chem 2006, 54, 7383-7390.
179. Kokkonen, M.; Ojala, L.; Parikka, P.; Jestoi, M. Mycotoxin production of selected Fusarium species at different culture conditions. Int J Food Microbiol 2010, 143, 17-25.
180. Hallas-Moeller, M.; Nielsen, K. F.; Frisvad, J. C. Production of the Fusarium Mycotoxin Moniliformin by Penicillium melanoconidium. J Agric Food Chem 2016, 64, 4505-4510.
181. Jonsson, M.; Jestoi, M.; Nathanail, A.V.; Kokkonen, U.M.; Anttila, M.; Koivisto, P.; Karhunen, P.; Peltonen, K. Application of OECD Guideline 423 in assessing the acute oral toxicity of moniliformin. Food Chem Toxicol. 2013, 53, 27-32. doi: 10.1016/j.fct.2012.11.023. Epub 2012 Nov 28. PMID: 23201451.
182. Burmeister, H.; Ciegler, A.; Vesonder, R.F. Moniliformin, a metabolite of Fusarium moniliforme NRRL 6322: purification and toxicity. Appl. Environ. Microbiol. 37, 11–13.
183. Ueno, Y. Developments in food science. Gen. Toxicol. 1983, 4, 135–146.
184. Nagaraj, R.Y.; Wu, W.; Will, J.A.; Vesonder, R.F. Acute cardiotoxicity of moniliformin in broiler chickens as measured by electrocardiography. Avian Dis. 1996, 40, 223–227
185. Kriek, N.P.J.; Marasas, W.F.O.; Steyn, P.S.; Van Rensburg, S.J.; Steyn M.; Toxicity of a moniliformin-producing strain of Fusarium moniliforme var. subglutinans isolated from maize. Food Cosmet. Toxicol. 1977, 15, 579–587
186. Nesic, K.; Ivanovic, S.; Nesic, V. Fusarial toxins: secondary metabolites of Fusarium fungi. Rev Environ Contam Toxicol. 2014, 228, 101-20. doi: 10.1007/978-3-319-01619-1_5. PMID: 24162094.
187. Burka, L.T.; Doran, J.; Wilson, B. J. Enzyme inhibition and the toxic action of moniliformin and other vinylogous α-ketoacids. Biochem Pharmacol. 1982, 31, 79-84.
188. Gathercole, P. S.; Thiel, P. G.; Hofmeyr, J. H. S. Inhibition of pyruvate dehydrogenase complex by moniliformin. Biochem J. 1986, 233, 719-723
189. Cao, J.; Zhang, A.; Yang, B.; Zhang, Z.T.; Fu, Q.; Hughes, C.E.; Caterson, B. The effect of fungal moniliformin toxin and selenium supplementation on cartilage metabolism in vitro. Osteoarthr. Cartil. 2007, 15(Suppl. 3), C108.
190. Jonsson, M.; Atosuo, J.; Jestoi, M.; Nathanail, A.V.; Kokkonen, U.M.; Anttila, M.; Koivisto, P.; Lilius, E.M.; Peltonen, K. Repeated dose 28-day oral toxicity study of moniliformin in rats. Toxicol. Lett. 2015, 233, 38-44.
191. Sharma, D.; Asrani, R.K.; Ledoux, D.R.; Rottinghaus, G.E.; Gupta, V.K. Toxic interaction between fumonisin B1 and moniliformin for cardiac lesions in Japanese quail. Avian Dis. 2012, 56, 545-554.
192. Stoev, S.; Denev, S.; Dutton, M.; Nkosi, B. Cytotoxic Effect of Some Mycotoxins and their Combinations on Human Peripheral Blood Mononuclear Cells as Measured by the MTT Assay. The Open Toxinology Journal, 2009, 2, 1-8
193. Domijan, A.M.; Gajski, G.; Novak Jovanović, I.; Gerić, M.; Garaj-Vrhovac, V. In vitro genotoxicity of mycotoxins ochratoxin A and fumonisin B(1) could be prevented by sodium copper chlorophyllin–implication to their genotoxic mechanism. Food Chem. 2015, 170:455-62. doi: 10.1016/j.foodchem.2014.08.036. Epub 2014 Aug 19. PMID: 25306371.
194. Heussner, A.H.; Bingle, L.E. Comparative Ochratoxin Toxicity: A Review of the Available Data. Toxins (Basel). 2015, 7(10), 4253-82. doi: 10.3390/toxins7104253. PMID: 26506387; PMCID: PMC4626733.
195. Khan, M.A.; Asrani, R.K.; Iqbal, A.; Patil, R.D. Fumonisin B1 and ochratoxin A nephrotoxicity in Japanese quail: An ultrastructural assessment. Comparative Clinical Pathology. 2013, 22(5), 835–843.
196. Klarić, M.S.; Rašić, D.; Peraica, M. Deleterious effects of mycotoxin combinations involving ochratoxin A. Toxins (Basel) 2013, 5(11), 1965-87. doi: 10.3390/toxins5111965. PMID: 24189375; PMCID: PMC3847710.
197. Li, X.; Zhao, L.; Fan, Y.; Jia, Y.; Sun, L.; Ma, S. et al. Occurrence of mycotoxins in feed ingredients and complete feeds obtained from the Beijing region of China. J. Anim. Sci. Biotechnol. 2014, 5, 37. 10.1186/2049-1891-5-37 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
198. Indresh, H. C.; Umakantha, B. Effects of ochratoxin and T-2 toxin combination on performance, biochemical and immune status of commercial broilers. Veterinary World 2013, EISSN: 2231-0916
199. Xue, H. L.; Bi, Y.; Wei, J. M.; Tang, Y. M.; Zhao, Y.; & Wang, Y. New method for the simultaneous analysis of types a and B trichothecenes by ultrahigh-performance liquid chromatography coupled with tandem mass spectrometry in potato tubers inoculated with Fusarium sulphureum. Journal of Agricultural and Food Chemistry 2013, 61, 9333–9338.
200. Wangikar, P.; Sinha, N.; Dwivedi, P.K.; Sharma, A. K. Teratogenic effects of ochratoxin A and aflatoxin B1 alone and in combination on post-implantation rat embryos in culture. Turkish-German Gynecol Assoc. 2007, 8(4)
201. Javed, T.; Bunte, RM.; Dombrink-Kurtzman, MA.; Richard, JL.; Bennett, GA.; Côté, LM.; Buck, WB. Comparative pathologic changes in broiler chicks on feed amended with Fusarium proliferatum culture material or purified fumonisin B1 and moniliformin. Mycopathologia. 2005, 159(4), 553-64. doi: 10.1007/s11046-005-4518-9. PMID: 15983742.
202. Luongo, D.; Severino, L.; Bergamo, P.; De Luna, R.; Lucisano, A.; Rossi, M. Interactive effects of fumonisin B1 and alpha-zearalenol on proliferation and cytokine expression in Jurkat T cells. Toxicol In Vitro. 2006, 20(8):1403-10. doi: 10.1016/j.tiv.2006.06.006. Epub 2006 Jun 30. PMID: 16899350.
203. Szabó, A.; Szabó-Fodor, J.; Fébel, H.; Romvári, R.; Kovács, M. Individual and combined haematotoxic effects of fumonisin B(1) and T-2 mycotoxins in rabbits. Food Chem Toxicol. 2014, 72, 257-64. doi: 10.1016/j.fct.2014.07.025. Epub 2014 Aug 1. PMID: 25092395.
204. Wan, L.Y.; Turner, P.C.; El-Nezami, H. Individual and combined cytotoxic effects of Fusarium toxins (deoxynivalenol, nivalenol, zearalenone and fumonisins B1) on swine jejunal epithelial cells. Food Chem Toxicol. 2013, 57, 276-83. doi: 10.1016/j.fct.2013.03.034. Epub 2013 Apr 4. PMID: 23562706.
205. Kouadio, J.H.; Dano, S.D.; Moukha, S.; Mobio, T.A.; Creppy, E.E. Effects of combinations of Fusarium mycotoxins on the inhibition of macromolecular synthesis, malondialdehyde levels, DNA methylation and fragmentation, and viability in Caco-2 cells. Toxicon 2007, 49(3), 306-17. doi: 10.1016/j.toxicon.2006.09.029. Epub 2006 Oct 11. PMID: 17109910.
206. Pleadin, J.; Frece, J.; Markov, K. Mycotoxins in food and feed. Adv Food Nutr Res. 2019; 89:297-345. doi: 10.1016/bs.afnr.2019.02.007. Epub 2019 Mar 6. PMID: 31351529.




 Prevención de micotoxicosis
Prevención de micotoxicosis