Al-Zahraa Mamdouh1 y Eman Zahran2*
1Departamento de Enfermedades de los Peces, Instituto Nacional de Oceanografía y Pesca (NIOF), Egipto
2Departamento de Medicina Interna, Enfermedades Infecciosas y de los Peces, Facultad de Medicina Veterinaria, Universidad de Mansoura, Mansoura, Egipto
*Autor correspondiente: [email protected]
Las micotoxinas son sustancias tóxicas producidas de forma natural por los hongos filamentosos como metabolitos secundarios, pudiendo encontrarse en los alimentos para humanos y en los piensos para el ganado.
Los cereales, las nueces, el maíz y el arroz, pueden contaminarse en el campo durante la cosecha o el almacenamiento, lo que los convierte en una fuente común de contaminación.
 La mayoría de las micotoxinas han demostrado ser tóxicas, nefrotóxicas, hepatotóxicas, carcinógenas, inmunosupresoras y mutagénicas en estudios con animales, y suponen una grave amenaza para la salud humana y animal. En esta revisión se describen las micotoxinas que han sido caracterizadas químicamente y que actualmente son objeto de investigación debido a su demostrada toxicidad potencial.
La mayoría de las micotoxinas han demostrado ser tóxicas, nefrotóxicas, hepatotóxicas, carcinógenas, inmunosupresoras y mutagénicas en estudios con animales, y suponen una grave amenaza para la salud humana y animal. En esta revisión se describen las micotoxinas que han sido caracterizadas químicamente y que actualmente son objeto de investigación debido a su demostrada toxicidad potencial.
La amenaza de las micotoxinas
Las micotoxinas son producidas por hongos filamentosos de forma natural como metabolitos secundarios sin función metabólica conocida (Edite Bezerra da Rocha et al., 2014).
⇰ Se consideran sustancias tóxicas cuando están presentes en la alimentación humana o animal.
Pueden aparecer durante la precosecha, la postcosecha, el procesamiento, el almacenamiento y la alimentación. Además, se encuentran comúnmente en los derivados alimentarios humanos y animales (Sforza et al., 2006).
Estas toxinas son producidas, principalmente, por especies de hongos pertenecientes a:
- ⇰ Aspergillus
- ⇰ Fusarium
- ⇰ Alternaria
- ⇰ Penicillium
- ⇰ Myrothecium
- ⇰ Trichothecium
- ⇰ Verticimonosporium
(Zain, 2011)
Las micotoxinas son una de las principales clases de sustancias tóxicas naturales que contaminan los alimentos y los piensos en todo el mundo (Hueza et al., 2014; Shetty et al., 2006; Taheur et al., 2017).
 Según la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), alrededor del 25% de los alimentos producidos en el mundo están contaminados con al menos una micotoxina (Rogowska et al., 2019).
Según la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), alrededor del 25% de los alimentos producidos en el mundo están contaminados con al menos una micotoxina (Rogowska et al., 2019).

La contaminación de los alimentos animales y humanos con micotoxinas se produce de forma directa o indirecta.
⇰ La contaminación directa se produce por la infección del alimento por un hongo toxigénico con la consiguiente producción de micotoxinas, mientras que la contaminación indirecta se produce por la contaminación previa de los ingredientes del alimento por un hongo toxigénico, aunque se haya eliminado durante el procesado (Edite Bezerra da Rocha et al., 2014).
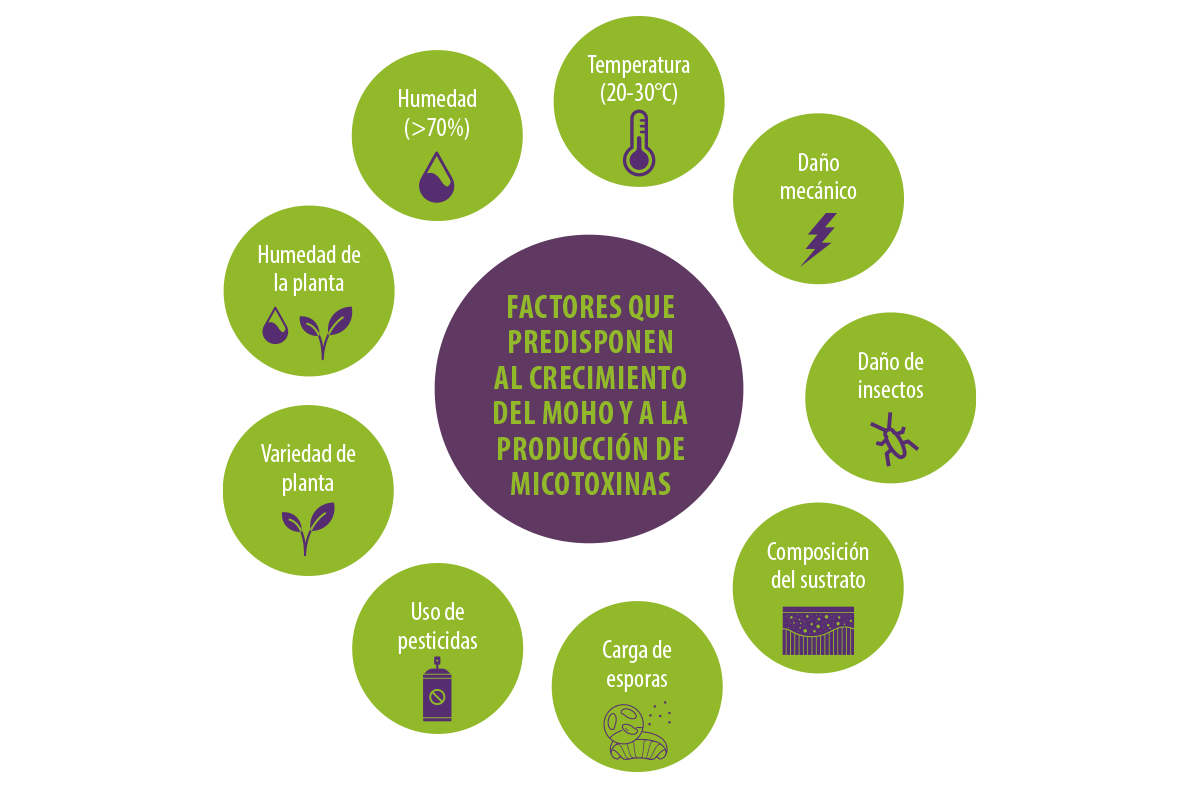
Entre los factores que favorecen el crecimiento del moho y la producción de micotoxinas se encuentran las condiciones meteorológicas, especialmente los niveles de humedad (superiores al 70%) y la temperatura (20-30°C).
Además, el contenido de humedad de la planta (por encima del 15%), los daños mecánicos, los daños de los insectos en los cultivos, la composición del sustrato, el uso de pesticidas, la variedad de plantas y la carga de esporas influyen en la producción de micotoxinas (Streit et al., 2012).
| Los ingredientes que contienen micotoxinas utilizados en la preparación de alimentos y piensos tienen menor valor nutricional y representan un riesgo para la salud animal y humana (Matejova et al., 2017). |
Principales micotoxinas que suponen un riesgo para la salud humana y animal
Aflatoxinas 
Las aflatoxinas son derivados de la difuranocumarina producidos en diversos alimentos, como el maíz, los cacahuetes, el arroz, el sorgo (Kew, 2013), el pistacho, los cacahuetes, los frutos secos (almendras, nueces, avellanas, nueces de Brasil), las semillas de algodón, las especias, los frutos secos, los cereales, la soja, el cacao, la leche, los productos lácteos y la carne (Patriarca y Pinto, 2017; Vila-Donat et al., 2018).
⇰ Son producidos principalmente por Aspergillus flavus y A parasiticus y, en menor medida, por A nomius, A bombycis, Aspergillus pseudotamari y Aspergillus ochraceoroseus (Varga et al., 2011).
En función de su fluorescencia azul o verde bajo luz ultravioleta, las principales aflatoxinas conocidas son B1, B2, G1 y G2.
AFB1 y AFB2 son producidas principalmente por A. flavus, mientras que las otras son producidas por A parasiticus (Dhanasekaran et al., 2011).
Otros tipos de aflatoxinas son P1, Q1, B2A y G2A, que se forman debido a la biotransformación o el metabolismo de las aflatoxinas en humanos y animales (Doi et al., 2002).
Además, la aflatoxina M1 es una forma hidroxilada de la aflatoxina B1 que se forma en los tejidos y fluidos animales como metabolito de la AFB1 (Neal et al., 1998), mientras que la aflatoxina M2 es un metabolito de la aflatoxina B2 que se forma en la leche del ganado (Dhanasekaran et al., 2011).
Varios factores favorecen la producción de aflatoxinas.
 Por ejemplo, las regiones tropicales y subtropicales caracterizadas por altas temperaturas y humedad, junto con el contenido de humedad de las plantas, tienen condiciones favorables para el crecimiento de Aspergillus y la producción de aflatoxinas (Kew, 2013).
Por ejemplo, las regiones tropicales y subtropicales caracterizadas por altas temperaturas y humedad, junto con el contenido de humedad de las plantas, tienen condiciones favorables para el crecimiento de Aspergillus y la producción de aflatoxinas (Kew, 2013).
La temperatura más favorable para su producción es de 25-32˚C, así como contenidos de humedad superiores al 12% e inferiores al 16%, y una humedad relativa del 85%.

MECANISMOS DE TOXICIDAD Y EFECTOS
Las aflatoxinas son el grupo de micotoxinas más estudiado por sus efectos cancerígenos y tóxicos en animales de laboratorio y en el ganado (Jha et al., 2013; Rotimi et al., 2017), así como por sus efectos hepatocarcinógenos y tóxicos agudos y crónicos en los seres humanos (Asim et al., 2011; Kew, 2013).
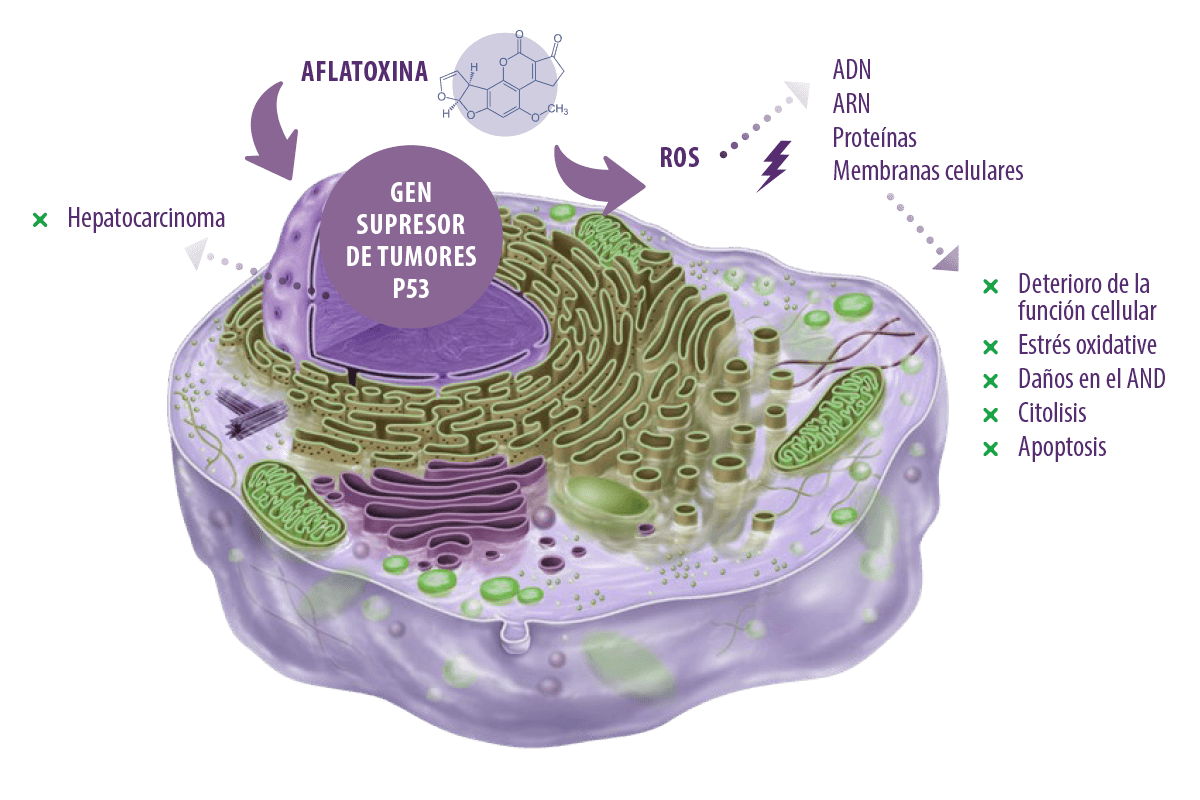
La toxicidad de las aflatoxinas se debe principalmente a la producción de especies reactivas de oxígeno (ROS) intracelulares, como el anión superóxido, el radical hidroxilo y el peróxido de hidrógeno (H2O2), durante su metabolismo por el citocromo P450 en el hígado.
⇰ Estas ROS atacan al ADN celular, al ARN, a las proteínas y a las membranas celulares, lo que conduce a la alteración de la función celular, al estrés oxidativo, al daño del ADN, a la citolisis y a la apoptosis (Asim et al., 2011; Yang et al., 2016). Además, pueden dirigirse al gen supresor de tumores p53 causando hepatocarcinoma (Kew, 2013).
Hepatotoxicidad
|
El metabolismo de las aflatoxinas se produce, principalmente, en el hígado bajo la acción del citocromo P450 en epóxido reactivo y electrófilo que, a su vez, se une al ADN, al ARN y a las macromoléculas celulares en el hígado (Abrar et al., 2013). Las aflatoxinas suelen estar asociadas al desarrollo de carcinoma hepatocelular (CHC) en los seres humanos debido a sus propiedades mutagénicas y carcinogénicas.
|
La AFB1 es el hepatocarcinógeno experimental más potente conocido (Humans and Cancer, 2002) y ningún modelo animal expuesto a la toxina ha dejado de desarrollar un CHC.
 También es responsable de aproximadamente el 9,2% de todos los nuevos cánceres en el mundo (Ferlay et al., 2010). También se ha señalado que otras enfermedades hepáticas, como la cirrosis (Humans, 2014) y la hepatomegalia (Gong et al., 2012), son consecuencias de la toxicidad inducida por las aflatoxinas en los seres humanos.
También es responsable de aproximadamente el 9,2% de todos los nuevos cánceres en el mundo (Ferlay et al., 2010). También se ha señalado que otras enfermedades hepáticas, como la cirrosis (Humans, 2014) y la hepatomegalia (Gong et al., 2012), son consecuencias de la toxicidad inducida por las aflatoxinas en los seres humanos.
![]() Los niveles de las enzimas hepáticas séricas se modificaron tras la administración de AFB1 mediante inyección intraperitoneal en ratas Wistar macho de 5 semanas de edad. También aumentó el malondialdehído (MDA) y disminuyó los niveles de glutatión, catalasa (CAT), superóxido dismutasa (SOD) y glutatión peroxidasa (GPx) (Ji et al., 2020).
Los niveles de las enzimas hepáticas séricas se modificaron tras la administración de AFB1 mediante inyección intraperitoneal en ratas Wistar macho de 5 semanas de edad. También aumentó el malondialdehído (MDA) y disminuyó los niveles de glutatión, catalasa (CAT), superóxido dismutasa (SOD) y glutatión peroxidasa (GPx) (Ji et al., 2020).
![]() Un estrés oxidativo similar fue representado por el aumento de los niveles de MDA y la disminución del contenido de glutatión (GSH) y la alteración de los niveles de enzimas hepáticas en ratas expuestas a AFB1 (Karaca et al., 2021; Vipin et al., 2017).
Un estrés oxidativo similar fue representado por el aumento de los niveles de MDA y la disminución del contenido de glutatión (GSH) y la alteración de los niveles de enzimas hepáticas en ratas expuestas a AFB1 (Karaca et al., 2021; Vipin et al., 2017).
![]() La tilapia del Nilo (Oreochromis niloticus) expuesta a la AFB1 sufrió estrés oxidativo y daño hepático indicado por los biomarcadores de daño hepático representados por la disminución de la actividad de CAT, GPx y niveles de SOD y el aumento del contenido de MDA (Ben Taheur et al., 2022).
La tilapia del Nilo (Oreochromis niloticus) expuesta a la AFB1 sufrió estrés oxidativo y daño hepático indicado por los biomarcadores de daño hepático representados por la disminución de la actividad de CAT, GPx y niveles de SOD y el aumento del contenido de MDA (Ben Taheur et al., 2022).
![]() La matrinxã (Brycon cephalus) y el pacú (Piaractus mesopotamicus) mostraron degeneración grasa, daño hepático y niveles alterados de enzimas hepáticas tras la exposición dietética a la AFB1 (Michelin et al., 2021).
La matrinxã (Brycon cephalus) y el pacú (Piaractus mesopotamicus) mostraron degeneración grasa, daño hepático y niveles alterados de enzimas hepáticas tras la exposición dietética a la AFB1 (Michelin et al., 2021).
Efectos inmunosupresores
Los efectos inmunosupresores de las aflatoxinas se han estudiado a fondo en seres humanos, aves de corral y especies acuáticas.
La AFB1 es tóxica para los linfocitos humanos y su citotoxicidad está mediada por la apoptosis y la necrosis (Al-Hammadi et al., 2014), y se ha demostrado que suprime la vía alternativa de activación del complemento (APCA) en patos (Valtchev et al., 2015).
El porcentaje de linfocitos, el título de anticuerpos frente a la influenza aviar en relación con el peso del timo y la respuesta inmunitaria a la fitohemaglutinina disminuyeron en los pollos de engorde expuestos a la AFB1 (Rashidi et al., 2020).
Del mismo modo, la exposición dietética de los pollos de engorde a la AFB1 indujo efectos inmunosupresores, incluyendo una reducción de la respuesta inmune a los glóbulos rojos de oveja (SRBC), la eliminación fagocítica de las partículas de carbón y la hipersensibilidad basófila cutánea mediada por la PHA-P, junto con la degeneración, necrosis y agotamiento del tejido linfoide (Bhatti et al., 2021).
La AFB1 redujo la actividad bactericida, la actividad de la lisozima y el nivel total de proteínas séricas en el bagre amarillo (Pelteobagrus fulvidraco) (Wang et al., 2016).
Del mismo modo, las actividades de lisozima, el contenido total de inmunoglobulinas y las actividades del complemento C3 y C4 disminuyeron significativamente en el plasma de la carpa común alimentada con una dieta que contenía aflatoxinas (Bitsayah et al., 2018).
Efectos sobre la reproducción
Los efectos hepatotóxicos y carcinogénicos de las aflatoxinas en mamíferos y organismos acuáticos han sido revisados intensamente, a diferencia de sus efectos en la reproducción. El mecanismo de la toxicidad reproductiva de las aflatoxinas no se conoce del todo (Shuaib et al., 2010), pero estudios anteriores informaron de que la exposición a las aflatoxinas induce efectos tóxicos en los testículos y otros órganos reproductores con el consiguiente deterioro de la espermatogénesis.
Se detectaron anomalías en los parámetros del semen (volumen, viscosidad, pH, fructosa, recuento de espermatozoides, morfología y motilidad) en los hombres infértiles con niveles altamente significativos de aflatoxinas en sangre y semen, en comparación con su nivel en los hombres fértiles (Uriah et al., 2001).
Se detectaron diversos cambios significativos en los índices reproductivos en ratas Wistar macho inyectadas por vía intramuscular con 20 μg de AFB1/kg de peso corporal (Supriya et al., 2014).
Además, se demostró que la AFB1 provoca cambios patológicos en el epidídimo, como la degeneración y la necrosis de las células epiteliales de los túbulos espermáticos con una disminución del número de espermatozoides (Murad et al., 2015).
Fumonisinas 
Las fumonisinas son producidas principalmente por Fusarium verticillioides (también conocido como Fusarium moniliforme), Fusarium proliferatum, Fusarium nygamai y otras especies de Fusarium, como Fusarium anthophilum, Fusarium dlamini, Fusarium napiforme, Fusarium subglutinans, Fusarium polyphialidicum y Fusarium oxysporum (Scott, 2012).
Se conocen 16 tipos de fumonisinas, denominadas B1 (FB1, FB2, FB3 y FB4), A1, A2, A3, AK1, C1, C3, C4, P1, P2, P3, PH1a y PH1.
 Suelen encontrarse en el maíz y en los alimentos a base de maíz (Marasas, 2001).
Suelen encontrarse en el maíz y en los alimentos a base de maíz (Marasas, 2001).

MECANISMOS DE TOXICIDAD Y EFECTOS
La FB1 tiene un efecto neurotóxico en los equinos, ya que provoca leucoencefalomalacia en los caballos (Vendruscolo et al., 2016), mientras que su órgano diana en los cerdos es el pulmón, ya que provoca edema pulmonar porcino (Freitas et al., 2012).
En animales de laboratorio es carcinogénica, hepatotóxica, nefrotóxica (Szabó et al., 2019; Szabó et al., 2018) y embriotóxica (Lumsangkul et al., 2019), mientras que, en humanos, las fumonisinas se asocian a cáncer de esófago (Yu et al., 2021) y a defectos del tubo neural (Copp et al., 2013).
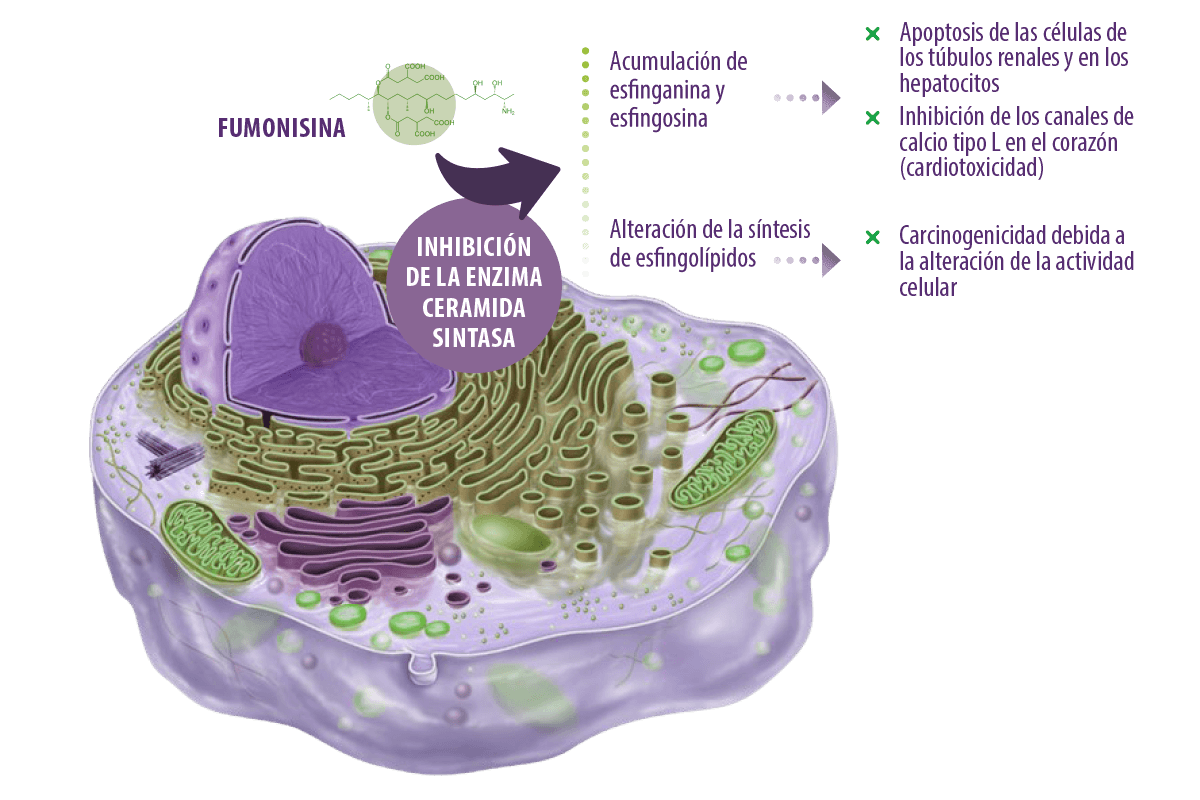
Las fumonisinas ejercen sus efectos tóxicos principalmente al inhibir la enzima ceramida sintasa, que es esencial para la síntesis de ceramida a partir de esfinganina y esfingosina (Voss y Riley, 2013).
Las ceramidas son los componentes estructurales básicos de todos los esfingolípidos (que se encuentran en las membranas celulares de animales y plantas) (Engelking, 2015).
⇰ Como resultado, tanto la esfinganina como la esfingosina se acumulan tras la inhibición de la enzima causando la apoptosis de las células de los túbulos renales y los hepatocitos (Voss y Riley, 2013).
Se ha sugerido, además, que la patogénesis del edema pulmonar en los cerdos y la cardiotoxicidad en los caballos expuestos al FB1 se debe en parte a la inhibición de los canales de calcio de tipo L en el corazón causada por la esfingosina y la esfinganina acumuladas, lo que conduce a la insuficiencia cardíaca del lado izquierdo (Voss et al., 2007).
Además, el efecto carcinogénico de las fumonisinas en los seres humanos está relacionado con la alteración de la biosíntesis de los esfingolípidos, lo que conduce a un deterioro de la actividad celular, ya que forman parte de la composición de la membrana celular y son esenciales para la comunicación célula-célula, las interacciones intracelulares y célula-matriz, y los factores de crecimiento (Edite Bezerra da Rocha et al., 2014).
Tricotecenos 
Los tricotecenos son metabolitos secundarios tóxicos producidos en plantas hospedadoras, alimentos y otras matrices orgánicas por varios géneros de hongos, como Fusarium, Microcyclospora, Myrothecium, Peltaster, Spicellum, Stachybotrys, Trichoderma y Trichothecium. Entre ellos, los tricotecenos de Fusarium son los que más preocupan para la seguridad de los alimentos y los piensos (Proctor et al., 2018).

Hay más de 150 toxinas pertenecientes a la familia de los tricotecenos, pero las más importantes son el deoxinivalenol (DON), el nivalenol (NIV), la toxina T2, la toxina HT2 y el diacetoxiscirpenol (DAS) (Yang et al., 2015).
⇰ Al igual que la mayoría de las micotoxinas, constituyen una importante preocupación en materia de seguridad alimentaria debido a los efectos nocivos que inducen la exposición aguda y crónica a las mismas (Sobrova et al., 2010). El DON es el tricoteceno más comúnmente encontrado en los granos de cereales (Tian et al., 2016).
MECANISMOS DE TOXICIDAD Y EFECTOS
Los tricotecenos son conocidos por su capacidad para inhibir la síntesis de proteínas eucariotas mediante la unión a la subunidad 60S de los ribosomas eucariotas y la inhibición de la actividad de la peptidil transferasa, lo que finalmente conduce a la inhibición de la iniciación, elongación o terminación del paso de elongación de la cadena en la síntesis de proteínas (Arunachalam y Doohan, 2013).
Estas toxinas también pueden inhibir la síntesis de ADN y ARN (Minervini et al., 2004), alterar la estructura de la membrana celular (Diesing et al., 2011), la función mitocondrial y detener el ciclo celular (Pestka, 2010a).
También pueden inducir el estrés oxidativo a través del aumento de la peroxidación de lípidos y la alteración de las defensas antioxidantes, lo que finalmente perjudica la síntesis de proteínas y causa daños en el ADN (Doi y Uetsuka, 2011; Wu et al., 2014).

![]() La toxina T-2 aumentó significativamente los niveles de ROS, disminuyó el GSH y elevó la peroxidación de lípidos, lo que provocó roturas de cadena simple en el ADN de las células de cáncer cervical humano (Chaudhari et al., 2009).
La toxina T-2 aumentó significativamente los niveles de ROS, disminuyó el GSH y elevó la peroxidación de lípidos, lo que provocó roturas de cadena simple en el ADN de las células de cáncer cervical humano (Chaudhari et al., 2009).
![]() Las concentraciones elevadas de DON aumentaron los niveles de ROS que conducen a la muerte celular en una línea celular humana (Costa et al., 2009).
Las concentraciones elevadas de DON aumentaron los niveles de ROS que conducen a la muerte celular en una línea celular humana (Costa et al., 2009).
![]() La exposición dietética de la trucha arco iris (Oncorhynchus mykiss) a 0,01 mg/kg PV. y 0,018 mg/kg PV de toxina T-2 aumentó la peroxidación de lípidos y las actividades de la glutatión-S-transferasa (GST), la glutatión reductasa (GR) y la glutatión peroxidasa (GPx) y disminuyó la actividad de la catalasa (CAT) (Modra et al., 2018).
La exposición dietética de la trucha arco iris (Oncorhynchus mykiss) a 0,01 mg/kg PV. y 0,018 mg/kg PV de toxina T-2 aumentó la peroxidación de lípidos y las actividades de la glutatión-S-transferasa (GST), la glutatión reductasa (GR) y la glutatión peroxidasa (GPx) y disminuyó la actividad de la catalasa (CAT) (Modra et al., 2018).
![]() En la misma especie de peces, las alteraciones significativas en las actividades de GPx en el riñón, GR en las branquias y el riñón, CAT en el riñón y el hígado, y GST en las branquias y el hígado siguieron a la exposición dietética a DON (Šišperová et al., 2015).
En la misma especie de peces, las alteraciones significativas en las actividades de GPx en el riñón, GR en las branquias y el riñón, CAT en el riñón y el hígado, y GST en las branquias y el hígado siguieron a la exposición dietética a DON (Šišperová et al., 2015).
![]() Los tricotecenos son bien conocidos por inducir la apoptosis y la muerte celular programada (PCD) a través de la vía mitocondrial de ROS (Zhuang et al., 2013).
Los tricotecenos son bien conocidos por inducir la apoptosis y la muerte celular programada (PCD) a través de la vía mitocondrial de ROS (Zhuang et al., 2013).
![]() El tratamiento con la toxina T-2 de las células de la granulosa ovárica de las ratas provocó cambios morfológicos típicos de la apoptosis, como la fragmentación nuclear y la reducción del potencial de la membrana mitocondrial, debido a la regulación al alza de las proteínas proapoptóticas p53 y Bax, al aumento de la relación Bax/Bcl-2 y a la activación de la vía de la caspasa 3 (Wu et al., 2011).
El tratamiento con la toxina T-2 de las células de la granulosa ovárica de las ratas provocó cambios morfológicos típicos de la apoptosis, como la fragmentación nuclear y la reducción del potencial de la membrana mitocondrial, debido a la regulación al alza de las proteínas proapoptóticas p53 y Bax, al aumento de la relación Bax/Bcl-2 y a la activación de la vía de la caspasa 3 (Wu et al., 2011).
![]() También indujo un aumento de la producción de ROS y la apoptosis celular, principalmente en las zonas de la cola de los embriones de pez cebra, revelado por la tinción con naranja de acridina (Yuan et al., 2014).
También indujo un aumento de la producción de ROS y la apoptosis celular, principalmente en las zonas de la cola de los embriones de pez cebra, revelado por la tinción con naranja de acridina (Yuan et al., 2014).
![]() En los condrocitos humanos, la apoptosis inducida por la toxina T-2 se asoció con el aumento de Fas, p53, el factor proapoptótico Bax y la caspasa 3, y la regulación a la baja del factor antiapoptótico Bcl-xl (Chen et al., 2008).
En los condrocitos humanos, la apoptosis inducida por la toxina T-2 se asoció con el aumento de Fas, p53, el factor proapoptótico Bax y la caspasa 3, y la regulación a la baja del factor antiapoptótico Bcl-xl (Chen et al., 2008).
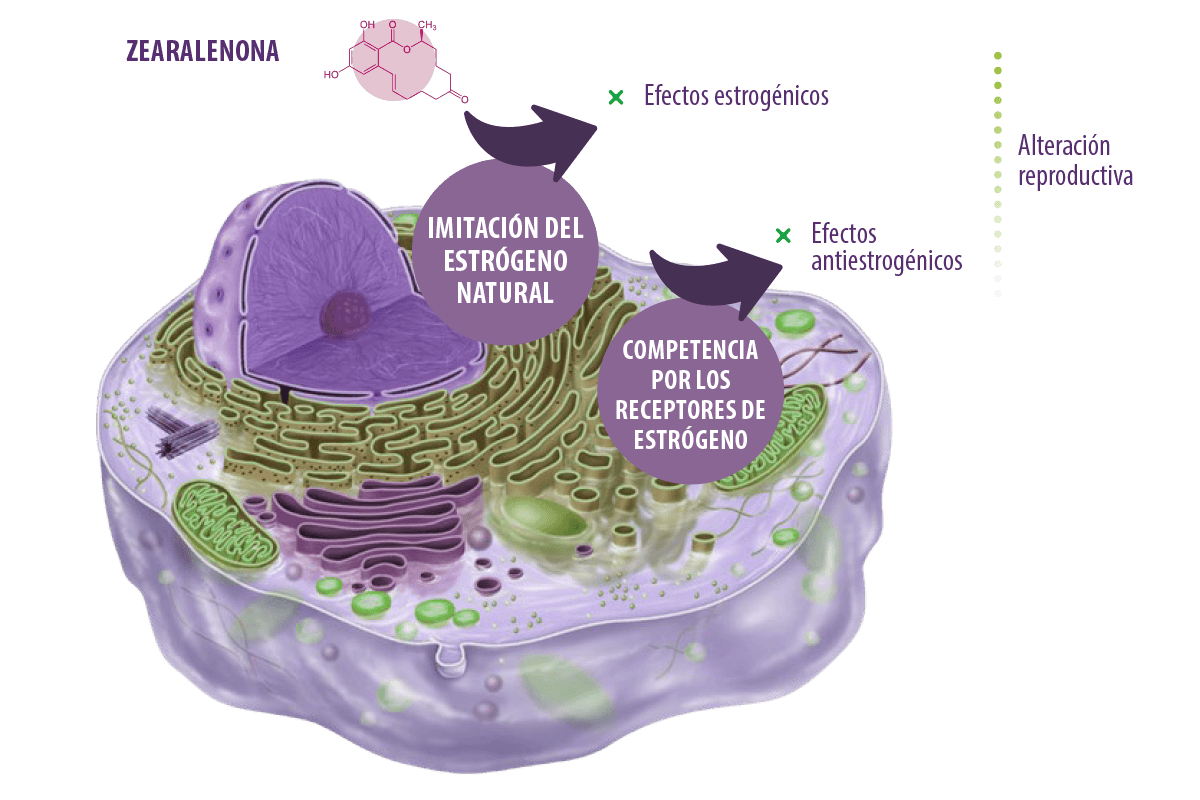
Zearalanona ![]()
La zearalenona (ZEN), también denominada micotoxina F-2 o RAL, es un metabolito secundario estrogénico no esteroideo biosintetizado principalmente por Fusarium graminearum y, en menor medida, por Fusarium culmorum, Fusarium cerealis o Fusarium equiseti (De Boevre et al., 2012; Taheur et al., 2017).
Tiene propiedades genotóxicas (Braicu et al., 2016; Taranu et al., 2015), inmunotóxicas (Assumaidaee et al., 2020; Hueza et al., 2014), teratogénicas, carcinogénicas (Abassi et al., 2016), hematotóxicas y hepatotóxicas (Bai et al., 2018), pero su toxicidad para el ser humano y los animales surge principalmente de sus actividades xenosteroides.
Su estructura química es similar a la del estrógeno natural y ejerce su acción actuando como un compuesto perturbador del sistema endocrino (EDC) (Rogowska et al., 2019), pudiendo cambiar las funciones del sistema endocrino en los seres vivos y causando efectos adversos para la salud. De hecho, se sabe que provocan alteraciones en las funciones fisiológicas controladas por las hormonas (homeostasis, crecimiento, desarrollo y reproducción) (Kar et al., 2021).

MECANISMOS DE TOXICIDAD Y EFECTOS
La zearalenona ejerce su acción imitando a los estrógenos naturales (dando lugar a un resultado similar al de los estrógenos naturales) o compitiendo con sus receptores (dando lugar a una reacción antiestrogénica).
⇰ En cualquier caso, el resultado final es una alteración reproductiva (Rogowska et al., 2019).
![]() La exposición dietética de lechones a 1 mg/kg de ZEN indujo un deterioro reproductivo representado por un aumento en la longitud, anchura y área de la vulva, el coeficiente del órgano genital y una disminución significativa de E2, LH y FSH (Su et al., 2018).
La exposición dietética de lechones a 1 mg/kg de ZEN indujo un deterioro reproductivo representado por un aumento en la longitud, anchura y área de la vulva, el coeficiente del órgano genital y una disminución significativa de E2, LH y FSH (Su et al., 2018).
![]() Del mismo modo, dosis bajas de ZEN afectaron a la capacidad reproductiva de ratones macho, con una disminución significativa de las células espermatogénicas, la concentración de esperma, la viabilidad, la motilidad y la tasa de hiperactividad, y un aumento significativo de la rotura de la doble cadena de ADN en las células espermatogénicas, además de un aumento significativo de la deformidad y la tasa de mortalidad de los espermatozoides (Pang et al., 2017).
Del mismo modo, dosis bajas de ZEN afectaron a la capacidad reproductiva de ratones macho, con una disminución significativa de las células espermatogénicas, la concentración de esperma, la viabilidad, la motilidad y la tasa de hiperactividad, y un aumento significativo de la rotura de la doble cadena de ADN en las células espermatogénicas, además de un aumento significativo de la deformidad y la tasa de mortalidad de los espermatozoides (Pang et al., 2017).
En los peces, varios estudios señalaron el efecto de la zearalenona en el rendimiento reproductivo, incluyendo la alteración de la reproducción de la trucha arco iris y la inducción de una alta concentración de espermatozoides y altos niveles de vitelogenina en plasma en los machos, y la inducción del desarrollo ovárico temprano en las hembras (Woźny et al., 2020).
En la misma línea, la zearalenona indujo la expresión del ARNm de la vtg-1 en el pez cebra (Danio rerio) de manera dependiente de la concentración tras 120 h de exposición (Bakos et al., 2013).
El mecanismo de la inmunotoxicidad asociada a la zearalenona surge porque es un xenoestrógeno y un EDC.
⇰ Los estrógenos no solo funcionan como hormonas reproductivas, sino que también tienen funciones no reproductivas, afectando también a las funciones inmunitarias. En este sentido, los estrógenos actúan sobre las células inmunitarias a través de los receptores de estrógenos (RE) que les permiten actuar de forma inmunomoduladora (Islam et al., 2017) o inmunosupresora (Abbès et al., 2013; Zahran et al., 2021).

Ocratoxinas 
Las ocratoxinas son metabolitos de dihidroisocumarina unidos a fenilalanina pentactida. Se clasifican en ocratoxina A (OTA), producida por Aspergillus ochraceus, y ocratoxina A, B y C, producida por otras especies de Aspergillus y Penicillium (Marroquín-Cardona et al., 2014).
Se ha comprobado que las ocratoxinas contaminan diversos alimentos como los cereales, el arroz, el trigo, los frutos secos, el café, el cacao, el vino, la cerveza y los alimentos de origen animal, en particular la carne de cerdo (Kumar et al., 2020).

MECANISMOS DE TOXICIDAD Y EFECTOS
La OTA induce la toxicidad al unirse a las proteínas, especialmente a las albúminas séricas, con la consiguiente bioacumulación en sus órganos diana (Duarte et al., 2012).
También es un inhibidor del factor 2 relacionado con el factor nuclear eritroide (Nrf2), induciendo así estrés oxidativo fisiológico, dañando aún más el ADN (Limonciel y Jennings, 2014).
La OTA es principalmente nefrotóxica:
- ⇰ En los seres humanos, es responsable de la nefropatía endémica de los Balcanes (BEN) (Stiborová et al., 2016), la nefropatía intersticial crónica (CIN) (Hassen et al., 2004), insuficiencia renal y tumores (Chen y Wu, 2017; Hope y Hope, 2012).
- ⇰ En los cerdos, provoca una nefropatía porcina endémica (Jørgensen y Petersen, 2002).
También es carcinogénico, clasificado como posible carcinógeno humano del grupo 2B (Marroquín-Cardona et al., 2014).
Los rumiantes y los roedores son, hasta cierto punto, resistentes a la OTA porque su microbiota puede producir enzimas carboxipeptidasas.
⇰ La enzima puede escindir el enlace peptídico y formar OTα menos tóxica (Abrunhosa et al., 2006).
A pesar de ello, la OTA es hepatotóxica, teratogénica, inmunotóxica y carcinogénica en modelos experimentales.
![]() Indujo hepatotoxicidad en ratas, con una disminución significativa de las actividades de SOD, CAT y GPx, un aumento significativo del nivel de MDA y lesiones histopatológicas en el hígado, incluyendo inflamación, esteatosis, necrosis y fibrosis (Damiano et al., 2021).
Indujo hepatotoxicidad en ratas, con una disminución significativa de las actividades de SOD, CAT y GPx, un aumento significativo del nivel de MDA y lesiones histopatológicas en el hígado, incluyendo inflamación, esteatosis, necrosis y fibrosis (Damiano et al., 2021).
![]() En otro estudio, la exposición a la OTA se asoció a un aumento significativo de los biomarcadores proinflamatorios y de daño oxidativo del ADN y a un aumento significativo de los niveles de óxido nítrico (NO) en riñones e hígado (Longobardi et al., 2021).
En otro estudio, la exposición a la OTA se asoció a un aumento significativo de los biomarcadores proinflamatorios y de daño oxidativo del ADN y a un aumento significativo de los niveles de óxido nítrico (NO) en riñones e hígado (Longobardi et al., 2021).
![]() El efecto carcinogénico de la OTA fue reportado en ratas representado por el aumento de los niveles de ARNm de la clusterina en los riñones, el aumento de la proliferación del antígeno nuclear celular (PCNA) en el hígado y el riñón, la regulación a la baja de las especies reactivas del oxígeno (ROS) y el gen p53, y la regulación al alza de la vimentina y la lipocalina en el riñón (Qi et al., 2014).
El efecto carcinogénico de la OTA fue reportado en ratas representado por el aumento de los niveles de ARNm de la clusterina en los riñones, el aumento de la proliferación del antígeno nuclear celular (PCNA) en el hígado y el riñón, la regulación a la baja de las especies reactivas del oxígeno (ROS) y el gen p53, y la regulación al alza de la vimentina y la lipocalina en el riñón (Qi et al., 2014).
![]() Además, el deterioro del hígado y el riñón fue evidente en la tilapia del Nilo expuesta a la OTA (Mansour et al., 2015), mientras que indujo la insuficiencia hepática y la supresión antioxidante en el morragute (Liza ramada) (Magouz et al., 2022).
Además, el deterioro del hígado y el riñón fue evidente en la tilapia del Nilo expuesta a la OTA (Mansour et al., 2015), mientras que indujo la insuficiencia hepática y la supresión antioxidante en el morragute (Liza ramada) (Magouz et al., 2022).
Eliminación de micotoxinas en modelos experimentales
La presencia de micotoxinas en los piensos ha hecho necesario el desarrollo de nuevas tecnologías que sean útiles, respetuosas con el medio ambiente y rentables para su eliminación.
A continuación, se describen ejemplos de algunos compuestos utilizados para mitigar la toxicidad de las micotoxinas.

 El selenito de sodio exhibe efectos protectores sobre la toxicidad inducida por la AFB1 al inhibir el estrés oxidativo y la apoptosis excesiva en el bazo de los pollos de engorde (Wang et al., 2013), disminuyendo el daño al ADN y las alteraciones histológicas en el hígado de los patos (Shi et al., 2015), y mejorando la toxicidad reproductiva en los ratones (Cao et al., 2017).
El selenito de sodio exhibe efectos protectores sobre la toxicidad inducida por la AFB1 al inhibir el estrés oxidativo y la apoptosis excesiva en el bazo de los pollos de engorde (Wang et al., 2013), disminuyendo el daño al ADN y las alteraciones histológicas en el hígado de los patos (Shi et al., 2015), y mejorando la toxicidad reproductiva en los ratones (Cao et al., 2017). La administración de silimarina mitiga los niveles elevados de expresión del factor de crecimiento endotelial vascular (VEGF) y del factor de crecimiento de fibroblastos-2 (FGF-2) y disminuye el daño hepático inducido por el FB1 en ratones (Sozmen et al., 2014).
La administración de silimarina mitiga los niveles elevados de expresión del factor de crecimiento endotelial vascular (VEGF) y del factor de crecimiento de fibroblastos-2 (FGF-2) y disminuye el daño hepático inducido por el FB1 en ratones (Sozmen et al., 2014). Lactobacillus paracasei alivia la genotoxicidad, el estado de estrés oxidativo y el daño histopatológico inducido por el FB1 en ratones (Ezdini et al., 2020), mientras que las cepas de Lb. delbrueckii subsp. lactis (LL) y P. acidilactici (PA) indujeron un efecto protector contra la antigenotoxicidad y las lesiones precancerosas causadas por el FB1 en ratas Sprague-Dawley (Khalil et al., 2015).
Lactobacillus paracasei alivia la genotoxicidad, el estado de estrés oxidativo y el daño histopatológico inducido por el FB1 en ratones (Ezdini et al., 2020), mientras que las cepas de Lb. delbrueckii subsp. lactis (LL) y P. acidilactici (PA) indujeron un efecto protector contra la antigenotoxicidad y las lesiones precancerosas causadas por el FB1 en ratas Sprague-Dawley (Khalil et al., 2015). La suplementación dietética de rutina en la tilapia del Nilo mejora el crecimiento, eleva la capacidad antioxidante del hígado y reduce el daño hepático y de la miofibra inducido por la toxina T-2 (Deng et al., 2019).
La suplementación dietética de rutina en la tilapia del Nilo mejora el crecimiento, eleva la capacidad antioxidante del hígado y reduce el daño hepático y de la miofibra inducido por la toxina T-2 (Deng et al., 2019). El daño oxidativo y las respuestas inmunitarias del hepatopáncreas inducidas por la toxina T-2 en el cangrejo de guante chino (Eriocheir sinensis) se reducen tras la suplementación dietética con arginina (Zhang et al., 2020).
El daño oxidativo y las respuestas inmunitarias del hepatopáncreas inducidas por la toxina T-2 en el cangrejo de guante chino (Eriocheir sinensis) se reducen tras la suplementación dietética con arginina (Zhang et al., 2020). La suplementación con vitamina C disminuye la toxicidad reproductiva, inmunológica y hematológica en lechones expuestos al ZEN (Su et al., 2018).
La suplementación con vitamina C disminuye la toxicidad reproductiva, inmunológica y hematológica en lechones expuestos al ZEN (Su et al., 2018).
 El resveratrol (RSV) es capaz de disminuir o revertir la toxicidad inducida por el ZEN en ratas Wistar macho adultas, aumentando la actividad enzimática antioxidante y mejorando los parámetros inmunológicos en las ratas expuestas (Virk et al., 2020).
El resveratrol (RSV) es capaz de disminuir o revertir la toxicidad inducida por el ZEN en ratas Wistar macho adultas, aumentando la actividad enzimática antioxidante y mejorando los parámetros inmunológicos en las ratas expuestas (Virk et al., 2020). La curcumina modula el estrés nitrosativo, la inflamación y el daño al ADN, la hepatotoxicidad y la nefrotoxicidad inducidas por la ocratoxina A en ratas (Longobardi et al., 2021).
La curcumina modula el estrés nitrosativo, la inflamación y el daño al ADN, la hepatotoxicidad y la nefrotoxicidad inducidas por la ocratoxina A en ratas (Longobardi et al., 2021). Las nanopartículas de zinc mediadas por el té verde mejoran la hepatotoxicidad y la nefrotoxicidad inducidas por la OTA en ratas albinas (Mansour et al., 2015).
Las nanopartículas de zinc mediadas por el té verde mejoran la hepatotoxicidad y la nefrotoxicidad inducidas por la OTA en ratas albinas (Mansour et al., 2015). Los probióticos enriquecidos con selenio (SP) mejoran la función renal, el rendimiento y los parámetros antioxidantes en lechones intoxicados con OTA (Gan et al., 2021).
Los probióticos enriquecidos con selenio (SP) mejoran la función renal, el rendimiento y los parámetros antioxidantes en lechones intoxicados con OTA (Gan et al., 2021). La suplementación con suero lácteo mejora la ocratoxicosis en la tilapia del Nilo (Mansour et al., 2015) y Bacillus subtilis dietético protege contra la insuficiencia hepática y la supresión antioxidante inducida por la ocratoxina A en el morragute (Liza ramada) (Magouz et al., 2022).
La suplementación con suero lácteo mejora la ocratoxicosis en la tilapia del Nilo (Mansour et al., 2015) y Bacillus subtilis dietético protege contra la insuficiencia hepática y la supresión antioxidante inducida por la ocratoxina A en el morragute (Liza ramada) (Magouz et al., 2022). El papel protector de Minazel® Plus en la salud de los peces se evidencia en el rendimiento, los parámetros hematológicos, las respuestas inmunitarias innatas y antioxidantes, la bioacumulación de micotoxinas en el hígado y la musculatura, y la evaluación histopatológica de los tejidos del hígado y el riñón (Zahran et al., 2020).
El papel protector de Minazel® Plus en la salud de los peces se evidencia en el rendimiento, los parámetros hematológicos, las respuestas inmunitarias innatas y antioxidantes, la bioacumulación de micotoxinas en el hígado y la musculatura, y la evaluación histopatológica de los tejidos del hígado y el riñón (Zahran et al., 2020).
CONCLUSIONES
Los metabolitos fúngicos secundarios toxigénicos, conocidos como micotoxinas, se consideran una amenaza para la salud humana y la seguridad alimentaria.
 Debido a su presencia en una amplia gama de productos agrícolas y alimentarios, siguen representando una grave amenaza para la salud de los animales y de los seres humanos.
Debido a su presencia en una amplia gama de productos agrícolas y alimentarios, siguen representando una grave amenaza para la salud de los animales y de los seres humanos.

REFERENCIAS
Abassi, H., Ayed-Boussema, I., Shirley, S., Abid, S., Bacha, H., Micheau, O., 2016. The mycotoxin zearalenone enhances cell proliferation, colony formation and promotes cell migration in the human colon carcinoma cell line HCT116. Toxicology letters 254, 1-7.
Abbès, S., Ben Salah-Abbes, J., Sharafi, H., Oueslati, R., Noghabi, K.A., 2013. Lactobacillus paracasei BEJ01 prevents immunotoxic effects during chronic zearalenone exposure in Balb/c mice. Immunopharmacology and immunotoxicology 35, 341-348.
Abrar, M., Anjum, F.M., Butt, M.S., Pasha, I., Randhawa, M.A., Saeed, F., Waqas, K., 2013. Aflatoxins: biosynthesis, occurrence, toxicity, and remedies. Critical reviews in food science and nutrition 53, 862-874.
Abrunhosa, L., Santos, L., Venâncio, A., 2006. Degradation of ochratoxin A by proteases and by a crude enzyme of Aspergillus niger. Food Biotechnology 20, 231-242.
Al-Hammadi, S., Marzouqi, F., Al-Mansouri, A., Shahin, A., Al-Shamsi, M., Mensah-Brown, E., Souid, A.-K., 2014. The cytotoxicity of aflatoxin b1 in human lymphocytes. Sultan Qaboos Univ Med J 14, e65-e71.
Arunachalam, C., Doohan, F.M., 2013. Trichothecene toxicity in eukaryotes: Cellular and molecular mechanisms in plants and animals. Toxicology letters 217, 149-158.
Asim, M., Sarma, M.P., Thayumanavan, L., Kar, P., 2011. Role of aflatoxin B1 as a risk for primary liver cancer in north Indian population. Clinical biochemistry 44, 1235-1240.
Assumaidaee, A.A., Ali, N.M., Ahmed, S.W., 2020. Zearalenone Mycotoxicosis: Pathophysiology and Immunotoxicity. The Iraqi Journal of Veterinary Medicine 44, 29-38.
Bai, X., Sun, C., Xu, J., Liu, D., Han, Y., Wu, S., Luo, X., 2018. Detoxification of zearalenone from corn oil by adsorption of functionalized GO systems. Applied surface science 430, 198-207.
Bakos, K., Kovács, R., Staszny, Á., Sipos, D.K., Urbányi, B., Müller, F., Csenki, Z., Kovács, B., 2013. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology 136-137, 13-21.
Ben Taheur, F., Mansour, C., Mechri, S., Laaouar, H., Safta Skhiri, S., Bouricha, M., Jaouadi, B., Mzoughi, R., Zouari, N., 2022. Protective effects of dietary Kefir against aflatoxin B1‐induced hepatotoxicity in Nile tilapia fish, Oreochromis niloticus. Food Science & Nutrition.
Bhatti, S.A., Khan, M.Z., Saleemi, M.K., Hassan, Z.U., 2021. Combating immunotoxicity of aflatoxin B1 by dietary carbon supplementation in broiler chickens. Environmental Science and Pollution Research 28, 49089-49101.
Bitsayah, A., Banaee, M., Nematdoost Haghi, B., 2018. Effects of aflatoxin-contaminated feed on immunological parameters of common carp (Cyprinus carpio). Iranian Journal of Toxicology 12, 7-12.
Bosetti, C., Turati, F., La Vecchia, C., 2014. Hepatocellular carcinoma epidemiology. Best practice & research Clinical gastroenterology 28, 753-770.
Braicu, C., Cojocneanu-Petric, R., Jurj, A., Gulei, D., Taranu, I., Gras, A.M., Marin, D.E., Berindan-Neagoe, I., 2016. Microarray based gene expression analysis of Sus Scrofa duodenum exposed to zearalenone: significance to human health. BMC genomics 17, 1-10.
Cao, Z., Shao, B., Xu, F., Liu, Y., Li, Y., Zhu, Y., 2017. Protective effect of selenium on aflatoxin B1-induced testicular toxicity in mice. Biological trace element research 180, 233-238.
Carvajal-Moreno, M., 2015. Metabolic changes of aflatoxin B1 to become an active carcinogen and the control of this toxin. Immunome Research 11, 1.
Chaudhari, M., Jayaraj, R., Bhaskar, A., Rao, P.L., 2009. Oxidative stress induction by T-2 toxin causes DNA damage and triggers apoptosis via caspase pathway in human cervical cancer cells. Toxicology 262, 153-161.
Chen, C., Wu, F., 2017. The need to revisit ochratoxin A risk in light of diabetes, obesity, and chronic kidney disease prevalence. Food and Chemical Toxicology 103, 79-85.
Chen, J.-h., Cao, J.-l., Chu, Y.-l., Wang, Z.-l., Yang, Z.-t., Wang, H.-l., 2008. T-2 toxin-induced apoptosis involving Fas, p53, Bcl-xL, Bcl-2, Bax and caspase-3 signaling pathways in human chondrocytes. Journal of Zhejiang University Science B 9, 455-463.
Copp, A.J., Stanier, P., Greene, N.D., 2013. Neural tube defects: recent advances, unsolved questions, and controversies. The Lancet Neurology 12, 799-810.
Costa, S., Schwaiger, S., Cervellati, R., Stuppner, H., Speroni, E., Guerra, M.C., 2009. In vitro evaluation of the chemoprotective action mechanisms of leontopodic acid against aflatoxin B1 and deoxynivalenol-induced cell damage. Journal of Applied Toxicology 29, 7-14.
da Rocha, M.E.B., Freire, F.d.C.O., Maia, F.E.F., Guedes, M.I.F., Rondina, D., 2014. Mycotoxins and their effects on human and animal health. Food Control 36, 159-165.
Damiano, S., Longobardi, C., Andretta, E., Prisco, F., Piegari, G., Squillacioti, C., Montagnaro, S., Pagnini, F., Badino, P., Florio, S., 2021. Antioxidative effects of curcumin on the hepatotoxicity induced by ochratoxin a in rats. Antioxidants 10, 125.
De Boevre, M., Di Mavungu, J.D., Landschoot, S., Audenaert, K., Eeckhout, M., Maene, P., Haesaert, G., De Saeger, S., 2012. Natural occurrence of mycotoxins and their masked forms in food and feed products. World Mycotoxin Journal 5, 207-219.
Deng, Y., Qiu, M., Wang, Y., Wang, R., Lu, P., Sun, L., Li, X., Gooneratne, R., 2019. Protective effect of antioxidant-enriched diets on T-2-toxin-induced damage in tilapia (Oreochromis niloticus). Aquaculture 506, 341-349.
Dhanasekaran, D., Shanmugapriya, S., Thajuddin, N., Panneerselvam, A., 2011. Aflatoxins and aflatoxicosis in human and animals. Aflatoxins-Biochemistry and Molecular Biology 10, 221-254.
Diesing, A.-K., Nossol, C., Dänicke, S., Walk, N., Post, A., Kahlert, S., Rothkötter, H.-J., Kluess, J., 2011. Vulnerability of polarised intestinal porcine epithelial cells to mycotoxin deoxynivalenol depends on the route of application. PloS one 6, e17472.
Doi, A.M., Patterson, P.E., Gallagher, E.P., 2002. Variability in aflatoxin B1–macromolecular binding and relationship to biotransformation enzyme expression in human prenatal and adult liver. Toxicology and applied pharmacology 181, 48-59.
Doi, K., Uetsuka, K., 2011. Mechanisms of mycotoxin-induced neurotoxicity through oxidative stress associated pathways. International journal of molecular sciences 12, 5213-5237.
Duarte, S.C., Lino, C.M., Pena, A., 2012. Food safety implications of ochratoxin A in animal-derived food products. The Veterinary Journal 192, 286-292.
Edite Bezerra da Rocha, M., Freire, F.d.C.O., Erlan Feitosa Maia, F., Izabel Florindo Guedes, M., Rondina, D., 2014. Mycotoxins and their effects on human and animal health. Food Control 36, 159-165.
Engelking, L.R. 2015. Chapter 59 – Sphingolipids, In: Engelking, L.R. (Ed.) Textbook of Veterinary Physiological Chemistry (Third Edition). Academic Press, Boston, 378-383.
Ezdini, K., Ben Salah-Abbès, J., Belgacem, H., Mannai, M., Abbès, S., 2020. Lactobacillus paracasei alleviates genotoxicity, oxidative stress status and histopathological damage induced by Fumonisin B1 in BALB/c mice. Toxicon 185, 46-56.
Ferlay, J., Shin, H.R., Bray, F., Forman, D., Mathers, C., Parkin, D.M., 2010. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. International journal of cancer 127, 2893-2917.
Freitas, B., Mota, M., Del Santo, T., Afonso, E., Silva, C., Utimi, N., Barbosa, L., Vilela, F., Araújo, L., 2012. Mycotoxicosis in Swine: a Review. J An Product Adv 2, 174-181.
Gan, F., Hou, L., Lin, Z., Ge, L., Liu, D., Li, H., Chen, X., Huang, K., 2021. Effects of Selenium-enriched probiotics on ochratoxin A-induced kidney injury and DNMTs expressions in piglets. Research in Veterinary Science 139, 94-101.
Gong, Y.Y., Wilson, S., Mwatha, J.K., Routledge, M.N., Castelino, J.M., Zhao, B., Kimani, G., Kariuki, H.C., Vennervald, B.J., Dunne, D.W., 2012. Aflatoxin exposure may contribute to chronic hepatomegaly in Kenyan school children. Environmental Health Perspectives 120, 893-896.
Hassen, W., Abid, S., Achour, A., Creppy, E., Bacha, H., 2004. Ochratoxin A and β2-microglobulinuria in healthy individuals and in chronic interstitial nephropathy patients in the centre of Tunisia: a hot spot of Ochratoxin A exposure. Toxicology 199, 185-193.
Hope, J.H., Hope, B.E., 2012. A review of the diagnosis and treatment of Ochratoxin A inhalational exposure associated with human illness and kidney disease including focal segmental glomerulosclerosis. Journal of Environmental and Public Health 2012.
Hueza, I.M., Raspantini, P.C.F., Raspantini, L.E.R., Latorre, A.O., Górniak, S.L., 2014. Zearalenone, an estrogenic mycotoxin, is an immunotoxic compound. Toxins 6, 1080-1095.
Humans, I.W.G.o.t.E.o.C.R.t., 2014. DIESEL AND GASOLINE ENGINE EXHAUSTS AND SOME NITROARENES. IARC MONOGRAPHS ON THE EVALUATION OF CARCINOGENIC RISKS TO HUMANS. IARC monographs on the evaluation of carcinogenic risks to humans 105, 9.
Humans, I.W.G.o.t.E.o.C.R.t., Cancer, I.A.f.R.o., 2002. Some traditional herbal medicines, some mycotoxins, naphthalene and styrene, Vol 82. World Health Organization.
Islam, M.R., Kim, J.W., Roh, Y.-S., Kim, J.-H., Han, K.M., Kwon, H.-J., Lim, C.W., Kim, B., 2017. Evaluation of immunomodulatory effects of zearalenone in mice. Journal of Immunotoxicology 14, 125-136.
Jha, A., Krithika, R., Manjeet, D., Verma, R.J., 2013. Protective effect of black tea infusion on aflatoxin induced hepatotoxicity in mice. Journal of Clinical and Experimental Hepatology 3, 29-36.
Ji, Y., Nyamagoud, S.B., SreeHarsha, N., Mishra, A., Gubbiyappa, S.K., Singh, Y., 2020. Sitagliptin protects liver against aflatoxin B1‐induced hepatotoxicity through upregulating Nrf2/ARE/HO‐1 pathway. Biofactors 46, 76-82.
Jørgensen, K., Petersen, A., 2002. Content of ochratoxin A in paired kidney and meat samples from healthy Danish slaughter pigs. Food Additives & Contaminants 19, 562-567.
Kar, S., Sangem, P., Anusha, N., Senthilkumaran, B., 2021. Endocrine disruptors in teleosts: Evaluating environmental risks and biomarkers. Aquaculture and Fisheries 6, 1-26.
Karaca, A., Yilmaz, S., Kaya, E., Altun, S., 2021. The effect of lycopene on hepatotoxicity of aflatoxin B1 in rats. Archives of Physiology and Biochemistry 127, 429-436.
Kew, M.C., 2013. Aflatoxins as a cause of hepatocellular carcinoma. Journal of Gastrointestinal & Liver Diseases 22.
Khalil, A.A., Abou-Gabal, A.E., Abdellatef, A.A., Khalid, A.E., 2015. Protective role of probiotic lactic acid bacteria against dietary fumonisin B1-induced toxicity and DNA-fragmentation in sprague-dawley rats. Preparative Biochemistry and Biotechnology 45, 530-550.
Kumar, P., Mahato, D.K., Sharma, B., Borah, R., Haque, S., Mahmud, M.C., Shah, A.K., Rawal, D., Bora, H., Bui, S., 2020. Ochratoxins in food and feed: Occurrence and its impact on human health and management strategies. Toxicon 187, 151-162.
Li, J., Liu, M. 2019. The carcinogenicity of aflatoxin B1, In: Aflatoxin B1 occurrence, detection and toxicological effects. IntechOpen.
Limonciel, A., Jennings, P., 2014. A review of the evidence that ochratoxin A is an Nrf2 inhibitor: implications for nephrotoxicity and renal carcinogenicity. Toxins 6, 371-379.
Longobardi, C., Damiano, S., Andretta, E., Prisco, F., Russo, V., Pagnini, F., Florio, S., Ciarcia, R., 2021. Curcumin Modulates Nitrosative Stress, Inflammation and DNA Damage and Protects against Ochratoxin A-Induced Hepatotoxicity and Nephrotoxicity in Rats. Antioxidants 10, 1239.
Lu, X., Hu, B., Shao, L., Tian, Y., Jin, T., Jin, Y., Ji, S., Fan, X., 2013. Integrated analysis of transcriptomics and metabonomics profiles in aflatoxin B1-induced hepatotoxicity in rat. Food and chemical toxicology 55, 444-455.
Lumsangkul, C., Chiang, H.-I., Lo, N.-W., Fan, Y.-K., Ju, J.-C., 2019. Developmental toxicity of mycotoxin fumonisin b1 in animal embryogenesis: an overview. Toxins 11, 114.
Magouz, F., Abu-Ghanima, H., Zaineldin, A.I., Gewaily, M.S., Soliman, A., Amer, A.A., Moustafa, E.M., Younis, E.M., Abdel-Warith, A.-W.A., Davies, S.J., Van Doan, H., Tapingkae, W., Dawood, M.A.O., 2022. Dietary Bacillus subtilis relieved the growth retardation, hepatic failure, and antioxidative depression induced by ochratoxin A in Thinlip Mullet (Liza ramada). Aquaculture Reports 22, 100984.
Mansour, T., Omar, A., Soliman, K., Srour, T., Nour, A., 2015. The antagonistic effect of whey on ochratoxin a toxicity on the growth performance, feed utilization, liver and kidney functions of Nile tilapia (Oreochromis niloticus). Middle East J Appl Sci 5, 176-183.
Marasas, W., 2001. Discovery and occurrence of the fumonisins: a historical perspective. Environmental Health Perspectives 109, 239-243.
Marroquín-Cardona, A., Johnson, N., Phillips, T., Hayes, A., 2014. Mycotoxins in a changing global environment–a review. Food and Chemical Toxicology 69, 220-230.
Matejova, I., Svobodova, Z., Vakula, J., Mares, J., Modra, H., 2017. Impact of mycotoxins on aquaculture fish species: a review. Journal of the world aquaculture society 48, 186-200.
Michelin, E., Bedoya-Serna, C., Carrion, L., Levy-Pereira, N., Cury, F., Passarelli, D., Lima, C., Yasui, G., Sousa, R., Fernandes, A., 2021. Effects of dietary aflatoxin on biochemical parameters and histopathology of liver in Matrinxã (Brycon cephalus) and Pacu (Piaractus mesopotamicus) fish. World Mycotoxin Journal 14, 421-430.
Minervini, F., Fornelli, F., Flynn, K., 2004. Toxicity and apoptosis induced by the mycotoxins nivalenol, deoxynivalenol and fumonisin B1 in a human erythroleukemia cell line. Toxicology in Vitro 18, 21-28.
Modra, H., Sisperova, E., Blahova, J., Enevova, V., Fictum, P., Franc, A., Mares, J., Svobodova, Z., 2018. Elevated concentrations of T‐2 toxin cause oxidative stress in the rainbow trout (Oncorhynchus mykiss). Aquaculture Nutrition 24, 842-849.
Murad, A.F., Ahmed, S., Abead, S., 2015. Toxicity effect of aflatoxin B1 on reproductive system of albino male rats. Pakistan Journal of Biological Sciences 18, 107.
Neal, G., Eaton, D., Judah, D., Verma, A., 1998. Metabolism and toxicity of aflatoxins M1and B1in human derivedin VitroSystems. Toxicology and applied pharmacology 151, 152-158.
Pang, J., Zhou, Q., Sun, X., Li, L., Zhou, B., Zeng, F., Zhao, Y., Shen, W., Sun, Z., 2017. Effect of low-dose zearalenone exposure on reproductive capacity of male mice. Toxicology and Applied Pharmacology 333, 60-67.
Patriarca, A., Pinto, V.F., 2017. Prevalence of mycotoxins in foods and decontamination. Current Opinion in Food Science 14, 50-60.
Pestka, J.J., 2010a. Deoxynivalenol-induced proinflammatory gene expression: mechanisms and pathological sequelae. Toxins 2, 1300-1317.
Pestka, J.J., 2010b. Deoxynivalenol: mechanisms of action, human exposure, and toxicological relevance. Archives of toxicology 84, 663-679.
Pinton, P., Tsybulskyy, D., Lucioli, J., Laffitte, J., Callu, P., Lyazhri, F., Grosjean, F., Bracarense, A.P., Kolf Clauw, M., Oswald, I.P., 2012. Toxicity of deoxynivalenol and its acetylated derivatives on the intestine: differential effects on morphology, barrier function, tight junction proteins, and mitogen-activated protein kinases. Toxicological Sciences 130, 180-190.
Proctor, R.H., McCormick, S.P., Kim, H.-S., Cardoza, R.E., Stanley, A.M., Lindo, L., Kelly, A., Brown, D.W., Lee, T., Vaughan, M.M., 2018. Evolution of structural diversity of trichothecenes, a family of toxins produced by plant pathogenic and entomopathogenic fungi. PLoS pathogens 14, e1006946.
Qi, X., Yu, T., Zhu, L., Gao, J., He, X., Huang, K., Luo, Y., Xu, W., 2014. Ochratoxin A induces rat renal carcinogenicity with limited induction of oxidative stress responses. Toxicology and Applied Pharmacology 280, 543-549.
Rashidi, N., Khatibjoo, A., Taherpour, K., Akbari-Gharaei, M., Shirzadi, H., 2020. Effects of licorice extract, probiotic, toxin binder and poultry litter biochar on performance, immune function, blood indices and liver histopathology of broilers exposed to aflatoxin-B1. Poultry Science 99, 5896-5906.
Rogowska, A., Pomastowski, P., Sagandykova, G., Buszewski, B., 2019. Zearalenone and its metabolites: Effect on human health, metabolism and neutralisation methods. Toxicon 162, 46-56.
Rotimi, O.A., Rotimi, S.O., Duru, C.U., Ebebeinwe, O.J., Abiodun, A.O., Oyeniyi, B.O., Faduyile, F.A., 2017. Acute aflatoxin B1–Induced hepatotoxicity alters gene expression and disrupts lipid and lipoprotein metabolism in rats. Toxicology reports 4, 408-414.
Scott, P., 2012. Recent research on fumonisins: a review. Food additives & contaminants: part A 29, 242 248.
Sforza, S., Dall’Asta, C., Marchelli, R., 2006. Recent advances in mycotoxin determination in food and feed by hyphenated chromatographic techniques/mass spectrometry. Mass Spectrometry Reviews 25, 54-76.
Shi, D., Liao, S., Guo, S., Li, H., Yang, M., Tang, Z., 2015. Protective effects of selenium on aflatoxin B1 induced mitochondrial permeability transition, DNA damage, and histological alterations in duckling liver. Biological trace element research 163, 162-168.
Shuaib, F.M., Ehiri, J., Abdullahi, A., Williams, J.H., Jolly, P.E., 2010. Reproductive health effects of aflatoxins: a review of the literature. Reproductive Toxicology 29, 262-270.
Šišperová, E., Modrá, H., Ziková, A., Kloas, W., Blahová, J., Matejová, I., Živná, D., Svobodová, Z., 2015. The effect of mycotoxin deoxynivalenol (DON) on the oxidative stress markers in rainbow trout (Oncorhynchus mykiss, Walbaum 1792). Journal of Applied Ichthyology 31, 855-861.
Sobrova, P., Adam, V., Vasatkova, A., Beklova, M., Zeman, L., Kizek, R., 2010. Deoxynivalenol and its toxicity. Interdisciplinary toxicology 3, 94.
Sozmen, M., Devrim, A.K., Tunca, R., Bayezit, M., Dag, S., Essiz, D., 2014. Protective effects of silymarin on fumonisin B1-induced hepatotoxicity in mice. Journal of veterinary science 15, 51-60.
Stiborová, M., Arlt, V.M., Schmeiser, H.H., 2016. Balkan endemic nephropathy: an update on its aetiology. Archives of toxicology 90, 2595-2615.
Streit, E., Schatzmayr, G., Tassis, P., Tzika, E., Marin, D., Taranu, I., Tabuc, C., Nicolau, A., Aprodu, I., Puel, O., 2012. Current situation of mycotoxin contamination and co-occurrence in animal feed—Focus on Europe. Toxins 4, 788-809.
Su, Y., Sun, Y., Ju, D., Chang, S., Shi, B., Shan, A., 2018. The detoxification effect of vitamin C on zearalenone toxicity in piglets. Ecotoxicology and Environmental Safety 158, 284-292.
Supriya, C., Girish, B., Reddy, P.S., 2014. Aflatoxin B1-induced reproductive toxicity in male rats: possible mechanism of action. International journal of toxicology 33, 155-161.
Szabó, A., Fébel, H., Ali, O., Kovács, M., 2019. Fumonisin B1 induced compositional modifications of the renal and hepatic membrane lipids in rats–Dose and exposure time dependence. Food Additives & Contaminants: Part A 36, 1722-1739.
Szabó, A., Szabó-Fodor, J., Kachlek, M., Mézes, M., Balogh, K., Glávits, R., Ali, O., Zeebone, Y.Y., Kovács, M., 2018. Dose and exposure time-dependent renal and hepatic effects of intraperitoneally administered fumonisin B1 in rats. Toxins 10, 465.
Taheur, F.B., Fedhila, K., Chaieb, K., Kouidhi, B., Bakhrouf, A., Abrunhosa, L., 2017. Adsorption of aflatoxin B1, zearalenone and ochratoxin A by microorganisms isolated from Kefir grains. International journal of food microbiology 251, 1-7.
Taranu, I., Braicu, C., Marin, D.E., Pistol, G.C., Motiu, M., Balacescu, L., Neagoe, I.B., Burlacu, R., 2015. Exposure to zearalenone mycotoxin alters in vitro porcine intestinal epithelial cells by differential gene expression. Toxicology Letters 232, 310-325.
Tian, Y., Tan, Y., Liu, N., Liao, Y., Sun, C., Wang, S., Wu, A., 2016. Functional agents to biologically control deoxynivalenol contamination in cereal grains. Frontiers in microbiology 7, 395.
Uriah, N., Ibeh, I.N., Oluwafemi, F., 2001. A study on the impact of aflatoxin on human reproduction. African Journal of Reproductive Health, 106-110.
Valtchev, I., Koynarski, T., Sotirov, L., Nikolov, Y., Petkov, P., 2015. Effect of Aflatoxin B1 on Moulard Duck’s Natural Immunity. Pakistan Veterinary Journal 35.
Varga, J., Frisvad, J.C., Samson, R., 2011. Two new aflatoxin producing species, and an overview of Aspergillus section Flavi. Studies in mycology 69, 57-80.
Vendruscolo, C.P., Frias, N.C., De Carvalho, C., De Sá, L., Belli, C.B., Baccarin, R.Y.A., 2016. Leukoencephalomalacia outbreak in horses due to consumption of contaminated hay. Journal of veterinary internal medicine 30, 1879.
Vila-Donat, P., Marín, S., Sanchis, V., Ramos, A., 2018. A review of the mycotoxin adsorbing agents, with an emphasis on their multi-binding capacity, for animal feed decontamination. Food and chemical toxicology 114, 246-259.
Vipin, A., Rao, R., Kurrey, N.K., KA, A.A., Venkateswaran, G., 2017. Protective effects of phenolics rich extract of ginger against Aflatoxin B1-induced oxidative stress and hepatotoxicity. Biomedicine & pharmacotherapy 91, 415-424.
Virk, P., Al-Mukhaizeem, N.A.R., Morebah, S.H.B., Fouad, D., Elobeid, M., 2020. Protective effect of resveratrol against toxicity induced by the mycotoxin, zearalenone in a rat model. Food and Chemical Toxicology 146, 111840.
Voss, K., Smith, G., Haschek, W., 2007. Fumonisins: Toxicokinetics, mechanism of action and toxicity. Animal feed science and technology 137, 299-325.
Voss, K.A., Riley, R.T., 2013. Fumonisin toxicity and mechanism of action: Overview and current perspectives. Food Safety 1, 2013006-2013006. Wang, F., Shu, G., Peng, X., Fang, J., Chen, K., Cui, H.,
Chen, Z., Zuo, Z., Deng, J., Geng, Y., 2013. Protective effects of sodium selenite against aflatoxin B1-induced oxidative stress and apoptosis in broiler spleen. International journal of environmental research and public health 10, 2834-2844.
Wang, X., Wang, Y., Li, Y., Huang, M., Gao, Y., Xue, X., Zhang, H., Encarnação, P., Santos, G.A., Gonçalves, R.A., 2016. Response of yellow catfish (Pelteobagrus fulvidraco) to different dietary concentrations of aflatoxin B1 and evaluation of an aflatoxin binder in offsetting its negative effects. Ciencias marinas 42, 15 29.
Woźny, M., Dobosz, S., Hliwa, P., Gomułka, P., Król, J., Obremski, K., Blahova, J., Svobodova, Z., Michalik, O., Ocalewicz, K., 2020. Feed-borne exposure to zearalenone impairs reproduction of rainbow trout. Aquaculture 528, 735522.
Wu, J., Jing, L., Yuan, H., Peng, S.-q., 2011. T-2 toxin induces apoptosis in ovarian granulosa cells of rats through reactive oxygen species-mediated mitochondrial pathway. Toxicology letters 202, 168-177.
Wu, Q.-H., Wang, X., Yang, W., Nüssler, A.K., Xiong, L.-Y., Kuča, K., Dohnal, V., Zhang, X.-J., Yuan, Z.-H., 2014. Oxidative stress-mediated cytotoxicity and metabolism of T-2 toxin and deoxynivalenol in animals and humans: an update. Archives of toxicology 88, 1309-1326.
Yang, S., Wang, Y., Beier, R.C., Zhang, H., Ruyck, K.D., Sun, F., Cao, X., Shen, J., Zhang, S., Wang, Z., 2015. Simultaneous determination of type A and B trichothecenes and their main metabolites in food animal tissues by ultraperformance liquid chromatography coupled with triple-quadrupole mass spectrometry. Journal of agricultural and food chemistry 63, 8592-8600.
Yang, X., Lv, Y., Huang, K., Luo, Y., Xu, W., 2016. Zinc inhibits aflatoxin B1-induced cytotoxicity and genotoxicity in human hepatocytes (HepG2 cells). Food and Chemical Toxicology 92, 17-25.
Yu, S., Jia, B., Liu, N., Yu, D., Zhang, S., Wu, A., 2021. Fumonisin B1 triggers carcinogenesis via HDAC/PI3K/Akt signalling pathway in human esophageal epithelial cells. Science of The Total Environment 787, 147405.
Yuan, G., Wang, Y., Yuan, X., Zhang, T., Zhao, J., Huang, L., Peng, S., 2014. T-2 toxin induces developmental toxicity and apoptosis in zebrafish embryos. Journal of Environmental Sciences 26, 917-925.
Zahran, E., Elbahnaswy, S., Mamdouh, A.Z., El‐Matbouli, M., 2021. Xenosteroids in aquaculture with special consideration to Lake Manzala (Northern delta lake, Egypt): Types, sources and mechanism of action. Aquaculture Research 52, 5962-5977.
Zahran, E., Risha, E., Hamed, M., Ibrahim, T., Palić, D., 2020. Dietary mycotoxicosis prevention with modified zeolite (Clinoptilolite) feed additive in Nile tilapia (Oreochromis niloticus). Aquaculture 515.
Zain, M.E., 2011. Impact of mycotoxins on humans and animals. Journal of Saudi chemical society 15, 129 144.
Zhang, C., Chi, C., Liu, J., Ye, M., Zheng, X., Zhang, D., Liu, W., 2020. Protective effects of dietary arginine against oxidative damage and hepatopancreas immune responses induced by T-2 toxin in Chinese mitten crab (Eriocheir sinensis). Fish & Shellfish Immunology 104, 447-456.
Zhuang, Z., Yang, D., Huang, Y., Wang, S., 2013. Study on the apoptosis mechanism induced by T-2 toxin. PloS one 8, e83105.




 De hecho, se consideran un importante factor de riesgo, junto con el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), para el CHC
De hecho, se consideran un importante factor de riesgo, junto con el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), para el CHC  Prevención de micotoxicosis
Prevención de micotoxicosis