Prof. Naresh Magan y Dr. Ángel Medina
Grupo de Micología Aplicada, Medio Ambiente y Agroalimentación, Universidad de Cranfield, MK43 0AL, U.K.
Email: [email protected]
 Sin embargo, cuando examinamos los ingredientes que se utilizan, especialmente en Europa, una cantidad importante son rechazados en las fronteras debido a la presencia de micotoxinas, especialmente cuando proceden de regiones subtropicales y tropicales (RASFF, 2019).
Sin embargo, cuando examinamos los ingredientes que se utilizan, especialmente en Europa, una cantidad importante son rechazados en las fronteras debido a la presencia de micotoxinas, especialmente cuando proceden de regiones subtropicales y tropicales (RASFF, 2019).
 Abordaremos el uso de estos conservantes y sus posibles inconvenientes, especialmente cuando se utilizan concentraciones subóptimas que pueden exacerbar la contaminación por micotoxinas.
Abordaremos el uso de estos conservantes y sus posibles inconvenientes, especialmente cuando se utilizan concentraciones subóptimas que pueden exacerbar la contaminación por micotoxinas.
También ha habido mucho interés por encontrar conservantes alternativos para los alimentos/pienso basados en antioxidantes y extractos de plantas, especialmente aceites esenciales. Sin embargo, muchos de ellos no se clasifican como compuestos GRAS (del inglés, Generally Recognized As Safe) porque no se han completado los análisis toxicológicos necesarios, además de ser necesario incluir los análisis de coste-beneficio para evaluar su potencial de uso comercial. También se abordarán estos aspectos.
ÁCIDOS ALIFÁTICOS Y SUS SALES PARA CONTROLAR EL DETERIORO Y LOS MOHOS MICOTOXIGÉNICOS
El pienso para alimentación animal consiste en mezclas de ingredientes, incluyendo cereales, subproductos de cereales, torta de semillas de algodón, torta de cacahuete, extractos de soja, pulpa de palma, legumbres y otros aditivos, dependiendo de si el producto se destina al ganado vacuno, al cerdo o a la avicultura.
La producción de piensos peletizados da lugar a un producto alimenticio relativamente seco que puede almacenarse eficazmente a corto y medio plazo, siempre que no absorba humedad durante la fase de almacenamiento, debido a la mala gestión post-cosecha.
Esto puede ocurrir debido a la partición inadecuada de los diferentes tipos de productos básicos durante el transporte o el almacenamiento, ya que los ingredientes de los piensos pueden reabsorber la humedad. Esto ocurre especialmente en el caso de ingredientes higroscópicos, facilitando el su deterioro por crecimiento de hongos y, concretamente, de hongos micotoxigénicos que los contaminan con micotoxinas (Perreira et al., 2019).
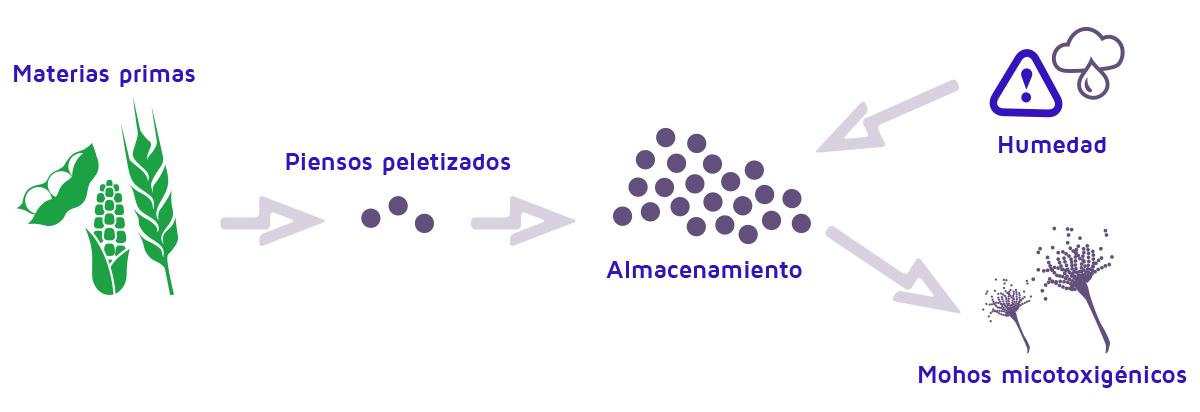
Económicamente, los mohos deteriorantes y la contaminación por micotoxinas son muy importantes.
En un estudio de 10 años de duración realizado en los Estados Unidos, se demostró que los ingredientes de los alimentos para animales y las muestras de forraje contenían cantidades significativas de micotoxinas. Por ejemplo:

Los forrajes, incluidos los concentrados, el grano de maíz, la harina de soja, la torta de semillas de algodón, el ensilado de maíz, el heno, y los ensilados de granos pequeños y de hierba han sido estudiados para detectar la presencia de micotoxinas.
Todos ellos han mostrado un aumento significativo en los últimos años en el porcentaje de muestras de alimento que están contaminados con diferentes micotoxinas, incluyendo las de Biomin, Alltech, Randox and Patent Co, entre otras (Biomin survey, 2019; Alltech survey, 2019; Randox survey, 2019, Patent Co 2019).
Los piensos no extrusionados, incluidos el forraje y los piensos mixtos, suelen tratarse con conservantes antimoho, generalmente a base de ácidos alifáticos individuales o mezclas, o sus sales. Esto puede reducir la probabilidad de que se inicie el deterioro por acción del moho y la contaminación por micotoxinas.
Sin embargo, la mayoría de las mezclas de conservantes que se utilizan comercialmente son fungistáticos, no fungicidas, por lo que no son letales para las esporas contaminantes de los mohos.
Zonas del alimento poco o nada tratados, aunque sean muy pequeñas, de unos pocos gramos, pueden proporcionar focos iniciales para el inicio de la germinación de esporas de los mohos deteriorantes/micotoxigénicos si el contenido de humedad del alimento es propicio para el crecimiento (Lord et al., 1981, 1983; Lacey et al., 1982).
Por lo tanto, es fundamental que, cuando se añadan conservantes, se logre una mezcla eficaz del conservante con el pienso para garantizar una cobertura del mismo con la concentración adecuada (efectiva) para minimizar las posibilidades de que se produzcan mohos deteriorantes/mohos micotoxigénicos y la contaminación con toxinas durante el almacenamiento a corto y medio plazo.
De hecho, elegantes estudios llevados a cabo por Lord et al. (1981) demostraron la importancia de la mezcla efectiva de los ácidos alifáticos o sus sales con el alimento para evitar focos de alimento infratratados o no tratados.
Sugirieron que puede iniciarse el deterioro del moho, así como la contaminación con aflatoxinas (AFs; carcinógenos de clase 1a), con otras micotoxinas como la ocratoxina A (OTA) o tricotecenos de tipo B, incluyendo DON y ZEN, y FUMs.
 Los estudios de diferentes mezclas de piensos para avicultura utilizadas como mezclas starter y finalizadores demostraron tener una diversidad de micobiota diferente según la estación y la forma en que se procesan las materias primas de los piensos.
Los estudios de diferentes mezclas de piensos para avicultura utilizadas como mezclas starter y finalizadores demostraron tener una diversidad de micobiota diferente según la estación y la forma en que se procesan las materias primas de los piensos.
A menudo, las especies de mohos deteriorantes predominantes pertenecían a los géneros Aspergillus, Penicillium y Fusarium, responsables de la contaminación por micotoxinas, especialmente en las regiones más cálidas del mundo, por ejemplo, el Asia sudoriental (Alam et al., 2010 a,b).
 En Asia, los piensos para avicultura son producidos en fábricas de piensos comerciales, así como por cooperativas locales. Los propietarios de las fábricas de piensos compran estos ingredientes a granel en la temporada de producción y los almacenan para su transformación en piensos durante todo el año.
En Asia, los piensos para avicultura son producidos en fábricas de piensos comerciales, así como por cooperativas locales. Los propietarios de las fábricas de piensos compran estos ingredientes a granel en la temporada de producción y los almacenan para su transformación en piensos durante todo el año.
Sin embargo, a menudo en las regiones climáticas tropicales y subtropicales, las materias primas cosechadas en los campos suelen tener un contenido de humedad relativamente alto, lo que las hace inseguras para el almacenamiento, incluso a corto plazo, sin deterioro por moho. Por lo tanto, sin un secado efectivo hasta una actividad de agua <0,70, las humedades intermedias permitirán el desarrollo de los mohos adaptados a ambientes secos, mencionados anteriormente (Ilangantileke, 1987; Sanchis, 2000; Figura 1).
Varias empresas comerciales venden formulaciones de conservantes a base de ácidos alifáticos, incluidos los ácidos fórmico, propiónico o sórbico, o sus mezclas.
A veces se prefieren sus sales porque tienen una volatilidad reducida y son más fáciles de usar.
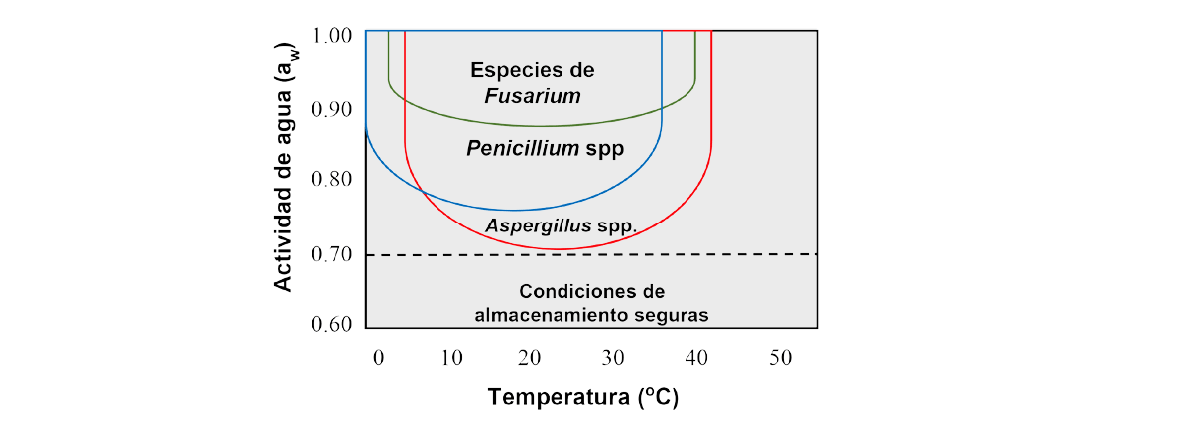
Figura 1. Perfiles diagramáticos delos límites de crecimiento/no crecimiento para los tres géneros micotoxigénicos clave en relación con los dos factores abióticos de interacción clave.
LA CONCENTRACIÓN ES CRÍTICA
 Por supuesto, los métodos de formulación son confidenciales para cada productor industrial. Sin embargo, el uso de la concentración correcta es fundamental para lograr un control eficaz del deterioro y los mohos micotoxigénicos.
Por supuesto, los métodos de formulación son confidenciales para cada productor industrial. Sin embargo, el uso de la concentración correcta es fundamental para lograr un control eficaz del deterioro y los mohos micotoxigénicos.
La Tabla 1 muestra las diferencias de concentración que pueden producirse al mezclar diferentes proporciones de ácidos alifáticos o sus sales y sus concentraciones reales.
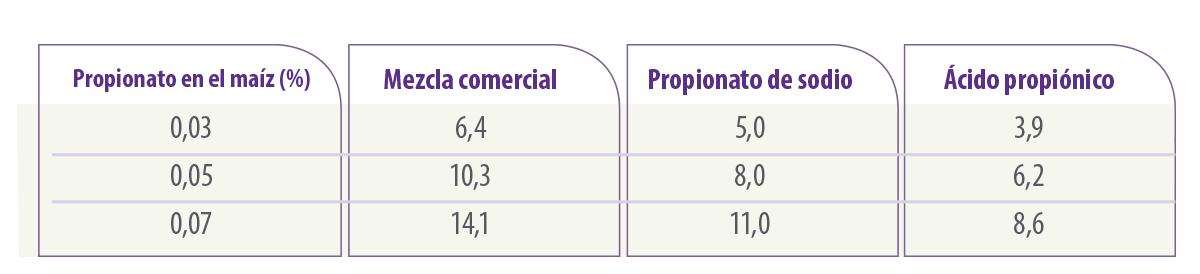
Tabla 1. Concentraciones de conservantes en soluciones madre (g en 100 ml de agua) (de Marin et al., 1999).
La Tabla 2 se compara el efecto de dos productos comerciales y el ácido propiónico sobre la Concentración Mínima Inhibitoria (CMI) necesaria para inhibir el crecimiento de tres importantes hongos micotoxigénicos en un medio a base de maíz (A. flavus, AFs; A. ochraceus/P. verrucosum, Ocratoxina A, OTA).
En maíz húmedo, el 0,25% fue necesario para lograr un control similar de A. flavus y A. parasiticus.

Tabla 2. Comparación de la concentración inhibitoria mínima (%) necesaria para el ácido propiónico y dos formulaciones comerciales de ácidos alifáticos in vitro en medios a base de maíz (Marin et al., 2000).
La Tabla 3 muestra el efecto del ácido sórbico en diferentes mohos deteriorantes, el rango de pH y concentración.
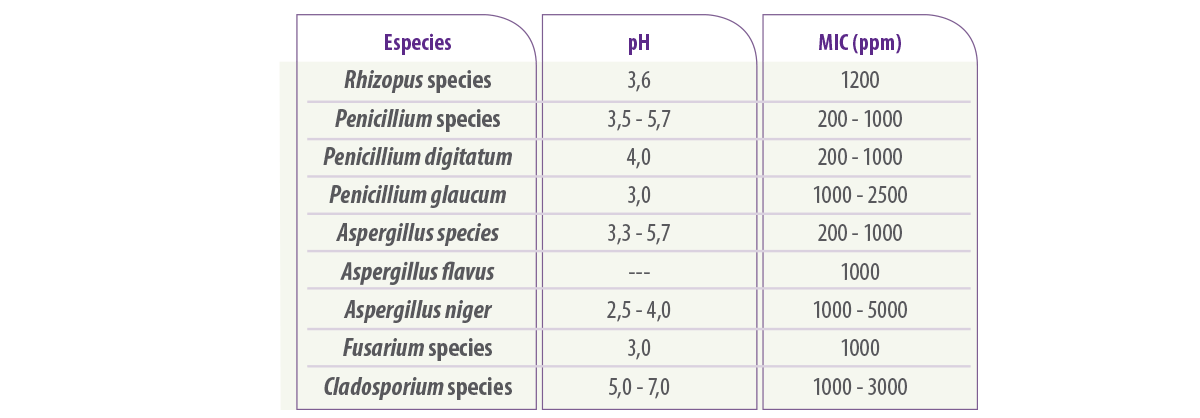
Tabla 3. Concentración mínima inhibitoria (CMI) de ácido sórbico frente a diferentes géneros de mohos deteriorantes o especies específicas (adaptado de Lück y Jager, 1997).
En la Figura 2 se compara el efecto de la utilización de mezclas de ácido propiónico y su sal de sodio en el crecimiento de las especies de la sección Liseola de Fusarium (F. verticillioides, F. proliferatum) responsables de la contaminación del maíz con FUM (Marin et al., 2000).
Esto muestra claramente que la proporción de la mezcla y, lo que es más importante, la actividad de agua del maíz afectó significativamente a la colonización del maíz por estas especies. En condiciones más húmedas no hubo prácticamente ningún control de F. verticillioides, aunque sí hubo algún control de F. proliferatum, pero sólo a 0,93-0,95 aw.
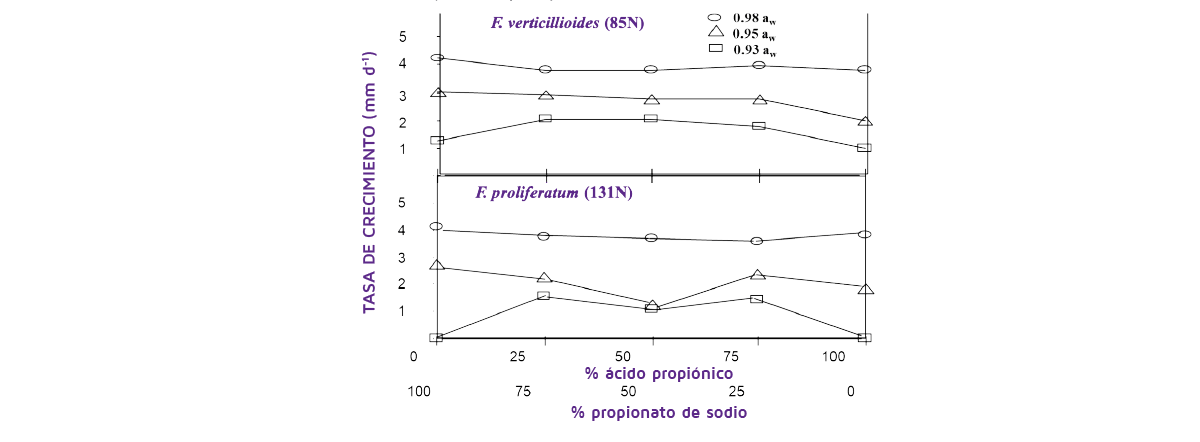
Figura 2. Efecto de diferentes proporciones de ácido propiónico/propionato de sodio en el grano de maíz a 25 o C sobre las tasas de crecimiento (Marin et al., 2000).
En la Tabla 4 se muestra el efecto de diferentes concentraciones de ácido propiónico y niveles de aw en la contaminación por fumonisina B1 del maíz contaminado naturalmente o la que se produce con un inóculo adicional de F. verticillioides después de 4 semanas de almacenamiento a 25ºC. Esto demuestra que, independientemente de las condiciones, sólo en la concentración más alta probada hubo una disminución significativa de la contaminación con esta micotoxina.
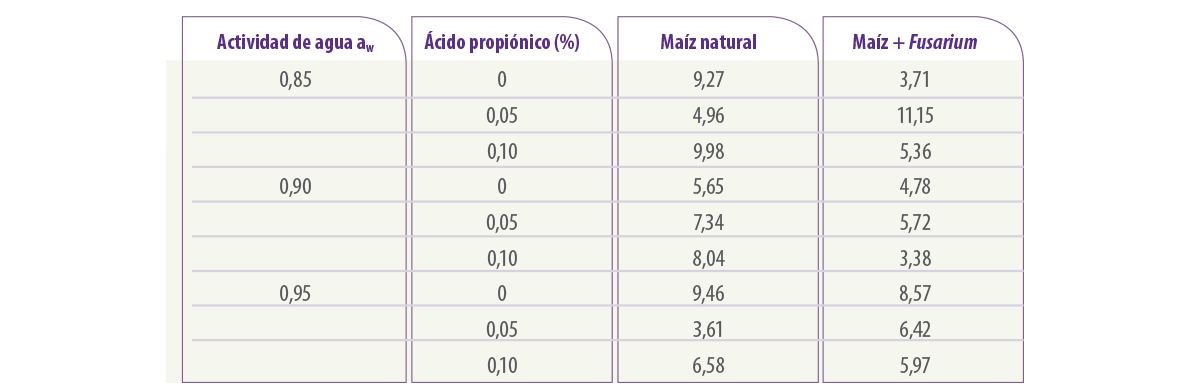
Tabla 4. Concentración de fumonisin B1 (µg/ml)en el maíz natural tratado con concentraciones de ácido propiónico y almacenado durante 4 semanas a 25oC. (de Marin et al., 2000). Estadísticamente, Fusarium, dosis de conservante e interacciones de aw: Sólo Fusarium x conservante fue estadísticamente significativo.
En algunos estudios se han examinado los cambios en las poblaciones de los distintos piensos de arranque y de engorde para avicultura en los países asiáticos (Alam et al., 2012). Esto demostró el predominio de los diferente micobiota presente en los distintos piensos y la relativa contaminación con micotoxinas, especialmente aflatoxinas en diferentes estaciones en los distintos piensos (Tabla 5).
Se demostró que el propionato de calcio en los piensos de arranque y engorde tiene importantes beneficios, ya que disminuye la población fúngica, especialmente la de A. flavus and A. parasiticus, y la contaminación con aflatoxinas (AFB1, AFB2, AFG1, AFG2; Alam et al., 2014a,b).
Es importante reducir la contaminación por aflatoxinas en los piensos para avicultura debido a su importante contribución a la aparición de aflatoxicosis, caracterizada por apatía, anorexia con una menor tasa de crecimiento, la utilización deficiente de los piensos, la pérdida en la ganancia de peso, la reducción del peso y la producción de huevos, el aumento de la susceptibilidad a las agresiones ambientales y microbianas y el aumento de la mortalidad (Leeson, 1995; Wild, 2000).
Así pues, las mezclas más eficaces de conservantes pueden proporcionar beneficios de efecto aditivo o sinérgico en el control relativo, especialmente de estas importantes micotoxinas, durante el almacenamiento a corto y medio plazo.
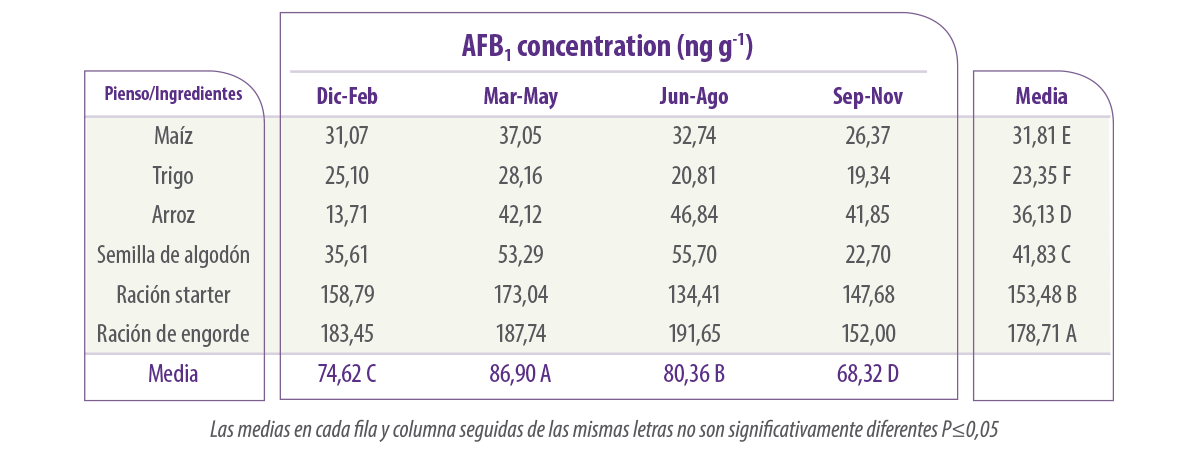
Tabla 5. Ocurrencia estacional de AFB1 (ng g-1) en alimentos para avicultura y sus ingredientes recogidos en Peshawar (de Alam et al., 2012).
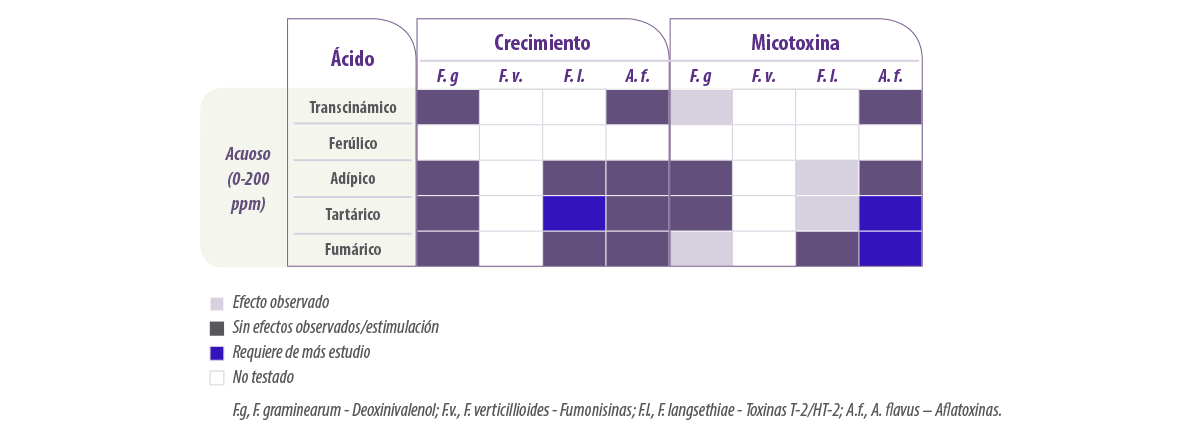
Se ha informado del uso de otros ácidos como el ácido adípico, ferúlico, fumárico, tartárico y transcinámico (extracto de plantas) contra los mohos micotoxigénicos para su aplicación en el pienso. Los efectos han sido variables, con una buena eficacia en algunos casos para controlar el crecimiento a >50-75%.
En la Tabla 6 se resume el efecto de los diferentes ácidos sobre el crecimiento y la producción de micotoxinas por diferentes mohos micotoxigénicos.
Tabla 6. Resumen de los efectos de diferentes ácidos en la forma acuosa o etanólica sobre el crecimiento y la producción de micotoxinas por diferentes especies de hongos (adaptado de Mylona, 2013).
En estudios anteriores también se han examinado ácidos alifáticos de diferentes longitudes de cadena para el control de los mohos deteriorantes.
⇰ Estudios anteriores con forraje húmedo han demostrado que la longitud de la cadena del ácido alifático puede influir en el control relativo de los mohos deteriorantes en los piensos como Paecilomyces variotii y el grupo Aspergillus glaucus (= especies Eurotium). Así pues, los ácidos grasos de una longitud de cadena de hasta C9-C10 fueron muy eficaces para controlar los mohos deteriorantes.
Sin embargo, la actividad antimoho disminuyó posteriormente al aumentar la longitud de la cadena con soluciones de ácido dodecanoico (C12) que fueron totalmente incapaces de controlar el crecimiento.
⇰ Estudios cebada húmeda (22, 28% HR) con dosis comerciales recomendadas de ácido propiónico mostraron que durante un período de 6 meses se controló la contaminación por A. flavus y AFs. Sin embargo, después de 4-6 meses el tratamiento fue menos eficaz frente a P. verrucosum, resultando en un aumento de la contaminación por OTA (Skudamore et al., 2004).
Así, mientras que una especie micotoxigénica fue controlada, otra fue más resistente y aumentó el riesgo de contaminación por OTA durante el almacenamiento a mediano plazo, especialmente en la cebada con un 22% de humedad.
Los estudios también han sugerido que las concentraciones intermedias de esos conservantes pueden dar lugar a una estimulación de la producción de micotoxinas.
- ⇰ Arroyo et al. (2000) mostraron que la producción de OTA por P. verrucosum fue estimulada por la reducción decimal de las dosis recomendadas de propionato de calcio o sorbato de potasio.
- ⇰ También se ha demostrado que las concentraciones intermedias de ácido propiónico estimulan la producción de AF por A. flavus (Al Hilli and Smith, 1979).
USO DE ANTIOXIDANTES, EXTRACTOS DE PLANTAS Y BIOCONSERVANTES
Ha habido un gran interés en el uso de compuestos alternativos, especialmente antioxidantes, extractos de plantas (tanto aceites esenciales como sus componentes volátiles) e inóculos bioconservantes para controlar el deterioro por mohos de los ingredientes individuales o los piensos mixtos para aves, ganado y cerdos.
Otros derivados fenólicos antioxidantes han sido examinados por su posible efecto antimicrobiano. El butilhidroxitolueno (BHT), el butilhidroxianisol (BHA), el galato de propilo (PG), el 2-terbutil hidroquinona (TBHQ) y los propilparabenos son algunos de ellos.
Por el contrario, mientras que muchos aceites esenciales crudos (AECs) o sus componentes (por ejemplo, eugenol, timol, cinamaldehído, vainillina, carvacrol, linalool) han sido examinados para controlar el deterioro y los mohos micotoxigénicos para su aplicación en piensos, muchos de ellos no han sido sometidos a las pruebas toxicológicas necesarias para que se apruebe su uso como antimicrobianos.
Los bioconservantes se han vuelto más interesantes en los últimos años, ya que muchos países, especialmente la Unión Europea, han prohibido una serie de grupos químicos para la protección de los cultivos debido a preocupaciones de seguridad y ambientales.
Esto ha sido un impulsor para el desarrollo de estrategias de biocontrol como parte de un enfoque de CIP (Control Integrado de Plagas).
 El uso de inóculos bioconservantes (especialmente las levaduras) son, por lo tanto, alternativas atractivas para tratar de preservar los piensos mixtos húmedos a base de cereales.
El uso de inóculos bioconservantes (especialmente las levaduras) son, por lo tanto, alternativas atractivas para tratar de preservar los piensos mixtos húmedos a base de cereales.ANTIOXIDANTES
PARABENOS
Originalmente, los propilparabenos, ésteres del ácido 4-hidroxibenzoico (PHB), fueron sintetizados como un posible sustituto de los conservantes existentes, como los ácidos salicílico y benzoico, eficaces sólo en el rango de pH muy ácido.
Aunque Lück and Jager (1997) afirmaron que una de las características más importantes de los parabenos, junto con una acción antimicrobiana mucho mayor que la de los fenoles y los ácidos orgánicos, es su actividad independiente del pH, algunos estudios sugieren una ligera influencia del pH en su actividad (Thomson et al., 1993).
Debido a su alto valor pKa (8,5), los parabenos son conservantes químicos efectivos en un rango más amplio de pH (3-8), estando la actividad antimicrobiana de los parabenos está relacionada con la longitud del grupo éster de la molécula.
Como aditivos, los parabenos se han aplicado ampliamente como soluciones alcalinas o como soluciones de etanol o propilenglicol en una serie de productos alimenticios, incluidas las verduras encurtidas (Belitz and Grosch, 1999). Sin embargo, pocos estudios han examinado sus posibles aplicaciones en los piensos.
Kubo y otros (2001) compararon la actividad antifúngica de tres galatos, el propilo (C3), el octilo (C8) y el dodecil (C12) y descubrieron que sólo el galato de octilo (OG) era el compuesto activo contra cuatro géneros de hongos diferentes con un CMI de 25 ppm.
Sin embargo, en esos resultados no se tuvieron en cuenta las condiciones ambientales, especialmente la aw y la temperatura, que han demostrado tener un impacto de eficacia.
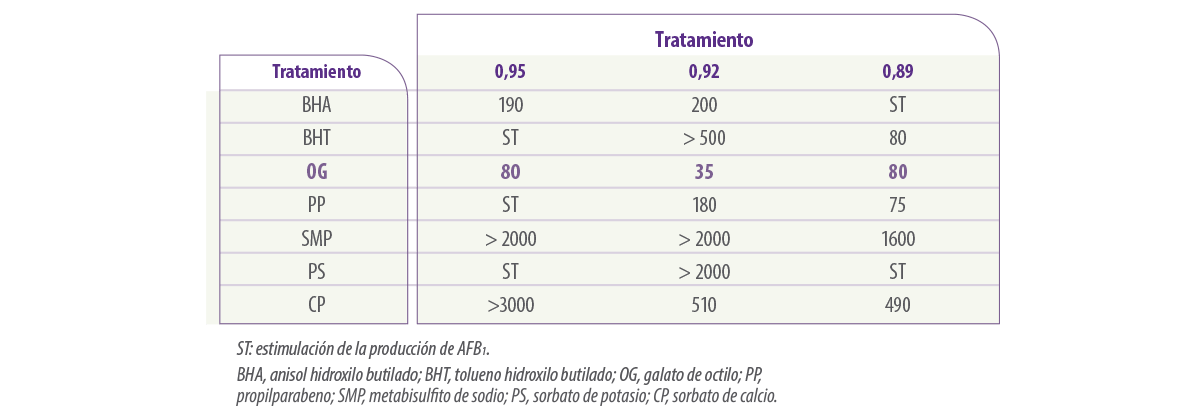
La Tabla 7 muestra estudios más recientes sobre la comparación de la eficacia de los OG y otros antioxidantes, así como las sales de los ácidos alifáticos y las concentraciones de ED50 necesarias para inhibir la producción de AFB1 por A. flavus.
Tabla 7. Dosis efectiva para el control del 50% (valores ED50, ppm) de antioxidantes y comparación con los ácidos alifáticos para la inhibición de la producción de AFB1 por A. flavus cuando se cultiva en diferentes condiciones de disponibilidad de agua a 25°C durante 10 días (Sultan, 2011).
Se realizaron estudios posteriores tratando los cacahuetes almacenados con diferentes concentraciones de OG y examinando el efecto sobre los cambios en las poblaciones temporales de A. flavus (UFC/g de cacahuetes) durante períodos de almacenamiento de 14 días a 25ºC (Figura 3).
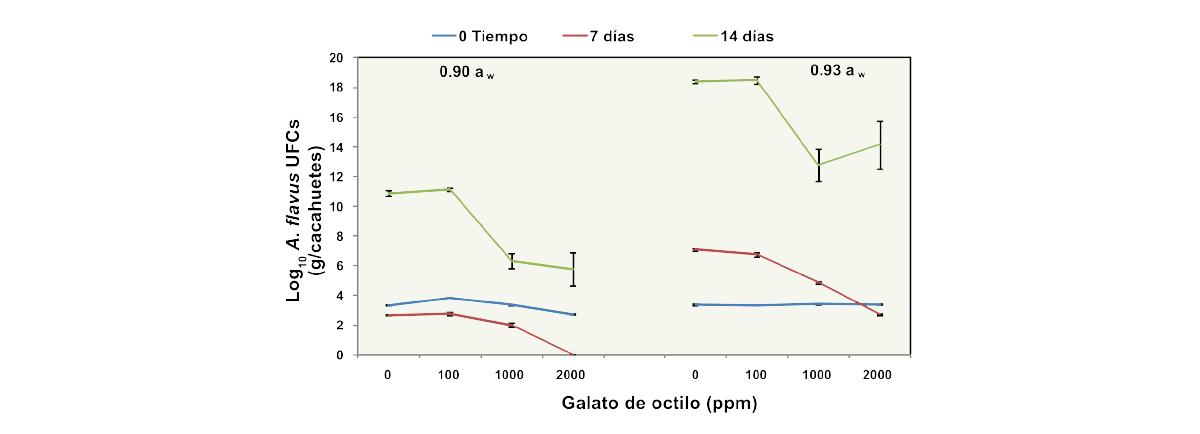
Figura 3. Efecto temporal de diferentes concentraciones de galato de octilo (OG, ppm) en poblaciones de A. flavus aisladas durante 14 días en cacahuetes almacenados a 25°C. Las barras indican el error estándar de las medias (de Sultan, 2011).
GALATOS
Las poblaciones aumentaron considerablemente, especialmente entre los 7 y 14 días de almacenamiento, lo que sugiere que la aplicación in situ no fue tan eficaz como en los estudios in vitro en medios a base de cacahuetes.
Estadísticamente, los tratamientos únicos, OG x Tiempo, aw x Interacciones de tiempo fueron todos significativos. Sin embargo, no hubo ningún efecto de las interacciones de OG x aw y OG x Tiempo x aw.
El tiempo de almacenamiento fue el principal factor importante, seguido de las condiciones de aw durante el almacenamiento.
Posteriormente, se analizaron los niveles de contaminación de los cacahuetes con AFB1.
- ⇰ Todos los factores (OG, tiempo, aw y sus interacciones) influyeron significativamente en la producción de toxinas, excepto la interacción OG x aw (P< 0.05).
- ⇰ El tiempo de almacenamiento fue el principal fac tor significativo, seguido de la aw inicial de los cacahuetes que entraban en el almacén. (Sultan, 2011).
- ⇰ Las poblaciones finales de A. flavus y los niveles de contaminación con AFB1 fueron significativamente más altos después de 14 días de almacenamiento, lo que indica que incluso con estas concentraciones de este antioxidante, la eficacia no era lo suficientemente buena en relación con los límites legislativos.
Las mezclas de compuestos pueden ser una forma de avanzar, siempre que puedan proporcionar un efecto sinérgico en lugar de sólo un efecto aditivo en términos de control de mohos deteriorantes o de la producción de toxinas en los piensos, especialmente en las mezclas de cereales, harina de semillas de algodón, legumbres y otros aditivos.
ACEITES ESENCIALES
Existe un importante volumen de trabajo sobre la eficacia de los aceites esenciales de plantas (AECs) o los compuestos extraídos de mezclas de AECs de plantas.
Recientemente, la eficacia de los AECs en relación con el control de los extractos de crudo, así como de los componentes purificados de los AECs, fue examinada por Prakash et al. (2015a,b).
Sin embargo, si bien se examinó su función de control de los mohos deteriorantes y la producción de micotoxinas en diferentes cadenas agroalimentarias, no se dio prioridad a su potencial de uso en los piensos.

La Figure 4 se muestra un ejemplo en el que se examinaron 25 AECs para determinar su eficacia y el control del P. verrucosum, responsable de la contaminación por OTA. Esto demostró claramente que sólo unos pocos tenían una eficacia significativa en el control del crecimiento de este moho micotoxigénico.
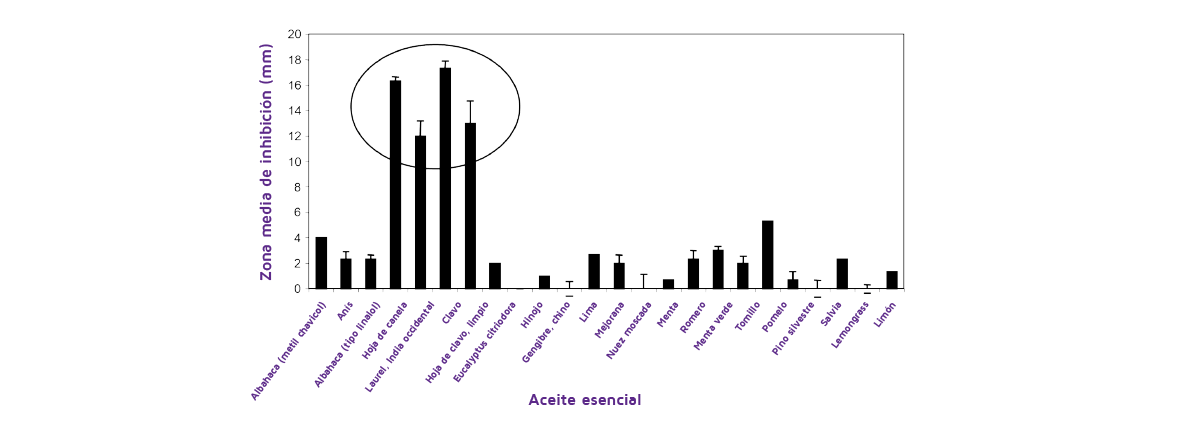
Figura 4. El efecto de 25 diferentes AECs diluidos 1:10 después de 48 horas a 25ºC sobre las zonas de inhibición frente al P. verrucosum (OTA11; productor de ocratoxina A) en un medio a base de trigo a 25ºC. Las barras indican SEM. El círculo indica los mejores tratamientos (de Cairns et al., 2003).
La Figura 5 muestra el ejemplo de las concentraciones de aceite de canela en el control relativo del crecimiento de una serie de hongos deteriorantes y micotoxigénicos. Esto muestra que sólo concentraciones más altas serán eficaces para los valores de control completo (CMI) para un rango de estos hongos.
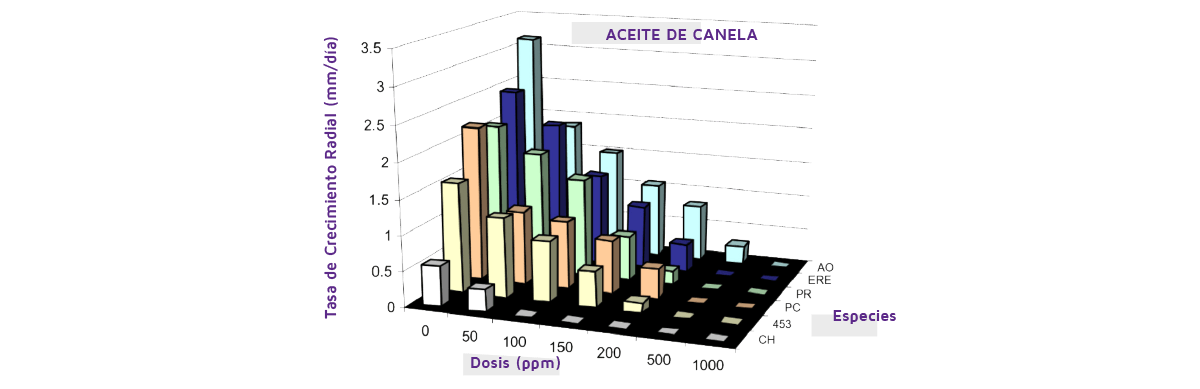
Figure 5. Efecto del aceite de canela a diferentes concentraciones sobre el crecimiento de seis especies diferentes deteriorantes y micotoxigénicas a 0,97 de actividad en el agua y pH 4,5 a 25ºC en un medio a base de cereales. CH, Cladosporium herbarum; 453; P. verrucosum strain 453); PC, Penicillium corylophilum; PR, Penicillium roqueforti; ERE, Eurotium repens (=Aspergillus glaucus); AO, Aspergillus ochraceus (=A. westerdijkiae). (De Arroyo, 2000).
En estudios posteriores más detallados se ha examinado la comparación de los AECs y, en algunos casos, de los antioxidantes para el control de micotoxinas específicas para las que existen límites legislativos. La Figura 6 muestra el efecto de 200 ppm de diferentes AECs y antioxidantes en el control del DON en el grano de trigo húmedo almacenado y naturalmente contaminado inoculado con F. culmorum. Esto muestra que hubo una buena eficacia a 0,93 y 0,95 aw. Sin embargo, a 0,97 aw la contaminación por DON no pudo ser controlada.
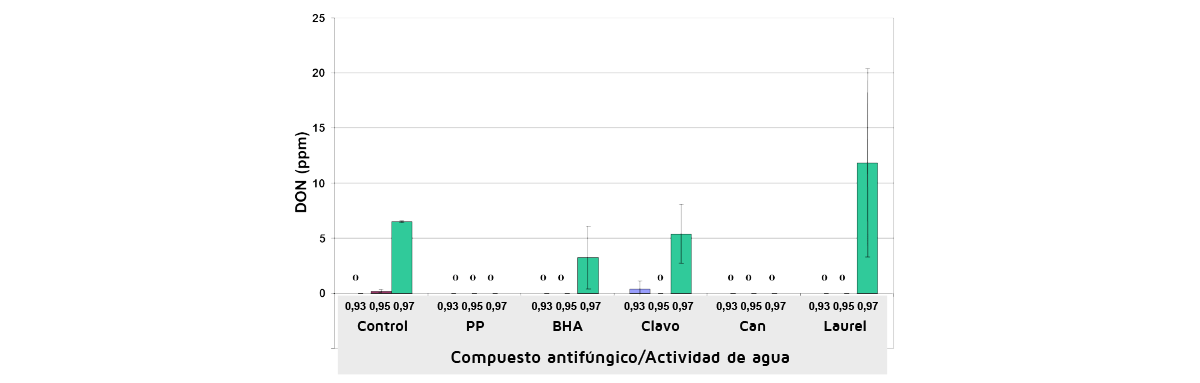
Figura 6. Ejemplos del efecto de diferentes aceites esenciales a 200 ppm, y su comparación con dos antioxidantes, sobre el control de la producción de deoxinivalenol por Fusarium culmorum en trigo almacenado naturalmente contaminado a diferentes niveles de actividad del agua durante 30 días a 25ºC.
PP, propilparabeno; Clavo, aceite esencial de clavo; Can, aceite esencial de canela; BHA, Hidroxibutilanisol; Laurel, aceite esencial de hoja de laurel. (Hope, Aldred y Magan, datos inéditos).
⇰ Los estudios in vitro demostraron que 200 ppm de PTS o PTSO redujeron el crecimiento de hongos en un 50-100% y la producción de micotoxinas en >90%, dependiendo de la especie, las condiciones de micotoxinas y la aw del trigo, la avena y el maíz molidos, respectivamente. El PTS fue generalmente más efectivo que el PTSO.
⇰ Sin embargo, los estudios in situ revelaron que:
- ⇰ DON y ZEN se redujeron un 50% con 80 ppm PTSO.
- ⇰ 100 ppm de PTS redujeron la producción de DON y ZEN en el trigo almacenado a 0,93 aw durante 20 días, aunque el nivel de contaminación seguía estando por encima de los límites legales.
⇰ Se encontraron efectos contrapuestos en cuanto a la contaminación de avena con toxina T-2/HT-2, dependiendo de la aw, with PTS stimulating production under marginal conditions (0.93 aw), but at 0.95 aw effective control was achieved with 100 ppm.
⇰ El tratamiento del maíz almacenado inoculado con F. verticillioides dio lugar a una estimulación de la producción total de fumonisinas en la mayoría de los tratamientos.
BIOPRESERVATIVOS
El enfoque aquí es añadir los inóculos a los cereales húmedos o a los piensos luego sellarlos para permitir la colonización y la conservación mediante la de compuestos antimicrobianos producidos naturalmente, incluidas las (BAL), y la colonización de los piensos por inóculos (por ejemplo, Pichia (Olstorpe et al., 2011).
PICHIA ANOMALA
Se ha llevado a cabo una cantidad significativa de estudios sobre los cereales húmedos para alimentación animal utilizando levaduras.
Por ejemplo, P. anomala se desarrolló como inóculo para la conservación del trigo y la cebada húmedos para la alimentación del ganado. Se formuló la levadura y se examinó el efecto de diferentes formulaciones tanto para el control del deterioro como para el de las micotoxinas (Druverfors et al., 2002; Mokiou y Magan, 2008).
La Figura 7 muestra el efecto de diferentes formulaciones de P. anomala sobre el control de la producción de ocratoxina A por parte de P. verrucosum almacenada durante 30 días (Mokiou y Magan, 2008).
Figura 7. Efecto de las formulaciones de bioconservantes a base de P. anomala sobre la contaminación con ocratoxina A del grano de trigo húmedo almacenado (0,93 aw) coinoculado con Penicillium verrucosum durante 30 días y 25ºC.
A: células de levaduras bioconservantes no modificadas; B: modificadas con prolina; C: prolina+ harina de semillas de algodón+ leche desnatada en agua; D: igual que C más soluciones isotónicas (de Mokiou y Magan, 2008).
Posteriormente, se realizaron estudios piloto a más largo plazo en silos de almacenamiento a con la inoculación de células frescas de P. anomala, la mejor formulación identificada.
La Figura 8 muestra los cambios a largo plazo en las células frescas, las células formuladas y la de P. roqueforti, que pueden crecer en condiciones microaerófilas. El período clave para el control se logró durante 8-9 meses pero posteriormente el inóculo fue menos efectivo.
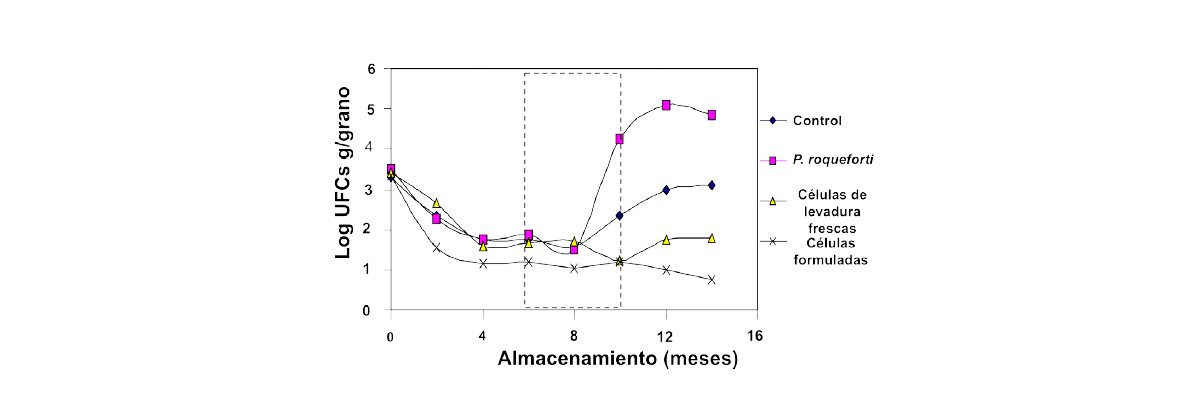
Figura 8. Estudio piloto con células de Pichia anomala formuladas y frescas durante un período de 15 meses de almacenamiento en el trigo húmedo para controlar los mohos deteriorantes, especialmente el Penicillium roqueforti (de Druverfors, Mokiou, Magan y Schnurer, datos no publicados).
CONCLUSIONES
⇰ Independientemente de los conservantes que se utilicen, es fundamental que se conserve el valor nutritivo del pienso final, ya sea a base de cereales, piensos mixtos o piensos peletizados extruidos, para garantizar el mantenimiento del valor nutritivo y las tasas de crecimiento animal necesarias.
⇰ El uso de las mezclas existentes o de éstas con conservantes naturales alternativos puede ser la principal área de desarrollo en el futuro.
Sin embargo, esto debe hacerse con la condición de que se pueda lograr una cobertura efectiva del tipo de alimento tratado al nivel recomendado necesario.
⇰ Además, algunas de las mezclas de conservantes no han demostrado ser suficientemente efectivas, especialmente en el caso de piensos mixtos a base de cereales, para controlar los mohos deteriorantes y micotoxigénicos.
⇰ Dado que el impacto de los factores abióticos relacionados con el clima son cada vez más importantes, el efecto sobre la microbiota residente de los productos básicos utilizados para fabricar diferentes alimentos podría cambiar significativamente.
⇰ Es posible que también haya que modificar los sistemas de conservación de los alimentos para animales, ya que las poblaciones de hongos dominantes podrían cambiar y las mezclas de micotoxinas producidas también podrían hacerlo (Medina et al., 2017).
Es necesario comparar los análisis de coste-beneficio relativos del uso de los AECs, antioxidantes solos o con ácidos alifáticos o sus sales como mezclas, para que su aplicación en la industria de los piensos tenga éxito.
Por ejemplo, los estudios de Aldred y otros (2008) compararon una serie de AECs y antioxidantes para controlar a P. verrucosum y la producción de OTA en trigo almacenado en diferentes condiciones. Se encontró que el resveratrol era más efectivo que otros.
Sin embargo, los costes fueron prohibitivos para el uso de esos compuestos en comparación con los ácidos alifáticos, que son económicamente más rentables, incluso a las dosis de aplicación y la mezcla y cobertura efectivas necesarias para su eficacia.
REFERENCIAS
Alam, S., Shah, H.U., Khan, H. & Magan, N. (2012). The effect of substrate, season and agroecological zone on mycoflora and aflatoxin contamination of poultry feed from Khyber Pakhtunkhwa, Pakistan. Mycopathologia 174, 341-349.
Alam, S., Shah, H.U., Afzal, M. & Magan, N. (2014) Influence of calcium propionate, water activity and storage time on mould incidence and aflatoxins production in broiler starter ration. Animal Food Science and Technology 188, 137-144.
Alam, S., Shah, H.U., Khan, N.A., Zeb, A., Shah, A.S. & Magan, N. (2014). Water availability and calcium propionate affect fungal populations and aflatoxins production in broiler finisher feed during storage. Food Additives and Contaminants Part A 31, 1896-1903.
Aldred, D; Cairns-Fuller, V. & Magan, N. (2008). Environmental factors affect e!cacy of some essential oils and resveratrol to control growth and ochratoxin A production by Penicillium verrucosum and A. westerdijkiae on wheat grain. Journal of Stored Product Research 44, 341-346.
Arroyo (2003) Natural antifungal systems for prevention of mould spoilage in bakery products. PhD Thesis, Institute of BioScience and Technology. Cranfield University, Cranfield. Beds. MK43 0AL, U.K.
Belitz, H.D. & Grosch W. (1999). Food Chemistry. Springer, Berlin., Germany
Cairns, R. & Magan, N. (2003). Impact of essential oils on growth and ochratoxin A production by Penicillium verrucosum and Aspergillus ochraceus on a wheat-based substrate. In Advances in Stored Product Protection. Eds. P.Credland, D.M. Armitage, C.H. Bell, P.M. Cogan. Cabi International, pp. 479-485.
Druvefors, U., Jonsson, N., Boysen, M.E. & Schnurer, J. (2002). Efficacy of the biocontrol yeast Pichia anomala during long-term storage of moist feed grain under different oxygen and carbon dioxide regimens. FEMS Yeast Research 2, 389-394
Kubo, 1., Xiao, P. and Fujita, K. (2001). Anti-fungal activity of octyl gallate: structural criteria and mode of action. Bioorganic Medical Chemical Letters 11, 347-350.
Lord, K.A., Gayley, G.R. and Lacey, J. (1981a). Laboratory application of preservatives to hay and the effects of irregular distribution on mould development. Animal Feed Science and Technology 6, 73-82.
Lord, K.A., Lacey, J., Cayley, G.R. and Manlove, R. (1981b). Fatty acids as substrates and inhibitors of fungi from propionic acid treated hay. Transactions of the British Mycological Society 77, 41-45.
Lacey, J., Lord, K.A., Cayley, G.R., Holden, M.R. and Sneath, R. W. (1983). Problems of testing novel chemicals for the preservation of damp hay. Animal Feed Science and Technology 8, 283-301.
Liick, E. & Jager, M. (1997). Antimicrobial food additives, Characteristics, Uses and Effects. Spinger, Berlin & Barcelona.
Magan, N. & Lacey, J. (1986a). Water relations and metabolism of propionate in two yeasts from hay. Journal of Applied Bacteriology 60, 169-173.
Magan, N. & Lacey, N. (1986b). The effects of two ammonium propionate formulations on growth in vitro of Aspergillus species isolated from hay. Journal of Applied Bacteriology 60, 221-225.
Marin, S., Sanchis, V., Ramos, A.J. & Magan, N. (1999). Control of growth and fumonisin B1 production by F. moniliforme and F. proliferatum isolates in maize grain with propionate formulations. Food Additives and Contaminants 16, 555-563.
Marin, S., Magan, N., Abellana, M., Canela, R., Ramos, A.J. & Sanchis, V. (2000). Selective effect of propionates on maize mycoflora and impact on fumonisin B1 accumulation. Journal of Stored Product Research 36, 203-214.
Medina, A., Akbar, A., Baazeem, A., Rodriguez, A. & Magan, N. (2017). Climate change, food security and mycotoxins: do we know enough? Fungal Biology Reviews 31, 143-154.
Mutasa, E.S. & Magan, N. (1990). Utilization of potassium sorbate by tobacco spoilage fungi.
Mycological Research 94, 965-970.
Mokiou, S. & Magan, N. (2008). Physiological manipulation and formulation of the 379 biocontrol yeast Pichia anomala for control of Penicillium verrucosum and 380 ochratoxin contamination of moist grain. Biocontrol Science and Technology 18, 1063-1073.
Mylona, K. (2013). Fusarium species in grains: dry matter losses, mycotoxin contamination and control strategies using ozone and chemical compounds. PhD thesis, Applied Mycology Group, Cranfield University, Cranfield. Bads. MK43 0AL, U.K.
Mylona, K., Garcia-Cela, E., Sulyok, M., Medina, A. & Magan, N. (2019). Effects of two garlic extracts [Propyl propane thiosulfonate (PTS) and Propyl propane thiosulfinate (PTSO)] on growth and mycotoxin production by Fusarium species in vitro and in stored cereals. Toxins 11, 495. Doi:10.3390/toxins11090495.
Olstorpe, M., Jacobsen, K., Passoth, V. & Schnurer, J. (2011). Controlling mould growth and mycotoxins in animal feed. In Protective Cultures, Antimicrobial Metabolites and Bacteriophages for Food and Beverage Biopreservation. Edt. C. Lacroix; Chapter 9, pp. 225-239. Woodhead Publishing Series in Food Science, Technology and Nutrition
Prakash, B., Mishra, P.K., Kedia, A., Dwivedi, A.K. & Dubey, N.K. (2015a). Efficacy of some essential oil components as food preservatives against food contaminating moulds, aflatoxin B1 production and free radicle generation. Journal of Food Quality, 38, 231-239.
Prakash, B., Kedia, A., Mishra, P.K., & Dubey, N.K. (2015b). Plant essential oils as food preservatives to control moulds, mycotoxin contamination and oxidative deterioration of agrifood commodities: potentials and challenges. Food Control 47, 381-391.
Pereira, C.S., Cunha, S.C. & Fernandes, J.O. (2019). Prevalent Mycotoxins in Animal Feed: Occurrence and Analytical Methods. Toxins 11, 290; doi:10.3390/toxins11050290
Skudamore, K., Banks, J.N., Rizvi, R. & Jennings, P. (2004). Formation of ochratoxin A and aflatoxins following the use of propionic acid as a grain preservative for storing damp barley. Mycotoxin Research 20, 68-79.
Sultan, Y. (2011). Biodiversity of mycotoxigenic Aspergillus species in Egyptian peanuts and strategies for minimizing aflatoxin contamination. PhD Thesis, Applied Mycology Group, Cranfield University, Cranfield, Beds. MK43 0AL, U.K.
Thomson, D.P.; Metevia, L. & Vessel, T. (1993). Influence of pH alone and in combination with phenolic antioxidants on growth and germination of mycotoxigenic species of Fusarium and Penicillium. Journal of Food Protection, 56, 134-138.




 Prevención de micotoxicosis
Prevención de micotoxicosis