Prof. Adjunto Panagiotis Tassis
Profesor Adjunto de Medicina y Reproducción Porcina, Clínica de Animales de Granja, Facultad de Medicina Veterinaria, Universidad Aristóteles de Tesalónica, Grecia
La amenaza de las micotoxinas en los granos en todo el mundo
Las micotoxinas son metabolitos secundarios producidos por hongos (géneros Aspergillus, Penicillium, Fusarium, Alternaria y Claviceps) que pueden encontrarse en los granos (por ejemplo, maíz, trigo, cebada) en todo el mundo.
 Estudios recientes han sugerido que hasta el 80% de los cultivos de alimentos y piensos están contaminados con micotoxinas a nivel mundial (ocurrencia por encima de los niveles detectables hasta el 60-80%), mientras que la co-contaminación de los granos con múltiples micotoxinas es un hallazgo común3.
Estudios recientes han sugerido que hasta el 80% de los cultivos de alimentos y piensos están contaminados con micotoxinas a nivel mundial (ocurrencia por encima de los niveles detectables hasta el 60-80%), mientras que la co-contaminación de los granos con múltiples micotoxinas es un hallazgo común3.
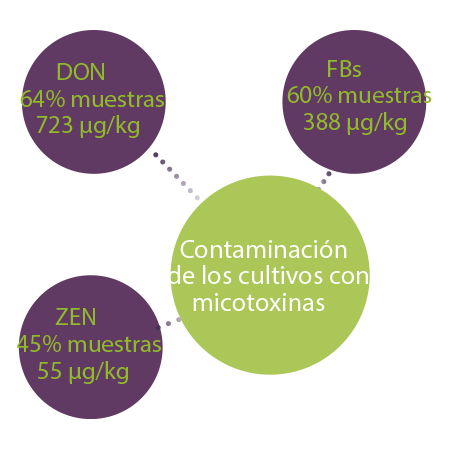
Un estudio de 10 años con muestras de 100 países reveló que el DON, la FB y la ZEN eran las micotoxinas más prevalentes y se detectaron en el 64%, 60% y 45% de todas las muestras, respectivamente. Las concentraciones medias fueron de 723 μg/kg, 388 μg/kg y 55 μg/kg para FBs, DON y ZEN, respectivamente1.
Los cerdos y las aves de corral son muy susceptibles y sensibles a los efectos de las micotoxinas4.
Los efectos de las micotoxinas en los cerdos son múltiples y dependen de5:
- ⇰ El tipo de micotoxina
- ⇰ El nivel y la duración de la exposición
- ⇰ La edad del animal

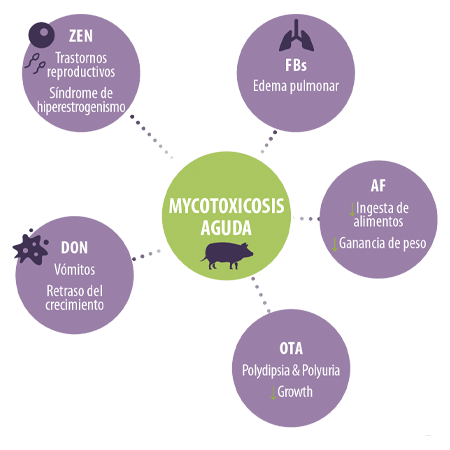
La ingestión de grandes cantidades puede inducir casos agudos de micotoxicosis con síntomas clínicos bien descritos, como2,4,6:
 Trastornos reproductivos y síndrome de hiperestrogenismo en el caso de ZEN
Trastornos reproductivos y síndrome de hiperestrogenismo en el caso de ZEN Vómitos y retraso del crecimiento en el caso de DON
Vómitos y retraso del crecimiento en el caso de DON Edema pulmonar tras la ingestión de FBs
Edema pulmonar tras la ingestión de FBs Reducción de la ingesta de alimentos y aumento de peso en los casos de AF aguda
Reducción de la ingesta de alimentos y aumento de peso en los casos de AF aguda Polidipsia, poliuria y reducción del crecimiento en los casos de OTA
Polidipsia, poliuria y reducción del crecimiento en los casos de OTA
Sin embargo, el consumo crónico de bajos niveles de micotoxinas y la inducción de síntomas clínicos inespecíficos parece más probable en condiciones de campo.
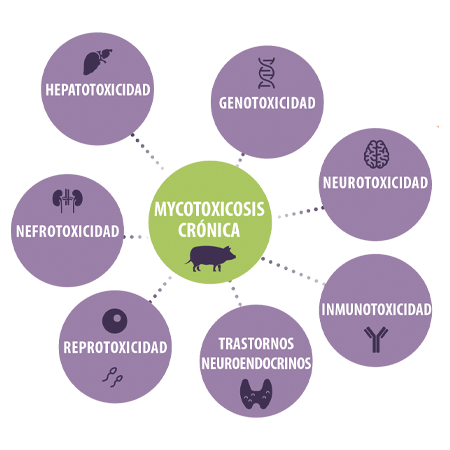
Los efectos tóxicos crónicos de las micotoxinas en los cerdos incluyen hepatotoxicidad, genotoxicidad, nefrotoxicidad, neurotoxicidad, reprotoxicidad, inmunotoxicidad y otros efectos como los trastornos neuroendocrinos6,7.
El sistema inmunitario del cerdo
El sistema inmunitario del cerdo es el principal mecanismo de defensa frente a los agentes infecciosos y otros agentes. Su respuesta es complicada, pero los aspectos básicos de la respuesta del sistema inmunitario son8:
- ✔ Inflamación
- ✔ Respuesta celular
- ✔ Respuesta humoral
De forma resumida, tras la estimulación del sistema inmunitario (por ejemplo, tras el contacto con un agente infeccioso), un primer mecanismo múltiple de defensa entra en acción.
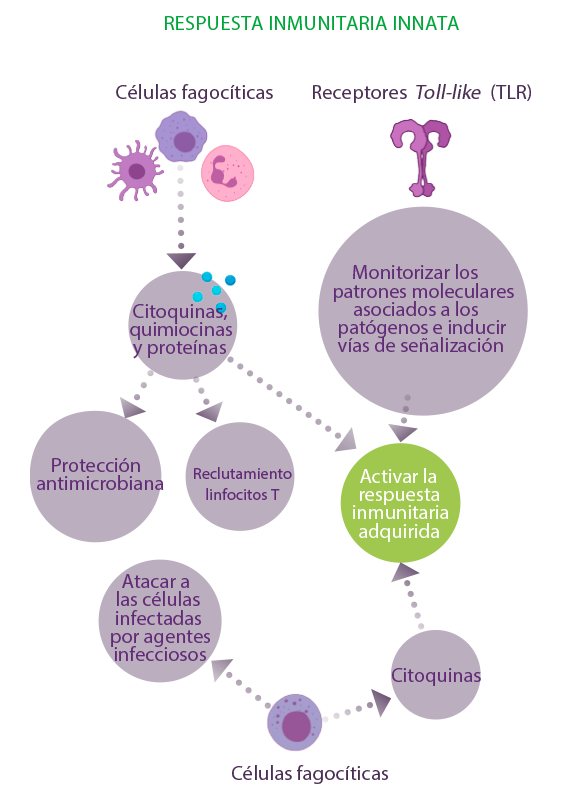
INMUNIDAD INNATA
Este mecanismo incluye la respuesta inmunitaria innata con células fagocíticas y la producción de diversas citoquinas, quimiocinas y proteínas que proporcionan protección antimicrobiana, reclutan linfocitos T a través del proceso inflamatorio y activan aún más la respuesta inmunitaria adaptativa o adquirida.
⇰ El sistema innato también incluye células Natural Killer (NK) que presentan una doble función, una respuesta innata para atacar a las células infectadas por agentes infecciosos y la producción de citoquinas para ayudar a la activación de la inmunidad adquirida9-11.
⇰ Además, los receptores de reconocimiento de patrones, incluidos los receptores Toll-like (TLR), participan en la monitorización de los patrones moleculares asociados a los patógenos e inducen vías de señalización que permitirán la activación del sistema inmunitario frente a la infección11.
INMUNIDAD ADQUIRIDA
Más adelante, el sistema inmunitario adaptativo utiliza linfocitos B, linfocitos T, citoquinas y anticuerpos con el fin de proporcionar una memoria específica del patógeno para protegerse de infecciones posteriores con el mismo patógeno.


El sistema inmunitario innato – Primera línea de defensa
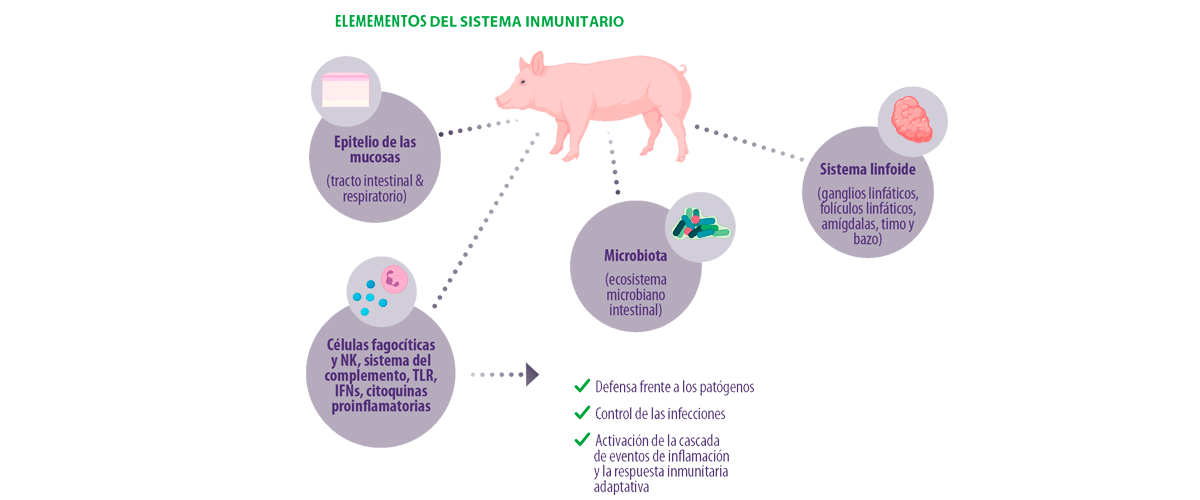
Hay partes importantes del sistema inmunitario innato que actúan como la primera línea de defensa o «barreras» frente a diferentes tipos de infecciones (físicas, químicas, microbianas), como las células epiteliales, los ácidos grasos bactericidas, la flora normal y la capa de moco, así como las células con capacidades fagocitarias como los leucocitos granulares (neutrófilos, basófilos, mastocitos y eosinófilos) y los fagocitos mononucleares (monocitos de sangre circulante y macrófagos de tejido).
Las células Natural Killer (NK) y otras partes del sistema inmunitario innato, como las defensinas (péptidos de defensa del huésped), el sistema del complemento, los receptores Toll-like (TLR), los interferones de tipo I (IFN), el factor de necrosis tumoral-α (TNF-α), IL-6, y IL-8 (citoquinas proinflamatorias)11:
- ⇰ Defienden frente a los patógenos
- ⇰ Controlan las infecciones
- ⇰ Activan la cascada de eventos de inflamación y la respuesta inmunitaria adaptativa
Las partes que desempeñan un papel importante en este sistema de defensa inmunitaria y en la respuesta frente a los patógenos son el epitelio de las mucosas (por ejemplo, el tracto intestinal y respiratorio), el microbioma (ecosistema microbiano intestinal) y el sistema linfoide porcino compuesto por los ganglios linfáticos, los folículos linfáticos, las amígdalas, el timo y el bazo12,13.
Adicionalmente, una microbiota óptima14:
- ✔ Evita la colonización del epitelio intestinal por patógenos y la penetración de la barrera intestinal
- ✔ Modula el tejido linfoide asociado al intestino (GALT) y la inmunidad sistémica
- ✔ Influye en el desarrollo gastrointestinal
Los efectos de las micotoxinas en el sistema inmunitario de los cerdos
Los efectos de las micotoxinas mencionadas anteriormente en los cerdos son múltiples y varían considerablemente.
Teniendo en cuenta que los cerdos ingieren alimentos contaminados con micotoxinas, la capa de células epiteliales gastrointestinales es el primer lugar de contacto e interacción14,15.
A partir de ese momento, se produce una inmunomodulación y una secuencia de reacciones inflamatorias que pueden ser alteradas por los efectos de la micotoxina a nivel molecular y celular.
Las micotoxinas de Fusarium pueden producir efectos inmunoestimulantes o inmunosupresores, según la edad del huésped, la dosis de exposición y la duración7,16, mientras que las AFs y la OTA inducen inmunosupresión17,18.

Las consecuencias sanitarias y económicas de los efectos de las micotoxinas en el sistema inmunitario de los cerdos son significativas. Se han descrito tres resultados principales19-21:
- ⇰ Mayor susceptibilidad a enfermedades infecciosas
- ⇰ Reactivación de infecciones crónicas
- ⇰ Disminución de la eficacia vacunal
Se ha sugerido una sensibilidad del sistema inmunitario a la inmunosupresión inducida por micotoxinas. Esto se debe a la vulnerabilidad de las células en continua proliferación y diferenciación que participan en actividades mediadas por el sistema inmunitario y que regulan la compleja red de comunicación entre los componentes celulares y humorales8.
⇰ Además, cabe señalar que los efectos de la mezcla de micotoxinas presentes en los piensos para cerdos sobre el sistema inmunitario también pueden aumentar la variabilidad del resultado y no pueden predecirse fácilmente, ya que podrían tener una interacción antagónica, aditiva o sinérgica y aumentar el impacto de cada micotoxina20.
El presente artículo se centrará en las evidencias relativas a los mecanismos subyacentes de la inmunomodulación inducida por las micotoxinas.
⇰ Se hace especial referencia a los ensayos con cerdos o líneas celulares porcinas, aunque también se presentan selectivamente pruebas de otros animales de granja, animales de laboratorio y líneas celulares.
⇰ La mayor parte de los hechos relacionados con los efectos de las micotoxinas sobre la eficacia de las vacunas y la susceptibilidad a las enfermedades se presentarán en un artículo específico.
TRICOTECENOS
 Los efectos del DON en el sistema inmunitario del cerdo
Los efectos del DON en el sistema inmunitario del cerdo
El DON y otras micotoxinas producidas por Fusarium afectan directamente a la síntesis de globulinas en el hígado y comprometen la respuesta inmunitaria de los cerdos22.
Los tricotecenos de tipo B, incluido el DON, tienen la capacidad aumentar y disminuir las funciones inmunitarias, interrumpiendo la señalización intracelular entre los leucocitos23.
⇰ Los efectos inmunoestimulantes o inmunosupresores de DON dependen de la dosis, frecuencia y duración de la exposición24, mientras que pocos estudios han demostrado los efectos de 3-Ac-DON, 15-Ac-DON y DON-3-glucósido en la respuesta inmunitaria.
⇰ En cuanto a las formas acetiladas de DON, hay pruebas de que al menos el 15-Ac-DON produce una toxicidad crónica general similar a la del DON, mientras que la inmunotoxicidad del 3-Ac-DON y del 15-Ac-DON podría estar menos expresada25.
Como se ha observado in vivo, los tricotecenos pueden ser estimulantes en algunos modelos de leucocitos, pero inhibidores en otros; paradójicamente, estas actividades a veces se producen conjuntamente26.
Las células inmunitarias (macrófagos, linfocitos B y T y células Natural Killer (NK)) son sensibles a DON, 3-Ac-DON y 15-Ac-DON, y se pueden observar efectos inmunoestimulantes/ inflamatorios o inmunosupresores dosis dependientes7,23,24,27,28.
La expresión genética inflamatoria diferencial y la apoptosis inducida por DON son mecanismos que juegan un papel importante en esos efectos inmunológicos.
La diana molecular más relevante de los tricotecenos es la subunidad ribosómica 60S, lo que sugiere que un mecanismo subyacente es la inhibición de la translocación29.
Sin embargo, se sabe que los tricotecenos y otros inhibidores de la translocación que se unen a los ribosomas también pueden activar rápidamente las proteínas quinasas activadas por mitógenos (MAPK), provocando la expresión de genes relacionados con la inflamación como citoquinas proinflamatorias23,24, e inducir la apoptosis en un proceso conocido como “respuesta al estrés ribotóxico“30,31.
 Los MAPKs modulan procesos fisiológicos como el crecimiento, diferenciación y apoptosis celular32 y son críticos para la transducción de señales en la respuesta inmunitaria33.
Los MAPKs modulan procesos fisiológicos como el crecimiento, diferenciación y apoptosis celular32 y son críticos para la transducción de señales en la respuesta inmunitaria33.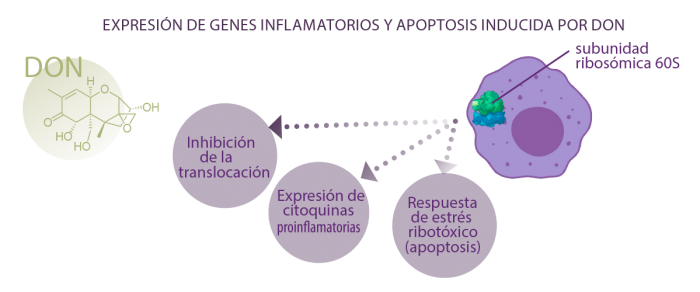
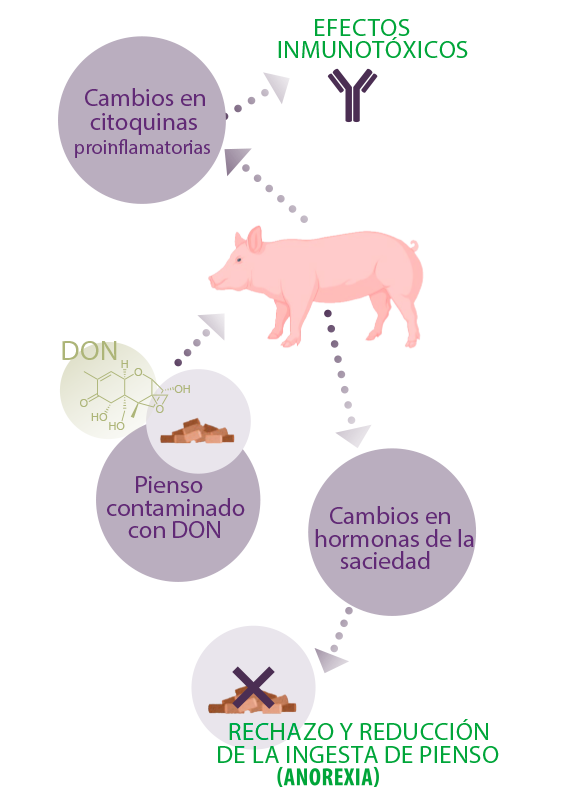
Los efectos tóxicos del DON en los animales de granja se han estudiado ampliamente25, siendo los efectos anorexígenos e inmunomoduladores los más pronunciados en los cerdos.
El rechazo y la reducción de la ingesta de alimentos después de la ingestión de pienso contaminado con DON se han asociado con los efectos hormonales e inmunotóxicos de DON, ya que se ha observado que los cambios en las hormonas de la saciedad (por ejemplo, colecistoquinina y péptido tirosina tirosina) y los cambios de las citoquinas proinflamatorias (por ejemplo, IL-1β, IL-6, TNF-alfa) están relacionados con la anorexia inducida por DON25.
⇰ Además, se ha sugerido que el DON afecta predominantemente a las células de proliferación intensa como las células epiteliales intestinales (IEC), el hígado y las células inmunitarias, y el orden de sensibilidad al DON es inmunitario >neuroendocrino> intestinal7,14.
 EFFECTOS INMUNOLÓGICOS DEL DON EN LECHONES
EFFECTOS INMUNOLÓGICOS DEL DON EN LECHONES
Como se ha descrito anteriormente34, las bajas concentraciones de DON (hasta 840 μg/kg de alimento durante 4 semanas) no afectan a la respuesta inmunitaria de los lechones en lo que respecta a la concentración de inmunoglobulinas, la proliferación de linfocitos y la producción de citoquinas.
 Sin embargo, en otros estudios se ha demostrado que el DON aumenta la concentración de IgA en la sangre, mientras que la proliferación de linfocitos inespecíficos puede aumentar o disminuir19,35-38.
Sin embargo, en otros estudios se ha demostrado que el DON aumenta la concentración de IgA en la sangre, mientras que la proliferación de linfocitos inespecíficos puede aumentar o disminuir19,35-38. Por otro lado, Ferrari et al.39 no demostraron efectos inmunitarios significativos tras 6 semanas de exposición oral a DON en cerdos, confirmando la variabilidad de los efectos inmunitarios de DON.
Por otro lado, Ferrari et al.39 no demostraron efectos inmunitarios significativos tras 6 semanas de exposición oral a DON en cerdos, confirmando la variabilidad de los efectos inmunitarios de DON. Según Frankic et al.37, el DON (4 mg/kg de alimento durante 14 días en cerdos destetados) aumentó significativamente la cantidad de daño en el ADN en los linfocitos en un 28%.
Según Frankic et al.37, el DON (4 mg/kg de alimento durante 14 días en cerdos destetados) aumentó significativamente la cantidad de daño en el ADN en los linfocitos en un 28%.
Según Döll y Dänicke40, de acuerdo con investigaciones anteriores sobre cerdos, otros animales de granja y humanos, normalmente sólo hay efectos menores (hasta 1,5 veces), insignificantes o ningún efecto del DON sobre la IgA.
 EFECTOS HEPATOTÓXICOS DEL DON
EFECTOS HEPATOTÓXICOS DEL DON
En el estudio in vitro (hepatocitos expuestos a 500 o 2000 nm de DON con o sin 1μg lipopolisacáridos (LPS)/ ml; incubación durante 48 horas) de Doll et al.41, se sugirió que el DON tiene el potencial de provocar y modular las reacciones inmunitarias en las células hepáticas de los cerdos. El estudio aportó pruebas de que:
- ⇰ DON y LPS fueron sinérgicos, aumentando la expresión de ARNm de TNF-α en los hepatocitos.
- ⇰ DON estimuló una inducción dependiente de la dosis de ARNm de IL-6.
- ⇰ Las concentraciones sobrenadantes de IL-6 inducidas por LPS se redujeron significativamente.
- ⇰ La expresión del ARNm de IL-10 antiinflamatoria aumentó.
 RESPUESTA INMUNITARIA A LA VACUNACIÓN
RESPUESTA INMUNITARIA A LA VACUNACIÓN
En un estudio sobre los efectos del DON sobre la respuesta inmunitaria a la vacunación (2,2-2,5 mg DON/kg de pienso, cerdos destetados durante 9 semanas)19, se observó un aumento de las IgA e IgG específicas de la ovoalbúmina (OVA), mientras que los ganglios linfáticos de los cerdos tratados tenían una expresión reducida del ARNm de TGF-β y de IFN-γ, lo que respaldaba la posibilidad de una reducción de la respuesta a la vacunación inducida por el DON.
La toxina tuvo un efecto bifásico sobre la proliferación de linfocitos específicos de OVA, sugiriendo un aumento en los días posteriores a la inmunización con OVA, pero una disminución en las semanas siguientes.
Otro estudio en cerdos inmunizados con OVA mostró un aumento de los títulos de IgG anti-OVA después de 42 días de exposición a una dieta contaminada con DON.
⇰ Simultáneamente, se incrementó la expresión de las quimiocinas implicadas en las reacciones inflamatorias [(IL-8, quimiocina (motivo C-X-C) ligando 20 (CXCL20), interferón-g (IFN-g)].
⇰ El desoxinivalenol aumentó la expresión del gen del antioxidante glutatión peroxidasa 2 (GPX-2) y redujo la expresión de los genes que codifican los antioxidantes enzimáticos, incluyendo GPX-3, GPX-4 y la superóxido dismutasa 3 (SOD-3), involucrados en el estrés oxidativo42.
⇰ También se observó una respuesta reducida o retardada de los anticuerpos a los antígenos dependientes del timo en cerdos en crecimiento alimentados con granos contaminados con DON22,43.
 EFECTOS EN MACRÓFAGOS
EFECTOS EN MACRÓFAGOS
El macrófago y el sistema inmunitario innato parecen ser sensibles a los tricotecenos26, 44. Se considera que los macrófagos son células con una mayor (10 a 100 veces) sensibilidad al DON en comparación con los fibroblastos, linfocitos, IEC o astrocitos.
Basándose en algunas hipótesis, el aumento de la sensibilidad puede atribuirse al aumento de la capacidad de DON para entrar en los macrófagos o al aumento de la apoptosis de los macrófagos tras la activación inducida por DON de la vía JAK/STAT4,45.
↓DON
La exposición a bajas dosis de DON resulta en:
⇰ Estimulación y activación de macrófagos (macrófagos humanos, de ratones, murinos y porcinos).
⇰ Secreción de citoquinas inflamatorias (IL-1β, IL-2, IL-4, IL-5, IL-6 y TNFα).
⇰ Expresión de las proteínas intracelulares COX-2 e iNOS (activación selectiva de la ERK, NFκB y de la proteína activadora-1)24,36,46-48, de la sintasa de óxido nítrico49 y de numerosas quimiocinas50,51.
↑DON
La exposición a altas DON dosis de DON induce efectos supresores de procesos relacionados con los macrófagos, como la secreción de citoquinas y la fagocitosis, e induce su apoptosis (mediante la activación de la quinasa p38), con lo que aumenta la susceptibilidad del huésped a los patógenos y reduce la activación de los linfocitos B y T (los macrófagos no actúan como células presentadoras de antígenos)52-54.
Sin embargo, los estudios en macrófagos porcinos primarios evidencian la falta de activación de la COX-2 y la IL-6 por el DON en los macrófagos porcinos, lo que sugiere un modo de acción distinto en esta especie36.
 EFECTOS SOBRE LAS CÉLULAS DENDRÍTICAS
EFECTOS SOBRE LAS CÉLULAS DENDRÍTICAS
La modulación de la función de las células dendríticas (CD) probablemente contribuye a los efectos inmunosupresores inducidos por el DON. La investigación in vitro e in vivo reveló la interacción entre DON y CD.
Los hallazgos tras alimentar a los cerdos con 5,3 ppm de DON en el pienso durante 5-11 semanas (in vivo) y/o tras el tratamiento de 100-800ng/mL de DON de DC derivado de monocitos (in vitro), incluyeron55:
- ⇰ Disminución de la actividad endocítica
- ⇰ Inhibición de la secreción de IL-10
- ⇰ Deterioro de la capacidad de las CD para la captación de antígenos
Los efectos del DON en el intestino de los cerdos han sido bien descritos por Pinton y Oswald56, sugiriendo múltiples efectos negativos sobre la integridad del epitelio y la barrera intestinal, así como la modulación de la actividad del epitelio intestinal en su papel en la respuesta inmunitaria, afectando la producción de citoquinas por las células intestinales o inmunitarias, y se supone que interfieren con el cruce entre las células epiteliales y otras células inmunitarias intestinales.
Cano et al.57, investigaron los efectos in vitro del DON purificado [IPEC-1 porcino y explantes yeyunales porcinos (modelo ex vivo)], y sugirieron que el DON puede:
- ⇰ Potenciar la expresión de genes relacionados con la inmunidad
- ⇰ Aumentar la concentración tiempo-dependiente de proteínas en las células diferenciadas IPEC-1
- ⇰ Causar una respuesta inflamatoria intestinal temprana
- ⇰ Interrumpir la homeostasis intestinal
- ⇰ Inclinar el sistema inmunitario intestinal hacia una respuesta del Th17
 Los efectos de la T-2 en el sistema inmunológico del cerdo
Los efectos de la T-2 en el sistema inmunológico del cerdo
Según la EFSA58, el cerdo doméstico se encuentra entre las especies más sensibles a los efectos inmunotóxicos y hematotóxicos de las toxinas T-2 y HT-2.
Se ha descrito que la toxina T-2 es inmunotóxica, ya sea por sus atributos citotóxicos, apoptóticos o inmunosupresores.
⇰ Al igual que otros tricotecenos, la toxina T-2 puede ser tanto inmunosupresora como inmunoestimuladora, dependiendo de la dosis y el momento de la exposición.
En diversos estudios se han demostrado los efectos de la toxina T-2 sobre la respuesta inmunitaria, tanto humoral como celular59. Además, la toxina T-260,61:
- ⇰ Induce la peroxidación de los lípidos, afectando la integridad de la membrana celular
- ⇰ Provoca depleción celular en el tejido linfoide
- ⇰ Inhibe la función de las células inflamatorias
- ⇰ Disminuye las respuestas inmunitarias humorales y celulares, lo que conduce a una mayor susceptibilidad a las infecciones
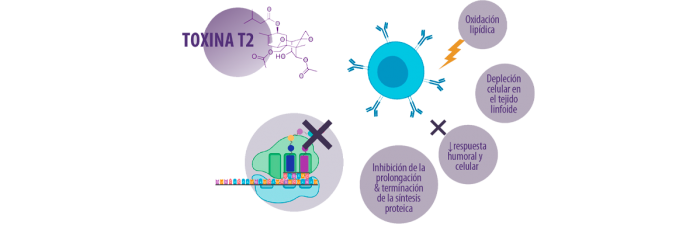
INHIBICIÓN DE LA SÍNTESIS PROTEICA
La diana molecular más destacada de los tricotecenos es la unidad ribosómica 60S, donde impide la iniciación de la cadena polipeptídica66.
⇰ Los estudios in vitro sugieren que la toxina T-2 interactúa con la peptidil transferasa, que es una integrante de la subunidad ribosómica 60S, inhibiendo así la transpeptidación en el proceso de formación de enlaces peptídicos, lo que da lugar a una inhibición de la prolongación y terminación de la síntesis de proteica62,63.
Los efectos tóxicos producidos por la toxina T-2 y la toxina HT-2 incluyen la inhibición de la síntesis proteica (mediante la unión e inactivación de la actividad de la peptidiltransferasa en el punto de transcripción), lo que afecta también a la síntesis de las inmunoglobulinas y, a su vez, a la inmunidad humoral67-69.
La exposición a la toxina T-2 provoca leucopenia y depleción celular en los órganos linfoides, lo que perjudica considerablemente la producción de anticuerpos, reduce la respuesta proliferativa de los linfocitos y obstaculiza el desarrollo de las células dendríticas70.
Además, puede afectar a las ADN polimerasas, a la desoxinucleotidil transferasa terminal, a la monoaminooxidasa y a varias otras proteínas que intervienen en la coagulación71.
⇰ Se ha demostrado un efecto perjudicial de la toxina T-2 sobre el ADN, tiempo- y dosis-dependiente, utilizando células mononucleares de sangre periférica de cerdos (incubación con 0,1-1 μM durante 24 o 42 horas)72.
Las células dendríticas, las más potentes células presentadoras de antígenos (APC) del sistema inmunitario, han demostrado ser sensibles a los tricotecenos, observándose que la toxina T-2 altera su proceso de maduración64.
Además, en un estudio in vitro anterior con macrófagos alveolares primarios de origen porcino, la preexposición de los macrófagos a 3 nM de toxina T-2 disminuyó la producción de mediadores inflamatorios (IL-1β, TNF-α, óxido nítrico) en respuesta al LPS y la disminución de la respuesta proinflamatoria se asoció con una disminución de la expresión del ARNm de TLR.
Así pues, la ingestión de bajas concentraciones de toxina T-2 puede afectar a la activación del TLR al disminuir el reconocimiento de patrones de patógenos, interfiriendo con el inicio de la respuesta inmunitaria inflamatoria frente a los patógenos65.
La toxicidad aguda T-2 (1,2 mg/kg de peso corporal por vía intravenosa) se caracteriza por emesis, paresia posterior, apatía y letargo, así como por graves daños en las células que se dividen activamente en la médula ósea, los ganglios linfáticos, el bazo, el timo y la mucosa intestinal. Sin embargo, en 24 horas, los cerdos supervivientes se recuperan y parecen normales60,73.
 En un estudio de alimentación con cerdos, se observó una inmunosupresión (0,5-3,0 mg T-2/kg de pienso).
En un estudio de alimentación con cerdos, se observó una inmunosupresión (0,5-3,0 mg T-2/kg de pienso).
⇰ Se inmunizó a los cerdos con globulina de caballo, observándose una reducción de la síntesis de anticuerpos esta globulina, así como una disminución dosis-dependiente de los elementos linfoides en el timo y el bazo.
⇰ El recuento de leucocitos y la porción de linfocitos T se redujo en todos los grupos de exposición74.
En los cerdos inmunizados con OVA, las dosis subclínicas de toxina T-2 indujeron un aumento temprano y transitorio de la concentración plasmática total de IgA, pero una disminución del título de IgG anti-OVA.
⇰ Los cerdos alimentados con 1,324 o 2,102 mg de toxina T-2 por kilogramo exhibieron una producción reducida de anticuerpos anti-ovalbúmina el día 21 sin alteración significativa de la proliferación de linfocitos específicos75.
Frankic et al.37 señalaron que la toxina T-2 (3 mg/kg de pienso durante 14 días en cerdos destetados) aumentaba la cantidad de daño del ADN en los linfocitos en un 27% y disminuía la IgG sérica total.
De manera análoga al efecto sobre la proliferación de los linfocitos, se comprobó que cantidades bajas de toxina T-2 aumentaban los niveles de anticuerpos, mientras que las cantidades altas eran inmunosupresoras60, por lo que se puede observar una mayor susceptibilidad a las enfermedades infecciosas (por ejemplo, Mycobacterium, Staphylococcus, Listeria, Toxoplasma y el virus del herpes simple (HSV-1) – efectos observados en ratas, ratones y pollos)58.
Li et al.76 explicaron que la supresión del IFN-γ por la toxina T-2 es probablemente uno de los factores responsables de la disminución de la inmunidad antiviral en presencia de la toxina T-2. La supresión del IFN-γ puede deberse a un aumento de la expresión de la IL-6 (interleucina 6).

Aspectos interesantes sobre la interacción entre tricotecenos y el sistema inmunitario
En conclusión, los macrófagos, la IgA y las citoquinas proinflamatorias tienen un papel significativo en los efectos inmunomoduladores de los tricotecenos77.
Los mecanismos subyacentes de los efectos del tricoteceno en el sistema inmunitario, como se sugiere en los estudios de Wu et al.77-79 y Liao et al.62, son:
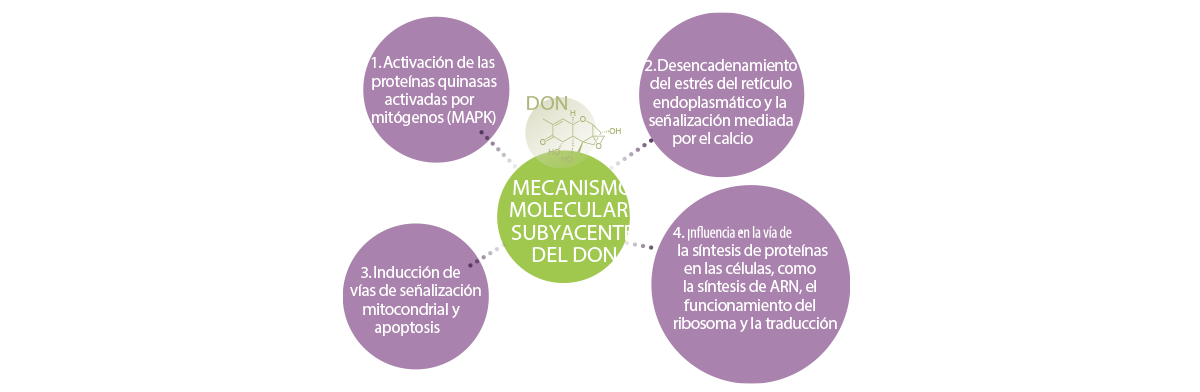
1. Activación de las proteínas quinasas activadas por mitógenos (MAPK)
La teoría más aceptada es que el DON y otros inhibidores de la traslación de la unión al ribosoma pueden activar a las proteínas quinasas activadas por mitógenos (MAPK) mediante un mecanismo conocido como proceso de “respuesta al estrés ribotóxico”30.
⇰ Los MAPKs, que son cruciales para la transducción de señales en la respuesta inmunitaria, median la regulación transcripcional y post-transcripcional de los genes causada por DON.
El DON se une al locus de la peptidil transferasa del ribosoma 28s, lo que activa la respuesta al estrés ribotóxico e induce la fosforilación de la proteína quinasa (PKR) y la quinasa hematopoyética (Hck), y luego desencadena rápidamente la vía de señalización MAPK (así como las vías NF-kB y JAK/STAT), lo que inalmente conduce a la apoptosis celular y a la expresión de citoquinas proinflamatorias80.
Además, los tricotecenos regulan las moléculas de señalización relacionadas con la apoptosis, como IL-6, IL-1β y TNF-α.

2. Desencadenamiento del estrés del retículo endoplasmático y la señalización mediada por el calcio
El DON también puede inducir estrés del retículo endoplásmico (RE)81, así como aumentar la expresión de las proteínas ATF3 y DDIT3 (dos de los principales marcadores de estrés del RE) en un plazo de 3 horas81.
⇰ Tal como se ha señalado, la sobreexpresión de ATF3 y DDIT3 podría dar lugar a la detención del ciclo celular y/o la apoptosis82,83.
El DON puede inducir la fosforilación de las proteínas quinasas JNK en las células Jurkat, desencadenando una respuesta de activación de los linfocitos T y la separación de la caspasa-3, un evento conocido por mediar la apoptosis, dentro de las 3 horas después de su exposición81.
⇰ La caspasa-12 activada puede inducir la activación de la caspasa-9 a través de la escisión directa de la caspasa-9, que a su vez induce la activación de la caspasa-3 y finalmente se produce la apoptosis84.
3. Inducción de vías de señalización mitocondrial y apoptosis
El DON también induce la apoptosis al involucrar la vía intrínseca mitocondrial a través de los siguientes mecanismos85,86:
- ⇰ Apertura del poro de transición de permeabilidad mitocondrial (mPTP)
- ⇰ Pérdida del potencial transmembrana mitocondrial Aumento del O2– (anión superóxido)
- ⇰ Liberación del citocromo C
Así pues, la disfunción mitocondrial, a raíz de la liberación del citocromo C en el citoplasma y la activación en serie de las caspasas contribuyen a la apoptosis inducida por DON, posiblemente modulada por la familia Bcl-262.
4. Influencia en la vía de la síntesis de proteínas en las células, como la síntesis de ARN, el funcionamiento del ribosoma y la traducción
El DON también puede aumentar la expresión de microARNs (miRNA) responsables de la inhibición de genes selectivos y la síntesis de los ribosomas87.
Además, los tricotecenos reducen considerablemente la expresión del IFN-γ en cerdos y ratones, reduciendo así la resistencia del hospedador a los virus y su capacidad de reparación19,93, mientras que el DON reduce la expresión del IFN-b y promueve la apoptosis celular48.
ESTRÉS OXIDATIVO
El estrés oxidativo es un importante mecanismo de toxicidad asociado a los tricotecenos, ya que altera el funcionamiento normal de las mitocondrias y genera radicales libres, incluidos los ROS.
⇰ Estos compuestos inducen la peroxidación de los lípidos, cambian el estado antioxidante de las células y reducen la actividad de las enzimas antioxidantes como la glutatión-S-transferasa (GST), la superóxido dismutasa (SOD) y la catalasa (CAT)77,88.
⇰ El daño al ADN también se asocia con la generación de ROS y la peroxidación de lípidos. Algunas vías de señalización, entre ellas MAPK, JAK/STAT y NF-κB, son inducidas posteriormente por el estrés oxidativo, y las vías de apoptosis mediada por caspasas también se activan89.
 El estrés oxidativo (generación de ROS tan pronto como 30 minutos después de la exposición) es el mecanismo por el cual la toxina T-2 causa daños en el ADN y apoptosis90-92.
El estrés oxidativo (generación de ROS tan pronto como 30 minutos después de la exposición) es el mecanismo por el cual la toxina T-2 causa daños en el ADN y apoptosis90-92.INMUNOMODULACIÓN
El efecto inmunomodulador de los tricotecenos está determinado por el equilibrio entre las vías de señalización de supervivencia y muerte celular26,88,94.
⇰ La apoptosis celular inducida por la toxina T-2 se inhibe simultáneamente por la vía JNK1-STAT3 (que mantiene la función normal de las mitocondrias) y se promueve por la vía STAT1 en la misma célula94.
⇰ El DON inicia tanto una vía de supervivencia (ERK/AKT/p90Rsk/Bad) como una vía apoptótica competidora (p38/p53/Bax/ Mitocondrias/Caspasa-3) en macrófagos RAW 264.726.
INMUNOESTIMULACIÓN
El efecto inmunoestimulador de los tricotecenos puede estar mediado, en parte, por la autofagia95,96.
⇰ Según Tang et al.96, la autofagia inducida por DON inhibe la apoptosis inducida por DON de las células epiteliales intestinales al mitigar el daño causado por el estrés oxidativo, lo que hace que la respuesta de las células al estrés falle.
⇰ Según Bin-Umer et al.95, la autofagia de las mitocondrias dañadas (mitofagia) desempeña un papel fundamental en la resistencia de las células a los tricotecenos.
EVASIÓN INMUNITARIA
Los tricotecenos tienen un mecanismo de “evasión inmunitaria” que suprime las defensas inmunitarias del hospedador y las inducidas por las vacunas.
⇰ Este mecanismo interfiere con los genes antiapoptóticos, promoviendo la apoptosis inducida por el estrés oxidativo93,97,98, permitiendo que las toxinas escapen a la reacción del hospedador y a la reparación inmunitaria78.
ZEARALENONA
Debido a sus propiedades estrogénicas, el ZEN se une a los receptores de estrógeno (REs) y se asocia típicamente con los trastornos reproductivos en el cerdo99.
⇰ Sin embargo, se sabe que el ZEN también produce hepatotoxicidad, hematotoxicidad, inmunotoxicidad y genotoxicidad45,100.
Dado que las células inmunitarias también expresan REs como REα en las células NK, macrófagos y células T, así como REβ en los monocitos y los linfocitos B101, la ZEN también puede unirse a tales RE y regular una variedad de vías metabólicas de la respuesta inmunitaria100.
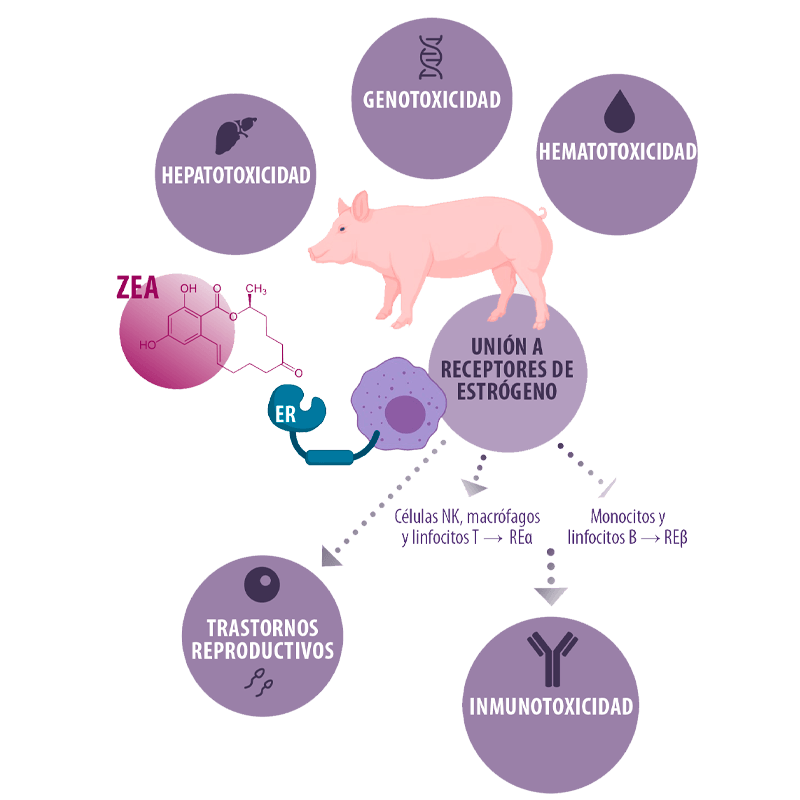

La ZEN no sólo activa los genes relacionados con la respuesta inmunitaria, sino que también interfiere con el sistema inmunitario esplénico, cambian los fenotipos de los linfocitos del bazo e incluso provoca la atrofia de los linfocitos en ratones o ratas102,103.
Además, la ZEN puede inducir la inmunosupresión al reducir las inmunoglobulinas en el suero y las citoquinas en los órganos linfoides104.
⇰ Por otro lado, la secuenciación del ARN en muestras de hígado de lechones alimentados con pienso contaminado con ZEN y DON, indicó un efecto sobre la expresión y conjunto de transcritos relacionadas con la inmunidad105.
 RESPUESTA INMUNITARIA HUMORAL
RESPUESTA INMUNITARIA HUMORAL
En cuanto a los efectos de la ZEN en la respuesta inmunitaria humoral, un estudio realizado con ratas (5,0 mg/kg de ZEN durante 36 días) reveló que la ZEN sola (sin desafío inmunitario) puede disminuir la producción de inmunoglobulinas106.
⇰ Además, un estudio in vitro con células mononucleares de sangre periférica (PBMC) de lechones también mostró una disminución de los niveles de inmunoglobulina107.
⇰ En cambio, en un estudio in vivo realizado por Swamy et al.108, se observaron mayores concentraciones de inmunoglobulinas séricas (se aumentaron las IgM e IgA, pero no las IgG) en cerdos alimentados con granos contaminados con DON, ácido fusárico (FA), ZEN y 15-acetildeoxinivalenol (15-acetilDON).
⇰ Según otro estudio in vivo realizado por el mismo grupo109 con diferentes concentraciones de las mismas micotoxinas en cerdos, se observó la ausencia de efecto de la dieta en los niveles de anticuerpos IgM e IgG.
 CITOTOXICIDAD Y DAÑO OXIDATIVO
CITOTOXICIDAD Y DAÑO OXIDATIVO
Los experimentos in vitro con células Vero y Caco-2 sugieren que la ZEN induce citotoxicidad y daño oxidativo además de su potencial estrogénico111.
Además, un estudio in vitro de Taranu et al.112, en el que se investigaban los efectos de la ZEN (10 mM) en la expresión génica de las células intestinales porcinas (IPEC-1), apoyó que, aunque esas concentraciones de ZEN no afectan a la viabilidad celular, el 70% de los 190 genes de expresión diferencial estaban sobreexpresados.
⇰ Los genes que codifican las enzimas glutatión peroxidasa (GPx6, GPx2, GPx1) se encontraban entre los más expresados, lo que aportaba pruebas de que las micotoxinas inducen daño oxidativo, mientras que también se revelaba una mayor expresión de las citoquinas implicadas en la inflamación (por ejemplo, TNF-α, IL-6, IL-8) y el reclutamiento de células inmunitarias (por ejemplo, IL-10), demostrando que la ZEN modula las vías de reparación inmunitaria y/o celular de las células intestinales.
METABOLITOS DE ZEN
Marin et al.113 investigaron los efectos de la ZEN y sus metabolitos, α- zearalenol (α-ZEL), β-zearalenol (β-ZEL), y la zearalanona (ZAN), sobre varias funciones de los neutrófilos como la proliferación, la síntesis de citoquinas y el estrés oxidativo en un modelo de células polimorfonucleares porcinas (PMN).
⇰ Se observó que la toxina parental era menos tóxica, mientras que los derivados de ZEN indujeron una disminución significativa de la síntesis de IL-8 en los PMN de los cerdos.
Se llegó a la conclusión de que la ZEN y sus derivados pueden tener efectos divergentes sobre importantes parámetros de la inmunidad innata de los cerdos, como la viabilidad de las células, la IL-8 y la síntesis de aniones superóxidos. En otro estudio realizado por el mismo grupo107 con PBMC, 5 y 10 μM de ZEN y ZAN disminuyeron significativamente la síntesis de TNF-α en el sobrenadante del cultivo celular de PBMC, y 10 μM de ZAN disminuyó también la síntesis de IL-8, mientras que el ZEN y sus metabolitos en concentraciones superiores al 5 μM también indujeron una disminución significativa de la concentración de IgG, IgA o IgM.
Una evaluación in vitro posterior de la toxicidad de α-ZEL y β-ZEL en macrófagos RAW264.7114 demostró que la β-ZEL tenía un efecto inhibitorio más fuerte sobre la viabilidad de los macrófagos que la α-ZEL.
β-ZEL también indujo la muerte celular, principalmente por apoptosis en lugar de necrosis, mientras que los otros metabolitos ZEN indujeron:
- ⇰ Pérdida de potencial de la membrana mitocondrial (MMP)
- ⇰ Cambios mitocondriales en las proteínas Bcl-2 y Bax
- ⇰ Liberación citoplasmática del citocromo c y el factor inductor de apoptosis (AIF)
FUMONISINA B
La toxicosis por FB, según el nivel de contaminación y el tiempo de exposición, puede provocar el síndrome de edema pulmonar porcino debido a los efectos tóxicos cardiovasculares, así como un aumento de la relación esfinganina/ esfingosina (Sa/So) en el suero y los tejidos, toxicidad hepática y renal, retraso en la madurez sexual y alteraciones de la funcionalidad reproductiva, deterioro de la respuesta inmunitaria innata y adquirida, lesiones histológicas en los órganos internos, así como alteraciones de la fisiología cerebral.
Debido a su parecido estructural con la ceramida, las fumonisinas inhiben competitivamente las ceramida sintasas (CerS), un grupo de enzimas clave en la biosíntesis de la ceramida y los esfingolípidos más complejos, lo que da lugar a la interrupción de la síntesis de novo de la ceramida, así como al metabolismo de los esfingolípidos y, en consecuencia, a alteraciones en las vías lipídicas115.
 INFLAMACIÓN
INFLAMACIÓN
Las FBs, especialmente la B1 (FB1), influyen en la respuesta inflamatoria21,116.
Se ha descrito una reducción de la expresión de citoquinas (IL-6, IL-1β, IL-12p40 y IL-8) en el bazo y un aumento significativo de la expresión de IL-1β, IL-6, IFN-γ y TNF-α en el intestino delgado de los lechones alimentados con dietas contaminadas [ya sea DON (3 mg/kg) o FB (6 mg/kg), o ambos durante 35 días]117.
⇰ Tras la ingestión de 2,8 μM FB1/kg de peso corporal (37-44 mg FB1/kg de alimento), se encontró una disminución de la expresión de la mayoría de las citoquinas en las diferentes porciones intestinales tras 14 días de exposición118.
⇰ Además, 8 mg de FB1/kg de pienso disminuyó la expresión génica de las citoquinas IL-4, IL-6 e IL-10 de Th2 en la sangre de los cerdos116,119. Algunos de los cambios en la expresión de ARNm de IL1α, IL1β, IL6, IL8, TNFα y MCP-1 inducidos por FB u otras toxinas de Fusarium también podrían estar relacionados con la citotoxicidad120.
 FUNCIÓN INTESTINAL
FUNCIÓN INTESTINAL
En cuanto a la morfología y la función intestinal, las FBs se han asociado con21:
- ⇰ Fusión y atrofia de las vellosidades intestinales
- ⇰ Disminución de la resistencia eléctrica transepitelial (TEER), densidad de células caliciformes, y expresión de oclusina y cadherina E
- ⇰ Mayor translocación bacteriana a otros órganos y proliferación de bacterias oportunistas intestinales
Se han demostrado efectos negativos significativos en el sistema inmunitario intestinal (exposición oral a 1 ppm FB durante 10 días, seguida de un desafío con Escherichia coli), que muestran una reducción de la expresión intestinal de IL-12p40, un deterioro de la función de las células presentadoras de antígenos intestinales (APC), una disminución de la expresión de la molécula del Complejo de Mayor de Histocompatibilidad clase II (MHC-II) y una reducción de la capacidad de estimulación de los linfocitos T tras la estimulación121.
 RESPUESTA INMUNITARIA HUMORAL
RESPUESTA INMUNITARIA HUMORAL
En cerdos expuestos a FB1 y vacunados frente al virus de la enfermedad de Aujeszky (Herpesvirus Suid 1 [SuHV1]), la respuesta inmunitaria humoral se vio muy alterada, con una fuerte disminución de los anticuerpos observados122.
De forma similar, la exposición in vivo (28 días) de lechones destetados a pienso contaminado con 8 mg de FB1/kg disminuyó significativamente la expresión del ARNm de la IL-4 por parte de los glóbulos sanguíneos de los cerdos y disminuyó el título de anticuerpos específicos tras la vacunación frente a Mycoplasma agalactiae116.
⇰ En un estudio similar con FB1 y vacunación frente a Mycoplasma agalactiae, se demostró que los niveles de anticuerpos específicos disminuyeron significativamente después de la vacunación, así como el nivel de expresión de ARNm de la IL-10119.
⇰ En otro estudio se constató una disminución de la expresión de IL-8 en el intestino de los cerdos tras la administración oral de 0,5 mg/kg de FB1, aunque otras citoquinas no se vieron afectadas123.
 Según experimentos in vitro e in vivo, la FB1 modifica el equilibrio de citoquinas Th1/ Th2 (T-helper 1/T-helper 2) en los cerdos de manera similar a una respuesta humoral alterada116,119, además de influir en la respuesta inflamatoria.
Según experimentos in vitro e in vivo, la FB1 modifica el equilibrio de citoquinas Th1/ Th2 (T-helper 1/T-helper 2) en los cerdos de manera similar a una respuesta humoral alterada116,119, además de influir en la respuesta inflamatoria.
⇰ La incubación de macrófagos alveolares porcinos con FB1 condujo a una reducción significativa del número de células viables y a la muerte celular por apoptosis124.
⇰ Un experimento in vivo con cerdos [ya sea DON (3 mg/ kg) o FB (6 mg/kg), o ambos durante 35 días] demostró que la IL-8, la IL-1β, la IL-6 y la proteína inflamatoria de los macrófagos-1β disminuían significativamente en el bazo de los lechones expuestos a dietas multicontaminadas (DON y FB), mientras que los animales que sólo recibieron alimentos contaminados con FB demostraron una disminución significativa en la codificación del ARNm para la IL-1b y la IL-6125.
AFLATOXINAS
Las aflatoxinas tienen propiedades hepatotóxicas, carcinogénicas e inmunotóxicas, perjudicando tanto la respuesta inmunitaria innata como la adquirida126.
La ingestión de aflatoxinas (140 y 280 ppb durante 4 semanas) tiene un efecto bifásico en el número total de leucocitos, de modo que una dosis baja de AF (140 ppb) disminuye el número total de leucocitos, mientras que una dosis alta (280 ppb) tiene el efecto opuesto, además de disminuir la expresión de los mRNA de citoquinas proinflamatorias (IL-1β, TNF-alfa) y aumentar la de los mRNA de citoquinas antiinflamatorias (IL-10)127.
⇰ En ese estudio también se observó una reducción de la respuesta inmunitaria inducida por Mycoplasma agalactiae en el grupo tratado con 280 ppm. Además, en lo que respecta a los efectos de la AFB1 en el proceso inflamatorio, se ha demostrado que la exposición in vitro de los macrófagos alveolares de los cerdos a esta toxina da lugar a una disminución de la viabilidad y la actividad fagocítica de las células de cultivos primarios en función del tiempo y la dosis124.
La evaluación de muestras de sangre de lechones de 25 días de edad, nacidos de cerdas que recibieron AF a través del pienso durante la gestación y lactación, demostró la reducción de la respuesta linfoproliferativa a los mitógenos y la incapacidad de los macrófagos derivados de monocitos para producir eficientemente aniones superóxidos tras la estimulación de estallido oxidativo in vitro, mientras que su capacidad de fagocitar glóbulos rojos no se vio comprometida.
⇰ Las células granulocíticas mostraron una reducción de la respuesta quimiotáctica al factor quimioatrayente bacteriano y a la caseína128.
La AFB1 interfiere en el desarrollo de la inmunidad adquirida en los cerdos tras la vacunación frente a la erisipela con una preparación bacteriana (una suspensión de bacterias muertas) de E. rhusiopathiae y aumenta la gravedad de la infección con E. rhusiopathiae129.
⇰ Por otra parte, en un modelo de cerdo vacunado con ovoalbúmina (OVA), la exposición a la AFB1 no tuvo un efecto importante sobre la inmunidad humoral (concentraciones de IgA, IgG e IgM totales y de IgG específicas anti-OVA), pero se detectó un fallo en la activación de los linfocitos130.
Los hallazgos de otro estudio131 sobre la implicación de la AFB1 en la replicación del virus de la gripe porcina (SIV) in vitro e in vivo, apoyaron que la exposición a la AFB1 acentúa la replicación del SIV, la inflamación y el daño pulmonar al activar la señalización de TLR4-NFkB.
Un estudio con esplenocitos porcinos132 proporcionó pruebas de los mecanismos subyacentes implicados en la inmunosupresión inducida por AFB1.
⇰ En el estudio, la AFB1 inhibió la producción de IL-2 en los esplenocitos porcinos, provocando una inmunotoxicidad dosis-dependiente.
Además, la AFB1 disminuyó el nivel de glutatión reducido (GSH) y aumentó la peroxidación lipídica en los esplenocitos porcinos, lo que va acompañado de un aumento de la fosforilación de ERK1/2.
Además, la AFB1 altera la inmunidad celular, probablemente por la desregulación de la capacidad de presentación de antígenos de las células dendríticas133.
⇰ Por otro lado, la exposición a AF aumenta la capacidad de inducción de proliferación de los linfocitos T de las por parte de las células dendríticas derivadas de monocitos porcinos, lo que mejora la capacidad de presentación de las células134.
OCRATOXINA A
La OTA es un importante agente nefrotóxico, además de tener propiedades hepatotóxicas, así como inmunotóxicas, neurotóxicas y teratogénicas21.

 RESPUESTA INMUNITARIA HUMORAL
RESPUESTA INMUNITARIA HUMORAL
Se describió una perturbación de la respuesta inmunitaria humoral en un estudio in vivo con cerdos (500 μg OTA/kg de pienso durante 3 meses)122, ya que se observó una fuerte disminución del título de anticuerpos tras la inmunización frente a la Enfermedad de Aujeszky (Pseudorabia).
Las cerdas jóvenes alimentadas con piensos contaminados con OTA mostraban135:
- ⇰ Una reducción de la respuesta de hipersensibilidad de los basófilos cutáneos a la fitohemaglutinina
- ⇰ Una reducción de la hipersensibilidad retardada a la tuberculina
- ⇰ Una disminución del índice de estimulación para la linfoblastogénesis
- ⇰ Una disminución de la producción de IL-2 cuando los linfocitos fueron estimulados con concanavalina A
- ⇰ Una disminución del número y la actividad fagocítica de los macrófagos
La aparición espontánea de una infección clínica por Salmonella choleraesuis relacionada con la dosis se produjo en lechones alimentados con 1 y 3 mg de OTA/kg de pienso136.
⇰ En otro experimento realizado por el mismo grupo, se vacunó a los lechones frente a S. choleraesuis, la ingestión de OTA (1mg de OTA /kg de pienso) provocó infecciones espontáneas de Brachyspira hyodysenteriae y Campylobacter coli que se asociaron a la inmunosupresión inducida por OTA, mostrando una respuesta retardada al antígeno y una respuesta humoral reducida136.
⇰ Por el contrario, en un estudio anterior135, la OTA (2,5 mg de OTA/kg de pienso durante 35 días) no tuvo ningún efecto en las concentraciones de inmunoglobulina total y específica.
EXPRESIÓN DE CITOQUINAS
La OTA también afecta a la expresión de citoquinas.
Un experimento realizado con lechones destetados que ingirieron una dieta contaminada con OTA (181 ng/g de pienso) mostró un aumento del nivel de TNF-α y de IL-10 en plasma, con una menor capacidad de responder con la expresión de citoquinas en un desafío ex vivo con lipopolisacáridos (LPS)137.
Hay evidencias, principalmente de estudios in vitro, de los efectos de la OTA sobre los neutrófilos y los macrófagos, incluido el estrés oxidativo, la apoptosis, la fosforilación del ERK1/2 y la liberación de TNFα por las vías del NF-kB138.
En un estudio sobre la toxicidad de las micotoxinas de Penicillium en la proliferación de linfocitos inducida por mitógenos, se observó que la OTA era el inhibidor de la proliferación celular más potente (50% de inhibición a 1,3 mM)139.
Además, se ha señalado que la OTA induce la fosforilación de P38 y ERK1/2 en los macrófagos alveolares porcinos, causando inmunotoxicidad mediante un aumento de las proteínas de la vía de señalización inflamatoria mediada por el receptor Toll-like 4 (TLR4) y una elevada producción de ROS intracelular140.
También se ha descubierto que la OTA modula la expresión de los microARN, en particular en las células renales in vivo e in vitro. Muchos de los miARNs alterados están involucrados en las vías de señalización del MAPK138.
La OTA también induce la fosforilación de P38 y ERK1/2 en los esplenocitos de los cerdos, lo que produce nefrotoxicidad e inmunotoxicidad, respectivamente143.
Según los enfoques proteómicos, el aumento de la expresión de las proteínas mitocondriales que participan en el transporte de electrones, la síntesis de proteínas, la respuesta al estrés y la muerte celular y la modulación de las proteínas que participan en la inflamación son factores relacionados con la toxicidad de la OTA144,145.
Además, se ha descrito una disminución de la viabilidad de los linfocitos T inducida por TCR en los linfocitos de la sangre periférica y esplenocitos (400, 800 μg/kg dieta) en cerdos146. Así pues, se sugiere que la nefrotoxicidad y la inmunotoxicidad de la OTA podrían involucrar estrés del RE, activación de la señalización MAPK y autofagia143,146.
Observaciones finales y notas prácticas
Se considera que los hongos son la mayor amenaza para la salud animal y vegetal entre todas las clases taxonómicas de patógenos147.
Las investigaciones actuales han proporcionado evidencias claras de que las micotoxinas afectan al sistema inmunitario de los cerdos.
El intestino es, sin duda, el eslabón clave entre las micotoxinas ingeridas y los efectos perjudiciales para el animal.
⇰ Los efectos negativos de las micotoxinas en el intestino (por ejemplo, la reducción de la integridad de la barrera) y en el sistema inmunitario implican que pueden desempeñar un papel fundamental en el inicio, la progresión y la duración de las infecciones intestinales (y sistémicas).
⇰ Por lo tanto, al comprometerse la integridad intestinal también aumentará la probabilidad de que los microbios o productos microbianos, o micotoxinas, entren a la circulación e induzcan enfermedades sistémicas148-150.
Los amplios efectos inmunosupresores de las micotoxinas pueden disminuir la resistencia del huésped a las enfermedades infecciosas20, mientras que la respuesta inmunitaria de las vacunas también se altera con dosis de micotoxinas que no alteran la respuesta inmunitaria global75,116,130.
⇰ Tal alteración de la inmunidad vacunal puede provocar la aparición de la enfermedad, incluso en grupos vacunados adecuadamente. Estos casos son de gran importancia cuando se investiga la efectividad de los programas de vacunación en las granjas.
Además, los casos de contaminación de los piensos con mezclas de micotoxinas deben ser considerados más probables que la contaminación con una sola micotoxina en condiciones de campo.
⇰ Los efectos de las mezclas de micotoxinas en el sistema inmunitario de los cerdos aún no se han aclarado por completo.
⇰ En cuanto a la reducción de la proliferación de linfocitos en estudios in vivo, se ha sugerido un fenómeno de aditividad tras la exposición conjunta a las toxinas AF y FB u OTA y T-2, y de sinergismo tras la exposición conjunta a FB y DON151.

Para comprender mejor la complejidad de las interacciones, la exposición conjunta in vivo a FB y DON dio lugar a una interacción sinérgica en la proliferación de linfocitos tras la estimulación mitogénica, una interacción aditiva en la expresión de citoquinas (IL-8; IL-1b, IL-6 y la proteína inflamatoria de los macrófagos 1b) y una interacción antagónica en los niveles de expresión de IgA y citoquinas específicas125.
 Cuando esas observaciones se combinan con las diversas propiedades inmunomoduladoras de las micotoxinas, resulta evidente que las respuestas a las vacunas, la susceptibilidad a las infecciones y el uso de antimicrobianos, así como la productividad y el rendimiento económico puedan verse alterados debido a la ingestión de micotoxinas, en condiciones de campo. Esas cuestiones deben tenerse en cuenta al evaluar la necesidad de un programa preventivo regular para las micotoxinas en las explotaciones agrícolas.
Cuando esas observaciones se combinan con las diversas propiedades inmunomoduladoras de las micotoxinas, resulta evidente que las respuestas a las vacunas, la susceptibilidad a las infecciones y el uso de antimicrobianos, así como la productividad y el rendimiento económico puedan verse alterados debido a la ingestión de micotoxinas, en condiciones de campo. Esas cuestiones deben tenerse en cuenta al evaluar la necesidad de un programa preventivo regular para las micotoxinas en las explotaciones agrícolas. REFERENCIAS
REFERENCIAS
1. Gruber-Dorninger, C.; Jenkins, T.; Schatzmayr, G. Global Mycotoxin Occurrence in Feed: A Ten-Year Survey. Toxins 2019, 11, 375, doi:10.3390/toxins11070375.
2. Devreese, M.; De Backer, P.; Croubels, S. Overview of the most important mycotoxins for the pig and poultry husbandry. Vlaams Diergen. Tijds. 2013a, 82, 171-180.
3. Eskola, M.; Kos, G.; Elliott, C.T.; Hajšlová, J.; Mayar S.; Krska R. Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’ of 25%, Crit. Rev. Food Sci. Nutr., 2019 DOI: 10.1080/10408398.2019.1658570.
4. Yang, C.; Song, G.; Lim, W. Effects of mycotoxin-contaminated feed on farm animals, J. Hazard. Mater. 2020, 389, 122087. doi:10.1016/j.jhazmat.2020.122087.
5. D’mello, J.; Placinta, C.; Macdonald, A. Fusarium mycotoxins: A review of global implications for animal health, welfare and productivity. Anim. Feed Sci. Tech. 1999, 80, 183–205. doi: 10.1016/S0377 8401(99)00059-0.
6. Ensley, S.M.; Radke, S.L. Mycotoxins in Grains and Feeds. In Disease of Swine, 11th ed.; Zimmerman, J.J.; Karriker, L.A., Ramirez, A., Schwartz, K.J., Stevenson, G.W., Zhang, J. Eds.; Wiley-Blackwell: Hoboken, NJ, USA, 2019; pp. 1055–1071, doi:10.1002/9781119350927. ch69.
7. Maresca, M. From the gut to the brain: journey and pathophysiological effects of the food-associated trichothecene mycotoxin deoxynivalenol. Toxins, 2013, 5(4), 784–820. doi: 10.3390/toxins5040784.
8. Oswald, I.P.; Marin, D.E.; Bouhet, S.; Pinton, P.; Taranu, I.; Accensi, F. Immunotoxicological risk of mycotoxins for domestic animals. Food Addit Contam. 2005, 22, 354-60. doi: 10.1080/02652030500058320.
9. Gerner, W.; Käser, T.; Saalmüller, A. Porcine T lymphocytes and NK cells–an update. Dev Comp Immunol. 2009, 33, 310-20. doi: 10.1016/j.dci.2008.06.003.
10. Mair, K.H.; Sedlak, C.; Käser, T.; Pasternak, A.; Levast, B.; Gerner, W.; Saalmüller, A.; Summerfield, A.; Gerdts, V.; Wilson, H.L.; Meurens, F. The porcine innate immune system: an update. Dev Comp Immunol. 2014, 45, 321-43. doi: 10.1016/j.dci.2014.03.022.
11. Chase, C.; Lunney J.K. The immune system. In Disease of Swine, 11th ed.; Zimmerman, J.J.; Karriker, L.A., Ramirez, A., Schwartz, K.J., Stevenson, G.W., Zhang, J. Eds.; Wiley-Blackwell: Hoboken, NJ, USA, 2019; pp. 264–291, doi:10.1002/9781119350927.ch69.
12. Rothkötter, H.L. Anatomical particularities of the porcine immune system—A physician’s view. Dev. Comp. Immunol. 2009, 33, 267-272. doi: 0.1016/j.dci.2008.06.016.
13. Wilson, H.; Obradovic, M.R. Evidence for a common mucosal immune system in the pig. Mol Immunol. 2015, 66, 22-34. doi: 10.1016/j.molimm.2014.09.004.
14. Broom L. Mycotoxins and the intestine. Anim. Nutr. 2015, 1, 262 265.
15. Bouhet, S.; Oswald, I.P. The effects of mycotoxins, fungal food contaminants, on the intestinal epithelial cell-derived innate immune response. Vet. Immunol. Immun. 2005, 108, 199–209. doi: 10.1016/j.vetimm.2005.08.010.
16. Corrier, D. Mycotoxicosis: Mechanisms of immunosuppression. Vet. Immunol. Immun. 1991, 30, 73–87. doi: 10.1016/0165- 2427(91)90010-A.
17. Ramos, A.J.; Hernandez, E. Prevention of aflatoxicosis in farm animals by means of hydrated sodium calcium aluminosilicate addition to feedstuffs: a review. Anim. Feed Sci. Technol. 1997, 65, 197-206. doi: 10.1016/S0377-8401(96)01084-X.
18. Duarte, S.C.; Lino, C.M.; Pena, A. Ochratoxin A in feed of food producing animals: an undesirable mycotoxin with health and performance effects. Vet Microbiol. 2011 154, 1-13. doi: 10.1016/j.vetmic.2011.05.006.
19. Pinton, P.; Accensi, F.; Beauchamp, E.; Cossalter, A-M.; Callu, P.; Grosjean, F.; Oswald, I.P. Ingestion of deoxynivalenol (DON) contaminated feed alters the pig vaccinal immune responses. Toxicol. Lett. 2008, 177, 215-222. doi:10.1016/j.toxlet.2008.01.015.
20. Antonissen, G.; Martel, A.; Pasmans, F.; Ducatelle, R.; Verbrugghe, E.; Vandenbroucke, V.; Li, S.; Haesebrouck, F.; Van Immerseel, F.; Croubels, S. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases. Toxins 2014, 6, 430-52. doi: 10.3390/toxins6020430.
21. Pierron, A.; Alassane-Kpembi, I.; Oswald, I.P. Impact of mycotoxin on immune response and consequences for pig health. Anim. Nutr. 2016, 2, 63-68. doi:10.1016/j.aninu.2016.03.001.
22. Rotter, B.A.; Thompson, B.K.; Lessard, M.; Trenholm, H.L.; Tryphonas, H. Influence of low-level exposure to Fusarium mycotoxins on selected immunological and hematological parameters in young swine. Fundam. Appl. Toxicol. 1994, 23, 117–124.
23. Pestka, J.J. Deoxynivalenol: mechanisms of action, human exposure, and toxicological relevance. Arch. Toxicol. 2010a, 84, 663–679.
24. Pestka JJ, Zhou HR, Moon Y, Chung YJ. Cellular and molecular mechanisms for immune modulation by deoxynivalenol and other trichothecenes: unraveling a paradox. Toxicol. Lett., 2004, 153, 61–73. doi: 10.1016/j.toxlet.2004.04.023.
25. EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain), Knutsen, H.K.; Alexander, J.; Barregard, L.; Bignami, M.; Bruschweiler, B.; Ceccatelli, S.; Cottrill, B.; Dinovi, M. et al. Scientific Opinion on the risks to human and animal health related to the presence of deoxynivalenol and its acetylated and modified forms in food and feed. EFSA J 2017, 15, 4718, 345 pp. doi: 10.2903/j efsa.2017.4718.
26. Zhou, H.R.; Islam, Z.; Pestka, J.J. Induction of competing apoptotic and survival signaling pathways in the macrophage by the ribotoxic trichothecene deoxynivalenol. Toxicol Sci. 2005, 87, 113–122. doi:10.1093/toxsci/kfi234.
27. Pestka, J.J. Mechanisms of deoxynivalenol-induced gene expression and apoptosis. Food Addit. Contam. 2008, 25, 1128–1140.
28. Pestka, J.J. Deoxynivalenol-induced proinflammatory gene expression: mechanisms and pathological sequelae. Toxins 2010b, 2, 1300–1317.
29. Ueno, Y. Toxicological features of T-2 toxin and related trichotnecenes. Fundam Appl. Toxicol. 1984, 4, S124–S132.
30. Iordanov, M.S.; Pribnow, D.; Magun, J.L.; Dinh, T.H.; Pearson, J.A.; Chen, S.L.; Magun, B.E. Ribotoxic stress response: Activation of the stress-activated protein kinase JNK1 by inhibitors of the peptidyl transferase reaction and by sequence-specific RNA damage to the alpha-sarcin/ricin loop in the 28S rRNA. Mol. Cell Biol. 1997, 17, 3373–3381.
31. Laskin, J.D.; Heck, D.E.; Laskin, D.L. The ribotoxic stress response as a potential mechanism for MAP kinase activation in xenobiotic toxicity. Toxicol. Sci. 2002, 69, 89–291.
32. Cobb, M.H. MAP kinase pathways. Prog. Biophys. Mol. Biol. 1999, 71, 479-500.
33. Dong, C.; Davis, R.J.; Flavell, R.A. MAP kinases in the immune response. Annu. Rev. Immunol. 2002, 20, 55–72.
34. Accensi, F.; Pinton, P.; Callu, P.; Abella-Bourges, N.; Guelfi, J.F.; Grosjean, F.; Oswald, I.P. Ingestion of low doses of deoxynivalenol does not affect hematological, biochemical, or immune responses of piglets. J Anim Sci. 2006, 84, 1935-42. doi: 10.2527/jas.2005-355.
35. Drochner, W.; Schollenberger, M.; Piepho, H.P.; Gotz, S.; Lauber, U.; Tafaj, M.; Klobasa, F.; Weiler, U.; Claus, R.; Steffl, M. Serum IgA-promoting effects induced by feed loads containing isolated deoxynivalenol (DON) in growing piglets. J. Toxicol. Environ. Health A.2004, 67, 1051–1067.
36. Döll, S.; Schrickx, J. A.; Dänicke, S.; Fink-Gremmels, J. Deoxynivalenol-induced cytotoxicity, cytokines and related genes in unstimulated or lipopolysaccharide stimulated primary porcine macrophages. Toxicol. Lett. 2009a, 184, 97–106.
37. Frankic, T.; Salobir, J.; Rezar, V. The effect of vitamin E supplementation on reduction of lymphocyte DNA damage induced by T-2 toxin and deoxynivalenol in weaned pigs. Anim. Feed Sci. Technol. 2008, 141: 274-286. doi: 10.1016/j.anifeedsci.2007.06.012.
38. Tiemann, U.; Brüssow, K.P.; Jonas, L.; Pohland, R.; Schneider, F.; Dänicke, S. Effects of diets with cereal grains contaminated by graded levels of two Fusarium toxins on selected immunological and histological measurements in the spleen of gilts. J Anim Sci 2006, 84, 236–245. doi: 0.2527/2006.841236x.
39. Ferrari, L.; Cantoni, A.M; Borghetti, P.; De Angelis, E.; Corradi, A. Cellular immune response and immunotoxicity induced by DON (deoxynivalenol) in piglets. Vet. Res. Comm. 2009, 33, 133-135.
40. Döll, S; Dänicke, D. The Fusarium toxins deoxynivalenol (DON) and zearalenone (ZON) in animal feeding. Prev. Vet. Med. 2011, 102, 132-45.
41. Döll, S.; Schrickx, J.A.; Dänicke, S.; Fink-Gremmels, J. Interactions of deoxynivalenol and lipopolysaccharides on cytokine excretion and mRNA expression in porcine hepatocytes and Kupffer cell enriched hepatocyte cultures. Toxicol Lett. 2009b, 190, 96-105. doi: 10.1016/j.toxlet.2009.07.007.
42. Lessard, M.; Savard, C.; Deschene, K.; Lauzon, K.; Pinilla, V.A.; Gagnon CA.; Lapointe, J.; Guay, F.; Chorfi, Y. Impact of deoxynivalenol (DON) contaminated feed on intestinal integrity and immune response in swine. Food Chem Toxicol. 2015, 80, 7-16.
43. Overnes, G.; Matre, T.; Sivertsen, T.; Larsen, H.J.; Langseth, W.; Reitan, L.J.; Jansen, J.H.. Effects of diets with graded levels of naturally deoxynivalenol-contaminated oats on immune response in growing pigs. Zentralbl Veterinarmed A. 1997, 44, 539–550.
44. Sobrova P, Adam V, Vasatkova A, Beklova M, Zeman L, Kizek R. Deoxynivalenol and its toxicity. Interdiscip. Toxicol. 2010, 3, 94–9. doi:10.2478/v10102-010-0019-x.
45. Wang, X.; Liu, Q.; Ihsan, A.; Huang, L.; Dai, M.; Hao, H.; Cheng, G.; Liu, Z.; Wang, Y.; Yuan, Z. JAK/STAT pathway plays a critical role in the proinflammatory gene expression and apoptosis of RAW264.7 cells induced by trichothecenes as DON and T-2 toxin. Toxicol. Sci. 2012, 127, 412–424.
46. Ayral, A.M.; Dubech, N.; le Bars, J.; Escoula, L. In vitro effect of diacetoxyscirpenol and deoxynivalenol on microbicidal activity of murine peritoneal macrophages. Mycopathologia 1992, 120, 121–127.
47. Sugita-Konishi, Y.; Pestka, J.J. Differential upregulation of TNF alpha, IL-6, and IL-8 production by deoxynivalenol (vomitoxin) and other 8-ketotrichothecenes in a human macrophage model. J. Toxicol. Environ. Health A 2001, 64, 619–636.
48. Sugiyama, K.; Muroi, M.; Tanamoto, K.; Nishijima, M.; Sugita Konishi, Y. Deoxynivalenol and nivalenol inhibit lipopolysaccharide induced nitric oxide production by mouse macrophage cells. Toxicol. Lett. 2010, 192, 150–154.
49. Ji, G.E.; Park, S.Y.; Wong, S.S.; Pestka, J.J. Modulation of nitric oxide, hydrogen peroxide and cytokine production in a clonal macrophage model by the trichothecene vomitoxin (deoxynivalenol). Toxicology 1998, 125, 203–214. doi: 10.1016/s0300-483x(97)00178-9.
50. Chung, Y.J.; Yang, G.H.; Islam, Z.; Pestka, J.J. Up-regulation of macrophage inflammatory protein-2 and complement 3A receptor by the trichothecenes deoxynivalenol and satratoxin G. Toxicology, 2003, 186, 51–65.
51. Kinser, S.; Jia, Q.; Li, M.; Laughter, A.; Cornwell, P.; Corton, J.C.; Pestka, J. Gene expression profiling in spleens of deoxynivalenol exposed mice: Immediate early genes as primary targets. J. Toxicol. Environ. Health A 2004, 67, 1423–1441.
52. Li, M.; Cuff, C.F.; Pestka, J. Modulation of murine host response to enteric reovirus infection by the trichothecene deoxynivalenol. Toxicol. Sci. 2005, 87, 134–145.
53. Li, M.; Harkema, J.R.; Cuff, C.F.; Pestka, J.J. Deoxynivalenol exacerbates viral bronchopneumonia induced by respiratory reovirus infection. Toxicol. Sci. 2007, 95, 412–426.
54. Waché, Y.J.; Hbabi-Haddioui, L.; Guzylack-Piriou, L.; Belkhelfa, H.; Roques, C.; Oswald, I.P. The mycotoxin deoxynivalenol inhibits the cell surface expression of activation markers in human macrophages. Toxicology 2009, 262, 239–244.
55. Bimczok, D.; Döll, S.; Rau, H.; Goyarts, T.; Wundrack, N.; Naumann, M.; Dänicke, S.; Rothkötter, H.-J. The Fusarium toxin deoxynivalenol disrupts phenotype and function of monocyte-derived dendritic cells in vivo and in vitro. Immunobiology 2007, 212, 655–666.
56. Pinton, P.; Oswald, I.P. Effect of deoxynivalenol and other type b trichothecenes on the intestine: A review. Toxins 2014, 6, 1615–1643.
57. Cano, P.M.; Seeboth, J.; Meurens, F.; Cognie, J.; Abrami, R.; Oswald, I.P; Guzylack-Piriou, L. Deoxynivalenol as a new factor in the persistence of intestinal inflammatory diseases: An emerging hypothesis through possible modulation of Th17-mediated response. PLoS ONE 2013, 8(1), e53647.
58. EFSA Panel on Contaminants in the Food Chain (CONTAM); Scientific Opinion on the risks for animal and public health related to the presence of T-2 and HT-2 toxin in food and feed. EFSA J. 2011, 9, 2481. 187 pp. doi:10.2903/j.efsa.2011.2481.
59. Bondy, G.S.; Pestka, J.J. Immunomodulation by fungal toxins. J. Toxicol. Environ. Health. B. Crit. Rev. 2000, 3, 109-143.
60. FAO/WHO (Food and Agriculture Organization of the United Nations/World Health Organization), 2001. WHO FOOD ADDITIVES SERIES: 47, Safety evaluation of certain mycotoxins in food. Deoxynivalenol. Prepared by the Fifty-sixth meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). Available from http://www.inchem.org/documents/jecfa/jecmono/v47je01.htm. 419-528.
61. Rocha, O.; Ansari, K.; Doohan, F.M. Effects of trichothecene mycotoxins on eukaryotic cells: a review. Food Addit. Contam. 2005, 22,369-378.
62. Liao, Y.; Peng, Z.; Chen, L.; Nüssler, A.K.; Liu, L.; Yang, W. Deoxynivalenol, gut microbiota and immunotoxicity: A potential approach? Food Chem. Toxicol., 2018, 112, 342-354, doi:10.1016/j.fct.2018.01.013.
63. Jaradat, Z.W. T-2 mycotoxin in the diet and its effects on tissues. In: Reviews in Food and Nutrition Toxicity. Volume 4. Eds Watson RR and Preedy VR. 2005, CRC Press, 173-212.
64. Hymery, N.; Leon, K.; Carpentier, F.G.; Jung, J.L.; Parent-Massin, D. T-2 toxin inhibits the differentiation of human monocytes into dendritic cells and macrophages. Toxicol In Vitro. 2009, 23, 509-519. 10.1016/j.tiv.2009.01.003.
65. Seeboth, J.; Solinhac, R.; Oswald, I.P.; Guzylack-Piriou, L. The fungal T-2 toxin alters the activation of primary macrophages induced by TLR-agonists resulting in a decrease of the inflammatory response in the pig. Vet Res 2012, 43, 35. https://doi.org/10.1186/1297-9716-43-35.
66. Devreese M, De Backer P, Croubels S. Different methods to counteract mycotoxin production and its impact on animal health. Vlaams Diergen Tijds. 2013b, 82, 181–190.
67. Henghold, W.B. Other biologic toxin bioweapons: ricin, staphylococcal enterotoxin B, and trichothecene mycotoxins. Dermatol Clin. 2004, 22, 257–262.
68. Afsah-Hejri, L.; Jinap, S.; Hajeb, P.; Radu, S.; Shakibazadeh, S.H. A review on mycotoxins in food and feed: Malaysia case study. Compr Rev Food Sci F. 2013, 12, 629–651.
69. Adhikari, M.; Negi, B.; Kaushik, N.; Adhikari, A.; Al-Khedhairy, A.A.; Kaushik, N.K.; Choi, E.H. T-2 mycotoxin: toxicological effects and decontamination strategies. Oncotarget. 2017 8, 33933-33952. doi: 10.18632/oncotarget.15422.
70. Obremski, K.; Podlasz, P.; Żmigrodzka, M.; Winnicka, A.; Woźny, M.; Brzuzan, P.; Jakimiuk, E.; Wojtacha, P.; Gajęcka, M.; Zielonka, L.;Gajęcki, M. The effect of T-2 toxin on percentages of CD4+, CD8+, CD4+CD8+ and CD21+ lymphocytes, and mRNA expression levels of selected cytokines in porcine ileal Peyer’s patches. Pol J Vet Sci. 2013, 16, 341–349.
71. Johnsen, H.; Odden, E.; Johnsen, B.A.; Bøyum, A.; Amundsen, E. Cytotoxicity and effects of T-2-toxin on plasma proteins involved incoagulation, fibrinolysis and kallikrein-kinin system. Arch Toxicol. 1988, 61, 237–240.
72. Horvatovich, K.; Hafner, D.; Bodnár, Z.; Dose-related genotoxic effect of T-2 toxin measured by comet assay using peripheral blood mononuclear cells of healthy pigs. Acta Vet Hung. 2013, 61, 175-186. doi:10.1556/AVet.2013.010.
73. Weaver, G.A.; Kurtz, H.J.; Bates, F.Y.; Chi, M.S.; Mirocha, C.J.; Behrens, J.C.; Robison, T.S. Acute and chronic toxicity of T-2 mycotoxin in swine. Vet. Rec. 1978, 103, 531-535.
74. Rafai, P.; Tuboly, S.; Bata, A.; Tilly, P.; Vanyi, A.; Papp, Z.; Jakab, L. Tury, E. Effect of various levels of T-2 toxin in the immune system ofgrowing pigs. Vet. Rec. 1995, 136, 511-514.
75. Meissonnier GM, Laffitte J, Raymond I, Benoit E, Cossalter AM, Pinton P, Bertin, G.; Oswald, I.P.; Galtier, P. Subclinical doses of T-2 toxin impair acquired immune response and liver cytochrome P450 in pigs. Toxicol. 2008a, 247, 46-54.
76. Li. M.; Harkema, J.R.; Islam. Z.; Cuff, C.F.; Pestka, J.J. T-2 toxin impairs murine immune response to respiratory reovirus andexacerbates viral bronchiolitis. Toxicol. Appl. Pharmacol., 2006b, 217, 76-85.
77. Wu, Q.H.; Wang, X.; Nepovimova, E.; Miron, A.; Liu, Q.Y.; Wang, Y.; Su, D.X.; Yang, H.L.; Li, L.; Kuca, K. Trichothecenes: Immunomodulatory effects, mechanisms, and anti-cancer potential. Arch. Toxicol. 2017a, 91, 3737–3785.
78. Wu Q., Wang X., Nepovimova E., Wang Y., Yang H., Li L., Zhang X., Kuca K. Antioxidant agents against trichothecenes: new hints foroxidative stress treatment. Oncotarget. 2017b, 8, 110708-110726.
79. Wu, Q, Wu W, Franca TCC, Jacevic V, Wang X, Kuca K. Immune Evasion, a Potential Mechanism of Trichothecenes: New Insights intoNegative Immune Regulations. Int J Mol Sci. 2018 19, 3307. doi: 10.3390/ijms19113307.
80. Payros, D.; Alassane-Kpembi, I.; Pierron, A. Loiseau, N.; Pinton, P.; Oswald, I.P. Toxicology of deoxynivalenol and its acetylated andmodified forms. Arch Toxicol. 2016, 90, 2931–2957. doi: 10.1007/s00204-016-1826-4.
81. Katika, M.R.; Hendriksen, P.J.M.; Shao, J.; van Loveren, H.; Peijnenburg, A. Transcriptome analysis of the human T lymphocyte cell line Jurkat and human peripheral blood mononuclear cells exposed to deoxynivalenol (DON): new mechanistic insights. Toxicol. Appl. Pharm.2012, 264, 51–64.
82. Mashima, T.; Udagawa, S.; Tsuruo, T. Involvement of transcriptional repressor ATF3 in acceleration of caspase protease activationduring DNA damaging agent induced apoptosis. J. Cell. Physiol. 2001, 188, 352–358.
83. Oyadomari, S.; Mori, M. Roles of CHOP/GADD153 in endoplasmic reticulum stress. Cell Death Differ. 2004, 11, 381–389.84. Qu, L.F.; Zhen, L.; Zhang, H.F.M.; Yue, S.; Xin, Y.; Sall, A.; Yang, D.C. Endoplasmic reticulum stress-induced cell survival and apoptosis. J. Chin. Clin. Med. 2009, 4, 452–459.
85. Bensassi, F.; Gallerne, C.; Sharaf, E.; Lemaire, C.; Hajlaoui, M.R. Involvement of mitochondria-mediated apoptosis in deoxynivalenolcytotoxicity. Food Chem. Toxicol. 2012, 50, 1680–1689.
86. Ma, Y.; Zhang, A.; Shi, Z.; He, C.; Ding, J.; Wang, X.; Ma, J.; Zhang, H. A mitochondria- mediated apoptotic pathway induced bydeoxynivalenol in human colon cancer cells. Toxicol. In Vitro 2012, 26, 414–420.
87. He, K.; Vines, L.; Pestka, J.J. Deoxynivalenol-induced modulation of microRNA expression in RAW 264.7 macrophages-A potentialnovel mechanism for translational inhibition. Toxicologist (Toxicol.Sci. Suppl.) 2010, 114, 310.
88. Wu, Q.H.; Wang, X.; Yang, W.; Nüssler, A.K.; Xiong, L.Y.; Kuča, K.; Dohnal, V.; Zhang, X.J.; Yuan, Z.H. Oxidative stress mediatedcytotoxicity and metabolism of T-2 toxin and deoxynivalenol in animals and humans: an update. Arch Toxicol. 2014a, 88, 1309-1326.
89. Zhou HR, Pestka JJ. Deoxynivalenol-induced apoptosis mediated by p38 MAPK-dependent p53 gene induction in RAW264.7macrophages. Toxicologist. 2003; 72:330.
90. Chaudhari, M.; Jayaraj, R.; Bhaskar, A.S.; Lakshmana Rao, P.V. Oxidative stress induction by T-2 toxin cause DNA damage and triggersapoptosis via caspase pathway in human cervical cancer cells. Toxicology. 2009a, 262, 153-161.
91. Chaudhari, M.; Jayaraj, R.; Santhosh, S.R.; Lakshmana Rao, P.V. Oxidative damage and gene expression profile of antioxidant enzymesafter T-2 toxin exposure in mice. J Biochem Mol Toxicol. 2009b, 23, 212-221.
92. Bócsai A, Pelyhe C, Zándoki E, Ancsin Z, Szabó-Fodor J, Erdélyi M, Mézes M, Balogh K. Short-term effects of T-2 toxin exposure onsome lipid peroxide and glutathione redox parameters of broiler chickens. J. Anim. Physiol. Anim. Nutr. 2016, 100, 520-525.
93. Li, M.; Cuff, C,F,; Pestka, J.J. T-2 toxin impairment of enteric reovirus clearance in the mouse associated with suppressedimmunoglobulin and IFN-γ responses. Toxic Appl Pharmacol. 2006a, 214, 318–325.
94. Wu, Q.; Wang, X.; Wan, D.; Li, J.; Yuan, Z. Crosstalk of JNK1-STAT3 is critical for RAW264.7 cell survival. Cell Signal 2014b, 26,2951–2960.
95. Bin-Umer, M.A.; McLaughlin, J.E.; Butterly, M.S.; McCormick, S.; Tumer, N.E. Elimination of damaged mitochondria throughmitophagy reduces mitochondrial oxidative stress and increases tolerance to trichothecenes. PNAS 2014, 111, 11798–11803.
96. Tang, Y.; Li, J.; Li, F.; A Hu, C.A.; Liao, P.; Tan, K.; Tan, B.; Xiong, X.; Liu, G.; Li, T.; Yin, Y. Autophagy protects intestinal epithelial cellsagainst deoxynivalenol toxicity by alleviating oxidative stress via IKK signaling pathway. Free Radical Bio Med 2015, 89, 944–951.
97. Alcami, A.; Koszinowski, U.H. Viral mechanisms of immune evasion. Mol Med Today 2000, 6, 365–372.
98. Sugiyama, K.; Muroi, M.; Kinoshita, M.; Hamada, O.; Minai, Y.; Sugita-Konishi, Y.; Kamata, Y.; Tanamoto, K. NF-κB activation viaMyD88-dependent Toll-like receptor signaling is inhibited by trichothecene mycotoxin deoxynivalenol. J Toxicol Sci 2016, 41, 273–279.
99. Dänicke, S.; Winkler, J. Invited review: Diagnosis of zearalenone (ZEN) exposure of farm animals and transfer of its residues into edibletissues (carry over). Food Chem. Toxicol. 2015, 84, 225–249, doi:10.1016/j.fct.2015.08.009.
100. Rai, A.; Das, M.; Tripathi A. Occurrence and toxicity of a fusarium mycotoxin, zearalenone, Crit. Rev. Food Sci. Nutr. 2019, 26, 1-20. doi:10.1080/10408398.2019.1655388.
101. Lang, T.J. Estrogen as immunomodulator. Clin. Immunol. 2004, 113, 224–230.
102. Abbès, S.; Salah-Abbès, J.B.; Ouanes, Z.; Houas, Z.; Othman, O.; Bacha, H.; Abdel-Wahhab, M.A.; Oueslati, R. Preventive role ofphyllosilicate clay on the immunological and biochemical toxicity of zearalenone in Balb/c mice. Int. Immunopharmacol. 2006, 6,1251–1258. doi: 10.1016/j.intimp.2006.03.012.
103. Hueza, I.M.; Raspantini, P.C.; Raspantini, L.E.; Latorre, A.O.; Górniak, S.L. Zearalenone, an estrogenic mycotoxin, is an immunotoxiccompound. Toxins 2014, 6, 1080-95.
104. Pistol, G.C.; Braicu, C.; Motiu, M.; Gras, M.A.; Marin, D.E.; Stancu, M.; Calin, L.; Israel-Roming, F.; Berindan-Neagoe, I.; Taranu, I.Zearalenone mycotoxin affects immune mediators, MAPK signalling molecules, nuclear receptors and genome-wide gene expression inpig spleen. PLoS ONE. 2015, 10, 0127503. doi: 10.1371/journal.pone.0127503.
105. Reddy, K.E.; Jeong, J.Y.; Lee, Y.; Lee, H.J.; Kim, M.S.; Kim, D.W.; Jung, H.J.; Choe, C.; Oh, Y.K.; Lee, S.D. Deoxynivalenol- and zearalenone-contaminated feeds alter gene expression profiles in the livers of piglets. Asian-Aust. J. Anim. Sci. 2018, 31, 595–606.
106. Choi, B.K.; Cho, J.H.; Jeong, S.H.; Shin, H.S.; Son, S.W.; Yeo, Y.K.; Kang, H.G. Zearalenone affects immune-related parameters inlymphoid organs and serum of rats vaccinated with porcine parvovirus vaccine. Toxicol Res. 2012, 28, 279-88.
107. Marin, D.E.; Taranu, I.; Burlacu, R.; Manda, G.; Motiu, M.; Neagoe I, Dragomir, C.; Stancu, M.; Calin, L. Effects of zearalenone and itsderivatives on porcine immune response. Toxicol In Vitro. 2011, 25, 1981-8.
108. Swamy, H.V.L.N.; Smith, T.K.; MacDonald, E.J.; Boermans, H.J.; Squires, E.J. Effects of feeding a blend of grains naturally contaminatedwith Fusarium mycotoxins on swine performance, brain regional neurochemistry and serum chemistry and the efficacy of a polymericglucomannan mycotoxin adsorbent. J. Anim. Sci. 2002, 80, 3257–3267.
109. Swamy, H.V.; Smith, T.K.; MacDonald, E.J.; Karrow, N.A.; Woodward, B.; Boermans, H.J. Effects of feeding a blend of grains naturally contaminated with Fusarium mycotoxins on growth and immunological measurements of starter pigs, and the efficacy of a polymeric glucomannan mycotoxin adsorbent. J Anim Sci. 2003, 81, 2792-2803. doi:10.2527/2003.81112792x.
110. Kuiper, G.G.; Lemmen, J.G.; Carlsson, B.; Corton, J.C.; Safe, S.H.; van der Saag, P.T.; van der Burg, B.; Gustafsson, J.A. Interaction ofestrogenic chemicals and phytoestrogens with estrogen receptor beta. Endocrinology. 1998, 139, 4252-63.111. Abid-Essefi, S., Ouanes, Z., Hassen, W., Baudrimont, I., Creppy, E., Bacha, H., 2004. Cytotoxicity, inhibition of DNA and proteinsyntheses and oxidative damage in cultured cells exposed to zearalenone. Toxicol. In Vitro 2004, 18, 467-474.
112. Taranu, I.; Braicu, C.; Marin, D.E.; Pistol, G.C.; Motiu, M.; Balacescu, L.; Neagoe, I.B.; Burlacu, R. Exposure to zearalenone mycotoxin alters in vitro porcine intestinal epithelial cells by differential gene expression. Toxicol. Lett. 2015, 232, 310-25.
113. Marin, D.E.; Taranu, I.; Burlacu, R.; Tudor, D.S. Effects of zearalenone and its derivatives on the innate immune response of swine.Toxicon 2010, 56, 956-963.
114. Lu, J., Yu, J.Y., Lim, S.S., Son, Y.O., Kim, D.H., Lee, S.A., Shi, X., Lee, J.C., 2013. Cellular mechanisms of the cytotoxic effects of thezearalenone metabolites alpha zearalenol and beta-zearalenol on RAW264.7 macrophages. Toxicol. In Vitro 2013, 27, 1007-1017.
115. EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain), Knutsen H-K, Alexander J, Barregard L, Bignami M, et al.Scientific opinion on the risks for animal health related to the presence of fumonisins, their modified forms and hidden forms in feed. EFSAJ. 2018, 16, 5242, 144 pp. https://doi.org/10.2903/j.efsa.2018.5242.
116. Taranu, I.; Marin, D.E.; Bouhet, S.; Pascale, F.; Bailly, J.D.; Miller, J.D.; Pinton, P.; Oswald, I.P. Mycotoxin fumonisin B1 alters the cytokineprofile and decreases the vaccinal antibody titer in pigs. Toxicol Sci 2005, 84, 301-7.
117. Grenier, B.; Loureiro-Bracarense, A.P.; Schwartz, H. E., Lucioli, J.; Cossalter, A.-M.; Moll, W.-D.; Schatzmayr, G.; Oswald, I.P. Biotransformationapproaches to alleviate the effects induced by fusarium mycotoxins in swine. J. Agric. Food Chem. 2013, 61, 6711−6719.
118. Grenier, B.; Bracarense, A.P.; Schwartz, H.E.; Trumel, C.; Cossalter, A.M.; Schatzmayr, G.; Kolf-Clauw, M.; Moll, W.D.; Oswald, I.P. The lowintestinal and hepatic toxicity of hydrolyzed fumonisin B1 correlates with its inability to alter the metabolism of sphingolipids. Biochem.Pharmacol., 2012, 83, 1465–1473. https://doi.org/10.1016/j.bcp. 2012.02.007.
119. Marin, D.E.; Taranu, I.; Pascale, F.; Lionide, A.; Burlacu, R.; Bailly, J.-D.; Oswald, I.P. Sex-related differences in the immune response ofweanling piglets exposed to low doses of fumonisin extract. Br. J. Nutr., 2006, 95, 1185-1192. doi: 10.1079/BJN20061773.
120. Wan, L.; Woo, C.; Turner, P.C.; Wan, J.M.; El-Nezami, H. Individual and combined effects of Fusarium toxins on the mRNA expression of pro-inflammatory cytokines in swine jejunal epithelial cells. Toxicol. Lett. 2013, 220, 238-246.
121. Devriendt, B.; Gallois, M.; Verdonck, F.; Wache, Y.; Bimczok, D.; Oswald, I.P.; Goddeeris B.M.; Cox E. The food contaminant fumonisinB1 reduces the maturation of porcine CD11R1+ intestinal antigen presenting cells and antigen-specific immune responses, leading to aprolonged intestinal ETEC infection. Vet. Res. 2009, 40, 40. doi:10.1051/vetres/2009023.
122. Stoev, S.D.; Gundasheva, D.; Zarkov, I.; Mircheva, T.; Zapryanova, D.; Denev, S.; Mitev, Y.; Daskalov, H.; Dutton, M.; Mwanza, M.;Schneider, Y.J. Experimental mycotoxic nephropathy in pigs provoked by a mouldy diet containing ochratoxin A and fumonisin B1. Experim. Toxicol. Pathol. 2012, 64, 733–741.
123. Bouhet, S.; Hourcade, E.; Loiseau, N.; Fikry, A.; Martinez, S.; Roselli, M.; Galtier, P.; Mengheri, E.; Oswald, I.P. The mycotoxin fumonisin B1 alters the proliferation and the barrier function of porcine intestinal epithelial cells. Toxicol. Sci. 2004, 77, 165–171.
124. Liu, B.H.; Yu, F.Y.; Chan, M.H.; Yang, Y.L. The effects of mycotoxins, fumonisin B1 and aflatoxin B1, on primary swine alveolarmacrophages. Toxicol. Appl. Pharmacol. 2002, 80, 197–204.
125. Grenier, B.; Loureiro-Bracarense, A.P.; Lucioli, J.; Pacheco, G.D.; Cossalter, A.M.; Moll, W.D.; Schatzmayr, G.; Oswald, I.P. Individual andcombined effects of subclinical doses of deoxynivalenol and fumonisins in piglets. Mol Nutr Food Res 2011, 55, 761-71.
126. Meissonnier, G.M.; Marin. D.E.; Galtier, P.; Bertin, G.; Taranu, I.; Oswald, I.P. Modulation of the immune response by a group of fungalfood contaminant, the aflatoxins. In: Mengheri E, Roselli M, Bretti MS, Finamore A, editors. Nutrition and immunity; 2006. 147-66.
127. Marin, D.E.; Taranu, I.; Bunaciu, P.R.; Pascale, F.; Tudor, D.S.; Avram, N.; Sarca, M.; Cureu, I.; Criste, R.D.; Suta, V.; Oswald, I.P. Changes in performance, blood parameters, humoral and cellular immune response in weanling piglets exposed to low doses of aflatoxin. J Anim. Sci. 2002, 80, 1250–1257.
128. Silvotti, L.; Petterino, C.; Bonomi, A.; Cabassi, E. Immunotoxicological effects on piglets of feeding sows diets containing aflatoxins. Vet Rec. 1997, 141, 469-72.
129. Cysewski, S.J.; Wood, R.L.; Pier, A.C.; Baetz, A.L. Effects of aflatoxin on the development of acquired immunity to swine erysipelas. Am J Vet Res 1978, 39, 445-8.
130. Meissonnier, G.M.; Pinton, P.; Laffitte, J.; Cossalter, A.M.; Gong, Y.Y.; Wild, C.P.; Bertin, G.; Galtier, P.; Oswald, I.P. Immunotoxicity ofaflatoxin B1: impairment of the cell-mediated response to vaccine antigen and modulation of cytokine expression. Toxicol Appl Pharmacol2008b, 231, 142-149.
131. Sun, Y.; Su, J.; Liu, Z.; Liu, D.; Gan, F.; Chen, X.; Huang, K. Aflatoxin B1 Promotes Influenza Replication and Increases Virus Related LungDamage via Activation of TLR4 Signaling. Front Immunol. 2018, 9, 2297. doi: 10.3389/fimmu.2018.02297.
132. Hao, S.; Pan, S.; Hu, J.; Qian, G.; Gan, F.; Huang, K. Aflatoxin B1 suppressed T-cell response to Anti-pig-CD3 monoclonal antibodystimulation in primary porcine splenocytes: a role for the extracellular regulated protein kinase (ERK1/2) MAPK signaling pathway. J. Agric.Food Chem. 2015, 63, 6094–6101.
133. Mehrzad, J.; Devriendt, B.; Baert, K.; Cox, E. Aflatoxin B(1) interferes with the antigen presenting capacity of porcine dendritic cells.Toxicol Vitro 2014, 28, 531-7.
134. Mehrzad, J.; Devriendt, B.; Baert, K.; Cox, E. Aflatoxins of type B and G affect porcine dendritic cell maturation in vitro. J Immunotoxicol2015, 12, 174-80.
135. Harvey, R.B.; Elissalde, M.H.; Kubena, L.F.; Weaver, E.A.; Corrier, D.E.; Clement, B.A. Immunotoxicity of ochratoxin A to growing gilts.Am J Vet Res. 1992, 53, 1966-70.
136. Stoev, S.D.; Goundasheva, D.; Mirtcheva, T.; Mantle, P.G. Susceptibility to secondary bacterial infections in growing pigs as an early response in ochratoxicosis. Experim. Toxicol. Pathol. 2000, 52, 287-296. doi: 10.1016/s0940-2993(00)80049-4.
137. Bernardini, C.; Grilli, E.; Duvigneau, J.C.; Zannoni, A.; Tugnoli, B.; Gentilini, F.; Bertuzzi, T.; Spinozzi, S.; Camborata, S.; Bacci, ML.; Piva,A.; Forni, M. Cellular stress marker alteration and inflammatory response in pigs fed with an ochratoxin contaminated diet. Res Vet Sci.2014, 97, 244-50.
138. EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain), Schrenk, D.; Bodin, L.; Chipman, J.K.; del Mazo, J.; et al..Scientific Opinion on the risk assessment of ochratoxin A in food. EFSA J. 2020, 18, 6113, 150 pp. https://doi.org/10.2903/j.efsa.2020.6113.
139. Keblys, M.; Bernhoft, A.; Höfer, C.C.; Morrison, E.; Larsen, H.J.; Flåøyen, A. The effects of the Penicillium mycotoxins citrinin, cyclopiazonic acid, ochratoxin A, patulin, penicillic acid, and roquefortine C on in vitro proliferation of porcine lymphocytes.Mycopathologia. 2004, 158, 317-24. doi: 10.1007/s11046-005-5523-8.
140. Xu, H., Hao, S., Gan, F., Wang, H., Xu, J., Liu, D., Huang, K.,. In vitro immune toxicity of ochratoxin A in porcine alveolar macrophages:a role for the ROS-relative TLR4/MyD88 signaling pathway. Chem. Biol. Interact. 2017, 272, 107–116.
141. Marin, D.E.; Braicu, C.; Gras, M.A.; Pistol, G.C.; Petric, R.C.; Berindan Neagoe, I.; Palade, M.; Taranu, I. Low level of ochratoxin A affects genome-wide expression in kidney of pig. Toxicon, 2017a, 136, 67–77.
142. Marin, D.E.; Pistol, G.C.; Gras, M.A.; Palade, M.L.; Taranu, I. Comparative effect of ochratoxin A on inflammation and oxidative stressparameters in gut and kidney of piglets. Regulatory Toxicol. and Pharmacol. 2017b, 89, 224–231.
143. Gan, F.; Zhou, Y.J.; Hou, L.L.; Qian, G.; Chen, X.X.; Huang, K.H. Ochratoxin A induces nephrotoxicity and immunotoxicity throughdifferent MAPK signaling pathways in PK15 cells and porcine primary splenocytes. Chemosphere. 2017a, 182, 630–637.
144. Ferrante, M.C.; Bilancione, M.; Raso, G.M.; Esposito, E.; Iacono, A.; Zaccaroni, A.; Meli, R. Expression of COX-2 and hsp72 in peritonealmacrophages after an acute ochratoxin A treatment in mice. Life Sci. 2006, 79, 1242– 1247.
145. Shen, X.L.; Zhang, Y.; Xu, W.; Liang, R.; Zheng, J.; Luo, Y.; Wang, Y.; Huang, K. An iTRAQ-based mitoproteomics approach for profilingthe nephrotoxicity mechanisms of ochratoxin A in HEK 293 cells. J. Proteomics, 2013, 78, 398–415. https://doi.org/10.1016/j.jprot.2012.10.010.
146. Gan F, Hou LL, Zhou YJ, Liu YH, Huang D, Chen XX and Huang KH, 2017b. Effects of ochratoxin A on ER stress, MAPK signalingpathway and autophagy of kidney and spleen in pigs. Environm. Toxicol. 2017b, 32, 2277–2286.
147. Fisher, M.; Henk, D.; Briggs, C.; Brownstein, J.S.; Madoff, L.C.;, McCraw, S.L.; Gurr, S.J. Emerging fungal threats to animal, plant andecosystem health. Nature 2012, 484, 186–194. https://doi.org/10.1038/nature10947.
148. Basso, K.; Gomes, F.; Bracarense, A.P.L. Deoxynivanelol and fumonisin, alone or in combination, induce changes on intestinal junction complexes and in e-cadherin expression. Toxins 2013, 5, 2341–52.
149. Pinton, P.; Nougayrède, J-P.; Del Rio, J-C.; Moreno, C.; Marin, D.E.; Ferrier, L.; Bracarense, A.P.; Kolf-Clauw, M.; Oswald, I.P. The foodcontaminant deoxynivalenol, decreases intestinal barrier permeability and reduces claudin expression. Toxicol Appl Pharmacol. 2009, 237,41–8.
150. Bracarense, A.F.L.; Lucioli, J.; Grenier, B.; Pacheco, G.D.; Moll, W.; Schatzmayr, G.; Oswald, I.P. Chronic ingestion of deoxynivalenol andfumonisin , alone or in interaction, induces morphological and immunological changes in the intestine of piglets. Br. J. Nutr., 2012, 107,1776–86. doi:10.1017/S0007114511004946.
151. Grenier, B.; Oswald, I.P. Mycotoxin co-contamination of foods and feeds: metaanalysis of publications describing toxicologicalinteractions. World Mycotoxin J 2011, 4, 285-313.




 Prevención de micotoxicosis
Prevención de micotoxicosis