Sabry El-khodary
Profesor de Medicina Interna y vicedecano de estudios de postgrado y asuntos de investigación, Facultad de Medicina Veterinaria, Universidad de Mansoura, Egipto
Los rumiantes son menos vulnerables a los efectos adversos causados por las micotoxinas en comparación con los animales monogástricos.
⇰ Esto se basa en la hipótesis de que la microbiota que reside en el rumen puede degradar e inactivar las micotoxinas, protegiendo así al animal (Fink-Gremmels, 2008a).
![]() Sin embargo, las micotoxinas que son capaces de resistir la degradación en el rumen pueden, sin duda, causar síntomas clínicos de intoxicación.
Sin embargo, las micotoxinas que son capaces de resistir la degradación en el rumen pueden, sin duda, causar síntomas clínicos de intoxicación.
Las vacas lecheras pueden estar expuestas a un número variable de micotoxinas procedentes de diferentes materias primas, como forrajes y concentrados (Smith, 2014).
Las Aflatoxinas (AF) producidas por especies de Aspergillus, las Fumonisinas (FUM), la Zearalenona (ZEN), la toxina T-2 (T-2) y el Deoxinivalenol (DON) producidos por especies de Fusarium, y la Ocratoxina A (OTA) producida por especies de Aspergillus y Penicillium son micotoxinas bien conocidas por su importancia agrícola (Changwa et al., 2018; Njobeh et al., 2012).

![]() Debido a un balance energético negativo preexistente, las vacas en periodo de transición son especialmente sensibles a la exposición a piensos contaminados con mohos, esporas fúngicas y micotoxinas (Donkor et al., 2016).
Debido a un balance energético negativo preexistente, las vacas en periodo de transición son especialmente sensibles a la exposición a piensos contaminados con mohos, esporas fúngicas y micotoxinas (Donkor et al., 2016).
La contaminación de los piensos para ganado lechero con micotoxinas ha sido señalada con frecuencia, lo que supone una grave limitación para la salud y la productividad de los animales.
Patogénesis de las micotoxicosis
Las micotoxinas afectan a los animales a través de diferentes mecanismos y varios factores influyen en el impacto que pueden tener, entre ellos:
- ⇰ Tipo de micotoxina
- ⇰ Especie animal
- ⇰ Edad del animal
- ⇰ Nivel y duración de la exposición a las micotoxinas
- (Pier et al., 1980)
Algunas micotoxinas afectan a órganos específicos como el hígado o los riñones (Elgioushy et al., 2020). Sin embargo, las condiciones ambientales, el estado de salud de los animales y otros factores estresantes también influyen en los efectos negativos de las micotoxinas (Tola y Kebede, 2016).
Aspergillus fumigatus es uno de los principales hongos micotoxigénicos que infectan forrajes en condiciones cálidas (Alonso et al., 2015; Frisvad et al., 2009; Storm et al., 2008).
Produce más de 226 metabolitos secundarios potencialmente bioactivos (Frisvad et al., 2009).
El DON y otros Tricotecenos, como las toxinas T-2 y HT-2, el Diacetoxiscirpenol (DAS) y el Nivalenol (NIV), son micotoxinas producidas por Fusarium, y se sospecha que están implicadas en brotes de enfermedades de animales de granja en muchas zonas del mundo (Antonissen et al., 2014).
Penicillium roqueforti y P. paneum producen varios metabolitos secundarios con efectos inmunosupresores, antibacterianos y otros efectos toxicológicos en animales (Gallo et al., 2015; O’Brien et al., 2006).

El punto de partida para que las micotoxinas afecten a la salud y la productividad de los animales es la inducción de estrés oxidativo, hipoxia, disminución de la fagocitosis e inmunosupresión (Oswald et al., 2005).
![]() Por ejemplo, se ha detectado gliotoxina, un inmunosupresor, en animales infectados por A. fumigatus con el consiguiente aumento de su virulencia (Sutton et al., 1996), y se ha descubierto que las aflatoxinas suprimen las citocinas inflamatorias en el ganado (Kurtz y Czuprynski, 1992).
Por ejemplo, se ha detectado gliotoxina, un inmunosupresor, en animales infectados por A. fumigatus con el consiguiente aumento de su virulencia (Sutton et al., 1996), y se ha descubierto que las aflatoxinas suprimen las citocinas inflamatorias en el ganado (Kurtz y Czuprynski, 1992).
 Las micotoxinas pueden afectar negativamente a la integridad intestinal, que actúa como barrera física que impide el paso de patógenos y toxinas al sistema circulatorio. También aumentan la permeabilidad intestinal y reducen la viabilidad de las células intestinales (Awad et al., 2017; Gao et al., 2020).
Las micotoxinas pueden afectar negativamente a la integridad intestinal, que actúa como barrera física que impide el paso de patógenos y toxinas al sistema circulatorio. También aumentan la permeabilidad intestinal y reducen la viabilidad de las células intestinales (Awad et al., 2017; Gao et al., 2020). Las micotoxinas afectan a la microbiota intestinal, provocando un desequilibrio en la población bacteriana.
Las micotoxinas afectan a la microbiota intestinal, provocando un desequilibrio en la población bacteriana.
Disminuyen las poblaciones bacterianas beneficiosas y aumentan las poblaciones bacterianas patógenas. Por lo tanto, debido a las vías mencionadas, pueden producirse diversos grados de enfermedad clínica (Guerre, 2020).
Por ejemplo, además de sus efectos sobre la reproducción, la Zearalenona y sus metabolitos pueden causar cambios en el ecosistema ruminal poco después de la ingestión, incluidos los eucariotas ruminales (Hartinger et al., 2023).
 Además, las micotoxinas causan daños en el tejido hepático y, en consecuencia, influyen en su capacidad de detoxifi cación (Średnicka et al., 2021).
Además, las micotoxinas causan daños en el tejido hepático y, en consecuencia, influyen en su capacidad de detoxifi cación (Średnicka et al., 2021).
Las fumonisinas actúan alterando la biosíntesis de los esfingolípidos, lo que provoca la acumulación de esfinganina y causa toxicidad (Mathur et al., 2001).
También inducen la formación de trampas extracelulares de neutrófilos (NETs), aumentan los niveles de especies reactivas de oxígeno (EROs) y disminuyen la actividad de SOD y CAT. Al mismo tiempo, la exposición a las fumonisinas provoca una fosforilación dependiente de la concentración de ERK-1/2 y p38 en los neutrófilos (Wang et al., 2020).
 Las micotoxinas producidas por Fusarium spp. y Aspergillus spp. en las dietas de vacas lecheras pueden influir negativamente en el recuento de células somáticas, los parámetros sanguíneos y la inmunidad (Jovaišienė et al., 2016).
Las micotoxinas producidas por Fusarium spp. y Aspergillus spp. en las dietas de vacas lecheras pueden influir negativamente en el recuento de células somáticas, los parámetros sanguíneos y la inmunidad (Jovaišienė et al., 2016).
Además, la respuesta de anticuerpos primarios a la inmunización con ovoalbúmina y las concentraciones séricas de sodio y osmolalidad son mayores en las vacas alimentadas con una dieta contaminada con micotoxinas de Fusarium, pero la acción fagocítica de los neutrófilos está deprimida (Korosteleva et al., 2009).
La Citrinina es una micotoxina nefrotóxica producida por varias especies de los géneros Aspergillus y Penicillium (Chain, 2012), pero también puede aparecer como contaminante indeseable en productos de fermentación de Monascus ruber y en concurrencia con OTA en alimentos o materias primas para piensos (Bouslimi et al., 2008).
![]() Los experimentos de campo han sugerido que las vacas alimentadas con dietas contaminadas con Citrinina muestran signos de prurito, pirexia y síndrome hemorrágico, así como fiebre, diarrea y uremia (Lloyd, 1980).
Los experimentos de campo han sugerido que las vacas alimentadas con dietas contaminadas con Citrinina muestran signos de prurito, pirexia y síndrome hemorrágico, así como fiebre, diarrea y uremia (Lloyd, 1980).
![]() Las micotoxinas potencialmente pueden afectar a la función reproductora del ganado (Caloni et al., 2009).
Las micotoxinas potencialmente pueden afectar a la función reproductora del ganado (Caloni et al., 2009).
ZEARALENONA
![]() Un estudio controlado con vacas no lactantes alimentadas con 500 mg de Zearalenona (concentraciones dietéticas calculadas de aproximadamente 25 ppm de Zearalenona) mostró que los cuerpos lúteos eran más pequeños en las vacas tratadas.
Un estudio controlado con vacas no lactantes alimentadas con 500 mg de Zearalenona (concentraciones dietéticas calculadas de aproximadamente 25 ppm de Zearalenona) mostró que los cuerpos lúteos eran más pequeños en las vacas tratadas.
![]() La ingesta de Zearalenona a través de la dieta, incluso cuando está por debajo del nivel umbral de contaminación permitido en Japón, puede afectar las poblaciones de folículos antrales ováricos, pero no la fertilidad, de las vacas postparto (Fushimi et al., 2015).
La ingesta de Zearalenona a través de la dieta, incluso cuando está por debajo del nivel umbral de contaminación permitido en Japón, puede afectar las poblaciones de folículos antrales ováricos, pero no la fertilidad, de las vacas postparto (Fushimi et al., 2015).
![]() Se ha encontrado que la contaminación por Zearalenona también es perjudicial para la calidad de los ovocitos en novillas (Silva et al., 2021).
Se ha encontrado que la contaminación por Zearalenona también es perjudicial para la calidad de los ovocitos en novillas (Silva et al., 2021).

Síntomas clínicos asociados a la exposición a micotoxinas
Las micotoxinas, alcaloides, ciertas lactonas y cumarinas, así como los ésteres carboxílicos eicosanoicos no son degradados (al menos, no completamente) por la microbiota ruminal y pueden producir signos clínicos (Fink-Gremmels, 2008b).
Toxinas específicas afectan a órganos o tejidos concretos como el hígado, el riñón, la mucosa oral y gástrica, el cerebro o el tracto reproductor (Fink-Gremmels, 2008b).
Las micotoxinas pueden provocar episodios agudos cuando los animales consumen cantidades críticas.
⇰ En la micotoxicosis aguda, los signos de la enfermedad suelen ser marcados y directamente referibles a los órganos diana afectados.
Sin embargo, a concentraciones más bajas (exposición crónica), los efectos de las micotoxinas son más variables.
⇰ Reducen la tasa de crecimiento de los animales jóvenes y algunos interfieren con los mecanismos de resistencia a las enfermedades y deterioran la capacidad de respuesta inmunitaria, haciendo que los animales sean más susceptibles a las infecciones (Pier et al., 1980).
Bajo estas circunstancias es frecuente observar problemas crónicos, como una mayor incidencia de enfermedades, un rendimiento reproductivo defi ciente o una producción de leche subóptima (Whitlow y Hagler Jr, 2010).
Síntomas asociados a la exposición a las aflatoxinas
Basándonos en la experiencia de campo, los principales hallazgos clínicos de la aflatoxicosis en rumiantes son:
- ⇰ Muerte súbita (Imagen 1)
- ⇰ Diarrea (Imagen 2)
- ⇰ Anorexia
- ⇰ Pelaje áspero

Imagen 1. Muerte súbita de una vaca por afl atoxicosis.

Imagen 2. Una vaca con signos de diarrea asociada a afl atoxicosis.
![]() Un brote de aflatoxicosis en ganado vacuno evidenció que la depresión y la inapetencia eran los hallazgos clínicos predominantes (Elgioushy et al., 2020).
Un brote de aflatoxicosis en ganado vacuno evidenció que la depresión y la inapetencia eran los hallazgos clínicos predominantes (Elgioushy et al., 2020).
![]() Van Halderen et al. (1989) describieron un brote de mortalidad en el campo de 7/25 terneros alimentados con raciones que contenían maíz con 11,790 μg de Aflatoxinas/kg.
Van Halderen et al. (1989) describieron un brote de mortalidad en el campo de 7/25 terneros alimentados con raciones que contenían maíz con 11,790 μg de Aflatoxinas/kg.
⇰ Los signos clínicos incluían pérdida de masa corporal, pelaje áspero, diarrea y prolapso rectal.
![]() En Australia, se reportó una aflatoxicosis aguda que causó la muerte de 12/90 terneros afectados por la sequía alimentados con heno de maní que contenía 2230 μg AF/kg (McKenzie et al., 1981).
En Australia, se reportó una aflatoxicosis aguda que causó la muerte de 12/90 terneros afectados por la sequía alimentados con heno de maní que contenía 2230 μg AF/kg (McKenzie et al., 1981).
![]() En Pakistán se registraron 45 casos de aflatoxicosis en una granja local de Okara (Sohooa et al., 2015).
En Pakistán se registraron 45 casos de aflatoxicosis en una granja local de Okara (Sohooa et al., 2015).
⇰ Las vacas fueron alimentadas con forraje rico en maíz con 33,500 μg de AF/kg y los signos clínicos observados fueron anorexia, depresión, fotosensibilización y diarrea, lo que provocó la muerte de 15 animales.
![]() Se observó una disminución significativa de la producción de leche en el ganado alimentado con 13 mg de AFB1/día durante 7 días (Applebaum et al., 1982).
Se observó una disminución significativa de la producción de leche en el ganado alimentado con 13 mg de AFB1/día durante 7 días (Applebaum et al., 1982).
![]() También se describió una disminución numérica de la producción de leche en vacas alimentadas con 75 μg/kg de ingesta de materia seca (IMS) (1725 μg/cabeza/día) durante 5 días (Ogunade et al., 2016) y (Jiang et al., 2018).
También se describió una disminución numérica de la producción de leche en vacas alimentadas con 75 μg/kg de ingesta de materia seca (IMS) (1725 μg/cabeza/día) durante 5 días (Ogunade et al., 2016) y (Jiang et al., 2018).
![]() En otro estudio (Sulzberger et al., 2017), se registró una depresión en la producción de leche y la conversión alimenticia a 100 μg AFB1/kg de IMS.
En otro estudio (Sulzberger et al., 2017), se registró una depresión en la producción de leche y la conversión alimenticia a 100 μg AFB1/kg de IMS.
![]() En cambio, algunos estudios sobre niveles bajos de aflatoxinas han mostrado una disminución poco significativa en la producción de leche (Kutz et al., 2009; Masoero et al., 2007; Sumantri et al., 2012).
En cambio, algunos estudios sobre niveles bajos de aflatoxinas han mostrado una disminución poco significativa en la producción de leche (Kutz et al., 2009; Masoero et al., 2007; Sumantri et al., 2012).
![]() Por ejemplo, se ha descrito una reducción de la producción de gas, de la digestibilidad de la materia seca y de las concentraciones de amoníaco-N causadas por la AFB1 in vitro (Mojtahedi et al., 2013).
Por ejemplo, se ha descrito una reducción de la producción de gas, de la digestibilidad de la materia seca y de las concentraciones de amoníaco-N causadas por la AFB1 in vitro (Mojtahedi et al., 2013).
![]() En otro estudio, la AFB1 redujo las concentraciones de amoníaco-N y ácidos grasos volátiles (AGV) sin reducir la digestibilidad de la materia seca ni afectar a los patrones de AGV (Jiang et al., 2012).
En otro estudio, la AFB1 redujo las concentraciones de amoníaco-N y ácidos grasos volátiles (AGV) sin reducir la digestibilidad de la materia seca ni afectar a los patrones de AGV (Jiang et al., 2012).
Síntomas asociados a la exposición al Deoxinivalenol
Se ha observado que el DON afecta a la fermentación ruminal y puede reducir la producción de leche (Whitlow y Hagler, 2010).
![]() En un estudio sobre el efecto de una dieta contaminada con DON en vacas lecheras Holstein no lactantes alimentadas con una dosis de 1,5 mg DON/kg y 6,4 mg DON/ kg de alimento durante 6 semanas, se produjo un ligero descenso en el consumo de alimento tras el cambio de la dosis baja (1,5 mg DON/kg) a la dosis alta (6,4 mg DON/kg) (Trenholm et al., 1985).
En un estudio sobre el efecto de una dieta contaminada con DON en vacas lecheras Holstein no lactantes alimentadas con una dosis de 1,5 mg DON/kg y 6,4 mg DON/ kg de alimento durante 6 semanas, se produjo un ligero descenso en el consumo de alimento tras el cambio de la dosis baja (1,5 mg DON/kg) a la dosis alta (6,4 mg DON/kg) (Trenholm et al., 1985).
![]() En terneros, se informó de insuficiencia hepática severa en terneros de 2-3 meses de edad sin rumen funcional inducida por 1,13 mg DON/kg de alimento (Valgaeren et al., 2019).
En terneros, se informó de insuficiencia hepática severa en terneros de 2-3 meses de edad sin rumen funcional inducida por 1,13 mg DON/kg de alimento (Valgaeren et al., 2019).

Síntomas asociados a la exposición Fumonisinas
Los rumiantes son más resistentes a la toxicidad de las fumonisinas que los animales monogástricos (Mathur et al., 2001).
![]() Sin embargo, en pruebas de alimentación con 75 mg FB1/kg, 94 mg FB1/kg, y 105 mg FB1/kg durante 14 días, 253 días, y 31 días, respectivamente, se encontró una reducción de la producción de leche, un menor consumo de alimento, hepatotoxicidad, nefrotoxicidad, y problemas de reproducción (Richard et al., 1996).
Sin embargo, en pruebas de alimentación con 75 mg FB1/kg, 94 mg FB1/kg, y 105 mg FB1/kg durante 14 días, 253 días, y 31 días, respectivamente, se encontró una reducción de la producción de leche, un menor consumo de alimento, hepatotoxicidad, nefrotoxicidad, y problemas de reproducción (Richard et al., 1996).
![]() La administración intravenosa experimental de 1 mg FB1/kg a terneros durante 7 días causó letargo, pérdida de apetito, hepatotoxicidad y nefrotoxicidad (Mathur et al., 2001).
La administración intravenosa experimental de 1 mg FB1/kg a terneros durante 7 días causó letargo, pérdida de apetito, hepatotoxicidad y nefrotoxicidad (Mathur et al., 2001).
![]() En un estudio con terneros machos Holstein alimentados con leche de 7 a 14 días tratados diariamente con 1 mg FB1/kg (iv) hasta la eutanasia el día 7, los terneros tratados estaban letárgicos y tenían menos apetito a partir del día 4 (Mathur et al., 2001).
En un estudio con terneros machos Holstein alimentados con leche de 7 a 14 días tratados diariamente con 1 mg FB1/kg (iv) hasta la eutanasia el día 7, los terneros tratados estaban letárgicos y tenían menos apetito a partir del día 4 (Mathur et al., 2001).
Síntomas asociados a la exposición a Ocratoxinas
La ocratoxicosis es raramente reportada en bovinos, lo que se atribuye a la capacidad de la microbiota ruminal para degradar fácilmente la OTA a formas no tóxicas (Richard et al., 1996).
![]() Sin embargo, se ha registrado experimentalmente anorexia, diarrea, dificultad para levantarse y cese de la producción de leche con recuperación al 4º día en ganado alimentado con una dosis única alta de OTA (13,3 mg DON/kg), mientras que en el campo dosis bajas (0,2 mg DON/kg, 0,75 mg DON/kg, y 1,66 mg DON/kg) durante 5 días no produjeron enfermedad clínica (Ribelin et al., 1978).
Sin embargo, se ha registrado experimentalmente anorexia, diarrea, dificultad para levantarse y cese de la producción de leche con recuperación al 4º día en ganado alimentado con una dosis única alta de OTA (13,3 mg DON/kg), mientras que en el campo dosis bajas (0,2 mg DON/kg, 0,75 mg DON/kg, y 1,66 mg DON/kg) durante 5 días no produjeron enfermedad clínica (Ribelin et al., 1978).
Síntomas asociados a la exposición a la Toxina T-2
En el ganado lechero, la Toxina T-2 se ha asociado con gastroenteritis hemorrágica (Whitlow y Hagler Jr, 2010), rechazo del alimento y lesiones gastrointestinales (Weaver et al., 1980).
![]() Weaver et al. (1980) reportaron depresión severa, ataxia de los cuartos traseros, knuckling de las patas traseras, apatía y anorexia en un ternero alimentado con 0,6 mg de toxina T-2/kg durante siete días consecutivos.
Weaver et al. (1980) reportaron depresión severa, ataxia de los cuartos traseros, knuckling de las patas traseras, apatía y anorexia en un ternero alimentado con 0,6 mg de toxina T-2/kg durante siete días consecutivos.
![]() La reducción de la producción de leche y la ausencia de celo también se han asociado a la T-2 (Whitlow y Hagler, 2010).
La reducción de la producción de leche y la ausencia de celo también se han asociado a la T-2 (Whitlow y Hagler, 2010).
Síntomas asociados a la exposición a la Zearalenona
![]() Se han registrado abortos precoces en ganado alimentado con heno que contenía 10 mg de ZEN/kg (Kallela y Ettala, 1984).
Se han registrado abortos precoces en ganado alimentado con heno que contenía 10 mg de ZEN/kg (Kallela y Ettala, 1984).
![]() También se han reportado ciclos estrales anormales, vaginitis, celo conductual en animales gestantes, desarrollo mamario en vaquillas prepuberales y esterilidad en ganado alimentado con 1,5 mg de ZEN/kg de alimento (Gupta, 2012).
También se han reportado ciclos estrales anormales, vaginitis, celo conductual en animales gestantes, desarrollo mamario en vaquillas prepuberales y esterilidad en ganado alimentado con 1,5 mg de ZEN/kg de alimento (Gupta, 2012).
![]() Estudios experimentales utilizando 500 mg y 250 mg de Zearalenona purificada al 99% en una cápsula de gelatina administrada por vía oral al ganado lechero lactante y novillas vírgenes, respectivamente, no mostraron efectos, excepto la depresión en la tasa de concepción en las novillas vírgenes (Weaver et al., 1986a, b).
Estudios experimentales utilizando 500 mg y 250 mg de Zearalenona purificada al 99% en una cápsula de gelatina administrada por vía oral al ganado lechero lactante y novillas vírgenes, respectivamente, no mostraron efectos, excepto la depresión en la tasa de concepción en las novillas vírgenes (Weaver et al., 1986a, b).
Síntomas asociados a otras infecciones fúngicas
![]() En un estudio experimental, se indujo Diplodiosis, un tipo de neuromicotoxicosis que afecta principalmente al ganado vacuno, caracterizada por ataxia, paresia y parálisis, en 13 cabezas de ganado vacuno, 16 ovejas y 3 cabras dosifi cándoles Diplodia maydis (Kellerman et al., 1985).
En un estudio experimental, se indujo Diplodiosis, un tipo de neuromicotoxicosis que afecta principalmente al ganado vacuno, caracterizada por ataxia, paresia y parálisis, en 13 cabezas de ganado vacuno, 16 ovejas y 3 cabras dosifi cándoles Diplodia maydis (Kellerman et al., 1985).
![]() En Australia, la Enfermedad Hepática Aguda Bovina (ABLD, por sus siglas en inglés) se registró en 45 bovinos afectados de forma natural en 13 brotes ocurridos entre 2010 y 2019.
En Australia, la Enfermedad Hepática Aguda Bovina (ABLD, por sus siglas en inglés) se registró en 45 bovinos afectados de forma natural en 13 brotes ocurridos entre 2010 y 2019.
⇰ Los signos clínicos incluían habitualmente una combinación de fotosensibilización leve, signos neurológicos progresivos e hipogalactia, que precedieron a la muerte en menos de 48 horas (Manthorpe et al., 2021).
Lesiones asociadas a la exposición a micotoxinas
Lesiones inducidas por aflatoxinas
Según la experiencia de campo, la vesícula biliar, el hígado y los riñones son los órganos más comúnmente afectados en casos de aflatoxicosis (Imágenes 3, 4 y 5).
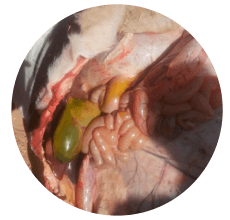
Imagen 3. Vesícula biliar agrandada en una vaca muerta afectada por aflatoxicosis.

Imagen 4. Congestión renal en ganado bovino afectado por aflatoxicosis.
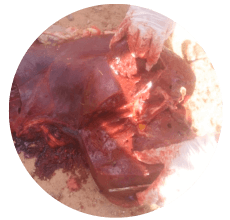
Imagen 5. Hígado con zonas necróticas en una vaca con aflatoxicosis.
Se ha observado que la toxicidad aguda por aflatoxinas provoca importantes signos de lesiones hepáticas que dan lugar a congestión y hemorragias (Pier, 1992; Pier y Richard, 1992).
La aflatoxicosis también provoca la acumulación de ácidos grasos en el hígado, los riñones y el corazón, y puede ser responsable de encefalopatías y edemas (Pfohl-Leszkowicz, 2000).
Sin embargo, la aflatoxicosis crónica es más frecuente y, en este caso, el hígado es el principal objetivo.
Las aflatoxinas actúan como agentes intercalantes del ADN, uniéndose a las bases de guanina y provocando la muerte celular o la formación de tumores (Pfohl-Leszkowicz, 2000).
Lesiones inducidas por Fumonisinas
![]() La administración oral de una dieta que contenía FB1 (2,36 mg FB1/kg/día incrementado a 3,54 mg FB1/kg/día) a terneros durante 239 a 253 días mostró proporciones elevadas de esfinganina/esfingosina con cambios morfológicos hepatocelulares leves acompañados de cambios epiteliales leves del conducto biliar (Baker y Rottinghaus, 1999).
La administración oral de una dieta que contenía FB1 (2,36 mg FB1/kg/día incrementado a 3,54 mg FB1/kg/día) a terneros durante 239 a 253 días mostró proporciones elevadas de esfinganina/esfingosina con cambios morfológicos hepatocelulares leves acompañados de cambios epiteliales leves del conducto biliar (Baker y Rottinghaus, 1999).
![]() Las concentraciones de esfinganina y esfingosina en hígado, riñón, pulmón, corazón y músculo esquelético aumentaron en terneros Holstein machos alimentados con leche de 7 a 14 días de edad tratados con 1 mg/kg (iv) diariamente hasta su eutanasia el día 7.
Las concentraciones de esfinganina y esfingosina en hígado, riñón, pulmón, corazón y músculo esquelético aumentaron en terneros Holstein machos alimentados con leche de 7 a 14 días de edad tratados con 1 mg/kg (iv) diariamente hasta su eutanasia el día 7.
⇰ En este caso, las lesiones hepáticas se caracterizaban por cordones hepáticos desorganizados, apoptosis de hepatocitos de gravedad variable, proliferación de hepatocitos y proliferación de células de los conductos biliares.
⇰ Además, las lesiones renales consistían en cambios vacuolares, apoptosis, cariomegalia y proliferación de células tubulares renales proximales, así como dilatación de los túbulos renales proximales (Mathur et al., 2001).
![]() Además, en dos terneros alimentados con el nivel máximo de Fumonisinas se describieron aumentos significativos de la actividad de las enzimas hepáticas en suero, con lesiones hepáticas microscópicas leves y una alteración final de la blastogénesis linfocitaria (Osweiler et al., 1993).
Además, en dos terneros alimentados con el nivel máximo de Fumonisinas se describieron aumentos significativos de la actividad de las enzimas hepáticas en suero, con lesiones hepáticas microscópicas leves y una alteración final de la blastogénesis linfocitaria (Osweiler et al., 1993).
Lesiones asociadas a otras infecciones fúngicas
![]() En un estudio experimental en el que se dosificaron bovinos, ovinos y caprinos con Diplodia maydis, se evidenció un extenso estado laminar subcortical de espongiosis en el cerebro y el cerebelo de una oveja que había estado paralizada durante mucho tiempo y de un novillo que presentaba trastornos locomotores permanentes (Kellerman et al., 1985).
En un estudio experimental en el que se dosificaron bovinos, ovinos y caprinos con Diplodia maydis, se evidenció un extenso estado laminar subcortical de espongiosis en el cerebro y el cerebelo de una oveja que había estado paralizada durante mucho tiempo y de un novillo que presentaba trastornos locomotores permanentes (Kellerman et al., 1985).
![]() En Australia, en los casos de Enfermedad Hepática Aguda Bovina (ABLD), las principales lesiones histológicas eran la necrosis coagulativa hepatocelular periportal grave y la acumulación de eritrocitos, que a menudo se extendía a una necrosis masiva.
En Australia, en los casos de Enfermedad Hepática Aguda Bovina (ABLD), las principales lesiones histológicas eran la necrosis coagulativa hepatocelular periportal grave y la acumulación de eritrocitos, que a menudo se extendía a una necrosis masiva.
REFERENCIAS
Albonico, M., Schutz, L.F., Caloni, F., Cortinovis, C., Spicer, L.J., 2017. In vitro effects of the Fusarium mycotoxins fumonisin B1 and beauvericin on bovine granulosa cell proliferation and steroid production. Toxicon 128, 38-45.
Alonso, V., Díaz Vergara, L., Aminahuel, C., Pereyra, C., Pena, G., Torres, A., Dalcero, A., Cavaglieri, L., 2015. Physiological behaviour of gliotoxigenic Aspergillus fumigatus sensu stricto isolated from maize silage under simulated environmental conditions. Food Additives & Contaminants: Part A 32, 236-244.
Antonissen, G., Martel, A., Pasmans, F., Ducatelle, R., Verbrugghe, E., Vandenbroucke, V., Li, S., Haesebrouck, F., Van Immerseel, F., Croubels, S., 2014. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases. Toxins 6, 430-452.
Applebaum, R.S., Brackett, R.E., Wiseman, D.W., Marth, E.H., 1982. Responses of dairy cows to dietary aflatoxin: Feed intake and yield, toxin content, and quality of milk of cows treated with pure and impure aflatoxin. Journal of Dairy Science 65, 1503-1508.
Awad, W.A., Hess, C., Hess, M., 2017. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins 9, 60.
Baker, D.C., Rottinghaus, G.E., 1999. Chronic experimental fumonisin intoxication of calves. Journal of Veterinary Diagnostic Investigation 11, 289-292.
Bouslimi, A., Bouaziz, C., Ayed-Boussema, I., Hassen, W., Bacha, H., 2008. Individual and combined effects of ochratoxin A and citrinin on viability and DNA fragmentation in cultured Vero cells and on chromosome aberrations in mice bone marrow cells. Toxicology 251, 1-7.
Caloni, F., Ranzenigo, G., Cremonesi, F., Spicer, L.J., 2009. Effects of a trichothecene, T-2 toxin, on proliferation and steroid production by porcine granulosa cells. Toxicon 54, 337-344.
Chain, E.P.o.C.i.t.F., 2012. Scientific Opinion on the risks for public and animal health related to the presence of citrinin in food and feed. EFSA Journal 10, 2605.
Changwa, R., Abia, W., Msagati, T., Nyoni, H., Ndleve, K., Njobeh, P., 2018. Multi-mycotoxin occurrence in dairy cattle feeds from the gauteng province of South Africa: A pilot study using UHPLC-QTOF-MS/MS. Toxins 10, 294.
Donkor, O., Ramchandran, L., Vasiljevic, T., 2016. Techniques 8 and Control of Mycotoxins Detection, Quantification in Dairy Products. Microbial Toxins in Dairy Products 7, 201.
Elgioushy, M.M., Elgaml, S.A., El-Adl, M.M., Hegazy, A.M., Hashish, E.A., 2020. Aflatoxicosis in cattle: clinical findings and biochemical alterations. Environmental Science and Pollution Research 27, 35526-35534.
Fink-Gremmels, J., 2008a. The role of mycotoxins in the health and performance of dairy cows. Vet J 176, 84-92.
Fink-Gremmels, J., 2008b. The role of mycotoxins in the health and performance of dairy cows. The Veterinary Journal 176, 84-92.
Frisvad, J.C., Rank, C., Nielsen, K.F., Larsen, T.O., 2009. Metabolomics of Aspergillus fumigatus. Medical Mycology 47, S53-S71.
Fushimi, Y., Takagi, M., Monniaux, D., Uno, S., Kokushi, E., Shinya, U., Kawashima, C., Otoi, T., Deguchi, E., Fink-Gremmels, J., 2015. Effects of Dietary Contamination by Zearalenone and Its Metabolites on Serum Anti-Müllerian Hormone: Impact on the Reproductive Performance of Breeding Cows. Reprod Domest Anim 50, 834-839.
Gallo, A., Giuberti, G., Bertuzzi, T., Moschini, M., Masoero, F., 2015. Study of the effects of PR toxin, mycophenolic acid and roquefortine C on in vitro gas production parameters and their stability in the rumen environment. The Journal of Agricultural Science 153, 163-176.
Gao, Y., Meng, L., Liu, H., Wang, J., Zheng, N., 2020. The compromised intestinal barrier induced by mycotoxins. Toxins 12, 619.
Gonçalves, B.L., Corassin, C.H., Oliveira, C.A.F.d., 2015. Mycotoxicoses in dairy cattle: a review. Asian Journal of Animal and Veterinary Advances 10, 752-760.
Guerre, P., 2020. Mycotoxin and gut microbiota interactions. Toxins 12, 769.
Gupta, R.C., 2012. Veterinary toxicology: basic and clinical principles. Academic press.
Hartinger, T., Kröger, I., Neubauer, V., Faas, J., Doupovec, B., Schatzmayr, D., Zebeli, Q., 2023. Zearalenone and Its Emerging Metabolites Promptly Aff ect the Rumen Microbiota in Holstein Cows Fed a Forage-Rich Diet. Toxins (Basel) 15.
Jiang, Y., Ogunade, I., Kim, D., Li, X., Pech-Cervantes, A., Arriola, K., Oliveira, A., Driver, J., Ferraretto, L., Staples, C., 2018. Effect of adding clay with or without a Saccharomyces cerevisiae fermentation product on the health and performance of lactating dairy cows challenged with dietary aflatoxin B1. Journal of dairy science 101, 3008-3020.




 Prevención de micotoxicosis
Prevención de micotoxicosis