Mursal Abdulkadir Hersi1, Dogukan Kaya2 y Ercument Genc1*
1Departamento de Ingeniería Pesquera y Acuícola, Facultad de Agricultura, Universidad de Ankara, Ankara, Turquía
2Centro de Investigación y Aplicaciones Agrícolas, Universidad Tokat Gaziosmanpasa, Tokat, Turquía
Autor correspondiente: [email protected]
En la primera parte de este artículo, revisamos los principales efectos asociados a la exposición a las micotoxinas en las especies acuáticas. En la segunda parte de este artículo, se revisan y discuten los diversos agentes adsorbentes de micotoxinas y aditivos para piensos utilizados en la acuicultura y su eficacia.
Agentes adsorbentes de micotoxinas y aditivos desintoxicantes para piensos
![]() El principal objetivo de la acuicultura y de otras industrias de producción de alimentos y piensos es evitar la aparición de micotoxinas. Sin embargo, la formación de micotoxinas es a veces inevitable debido a muchos factores ambientales e interacciones microbianas.
El principal objetivo de la acuicultura y de otras industrias de producción de alimentos y piensos es evitar la aparición de micotoxinas. Sin embargo, la formación de micotoxinas es a veces inevitable debido a muchos factores ambientales e interacciones microbianas.
En estos casos, sustancias, compuestos o microbios que pueden:
- ⇰ Eliminar las micotoxinas mediante la excreción del cuerpo de los animales expuestos.
- ⇰ Minimizar su adsorción por parte del animal
- ⇰ Mitigar sus efectos
(Vila-Donat et al., 2018)
 Sin embargo, la aplicación de estas sustancias no significa necesariamente que los animales deban ser alimentados con piensos que contengan micotoxinas por encima de las dosis máximas permitidas.
Sin embargo, la aplicación de estas sustancias no significa necesariamente que los animales deban ser alimentados con piensos que contengan micotoxinas por encima de las dosis máximas permitidas.Actualmente, se pueden utilizar tres métodos básicos (químico, físico y biológico) para detoxificar las micotoxinas, todos ellos sometidos a importantes estudios de investigación (Karlovsky et al., 2016; Zhou et al., 2018).

 MÉTODOS QUÍMICOS
MÉTODOS QUÍMICOS
Los enfoques químicos implican la aplicación de diferentes compuestos químicos como sustancias oxidantes, álcalis y ácidos para destruir las micotoxinas (Čolović et al. 2019).
Sin embargo, el uso de productos químicos está asociado a graves efectos sobre la salud. Por ejemplo:
 El dióxido de cloro utilizado para purificar los piensos contaminados con micotoxinas ha sido reportado por deteriorar tanto el sabor como la textura de las dietas.
El dióxido de cloro utilizado para purificar los piensos contaminados con micotoxinas ha sido reportado por deteriorar tanto el sabor como la textura de las dietas. El ozono, que también puede destruir la mayoría de las micotoxinas, no es seguro para los animales ni para los seres humanos.
El ozono, que también puede destruir la mayoría de las micotoxinas, no es seguro para los animales ni para los seres humanos. El hipoclorito de sodio, del que se ha informado que elimina los tricotecenos, tiene consecuencias perjudiciales (Yu et al., 2020).
El hipoclorito de sodio, del que se ha informado que elimina los tricotecenos, tiene consecuencias perjudiciales (Yu et al., 2020).
Por lo tanto, no se recomienda aplicar productos químicos para detoxificar micotoxinas (Conte et al., 2020).
![]() MÉTODOS FÍSICOS
MÉTODOS FÍSICOS
Los métodos físicos incluyen la detoxificación de micotoxinas a través de la adsorción (Yu et al., 2020). Tras la ingestión y antes de que la micotoxina sea absorbida y circule por el organismo, los agentes aglutinantes o adsorbentes se unen a ella para que pueda ser excretada fácilmente.
Los adsorbentes de micotoxinas tienen diferentes mecanismos para unirse a las micotoxinas, como las interacciones hidrofóbicas, las interacciones dipolo-dipolo y la atracción o repulsión electrostática (Di Gregorio et al., 2014).
⇰ El éxito de estos agentes secuestrantes o adsorbentes también se ve afectado por sus propiedades físicas, como su forma y sus poros, la polaridad y la solubilidad de la micotoxina objetivo, y el nivel de pH (Kabak et al., 2006).
Aunque los adsorbentes de micotoxinas son métodos eficaces en comparación con los mecanismos químicos, no pueden detoxificar todas las toxinas (Battilani, 2008; Ji y Xie, 2021).

![]() MÉTODOS BIOLÓGICOS
MÉTODOS BIOLÓGICOS
Con los métodos biológicos, las micotoxinas no se eliminan del organismo, sino que se biotransforman en compuestos menos tóxicos. Este mecanismo implica el uso de microorganismos (bacterias, hongos, etc.) y enzimas para descomponer las micotoxinas (Wielogórska et al., 2016).

Sin embargo, hay muchos desafíos en la aplicación de los métodos biológicos, incluyendo:
- ⇰ Datos limitados sobre el modo de acción de los microbios durante la detoxificación de micotoxinas.
- ⇰ La seguridad de los productos derivados tras la degradación.
- ⇰ Cómo puede afectar el proceso al contenido de nutrientes de los piensos.
(Conte et al., 2020)
No obstante, en condiciones ambientales favorables, los microbios implicados tienen una mayor capacidad de detoxificación y, por tanto, esta estrategia se considera el mejor remedio contra las micotoxinas (Zychowski et al. 2013).
Adsorbentes de micotoxinas
Como se ha mencionado anteriormente, se utilizan diferentes agentes adsorbentes o partículas de nanoarcilla para eliminar las micotoxinas del cuerpo del animal expuesto.
 Debido a su importancia y a su amplia gama de aplicaciones en los últimos años, las partículas de nanoarcilla se han incorporado de forma significativa a diversos campos, incluida la acuicultura, para mejorar los parámetros de calidad del agua (Nathanail et al., 2016).
Debido a su importancia y a su amplia gama de aplicaciones en los últimos años, las partículas de nanoarcilla se han incorporado de forma significativa a diversos campos, incluida la acuicultura, para mejorar los parámetros de calidad del agua (Nathanail et al., 2016).
Los agentes adsorbentes son nanopartículas ultrafinas que suelen tener un tamaño inferior a 100 nm y tienen el potencial de proporcionar una buena superficie para la unión de micotoxinas (Feng et al., 2009). Pueden clasificarse como adsorbentes sintéticos, obtenidos mediante molienda mecánica o a máquina, y adsorbentes naturales (Wagner et al., 2014).

Las nanopartículas más comunes para la adsorción de micotoxinas son los aluminosilicatos (aluminosilicato cálcico de sodio hidratado, bentonitas, zeolitas, etc.) y las paredes celulares de levadura (Arana et al., 2011).
![]() La tasa de eficiencia de eliminación de micotoxinas de la mayoría de las nanopartículas o agentes adsorbentes se estima entre el 20% y el 80% (Nathanail et al., 2016).
La tasa de eficiencia de eliminación de micotoxinas de la mayoría de las nanopartículas o agentes adsorbentes se estima entre el 20% y el 80% (Nathanail et al., 2016).
Sin embargo, uno de los principales inconvenientes de los adsorbentes de micotoxinas es su capacidad para absorber también otros micronutrientes en el organismo de los animales, lo que puede provocar una deficiencia de minerales (Kolosova y Stroka, 2011).
Aluminosilicatos
Los aluminosilicatos, que representan los minerales más abundantes en la formación de rocas, caracterizan el tetraedro de silicio-oxígeno unido por láminas octaédricas de aluminio (Tapia-Salazar et al., 2010). Los silicatos de lámina (filosilicatos) y los tectosilicatos son los dos grupos principales de aluminosilicatos.
Entre los adsorbentes más comunes del grupo de los filosilicatos están las bentonitas, caolinitas, esmectitas y montmorillonitas, mientras que las zeolitas son los agentes secuestrantes más utilizados en el grupo de los tectosilicatos (Di Gregorio et al., 2014).
Todos estos adsorbentes de micotoxinas ofrecen una gran superficie para la unión de micotoxinas y se ven afectados por su tamaño, porosidad, forma y selectividad (Huwig et al. 2001).

BENTONITAS
Las bentonitas, también conocidas como montmorillonitas, son un grupo de partículas de arcilla de silicato laminar que son eficientes en la adsorción de micotoxinas (Kolosova y Stroka, 2011).
⇰ La capacidad de unión de las bentonitas está asociada a la presencia y contenido de minerales de esmectita (montmorillonita), la principal materia prima utilizada en la producción de partículas de nanoarcilla (Benvindo da Luz y Lins, 2008).
 Las bentonitas son minerales cosmopolitas y suelen incorporarse a la mayoría de los alimentos acuícolas comerciales para mejorar los índices de calidad del agua (Hussain 2018).
Las bentonitas son minerales cosmopolitas y suelen incorporarse a la mayoría de los alimentos acuícolas comerciales para mejorar los índices de calidad del agua (Hussain 2018).
En los últimos años, se han realizado muchos estudios para investigar el papel de la bentonita en la desintoxicación de micotoxinas en la acuicultura.
![]() Un estudio de Neeratanaphan y Tengjaroenkul (2018) evaluó la e icacia de la bentonita sódica al 1% para mejorar el crecimiento y la histomorfología de los tejidos de la tilapia del Nilo alimentada con dietas que contenían 10-40 mg/kg de AFB1.
Un estudio de Neeratanaphan y Tengjaroenkul (2018) evaluó la e icacia de la bentonita sódica al 1% para mejorar el crecimiento y la histomorfología de los tejidos de la tilapia del Nilo alimentada con dietas que contenían 10-40 mg/kg de AFB1.
Los exámenes patológicos de los grupos alimentados con dietas que contenían aflatoxina sin suplemento de bentonita, mostraron una disminución significativa de la tasa de crecimiento, lesiones en las branquias, infiltración de leucocitos, dilatación vascular, degeneración y falta de integridad en el hígado.
⇰ Sin embargo, en este estudio se detectaron mejoras en el rendimiento del crecimiento y en la histomorfología de los tejidos cuando se complementó el 1% de bentonita sódica con los piensos para tilapias.
![]() Hussain et al. (2017b) encontraron resultados similares cuando examinaron el efecto de mejora de la arcilla de bentonita de calcio al 0,5% contra el retraso del crecimiento causado por 2 y 4 mg/kg de aflatoxinas.
Hussain et al. (2017b) encontraron resultados similares cuando examinaron el efecto de mejora de la arcilla de bentonita de calcio al 0,5% contra el retraso del crecimiento causado por 2 y 4 mg/kg de aflatoxinas.
⇰ Antes de la suplementación con bentonita, los animales experimentaron importantes reducciones de crecimiento y una escasa utilización del alimento. Sin embargo, se observaron considerables mejoras en el crecimiento y la eficiencia alimentaria cuando se alimentó a los animales con pienso que contenía adsorbente.
![]() Las bentonitas se utilizan principalmente para la detoxificación de aflatoxinas.
Las bentonitas se utilizan principalmente para la detoxificación de aflatoxinas.
![]() Kannewischer (2006) destacó que la aplicación de bentonitas en la acuicultura tiene un resultado prometedor y, por tanto, debería utilizarse para la desintoxicación.
Kannewischer (2006) destacó que la aplicación de bentonitas en la acuicultura tiene un resultado prometedor y, por tanto, debería utilizarse para la desintoxicación.

ALUMINOSILICATO SÓDICO-CÁLCICO HIDRATADO
El aluminosilicato cálcico hidratado es otro potente adsorbente de micotoxinas en general, en particular de aflatoxinas (Di Gregorio et al. 2014).
⇰ Este agente, generalmente utilizado como antiaglomerante, también ha demostrado su importancia en la unión y eliminación de micotoxinas del organismo.
![]() Huwig et al. (2001) analizaron la eficacia de diferentes absorbentes de micotoxinas, incluyendo zeolitas, bentonitas, paredes celulares de levadura y aluminosilicato cálcico hidratado.
Huwig et al. (2001) analizaron la eficacia de diferentes absorbentes de micotoxinas, incluyendo zeolitas, bentonitas, paredes celulares de levadura y aluminosilicato cálcico hidratado.
Llegaron a la conclusión de que el aluminosilicato cálcico de sodio hidratado tenía la mayor capacidad de eliminación de micotoxinas.

![]() Fadl et al. (2020) evaluaron los efectos de mejora de los silicatos de aluminio sódico hidratados en la dieta (0,2-0,5g) contra la toxicidad de la ocratoxina A (1 mg/kg) en el crecimiento de la tilapia del Nilo, la bioquímica sérica y la histopatología de los tejidos durante seis semanas.
Fadl et al. (2020) evaluaron los efectos de mejora de los silicatos de aluminio sódico hidratados en la dieta (0,2-0,5g) contra la toxicidad de la ocratoxina A (1 mg/kg) en el crecimiento de la tilapia del Nilo, la bioquímica sérica y la histopatología de los tejidos durante seis semanas.
⇰ Los resultados mostraron que la suplementación con silicatos de aluminio sódico protegía de los efectos histopatológicos anómalos, mantenía un rendimiento estable y promovía parámetros bioquímicos saludables.
![]() Del mismo modo, El-Alim et al. (2017) también comprobaron la eficacia de la suplementación con silicato de aluminio sódico hidratado al 0,5% contra la toxicidad inducida por 2,5 mg/kg de aflatoxinas en tilapia del Nilo durante seis semanas.
Del mismo modo, El-Alim et al. (2017) también comprobaron la eficacia de la suplementación con silicato de aluminio sódico hidratado al 0,5% contra la toxicidad inducida por 2,5 mg/kg de aflatoxinas en tilapia del Nilo durante seis semanas.
⇰ Se detectó anemia, leucopenia, linfopenia, disminución del índice fagocítico y una tasa de mortalidad de más del 16% en los grupos alimentados con dietas que contenían aflatoxina sola.
⇰ En cambio, se observó una mejora del crecimiento y de los parámetros bioquímicos en los grupos alimentados con dietas que contenían aflatoxina y silicato de aluminio hidratado.
ZEOLITAS
Las zeolitas son tectosilicatos cristalinos microporosos utilizados ampliamente en la acuicultura en los últimos años.
⇰ Debido a sus excelentes propiedades físicas y químicas, incluyendo la adsorción y el intercambio de iones, varias industrias han aplicado las zeolitas para diferentes propósitos (Ghasemi et al., 2018).
|
![]() Un experimento de tres meses realizado por Hassaan et al. (2020) reveló que las aflatoxinas a una dosis de 3 mg/kg, causaban una disminución significativa en la conversión del alimento, la tasa de crecimiento, la digestión y las enzimas antioxidantes y un aumento de las enzimas hepáticas, así como un agravamiento del ADN y dejaban residuos en el cuerpo de la tilapia del Nilo.
Un experimento de tres meses realizado por Hassaan et al. (2020) reveló que las aflatoxinas a una dosis de 3 mg/kg, causaban una disminución significativa en la conversión del alimento, la tasa de crecimiento, la digestión y las enzimas antioxidantes y un aumento de las enzimas hepáticas, así como un agravamiento del ADN y dejaban residuos en el cuerpo de la tilapia del Nilo.
⇰ Sin embargo, durante este estudio, la mayoría de estos resultados patológicos se redujeron al añadir de 5 a 10 g/kg de partículas de nanozeolita a los piensos para tilapias.
![]() Diferentes autores han informado de resultados similares utilizando otras especies de peces como la tilapia del Nilo (Zahran et al. 2020) y la trucha arco iris (Alinezhad et al. 2020).
Diferentes autores han informado de resultados similares utilizando otras especies de peces como la tilapia del Nilo (Zahran et al. 2020) y la trucha arco iris (Alinezhad et al. 2020).


CARBÓN ACTIVADO
El carbón activado es una sustancia que se produce después de que la biomasa se someta a un proceso llamado pirólisis. Se trata de un agente altamente poroso y es uno de los adsorbentes de micotoxinas más eficaces, utilizado principalmente en la industria ganadera (Avantaggiato et al. 2005). Además de adsorber micotoxinas, en la acuicultura, el carbón activado se utiliza para diferentes fines, como la purificación del agua y mejorar del bienestar de los peces (Selim et al. 2013).
⇰ La capacidad del carbón activado para adsorber o secuestrar micotoxinas se ve afectada por su tamaño, forma, porosidad y estructura. Al igual que otros adsorbentes, el carbón activado tiende a adherirse a otros micronutrientes del organismo, especialmente cuando su presencia es mayor que la de las micotoxinas, por lo que debe ser tratado (Vekiru et al. 2007).
Muchos estudios han demostrado el efecto positivo del carbón activado para mitigar los efectos de las micotoxinas, especialmente la vomitoxina (Diaz y Smith 2005).
 Selim et al. (2013) revelaron que las aflatoxinas dañan significativamente el crecimiento y los parámetros bioquímicos en la sangre de la tilapia del Nilo, pero la adición de carbón activado al alimento produce mejoras en los índices hematológicos y de rendimiento del crecimiento.
Selim et al. (2013) revelaron que las aflatoxinas dañan significativamente el crecimiento y los parámetros bioquímicos en la sangre de la tilapia del Nilo, pero la adición de carbón activado al alimento produce mejoras en los índices hematológicos y de rendimiento del crecimiento.
Microorganismos y otros aditivos para piensos
MICROORGANISMOS
Además de la aplicación de minerales adsorbentes de micotoxinas, también se aplican microorganismos que adsorben o descomponen las sustancias tóxicas.
ADSORCIÓN DE MICOTOXINAS
Para la adsorción, varios microorganismos tienen una estructura de pared celular única que puede unirse a diferentes micotoxinas a través de diferentes interacciones como los enlaces de hidrógeno y los enlaces iónicos e hidrofóbicos (Haskard et al., 2001).
⇰ Esto se consigue antes de la interacción de la micotoxina con el cuerpo y reduce significativamente la biodisponibilidad de la micotoxina (Kolosova y Stroka, 2011).
Los microorganismos más utilizados para este fin son el Saccharomyces cerevisiae y las bacterias ácido-lácticas.
SACCHAROMYCES CEREVISIAE
S. cerevisiae tiene una variedad de aplicaciones, tanto en la industria alimentaria como en la de los piensos, y se ha utilizado durante mucho tiempo en los procesos de fermentación (Taheur et al., 2017).
Algunos han señalado que S. cerevisiae adsorbe y elimina diferentes micotoxinas (zearalenona, ocratoxina A y fumonisinas) del cuerpo de los animales (Fruhauf et al., 2012; Taheur et al., 2017).
BACTERIAS ÁCIDO-LÁCTICAS
Las bacterias ácido-lácticas son grupos bacterianos grampositivos que se encuentran habitualmente en los productos lácteos y en la biomasa vegetal en descomposición.
Anteriormente, diferentes especies de este grupo, como Lactobacillus rhamnosus, han demostrado una gran capacidad para secuestrar micotoxinas, en particular aflatoxinas y zearalenona (Rahaie et al., 2012).
DETOXIFICACIÓN DE MICOTOXINAS
Los microorganismos también pueden, en algún momento de su ciclo vital, segregar sustancias químicas que pueden:
- ⇰ Alterar la estructura de las micotoxinas y producir compuestos menos tóxicos.
- ⇰ Destruir las micotoxinas.
Durante este proceso de degradación, se utilizan diferentes microrganismos que producen varias enzimas. Algunas de esas enzimas son:
- ⇰ Aflatoxina oxidasa producida por Armillariella tabescens (Cao et al., 2011).
- ⇰ Peroxidasa producida por especies de Pseudomonas (Zaid, 2017).
- ⇰ Reductasa producida por Mycobacterium smegmatis (Li et al., 2019).
Se sabe que los probióticos también mejoran los índices zootécnicos y bioquímicos de los animales acuáticos.
![]() Un estudio reciente de Sadeghi et al., (2020) comprobó el efecto de mejora de las bacterias probióticas L. rhamnosus frente a la aflatoxicosis en truchas arco iris durante 4 semanas.
Un estudio reciente de Sadeghi et al., (2020) comprobó el efecto de mejora de las bacterias probióticas L. rhamnosus frente a la aflatoxicosis en truchas arco iris durante 4 semanas.
⇰ Al final del experimento, los grupos alimentados con dietas que contenían aflatoxinas mostraron un aumento considerable del cortisol, de la enzima fosfato alcalino, de la glucosa en sangre y de la mortalidad, así como reducciones significativas de la enzima quimotripsina del sistema digestivo. En cambio, con la inclusión de L. rhamnosus, se encontraron efectos de mejora en el crecimiento, la supervivencia y el equilibrio enzimático.
![]() Del mismo modo, un estudio más reciente de Khalafalla et al. (2022) examinó el efecto de 106 UFC/mL por kg de dieta de la bacteria probiótica Lactobacillus acidophilus frente a la a la toxicosis inducida por 0,5- 1 mg/kg de aflatoxinas en el crecimiento, la bioquímica sanguínea y la histopatología del salmonete (Liza ramada) durante 8 semanas.
Del mismo modo, un estudio más reciente de Khalafalla et al. (2022) examinó el efecto de 106 UFC/mL por kg de dieta de la bacteria probiótica Lactobacillus acidophilus frente a la a la toxicosis inducida por 0,5- 1 mg/kg de aflatoxinas en el crecimiento, la bioquímica sanguínea y la histopatología del salmonete (Liza ramada) durante 8 semanas.
⇰ En los grupos alimentados únicamente con piensos que contenían aflatoxinas se registraron reducciones significativas de las tasas de crecimiento, los leucocitos, los eritrocitos, la hemoglobina, el hematocrito, las proteínas totales y la albúmina en sangre, y el colesterol, así como un aumento considerable de las enzimas hepáticas, la glucosa en sangre y el cortisol. La histomorfología de los tejidos en los grupos alimentados con aflatoxinas también mostró daños significativos.
⇰ Los grupos suplementados con L. acidophilus y aflatoxinas mostraron notables mejoras en el crecimiento, la bioquímica sanguínea, las enzimas antioxidantes como la catalasa y la superóxido dismutasa, y la histopatología hepática e intestinal.
![]() Otro ensayo realizado por Fang et al. (2020) también reveló que la bacteria probiótica Lactiplantibacillus pentosus mejoró el retraso del crecimiento inducido por las aflatoxinas, la inmunosupresión y los daños en la microbiota intestinal, así como la histomorfología de los tejidos del camarón blanco del Pacífico.
Otro ensayo realizado por Fang et al. (2020) también reveló que la bacteria probiótica Lactiplantibacillus pentosus mejoró el retraso del crecimiento inducido por las aflatoxinas, la inmunosupresión y los daños en la microbiota intestinal, así como la histomorfología de los tejidos del camarón blanco del Pacífico.
 Para acelerar el proceso de detoxificación de las micotoxinas en la acuicultura también se puede implementar una combinación de microorganismos (probióticos preferentemente), enzimas degradantes y/o agentes adsorbentes (Guan et al., 2021). Para acelerar el proceso de detoxificación de las micotoxinas en la acuicultura también se puede implementar una combinación de microorganismos (probióticos preferentemente), enzimas degradantes y/o agentes adsorbentes (Guan et al., 2021). |
![]() Huang et al. (2018b) descubrieron que la aplicación de una combinación de Bacillus subtilis, Lactobacillus casei y una enzima degradadora producida por Aspergillus oryzae aceleraba significativamente el proceso de detoxificación de micotoxinas.
Huang et al. (2018b) descubrieron que la aplicación de una combinación de Bacillus subtilis, Lactobacillus casei y una enzima degradadora producida por Aspergillus oryzae aceleraba significativamente el proceso de detoxificación de micotoxinas.
Aditivos de origen vegetal para piensos frente a las micotoxicosis
Entre las diferentes estrategias utilizadas para hacer frente a los desafíos de las micotoxinas en la acuicultura, se encuentra el concepto de aditivos para piensos de origen vegetal.
Las plantas muestran una variedad de aceites esenciales, especias, hierbas y otros extractos que pueden desempeñar un noble papel en la mitigación de los efectos sobre la salud causados por las micotoxinas (Gowda et al., 2013).
Se consideran productos ecológicos, disponibles y asequibles para hacer frente no solo a las micotoxinas, sino también a muchos otros problemas en las industrias de piensos y alimentos (Iram et al., 2016).
![]() En los últimos años, se ha descubierto que los compuestos derivados de las plantas, las cumarinas y los flavonoides, inhiben el efecto cancerígeno de las aflatoxinas (Lee et al., 2001).
En los últimos años, se ha descubierto que los compuestos derivados de las plantas, las cumarinas y los flavonoides, inhiben el efecto cancerígeno de las aflatoxinas (Lee et al., 2001).
![]() También se ha informado de que la curcumina, el ingrediente bioactivo de la cúrcuma, tiene un efecto curativo contra la aflatoxicosis (Ferreira et al., 2013).
También se ha informado de que la curcumina, el ingrediente bioactivo de la cúrcuma, tiene un efecto curativo contra la aflatoxicosis (Ferreira et al., 2013).
![]() Un estudio realizado por Vijayanandraj et al. (2014) examinó la capacidad de degradación de varios extractos de plantas y concluyó que también mostraban la mayor tasa de degradación de aflatoxinas (alrededor del 98%).
Un estudio realizado por Vijayanandraj et al. (2014) examinó la capacidad de degradación de varios extractos de plantas y concluyó que también mostraban la mayor tasa de degradación de aflatoxinas (alrededor del 98%).
![]() También se ha informado de que el aceite extraído de Chenopodium ambrosioides es un inhibidor tanto de las aflatoxinas como de las micotoxinas de Fusarium (Sandosskumar et al., 2007).
También se ha informado de que el aceite extraído de Chenopodium ambrosioides es un inhibidor tanto de las aflatoxinas como de las micotoxinas de Fusarium (Sandosskumar et al., 2007).
![]() Abdelhiee et al. (2020) realizaron un estudio de cuatro semanas para examinar cómo el 0,5-1% de Moringa oleifera mitiga los impactos adversos inducidos por 1 mg/ kg de AFB1 en el crecimiento, la respuesta inmunitaria y los índices bioquímicos y hematológicos de la tilapia del Nilo.
Abdelhiee et al. (2020) realizaron un estudio de cuatro semanas para examinar cómo el 0,5-1% de Moringa oleifera mitiga los impactos adversos inducidos por 1 mg/ kg de AFB1 en el crecimiento, la respuesta inmunitaria y los índices bioquímicos y hematológicos de la tilapia del Nilo.
⇰ Los exámenes necroscópicos de los grupos alimentados con dietas con aflatoxinas pero sin moringa dieron como resultado un rendimiento de crecimiento inferior (aumento de peso, tasa de crecimiento específica, etc.), bioquímica sérica (glóbulos rojos y blancos, hemoglobina, hematocrito y albúmina), enzimas antioxidantes (superóxido dismutasa y catalasa), así como un aumento significativo de las enzimas hepáticas.
⇰ En el examen histopatológico de los grupos alimentados con piensos que contenían aflatoxinas, se detectó dilatación vascular, congestión e hígado necrótico, así como falta de integridad en los intestinos y lesiones en las branquias. Además, cuando se complementó la Moringa oleifera con las dietas de este experimento, se obtuvieron mejoras significativas en el crecimiento, los índices bioquímicos séricos, la histomorfología de los tejidos, la expresión génica y el sistema inmunitario.
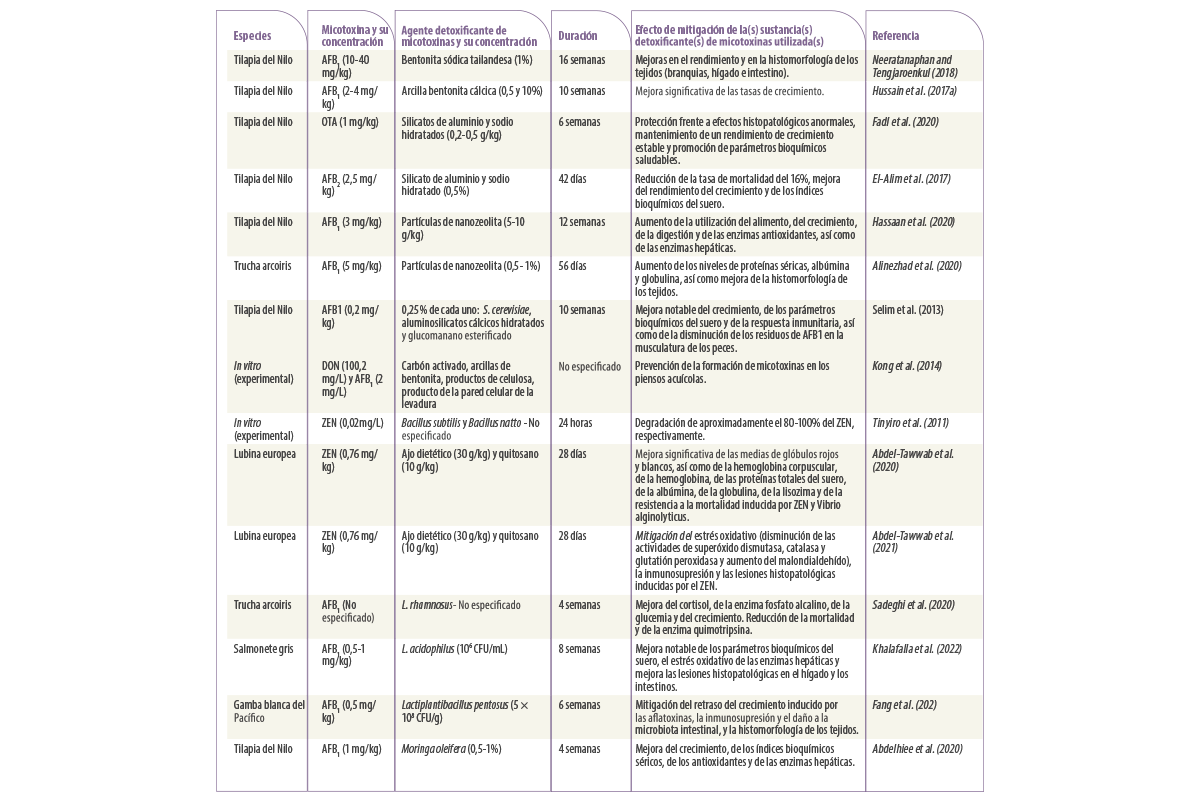
Tabla 1. Estudios sobre la aplicación de estrategias físicas, biológicas y microbianas para mitigar los efectos adversos inducidos por la micotoxicosis en la acuicultura.
Conclusiones
Se han introducido numerosos mecanismos para eliminar o reducir las micotoxinas en la acuicultura antes o después de que los animales estén expuestos a ellas.
Los métodos químicos implican la aplicación de compuestos químicos como el ozono, el hidróxido de sodio, el amoníaco y diferentes ácidos, que se utilizan principalmente para prevenir la formación de micotoxinas en los alimentos.
 Aunque los métodos químicos son eficaces para combatir las micotoxinas, producen efectos perjudiciales, ya que dejan residuos y afectan negativamente al sabor y aspecto de los piensos. Aunque los métodos químicos son eficaces para combatir las micotoxinas, producen efectos perjudiciales, ya que dejan residuos y afectan negativamente al sabor y aspecto de los piensos. |
Los enfoques físicos afectan a las micotoxinas con diversos métodos como la limpieza, las luces UV, la clasificación y los agentes secuestrantes o adsorbentes. Este último, en particular, se ha convertido en un imán para muchos estudios, y se ha demostrado su eficacia.
⇰ Sin embargo, uno de los principales inconvenientes del enfoque físico es la escasa capacidad de adsorción. Por ello, la combinación de diferentes agentes minerales adsorbentes podría ser beneficiosa, pero es necesario realizar futuras investigaciones al respecto.
El enfoque microbiológico se asocia con la aplicación de bacterias comensales, hongos, las enzimas que producen y aditivos para piensos de origen vegetal.
Los aditivos para piensos de origen vegetal también son muy recomendables, ya que contienen aceites esenciales, hierbas, especias y otros extractos vitales que son eficaces en cierta medida para combatir las micotoxinas.
Los macroorganismos son baratos, respetuosos con el medio ambiente y, lo que es más importante, muy eficaces a la hora de degradar o adsorber micotoxinas. Sin embargo, los compuestos producidos cuando se degradan las micotoxinas pueden no ser seguros y se sabe poco sobre cómo esos productos pueden afectar a los animales, una preocupación del enfoque microbiológico.
⇰ Por ello, se consideran necesarios los estudios destinados a descubrir los métodos, la dosificación, la duración de la desintoxicación microbiológica y la seguridad de los productos producidos por los microbios.
REFERENCIAS
Abdelhiee, E.Y., Elbialy, Z.I., Saad, A.H., Dawood, M.A., Aboubakr, M., El Nagar, S.H., El-Diasty, E.M., Salah, A.S., Saad, H.M. and Fadl, S.E., 2021. The impact of Moringa oleifera on the health status of Nile tilapia exposed to aflatoxicosis. Aquaculture, 533, 736110.
Abdel-Tawwab, M., Khalifa, E., Diab, A.M., Khallaf, M.A., Abdel-Razek, N. and Khalil, R.H., 2020. Dietary garlic and chitosan alleviated zearalenone toxic effects on performance, immunity, and challenge of European sea bass, Dicentrarchus labrax, to Vibrio alginolyticus infection. Aquaculture International, 28(2), 493-510.
Abdel-Tawwab, M., Khalil, R.H., Diab, A.M., Khallaf, M.A., Abdel-Razek, N., Abdel-Latif, H.M. and Khalifa, E., 2021. Dietary garlic and chitosan enhanced the antioxidant capacity, and immunity, and modulated the transcription of HSP70 and Cytokine genes in Zearalenone-intoxicated European seabass. Fish & Shellfish Immunology, 113, 35-41.
Alinezhad, S., Faridi, M., Falahatkar, B., Nabizadeh, R. and Davoodi, D., 2017. Effects of nanostructured zeolite and aflatoxin B1 in growth performance, immune parameters, and pathological conditions of rainbow trout Oncorhynchus mykiss. Fish & Shellfish Immunology, 70, 648-655.
Alinezhad, S., Tolouee, M., Kamalzadeh, A., Motalebi, A.A., Nazeri, M., Yasemi, M., Shams, G.M., Tolouei, R. and Razzaghi, A.M., 2011. Mycobiota and aflatoxin B1 contamination of rainbow trout (Oncorhynchus mykiss) feed with emphasis to Aspergillus section Flavi. Iranian Journal of Fisheries, 10(3), 363-374.
Arana, S., Dagli, M.L., Sabino, M., Tabata, Y.A., Rigolino, M.G. and Hernandez-Blazquez, F.J., 2011. Evaluation of the efficacy of hydrated sodium aluminosilicate in the prevention of aflatoxin-induced hepatic cancer in rainbow trout. Pesquisa veterinaria brasileira, 31, 751-755.
Avantaggiato, G., Havenaar, R. and Visconti, A., 2004. Evaluation of the intestinal absorption of deoxynivalenol and nivalenol by an in vitro gastrointestinal model, and the binding efficacy of activated carbon and other adsorbent materials. Food and Chemical Toxicology, 42(5), 817-824.
Battilani, C.P., 2008. Food mycology-a multifaceted approach to fungi and food. World Mycotoxin Journal, 1(2), 223-224.
Benvindo da Luz, A., & Lins, FAF., 2008. Rochas & minerais industriais: usos e especificações. ed. Rio de Janeiro, RJ: CETEM/MCT.
Brown, K.A., Mays, T., Romoser, A., Marroquin‐Cardona, A., Mitchell, N.J., Elmore, S.E. and Phillips, T.D., 2014. Modified hydra bioassay to evaluate the toxicity of multiple mycotoxins and predict the detoxification efficacy of a clay based sorbent. Journal of Applied Toxicology, 34(1), 40-48.
Cao, H., Liu, D., Mo, X., Xie, C. and Yao, D., 2011. A fungal enzyme with the ability of aflatoxin B1 conversion: Purification and ESI-MS/MS identification. Microbiological Research, 166(6), 475-483.
Čolović, R., Puvača, N., Cheli, F., Avantaggiato, G., Greco, D., Đuragić, O., Kos, J. and Pinotti, L., 2019. Decontamination of mycotoxin-contaminated feedstuffs and compound feed. Toxins, 11(11), p.617.
Conte, G., Fontanelli, M., Galli, F., Cotrozzi, L., Pagni, L. and Pellegrini, E., 2020. Mycotoxins in feed and food and the role of ozone in their detoxification and degradation: An update. Toxins, 12(8), p.486.
Daković, A., Kragović, M., Rottinghaus, G.E., Sekulić, Ž., Milićević, S., Milonjić, S.K. and Zarić, S., 2010. Influence of natural zeolitic tuff and organozeolites surface charge on sorption of ionizable fumonisin B1. Colloids and Surfaces B: Biointerfaces, 76(1), 272-278.
Di Gregorio, M.C., Neeff, D.V.D., Jager, A.V., Corassin, C.H., Carão, Á.C.D.P., Albuquerque, R.D., Azevedo, A.C.D. and Oliveira, C.A.F., 2014. Mineral adsorbents for prevention of mycotoxins in animal feeds. Toxin Reviews, 33(3), 125-135.
Diaz, D.E and Smith, T.K., 2005. Mycotoxin sequestering agents: practical tools for the neutralisation of mycotoxins. The Mycotoxin Blue Book: 323-339.
El-Alim, A., Galal, A.A., Mahmoud, S.H. and El-Sayed, W.A., 2017. Comparative ameliorative effect of hydrated sodium calcium aluminosilicate and Saccharomyces cerevisiae (Brewer’s yeast) against toxic impact of aflatoxin B1 in Oreochromis niloticus (Nile tilapia). Zagazig Veterinary Journal, 45(Supp. 1), 210-220.
Fadl, S.E., El-Shenawy, A.M., Gad, D.M., El Daysty, E.M., El-Sheshtawy, H.S. and Abdo, W.S., 2020. Trial for reduction of Ochratoxin A residues in fish feed by using nano particles of hydrated sodium aluminum silicates (NPsHSCAS) and copper oxide. Toxicon, 184, 1-9.
Fang, H., Wang, B., Jiang, K., Liu, M. and Wang, L., 2020. Effects of Lactobacillus pentosus HC-2 on the growth performance, intestinal morphology, immune-related genes and intestinal microbiota of Penaeus vannamei affected by aflatoxin B1. Aquaculture, 525, 735289.
Ferreira, F.D., Kemmelmeier, C., Arrotéia, C.C., da Costa, C.L., Mallmann, C.A., Janeiro, V., Ferreira, F.M.D., Mossini, S.A.G., Silva, E.L. and Machinski Jr, M., 2013. Inhibitory effect of the essential oil of Curcuma longa L. and curcumin on aflatoxin production by Aspergillus flavus Link. Food Chemistry, 136(2), 789-793.
Fruhauf, S., Schwartz, H., Ottner, F., Krska, R. and Vekiru, E., 2012. Yeast cell based feed additives: studies on aflatoxin B1 and zearalenone. Food Additives & Contaminants: Part A, 29(2), 217-231.
Ghasemi, Z., Sourinejad, I., Kazemian, H. and Rohani, S., 2018. Application of zeolites in aquaculture industry: a review. Reviews in Aquaculture, 10(1), 75-95.
Gowda, N.K.S., Swamy, H.V.L.N. and Mahajan, P., 2013. Recent advances for control, counteraction and amelioration of potential aflatoxins in animal feeds. In: Aflatoxins-Recent Advances and Future Prospects, Ed: Mehdi Razzaghi Abyaneh, Chapter 6., pp.129-140. Published by InTech, Rijeka, Croatia.
Guan, Y., Chen, J., Nepovimova, E., Long, M., Wu, W. and Kuca, K., 2021. Aflatoxin detoxification using microorganisms and enzymes. Toxins, 13(1), p.46.
Hassaan, M.S., Nssar, K.M., Mohammady, E.Y., Amin, A., Tayel, S.I. and El Haroun, E.R., 2020. Nano-zeolite efficiency to mitigate the aflatoxin B1 (AFB1) toxicity: Effects on growth, digestive enzymes, antioxidant, DNA damage and bioaccumulation of AFB1 residues in Nile tilapia (Oreochromis niloticus). Aquaculture, 523, 735123.
Haskard, C.A., El-Nezami, H.S., Kankaanpää, P.E., Salminen, S. and Ahokas, J.T., 2001. Surface binding of aflatoxin B1 by lactic acid bacteria. Applied and environmental microbiology, 67(7), 3086-3091.
Huang, W.; Chang, J.; Wang, P. 2018b. Effect of the combined compound probiotics with mycotoxin-degradation enzyme on detoxifying aflatoxin B1 and zearalenone. J. Toxicol. Sci. 43, 377–385.
Hussain, D. and Mateen, A., 2017b. Alleviation of aflatoxin-B1 toxicity by using clay adsorbent in Nile tilapia (Oreochromis niloticus) diets. Pakistan Journal of Zoology, 49(2), 425-431.
Hussain, D., Mateen, A. and Gatlin III, D.M., 2017a. Alleviation of aflatoxin B1 (AFB1) toxicity by calcium bentonite clay: Effects on growth performance, condition indices and bioaccumulation of AFB1 residues in Nile tilapia (Oreochromis niloticus). Aquaculture, 475, 8-15.
Hussain, D., 2018. Effect of aflatoxins in aquaculture: use of bentonite clays as promising remedy. Turkish Journal of Fisheries and Aquatic Sciences, 18(8), 1009-1016.
Huwig, A., Freimund, S., Käppeli, O. and Dutler, H., 2001. Mycotoxin detoxication of animal feed by different adsorbents. Toxicology letters, 122(2), 179-188.
Ji, J. and Xie, W., 2021. Removal of aflatoxin B1 from contaminated peanut oils using magnetic attapulgite. Food Chemistry, 339, 128072.
Iram, W., Anjum, T., Iqbal, M., Ghaffar, A. and Abbas, M., 2016. Structural elucidation and toxicity assessment of degraded products of aflatoxin B1 and B2 by aqueous extracts of Trachyspermum ammi. Frontiers in Microbiology, 7, 346.
Kabak, B., Dobson, A.D. and Var, I.I.L., 2006. Strategies to prevent mycotoxin contamination of food and animal feed: a review. Critical reviews in food science and nutrition, 46(8), 593-619.
Kannewischer, I., Arvide, M.G.T., White, G.N. And Dixon, J.B., 2006. Smectite clays as adsorbents of aflatoxin B1: Initial steps. Clay Science, 12 (Supp 2), 199-204
Karlovsky, P., Suman, M., Berthiller, F., De Meester, J., Eisenbrand, G., Perrin, I., Oswald, I.P., Speijers, G., Chiodini, A., Recker, T. and Dussort, P., 2016. Impact of food processing and detoxification treatments on mycotoxin contamination. Mycotoxin Research, 32(4), 179-205.
Khalafalla, M.M., Zayed, N.F., Amer, A.A., Soliman, A.A., Zaineldin, A.I., Gewaily, M.S., Hassan, A.M., Van Doan, H., Tapingkae, W. and Dawood, M.A., 2022. Dietary Lactobacillus acidophilus ATCC 4356 Relieves the Impacts of Aflatoxin B1 Toxicity on the Growth Performance, Hepatorenal Functions, and Antioxidative Capacity of Thinlip Grey Mullet (Liza ramada)(Risso 1826). Probiotics and Antimicrobial Proteins, 14(1), 189-203.
Kolosova, A. and Stroka, J., 2011. Substances for reduction of the contamination of feed by mycotoxins: A review. World Mycotoxin Journal, 4(3), 225-256.
Kong, C., Shin, S.Y. and Kim, B.G., 2014. Evaluation of mycotoxin sequestering agents for aflatoxin and deoxynivalenol: an in vitro approach. SpringerPlus, 3(1), 346.
Lee, S.E., Campbell, B.C., Molyneux, R.J., Hasegawa, S. and Lee, H.S., 2001. Inhibitory effects of naturally occurring compounds on aflatoxin B1 biotransformation. Journal of Agricultural and Food Chemistry, 49(11), 5171 5177.
Li, C.H., Li, W.Y., Hsu, I.N., Liao, Y.Y., Yang, C.Y., Taylor, M.C., Liu, Y.F., Huang, W.H., Chang, H.H., Huang, H.L. and Lo, S.C., 2019. Recombinant aflatoxin-degrading F420H2-dependent reductase from mycobacterium smegmatis protects mammalian cells from aflatoxin toxicity. Toxins, 11(5), 259.
Nathanail, A.V., Gibson, B., Han, L., Peltonen, K., Ollilainen, V., Jestoi, M. and Laitila, A., 2016. The lager yeast Saccharomyces pastorianus removes and transforms Fusarium trichothecene mycotoxins during fermentation of brewer’s wort. Food Chemistry, 203, 448-455.
Neeratanaphan, L. and Tengjaroenkul, B., 2018. Protective effects of Thai bentonite on aflatoxin B1 contaminated in diet of tilapia fish. Livestock Research for Rural Development, 30(8), 152.
Rahaie, S., Emam‐Djomeh, Z., Razavi, S.H. and Mazaheri, M., 2012. Evaluation of aflatoxin decontaminating by two strains of Saccharomyces cerevisiae and Lactobacillus rhamnosus strain GG in pistachio nuts. International Journal Of Food Science & Technology, 47(8), 1647-1653.
Sadeghi, N., Bahadori, R., Ojagh, S.M. and Salamroodi, E., 2020. Effect of dietary Lactobacillus rhamnosus on blood biochemical indices and some digestive enzymes activity in rainbow trout (Oncorhynchus mykiss) fed with aflatoxin B1 infected diet. Journal of Animal Environment, 12(2), 151-160.
Sandosskumar, R., Karthikeyan, M., Mathiyazhagan, S., Mohankumar, M., Chandrasekar, G. and Velazhahan, R., 2007. Inhibition of Aspergillus flavus growth and detoxification of aflatoxin B1 by the medicinal plant zimmu (Allium sativum L.× Allium cepa L.). World Journal of Microbiology and Biotechnology, 23(7), 1007-1014.
Sava, S.C., Pogurschi, E., Bahaciu, G.V., Dragomir, N. and Nicolae, C.G., 2019. The effects of clinoptilolite from feed upon fish rearing and water quality. Current Trends in Natural Sciences, 8(16), 212-219.
Selim, K.M., El-hofy, H. and Khalil, R.H., 2014. The efficacy of three mycotoxin adsorbents to alleviate aflatoxin B1-induced toxicity in Oreochromis niloticus. Aquaculture International, 22(2), 523-540.
Shaban, M., AbuKhadra, M.R., Nasief, F.M. and El-Salam, A., 2017. Removal of ammonia from aqueous solutions, ground water, and wastewater using mechanically activated clinoptilolite and synthetic zeolite-a: kinetic and equilibrium studies. Water, Air, & Soil Pollution, 228(11), 1-16.
Taheur, F.B., Fedhila, K., Chaieb, K., Kouidhi, B., Bakhrouf, A. and Abrunhosa, L., 2017. Adsorption of aflatoxin B1, zearalenone and ochratoxin A by microorganisms isolated from Kefir grains. International Journal of Food Microbiology, 251, 1-7.
Tapia Salazar, M., García-Pérez, O.D., Nieto López, M., Ricque Marie, D., Villarreal Cavazos, D. and Cruz Suárez, L.E., 2010. Mycotoxins in aquaculture: Occurrence in feeds components and impact on animal performance. In: Avances en Nutrición Acuícola X-Memorias del Décimo Simposio Internacional de Nutrición Acuícola (pp.8-10).
Tinyiro, S.E., Wokadala, C., Xu, D. and Yao, W., 2011. Adsorption and degradation of zearalenone by bacillus strains. Folia Microbiologica, 56(4), 321-327.
Vekiru, E., Fruhauf, S., Sahin, M., Ottner, F., Schatzmayr, G. and Krska, R., 2007. Investigation of various adsorbents for their ability to bind aflatoxin B1. Mycotoxin Research, 23(1), 27-33.
Vijayanandraj, S., Brinda, R., Kannan, K., Adhithya, R., Vinothini, S., Senthil, K., Chinta, R.R., Paranidharan, V. and Velazhahan, R., 2014. Detoxification of aflatoxin B1 by an aqueous extract from leaves of Adhatoda vasica Nees. Microbiological Research, 169(4), 294-300.
Vila-Donat, P., Marín, S., Sanchis, V. and Ramos, A.J., 2018. A review of the mycotoxin adsorbing agents, with an emphasis on their multi-binding capacity, for animal feed decontamination. Food and Chemical Toxicology, 114, 246-259.
Wagner, S., Gondikas, A., Neubauer, E., Hofmann, T. and von der Kammer, F., 2014. Spot the difference: engineered and natural nanoparticles in the environment—release, behavior, and fate. Angewandte Chemie International Edition, 53(46), 12398-12419.
Wielogórska, E., MacDonald, S. and Elliott, C.T., 2016. A review of the efficacy of mycotoxin detoxifying agents used in feed in light of changing global environment and legislation. World Mycotoxin Journal, 9(3), 419-433.
Yu, Y., Shi, J., Xie, B., He, Y., Qin, Y., Wang, D., Shi, H., Ke, Y. and Sun, Q., 2020. Detoxification of aflatoxin B1 in corn by chlorine dioxide gas. Food Chemistry, 328, 127121.
Zahran, E., Risha, E., Hamed, M., Ibrahim, T. and Palić, D., 2020. Dietary mycotoxicosis prevention with modified zeolite (Clinoptilolite) feed additive in Nile tilapia (Oreochromis niloticus). Aquaculture, 515, 734562.
Zaid, A.M.A., 2017. Biodegradation of aflatoxin by peroxidase enzyme produced by local isolate of Pseudomonas sp. Int J Sci Res Manag, 5, 7456-7467.
Zhou, J., Tang, L., Wang, J. and Wang, J.S., 2018. Aflatoxin B1 disrupts gut microbial metabolisms of short-chain fatty acids, long-chain fatty acids, and bile acids in male F344 rats. Toxicological sciences, 164(2), 453-464.
Zychowski, K.E., Hoffmann, A.R., Ly, H.J., Pohlenz, C., Buentello, A., Romoser, A., Gatlin, D.M. and Phillips, T.D., 2013. The effect of aflatoxin-B1 on red drum (Sciaenops ocellatus) and assessment of dietary supplementation of NovaSil for the prevention of aflatoxicosis. Toxins, 5(9), 1555-1573.




 Prevención de micotoxicosis
Prevención de micotoxicosis