Jog Raj* y Marko Vasiljevic
PATENT CO, DOO., Vlade Ćetkovića 1A, 24 211, Mišićevo, Serbia
*Corresponding author: [email protected]
Las micotoxinas son metabolitos secundarios nocivos, producidos por mohos, que tienen importantes efectos perjudiciales para la salud de los seres humanos y los animales (Haschek et al., 2013).
Son compuestos de bajo peso molecular considerados nocivos incluso a bajas concentraciones (Milićević et al., 2010).
 A menudo, se presume que aproximadamente el 25% de los cultivos, incluidos los granos de cereales y los frutos secos, están contaminados por hongos (Pandya et al., 2016, Raj et al., 2022).
A menudo, se presume que aproximadamente el 25% de los cultivos, incluidos los granos de cereales y los frutos secos, están contaminados por hongos (Pandya et al., 2016, Raj et al., 2022).
Para conocer en profundidad los efectos de las micotoxinas y, en particular, de las fumonisinas en los animales y las estrategias disponibles para su remediación, este artículo se estructura como sigue:
- ⇰ Ocurrencia de micotoxinas
- ⇰ Los efectos de las micotoxinas en los animales
- ⇰ Los efectos de las fumonisinas en los animales
- ⇰ Remediación de fumonisinas con Minazel Plus® in vitro e in vivo
- ⇰ Conclusiones

OCURRENCIA DE MICOTOXINAS
En 2022, PATENT CO DOO realizó un estudio del maíz cosechado en 15 países (Argentina, Bosnia y Herzegovina, Brasil, Chile, Colombia, Croacia, Ecuador, Filipinas, Guatemala, Italia, México, Perú, Serbia, Sudáfrica y Taiwán).
⇰ El 96% de las muestras estaban contaminadas con una o más micotoxinas.
Entre este 96% de muestras, el 4% tenía 1 tipo de micotoxina, el 4% tenía 2 tipos de micotoxinas, el 7% tenía 3 tipos de micotoxinas y el 81% tenía más de 3 tipos de micotoxinas presentes al analizarlas LC-MS/MS (Figura 1).
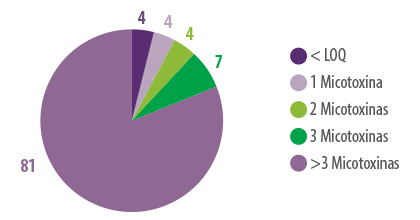
Figura 1. Número de micotoxinas detectadas en muestras de maíz de 15 países en la cosecha de 2022.
 Para más información, lea «Mayor prevalencia de Fumonisinas y Ácido fusárico en el maíz cosechado en 2022»
Para más información, lea «Mayor prevalencia de Fumonisinas y Ácido fusárico en el maíz cosechado en 2022»

LOS EFECTOS DE LAS MICOTOXINAS EN LOS ANIMALES
Las micotoxinas nocivas más frecuentes en alimentos y piensos son:
- ⇰ Aflatoxina B1 (AFB1)
- ⇰ Ocratoxina A (OTA)
- ⇰ Tricotecenos
- ⇰ Deoxinivalenol (DON)
- ⇰ Toxina HT-2
- ⇰ Toxina T-2
- ⇰ Fumonisina B1 (FB1)
- ⇰ Citrinina (CTN)
- ⇰ Zearalenona (ZEN)
- ⇰ Alcaloides Ergóticos
Se ha documentado a nivel mundial una distribución predominantemente marcada de Fumonisinas, Aflatoxinas, Zearalenona y Deoxinivalenol (Binder, 2007).
Los cultivos de cereales pueden contaminarse en el campo o durante las prácticas de cosecha, transporte, procesamiento o almacenamiento (Coffee, 2006; Khazaeli et al., 2014).
 La tasa de contaminación de los cultivos por hongos se dispara con mayor frecuencia en la época de lluvias (Pleadin et al., 2013, 2015, 2019).
La tasa de contaminación de los cultivos por hongos se dispara con mayor frecuencia en la época de lluvias (Pleadin et al., 2013, 2015, 2019).
Varios factores conocidos facilitan la producción de micotoxinas en productos contaminados, entre ellos:
- ⇰ El contenido de humedad (20-25%)
- ⇰ La temperatura ambiental (22-30ºC)
- ⇰ La composición de los alimentos
- ⇰ La humedad relativa del aire (70-90%)
- ⇰ Los daños físicos en los cereales por plagas
- ⇰ El pH
- ⇰ La presencia de esporas de moho
(Pleadin et al., 2015)
Vías habituales de entrada de micotoxinas al organismo
La principal vía es el consumo directo de productos contaminados de origen vegetal (cereales, frutos secos, pan, etc.) y productos obtenidos de animales (carne y productos cárnicos, leche, despojos, embutidos fermentados, etc.) (Carvet et al., 2006; Pleadin et al., 2015).
El contacto dérmico y la inhalación no son vías muy comunes, pero pueden actuar como un modo potencial de entrada en el organismo (Creppy, 2002).
Efectos tóxicos de las micotoxinas
Los efectos nocivos de las micotoxinas dependen de:
- ⇰ El tipo de micotoxina
- ⇰ La dosis introducida en el organismo
- ⇰ La duración de la exposición a las micotoxinas
(Creppy, 2002; Speijers, 2004)
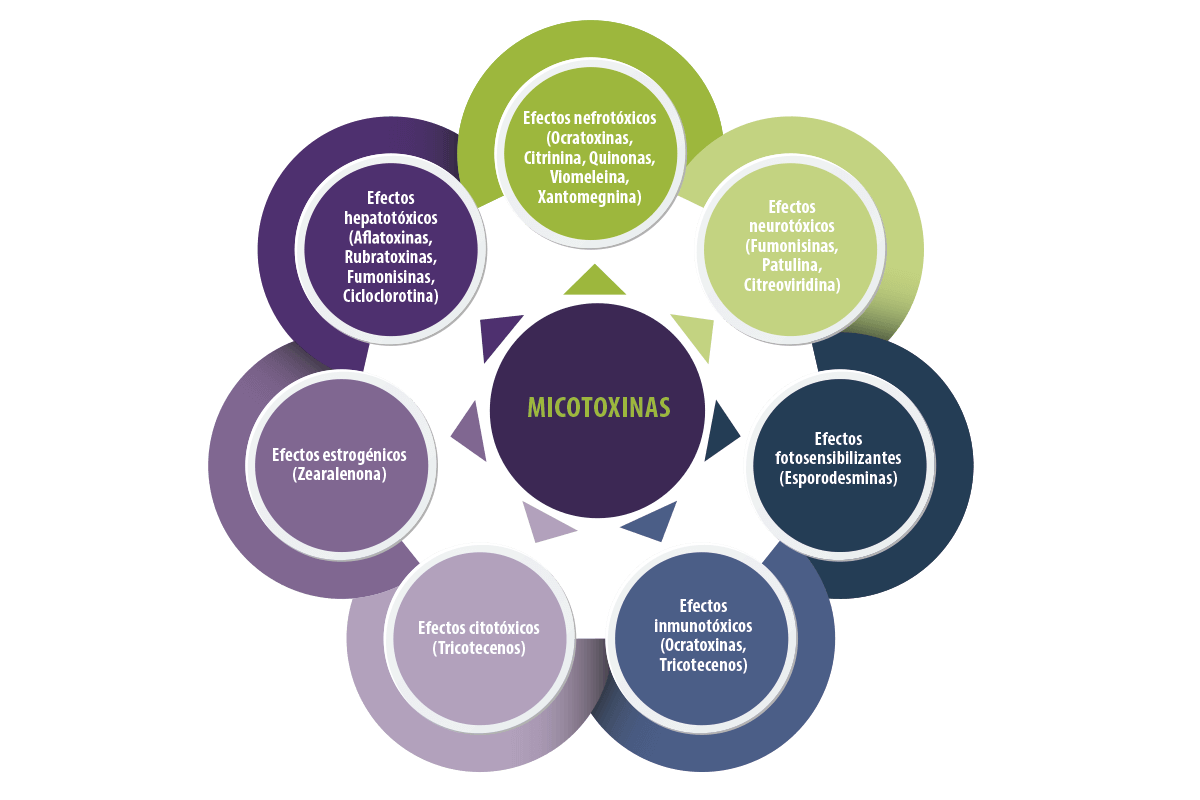
Figura 2. Clasificación de las micotoxinas en función de las manifestaciones clínicas.

LOS EFECTOS DE LAS MICOTOXINAS EN LOS ANIMALES
En la Tabla 1 se resumen los efectos de las micotoxinas en los animales.
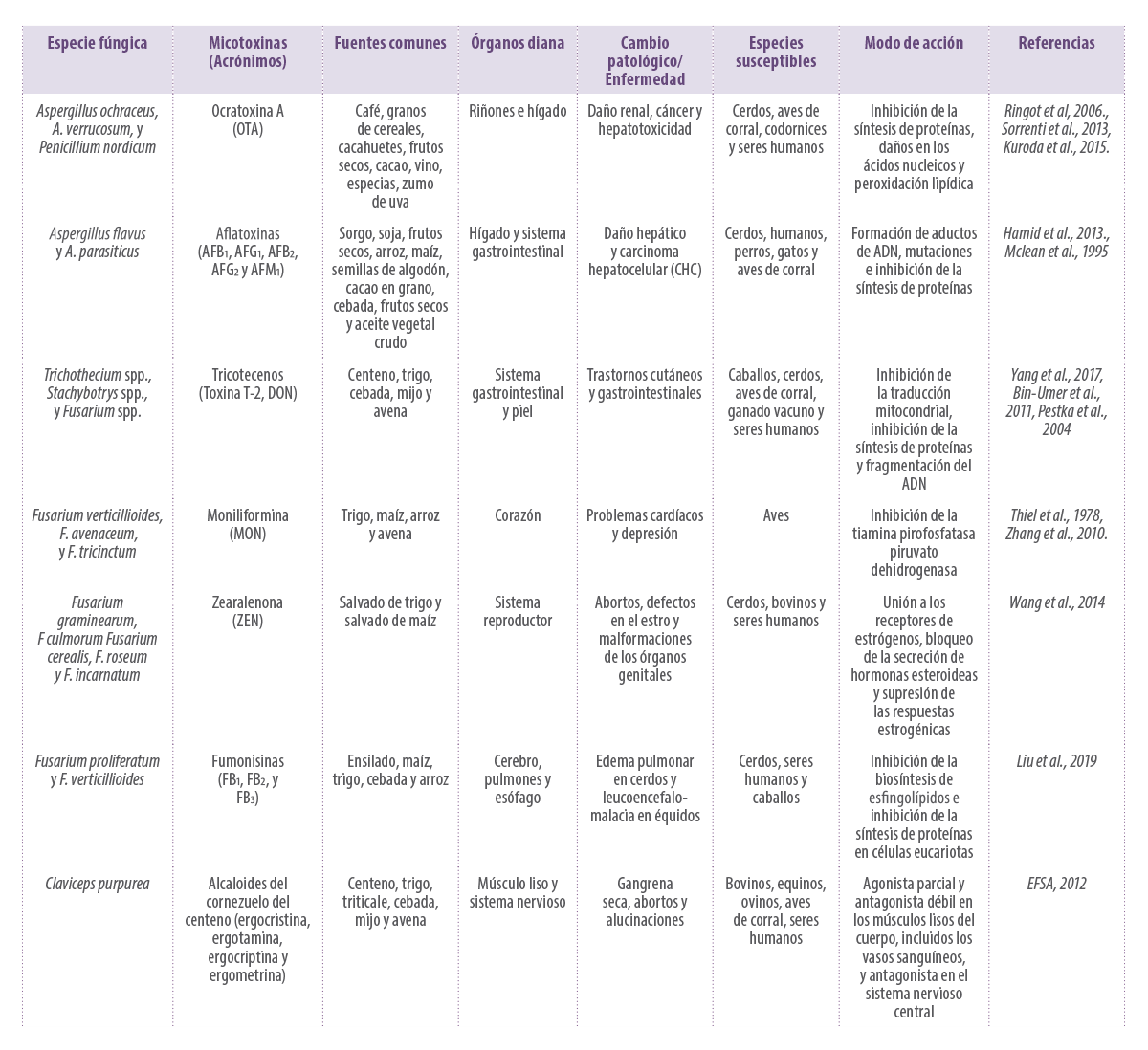
Tabla 1. Resumen de las principales micotoxinas y sus efectos tóxicos.
LOS EFECTOS DE LAS MICOTOXINAS EN LOS ANIMALES
Las fumonisinas son producidas por especies fúngicas como Fusarium verticillioides y F. proliferatum.
 Estos mohos aparecen con frecuencia en las plantas de maíz, dándole un aspecto blanquecino.
Estos mohos aparecen con frecuencia en las plantas de maíz, dándole un aspecto blanquecino.
Las formas más comunes de Fumonisinas incluyen la A y la B (B1, B2, B3 y B1 hidrolizada), siendo la Fumonisina B1 la más común y potente (Voss et al., 2014).
 La producción de esta micotoxina se ve favorecida cuando el contenido de humedad es <19%.
La producción de esta micotoxina se ve favorecida cuando el contenido de humedad es <19%.

La toxicidad de las Fumonisinas se señaló por primera vez en 1980 como causa de encefalomalacia equina (ELM) y edema pulmonar porcino (PPE) en Estados Unidos, y de cáncer de esófago en África.
⇰ También se ha señalado que las Fumonisinas provocan leucoencefalomalacia en caballos, carcinoma hepatocelular en ratas y edema pulmonar asociado a hidrotórax en cerdos.
 La IARC también ha documentado el potencial cancerígeno de las Fumonisinas en los seres humanos (IARC, 2002).
La IARC también ha documentado el potencial cancerígeno de las Fumonisinas en los seres humanos (IARC, 2002).
En la Tabla 2 se muestra un resumen de los efectos negativos de las Fumonisinas.
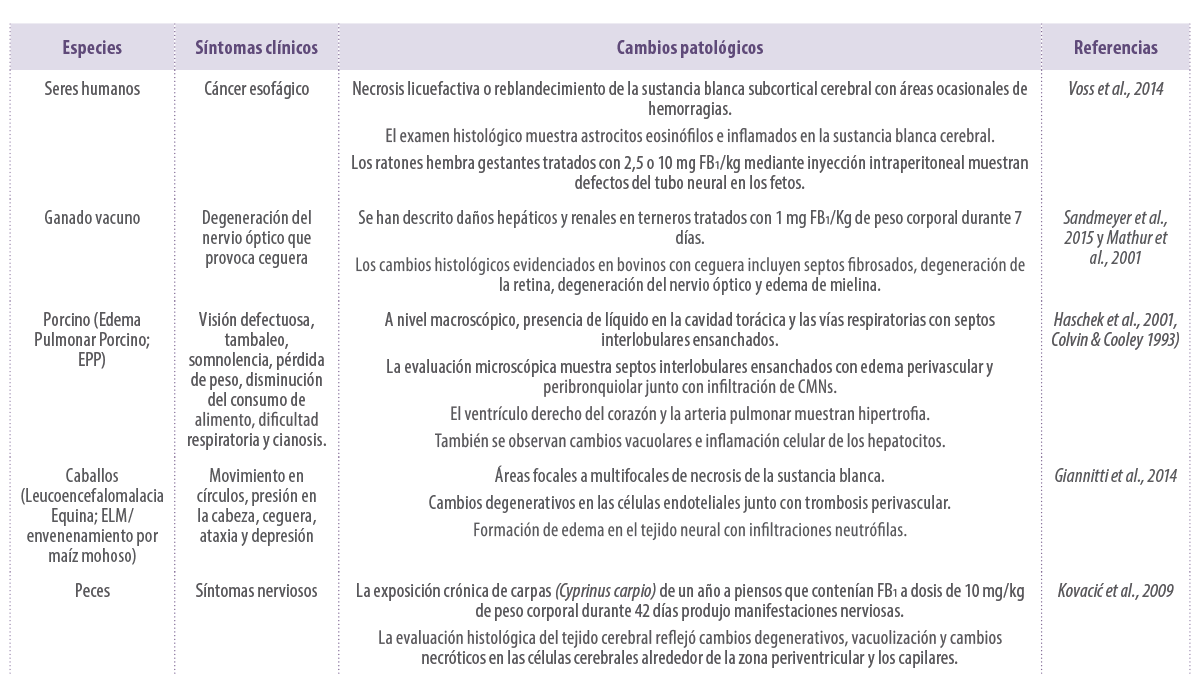
Tabla 2. Efectos clínicos y anatomopatológicos de las Fumonisinas.
Mecanismos de acción de las Fumonisinas
Las Fumonisinas compiten con la enzima ceramida sintasa, causando estrés oxidativo junto con estrés del retículo endoplásmico, interfiriendo con la modulación de la autofagia y alterando la metilación del ADN (Figura 3).

Figura 3. Mecanismos de inhibición del metabolismo de los esfingolípidos (Liu et al., 2019).
Efectos de las Fumonisinas en los caballos
Las Fumonisinas pueden ser extremadamente nocivas para los caballos. Cuando están presentes en el maíz u otros cereales, pueden provocar intoxicación por maíz mohoso o leucoencefalomalacia.
⇰ El síndrome se denominó Leucoencefalomalacia debido al tipo (malacia = reblandecimiento [debido a necrosis]) y distribución (leuco = materia blanca) de la lesión más prominente en el cerebro.
Los équidos son la única especie en la que las Fumonisinas inducen este tipo de lesión.
Los síntomas más comunes son (Imagen 1):
- ⇰ Desorientación y caminar sin rumbo
- ⇰ Caminar en círculos
- ⇰ Comportamiento alterado
- ⇰ Cólico
- ⇰ Presión de la cabeza contra objetos sólidos
- ⇰ Ceguera
- ⇰ Muerte en algunos casos
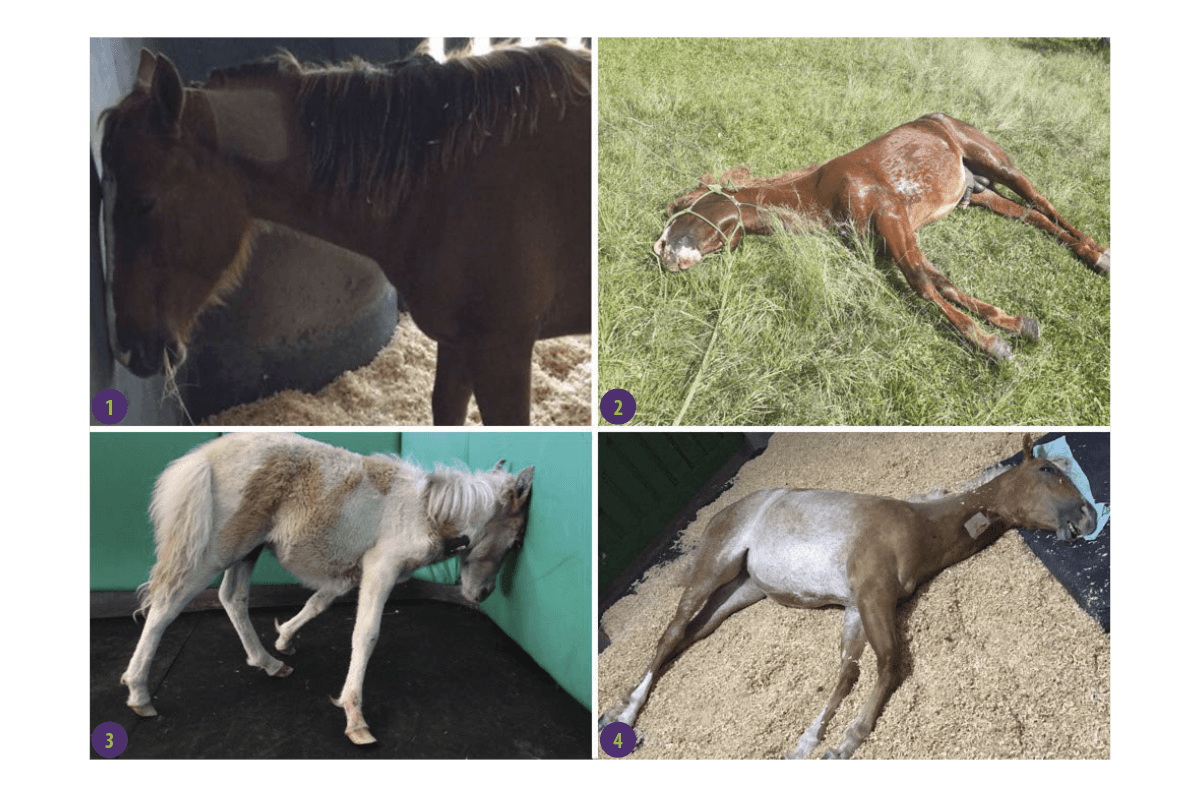
Imagen 1. Presentación clínica de caballos afectados por leucoencefalomalacia. (1-2) Caballos que muestran presión en la cabeza. (3-4) Caballos que presentan estado mental semicomatoso y decúbito lateral (Fuente: Albertino et al., 2021).
Efectos de las Fumonisinas en los cerdos
Los cerdos intoxicados crónicamente con FB1 y FB2, incluso a dosis bajas, presentan síntomas clínicos inespecíficos, como:
⇰ Reducción del consumo diario de pienso y de la ganancia de peso.
⇰ Empeoramiento del índice de conversión alimenticia y de la calidad de la canal asociado a lesiones hepáticas y a un estado general de salud debilitado.
En el ganado porcino, las Fumonisinas se asocian principalmente con el edema pulmonar porcino (EPP) y los síntomas se muestran en la Figura 4.
Numerosos estudios han demostrado que la toxicidad aguda de las Fumonisinas en los cerdos está relacionada con el edema pulmonar que, generalmente, se produce entre 3 y 5 días después del consumo inicial del pienso contaminado.
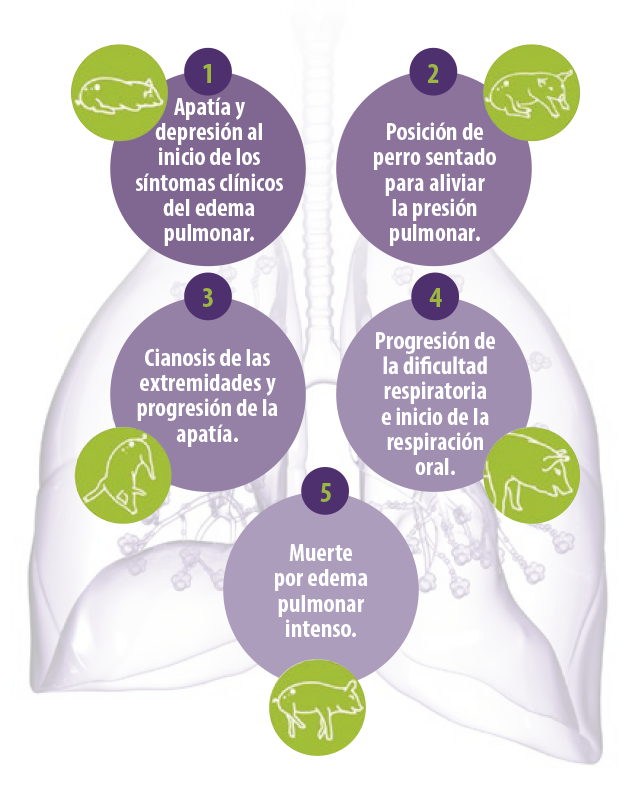
Figura 4. Diferentes fases del Síndrome de Edema Pulmonar Porcino en cerdos inducido por intoxicación con Fumonisinas.

Efectos de las Fumonisinas en las aves de corral
A pesar de la relativa resistencia a las Fumonisinas de las aves de corral, estas micotoxinas pueden seguir teniendo efectos negativos (Figura 5).
Los efectos más importantes de las fumonisinas en las aves de corral son:
- ⇰ Reducción del peso del timo
- ⇰ Reducida inmunización frente a la enfermedad de Newcastle
- ⇰ Reducción del nivel de macrófagos
- ⇰ Disminución de la respuesta linfocitaria a las infecciones por Salmonella gallinarum

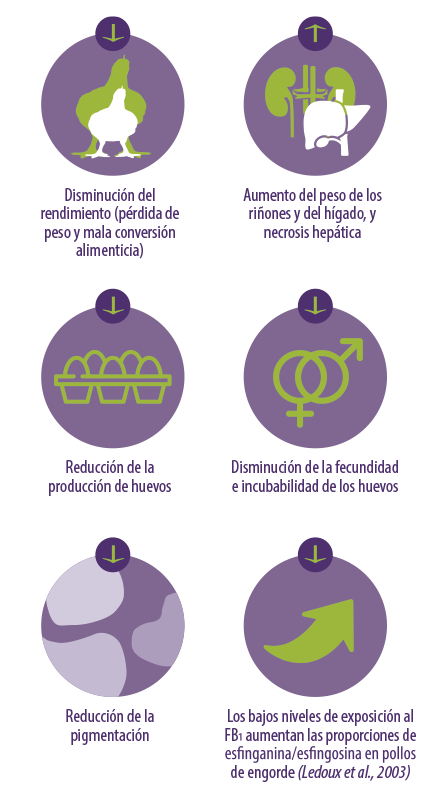
Figura 5. Efectos de las Fumonisinas en las aves de corral.
REMEDIACIÓN DE FUMONISINAS CON MINAZEL PLUS® – IN VITRO E IN VIVO
En todo el mundo se han adoptado numerosas estrategias antes y después de la cosecha para reducir la amenaza de las micotoxinas en los alimentos para animales.
Un método común es el uso de compuestos orgánicos nutricionalmente inertes (paredes celulares de levadura y glucomananos) o inorgánicos (minerales arcillosos como el aluminosilicatos, la bentonita y la zeolita) como adsorbentes que fijan las micotoxinas en el tracto gastrointestinal de los animales y reducen su biodisponibilidad.
Desde hace poco, se está extendiendo el uso de otra categoría de agentes biotransformadores de micotoxinas de origen biológico (bacterias, hongos, enzimas y plantas) (Loi et al., 2017).
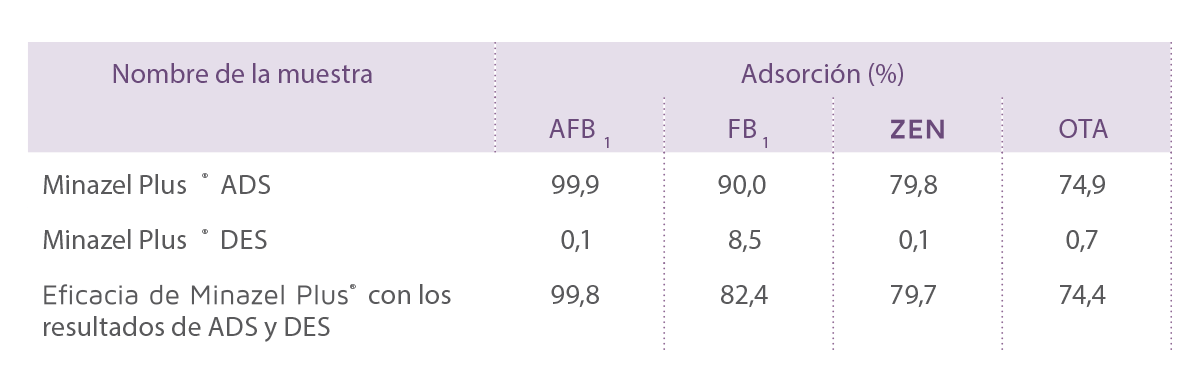
Estudios de adsorción y desorción in vitro con Minazel Plus®
Minazel Plus® es un producto basado en la modificación orgánica de la clinoptilolita.
⇰ Se ha estudiado a pH 3,0 para la adsorción (ADS) y a pH 6,5 para la desorción (DES) mediante LC-MS/MS.
Los resultados para ADS y DES de Minazel Plus® se muestran en la Tabla 3.
Estudio in vivo con Minazel Plus® frente a Fumonisinas en lechones destetados
Para demostrar la eficacia de Minazel Plus®, se realizó un estudio in vivo en lechones.
![]() El objetivo de este estudio fue evaluar la capacidad de un compuesto a base de zeolita clinoptilolita modificada (Minazel® Plus, Patent Co DOO, Misicevo, Serbia) para prevenir la absorción gastrointestinal de FB1 en lechones que recibieron dietas contaminadas con Fumonisinas.
El objetivo de este estudio fue evaluar la capacidad de un compuesto a base de zeolita clinoptilolita modificada (Minazel® Plus, Patent Co DOO, Misicevo, Serbia) para prevenir la absorción gastrointestinal de FB1 en lechones que recibieron dietas contaminadas con Fumonisinas.
Este estudio fue llevado a cabo por el Dr. Panagiotis Tassis, DVM, PhD Profesor (Medicina y Reproducción Porcina), Escuela de Medicina Veterinaria de la Universidad Aristóteles de Tesalónica, Grecia en 2016.
⇰ El estudio se realizó con un total de 24 lechones (28 días de edad) repartidos en 4 grupos (6 animales/ grupo), cada uno con igual número de machos y hembras. El periodo total del ensayo fue de 42 días.

Los grupos del ensayo y sus respectivas intervenciones fueron los siguientes:
- ⇰ Grupo control: lechones alimentados con una dieta control sin la adición de Minazel Plus® o FB.
- ⇰ Grupo Min 1: lechones que recibieron el pienso control con la adición de 10 ppm de FB, sin la inclusión de Minazel Plus®.
- ⇰ Grupo Min 2: lechones que recibieron el pienso control con la adición de 10 ppm de FB y 2 kg de Minazel Plus®/tonelada de pienso.
Los lechones se distribuyeron en secciones independientes y separadas de la estación experimental que cumplían todos los requisitos de bioseguridad y bienestar.
El pienso (mezcla equilibrada de maíz, trigo y cebada) se ofreció ad libitum a los animales del ensayo.
Las Fumonisinas se introdujeron en el pienso sustituyendo el maíz de control por un maíz contaminado de forma natural.
Al final del ensayo, se registraron los siguientes resultados en relación con la inclusión de Minazel Plus® en el pienso:
EFECTOS EN LOS PARÁMETROS PRODUCTIVOS
⇰ Ausencia de diferencias significativas en los niveles medios de los parámetros productivos en comparación con el grupo control.
⇰ Ausencia de diferencias significativas en la GMD entre el grupo control y los lechones alimentados con 10 ppm de FB1 + Minazel Plus® durante 42 días (Figura 6).
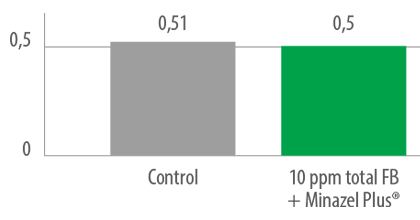
Figura 6. Ganancia media diaria (kg) – período de prueba total.
⇰ Ausencia de diferencias significativas en el IC entre los controles y los lechones alimentados con 10 ppm de FB1 + Minazel Plus® durante 42 días (Figura 7).
⇰ Ausencia de diferencias significativas en los niveles medios de enzimas hepáticas en comparación con el grupo de control.
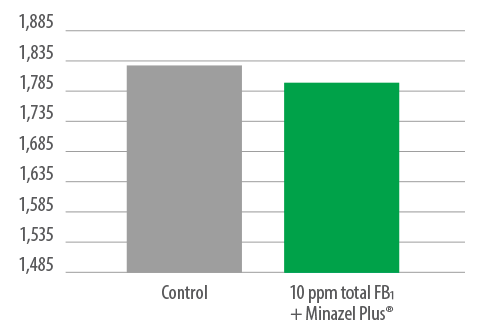
Figura 7. IC (F:G) – Periodo de prueba total.
EXAMEN HISTOLÓGICO
Las características histológicas mostraron unos límites normales en el hígado, los pulmones y el intestino de todos los animales examinados (Imagen 2).
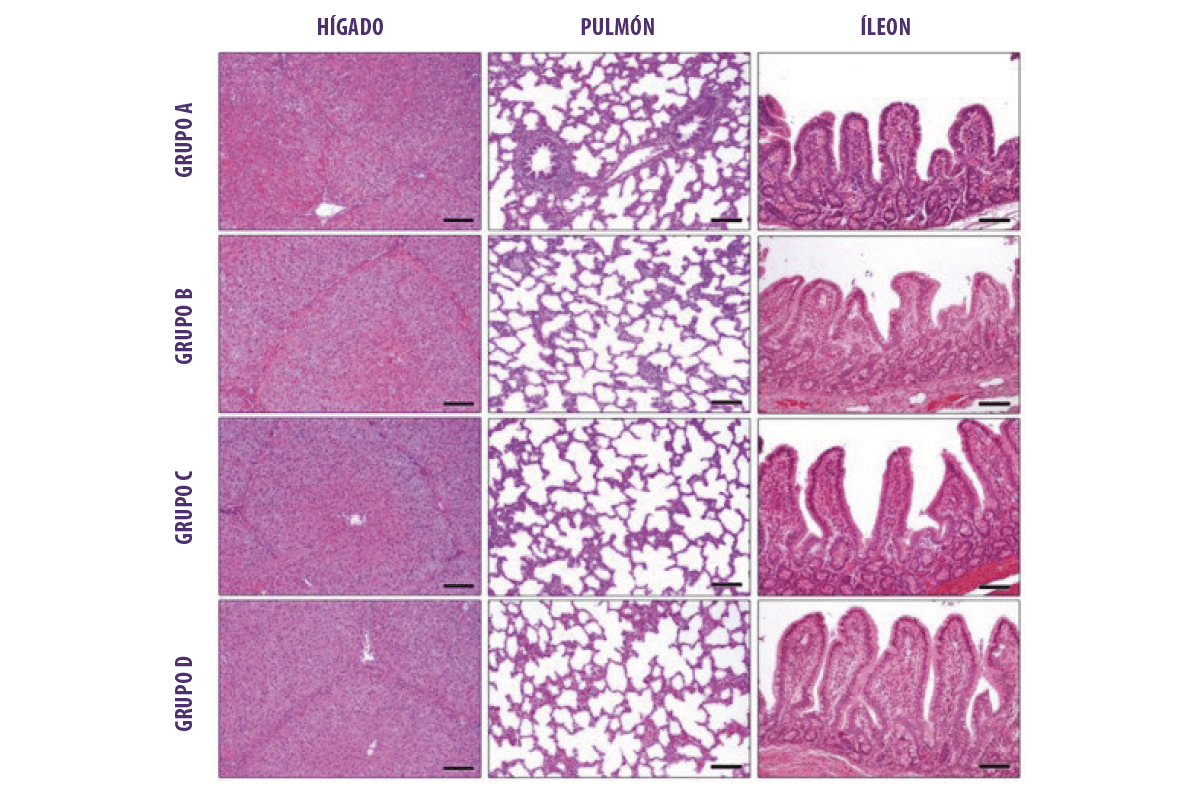
Imagen 2. Características histológicas (hematoxilina y eosina. Barra: 100 μm) de hígado, pulmón e íleon. Grupo A= Control; Grupo B = Grupo Min 1; Grupo C/D =Grupo Min 2.
Estos resultados permitieron extraer las siguientes conclusiones:
![]() No hubo diferencias significativas en la GMD entre el grupo control y el grupo que recibió 10 ppm FB1 + Minazel Plus® durante 42 días.
No hubo diferencias significativas en la GMD entre el grupo control y el grupo que recibió 10 ppm FB1 + Minazel Plus® durante 42 días.
![]() No hubo diferencias significativas en el IC entre el grupo control y el grupo que recibió 10 ppm FB1 + Minazel Plus® durante 42 días.
No hubo diferencias significativas en el IC entre el grupo control y el grupo que recibió 10 ppm FB1 + Minazel Plus® durante 42 días.
![]() Se observaron características histológicas dentro de los límites normales en el hígado, los pulmones y el intestino de todos los animales examinados.
Se observaron características histológicas dentro de los límites normales en el hígado, los pulmones y el intestino de todos los animales examinados.

CONCLUSIONES ![]()
Según estudios recientes, el 96% de las muestras están contaminadas con una o más micotoxinas y las Fumonisinas son las micotoxinas más comunes en todo el mundo.
Los resultados de estos estudios han puesto de manifiesto la coocurrencia de dos o más micotoxinas en el maíz y en las materias primas para piensos.
La presencia conjunta de más de una micotoxina puede tener efectos aditivos o sinérgicos cuando se administra a especies animales sensibles (por ejemplo, cerdos y aves de corral).
⇰ Esto sugiere que se requieren tecnologías para el control de mezclas de tales contaminantes en piensos basados predominantemente en maíz, con el fin de minimizar los impactos en el desarrollo animal.
Las Fumonisinas son producidas por varias especies de Fusarium, siendo Fusarium moniliforme reconocido como el principal productor de esta micotoxina.
Las Fumonisinas son muy solubles y tienen una mayor capacidad para propagarse fácilmente, contaminando grandes volúmenes de agua y piensos.
 Entre los animales, los cerdos son los más sensibles a las Fumonisinas, pero también afectan a las aves de corral y las vacas.
Entre los animales, los cerdos son los más sensibles a las Fumonisinas, pero también afectan a las aves de corral y las vacas.

REFERENCIAS 
Albertino, L.G. et al. (2021) ‘Clinical findings of equine leukoencephalomalacia’, Pesquisa Veterinária Brasileira, 41. doi:10.1590/1678-5150-pvb-6912.
Binder, E.M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology 2007, 133 (1–2), 149-166.
Bin-Umer, M.A.; McLaughlin, J.E.; Basu, D.; McCormick, S.; Tumer, N.E. Trichothecene mycotoxins inhibit mitochondrial translation-implication for the mechanism of toxicity. Toxins 2011, 3(12), 1484-501. doi: 10.3390/toxins3121484.
Cavret, S.; Lecoeura, S. Fusariotoxin transfer in animal. Food and Chemical Toxicology 2006, 44(3), 444-453
Coffey, R. EndaCummins; ShaneWard. xposure assessment of mycotoxins in dairy milk. Food Control 2009, 20 (3), 239-249.
Colvin, B.M.; Cooley, A.J.; Beaver, RW. Fumonisin toxicosis in swine: clinical and pathological findings. J. Vet. Diagn. Invest. 1993, 5, 232–241.
Creppy, E.E. Update of survey, regulation and toxic effects of mycotoxins in Europe. Toxicol Lett. 2002, 28, 127(1-3), 19-28. doi: 10.1016/s0378-4274(01)00479-9.
EFSA Panel on Contaminants in the Food Chain (CONTAM); Scientific Opinion on Ergot alkaloids in food and feed. EFSA Journal 2012, 10(7), 2798. [158 pp.] doi:10.2903/j.efsa.2012.2798.
Giannitti, F.; Diab, S.; Pacin, A.; Barrandeguy, M.; Larrere, C et al. Equine leukoencephalomalacia due to fumonisins B1 and B2 in Argentina. Pesq Vet Bras. 2011, 31, 407-412.
Hamid, A.S.; Tesfamariam, I.G.; Zhang, Y.; Zhang, Z.G. Aflatoxin B1-induced hepatocellular carcinoma in developing countries: geographical distribution, mechanism of action and prevention. Oncology letters 2013, 5, 1087-1092
Haschek, W.M.; Gumprecht, L.A.; Smith, G.; Tumbleson, M.E.; Constable, P.D. Fumonisin toxicosis in swine: an overview of porcine pulmonary edema and current perspectives. Environ Health Perspect. 2001,109 (Suppl 2), 251-7. doi: 10.1289/ehp.01109s2251. PMID: 11359693; PMCID: PMC1240673.
Haschek, W.M.; Voss, K.A. Mycotoxins. Haschek and Rousseaux’s Handbook of Toxicologic Pathology. Third Edition. University of Illinois, Urbana, IL, USA, 2 USDA Agricultural Research Service, Athens, GA, USA, 2013; 1187-1258. http://dx.doi.org/10.1016/B978-0-12-415759-0.00039-X
IARC (International Agency for Research on Cancer). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 82. Lyon, International Agency for Research on Cancer, 2002; 82.
Khazaeli, P.; Najafi, M.L.; Bahaabadi, GA.; Shakeri, F.; Naghibzadeh tahami, A. Evaluation of aflatoxin contamination in raw and roasted nuts in consumed Kerman and effect of roasting, packaging and storage conditions. Life Sci. J. 2014, 10, 578–583.
Kovacić, S.; Pepeljnjak, S.; Petrinec, Z.; Klarić, M.S. Fumonisin B1 neurotoxicity in young carp (Cyprinus carpio L.). Arh Hig Rada Toksikol. 2009, 60(4), 419-26. doi: 10.2478/10004-1254-60-2009-1974. PMID: 20061242.
Kuroda, K.; Hibi, D.; Ishii, Y.; Yokoo, Y.; Takasu, S.; Kijima, A.; Matsushita K.; Masumura K.I.; Kodama Y.; Yanai T.; Sakai H.; Nohmi T.; Ogawa, K.; Umemura, T. Role of p53 in the progression from ochratoxin A-induced DNA damage to gene mutations in the kidneys of mice. Toxicological Sciences 2015, 144, 65-76
Liu, X.; Fan, L.; Yin, S.; Chen, H.; Hu, H. Molecular mechanisms of fumonisin B1-induced toxicities and its applications in the mechanism-based interventions. Toxicon. 2019, 167, 1-5. doi: 10.1016/j.Toxicon.2019.06.009.
Mathur, S.; Constable, P.D.; Eppley, R.M.; Waggoner, A.L.; Tumbleson, M.E.; Haschek, W.M. Fumonisin B(1) is hepatotoxic and nephrotoxic in milk-fed calves. Toxicol Sci. 2001, 60(2), 385-96. doi: 10.1093/toxsci/60.2.385. PMID: 11248152.
McLean, M.; Dutton, M.F. Cellular interactions and metabolism of aflatoxin: an update. Pharmacology and Therapeutics 1995, 65, 163-192.
Milićević, D.R.; Skrinjar, M.; Baltić, T. Real and perceived risks for mycotoxin contamination in foods and feeds: challenges for food safety control. Toxins 2010, 4, 572-92. doi: 10.3390/toxins2040572.
Pandya, J.P.; Arade, P.C. Mycotoxin: a devil of human, animal and crop health. Adv. Life Sci. 2016, 5, 3937–3941.
Pestka, J.J.; Zhou, H.R.; Moon, Y.; Chung, Y.J. Cellular and molecular mechanisms for immune modulation by deoxynivalenol and other trichothecenes: unraveling a paradox. Toxicology Letters 2004,153, 61-73.
Pleadin, J.; Frece, J.; Markov, K. Mycotoxins in food and feed. Adv Food Nutr Res. 2019, 89, 297-345. doi: 10.1016/bs.afnr.2019.02.007.
Pleadin, J.; Kovačević, D.; Peršia, N. Ochratoxin A contamination of the autochthonous dry-cured meat product “Slavonski Kulen” during a six month production process. Food Control 2015, 57, 377-384
Pleadin, J.; Staver, M.M.; Vahčić, N.; Kovačević, D.; Milone, S.; LaraSaftićb Scortichini, G. Survey of aflatoxin B1 and ochratoxin A occurrence in traditional meat products coming from Croatian households and markets. Food Control 2015, 52, 71-77
Pleadin, J.; Vahcic, N.; Persi.; Sevelj.; Markov, K.; Frece, J. Fusarium mycotoxins’ occurrence in cereals harvested from Croatian fields. Food Control 2013, 32, 49-54
Raj j, Farkaš, H, Jakovčević, Zdenka, Medina, A, Magan, A, Čepela R and Vasiljević M (2022) Comparison of multiple mycotoxins in harvested maize samples in three years (2018-2020) in four continents. Food Additives and Contaminants Part A, Mar;39(3):599-608.
Ringot, D.; Chango, A.; Schneiderb, Y.J.; Larondelle, Y. Toxicokinetics and toxicodynamics of ochratoxin A, an update. Chemico-Biological Interactions 2006, 159, 18-46
Sandmeyer, L.S.; Vujanovic, V.; Petrie, L.; Campbell, J.R.; Bauer, B.S.; Allen, AL.; Grahn, B.H. Optic neuropathy in a herd of beef cattle in Alberta associated with consumption of moldy corn. Can Vet J. 2015, 56(3), 249-56. PMID: 25750444; PMCID: PMC4327135.
Sorrenti, V.; Di Giacomo, C.; Acquaviva, R.; Barbagallo, I.; Bognanno, M.; Galvano, F. Toxicity of ochratoxin A and its modulation by antioxidants: a review. Toxins 2013, 5, 1742-1766.
Speijers, G.J.; Speijers, M.H. Combined toxic effects of mycotoxins. Toxicol Lett. 2004, 153(1), 91-8. doi: 10.1016/j.toxlet.2004.04.046.
Thiel, P.G. A molecular mechanism for the toxic action of moniliformin, a mycotoxin produced by Fusarium moniliforme. Biochem Pharmacol. 1978, 27, 483-486.
Voss, K.A.; Riley, T.R.; Waes Gelineau-van, J. Fumonisin B1 induced neural tube defects were not increased in LM/Bc mice fed folate-deficient diet. Molecular Nutrition & Food Research, 2014, 58(6).
Wang, Y.; Zheng, W.; Bian, X.; Yuan, Y.; Gu, J.; Liu, X.; Liu, Z.; Bian, J. Zearalenone induces apoptosis and cytoprotective autophagy in primary leydig cells. Toxicology Letters 2014, 226 (2), 182–91.
Weidner, M.; Welsch, T.; Hübner, F.; Schwerdt, G.; Gekle, M.; Humpf, H.U. Identification and apoptotic potential of T-2 toxin metabolites in human cells. Journal of Agricultural and Food Chemistry 2012, 60, 5676-5684.
WHO (World Health Organization). Safety Evaluation of Certain Mycotoxins in Food. WHO Food Additive Series 47, Geneva, 2001.
Yang, L.; Tu, D.; Zhao, Z.; Cui, J. Cytotoxicity and apoptosis induced by mixed mycotoxins (T-2 and HT-2 toxin) on primary hepatocytes of broilers in vitro. Toxicon 2017, 129, 1–10. 10.1016/j.toxicon.2017.01.001
Zhang, A.; Cao, J.L.; Yang, B.; Chen, J.H. Zhang, Z.-T.; Li, S.-Y.; Fu, Q.; Hugnes, C.; Caterson, B. Effects of moniliformin and selenium on human articular cartilage metabolism and their potential relationships to the pathogenesis of Kashin-Beck disease. J. Zhejiang Univ. Sci. B. 2010, 11 (3), 200–208.




 Prevención de micotoxicosis
Prevención de micotoxicosis