Sabry El-khodary
Catedrático de Medicina Interna y Vicedecano de Estudios de Postgrado e Investigación, Facultad de Medicina Veterinaria, Universidad de Mansoura, Egipto
Numerosos estudios han demostrado que, una vez ingeridos, los piensos contaminados con micotoxinas pueden inducir efectos nocivos, como toxicidad hepatorrenal, reproductiva, cardiaca y neurotoxicidad, así como inmunotoxicidad en los animales (Fang et al., 2022). Cuando el ganado ingiere una o varias micotoxinas, el efecto sobre su salud puede ser agudo, mostrando signos evidentes de enfermedad o incluso causando la muerte.![]() Sin embargo, la manifestación aguda de micotoxicosis es rara en condiciones de granja (Vieira et al., 2014).
Sin embargo, la manifestación aguda de micotoxicosis es rara en condiciones de granja (Vieira et al., 2014).
Los efectos de la ingestión de micotoxinas son principalmente crónicos y conducen a trastornos ocultos con reducción de la ingestión, la productividad y la fertilidad (Fink-Gremmels, 2008). Tales efectos causan graves pérdidas económicas debido a: (Oswald et al., 2005; Storm et al., 2014a)

Efectos inmunotóxicos de las MICOTOXINAS en rumiantes
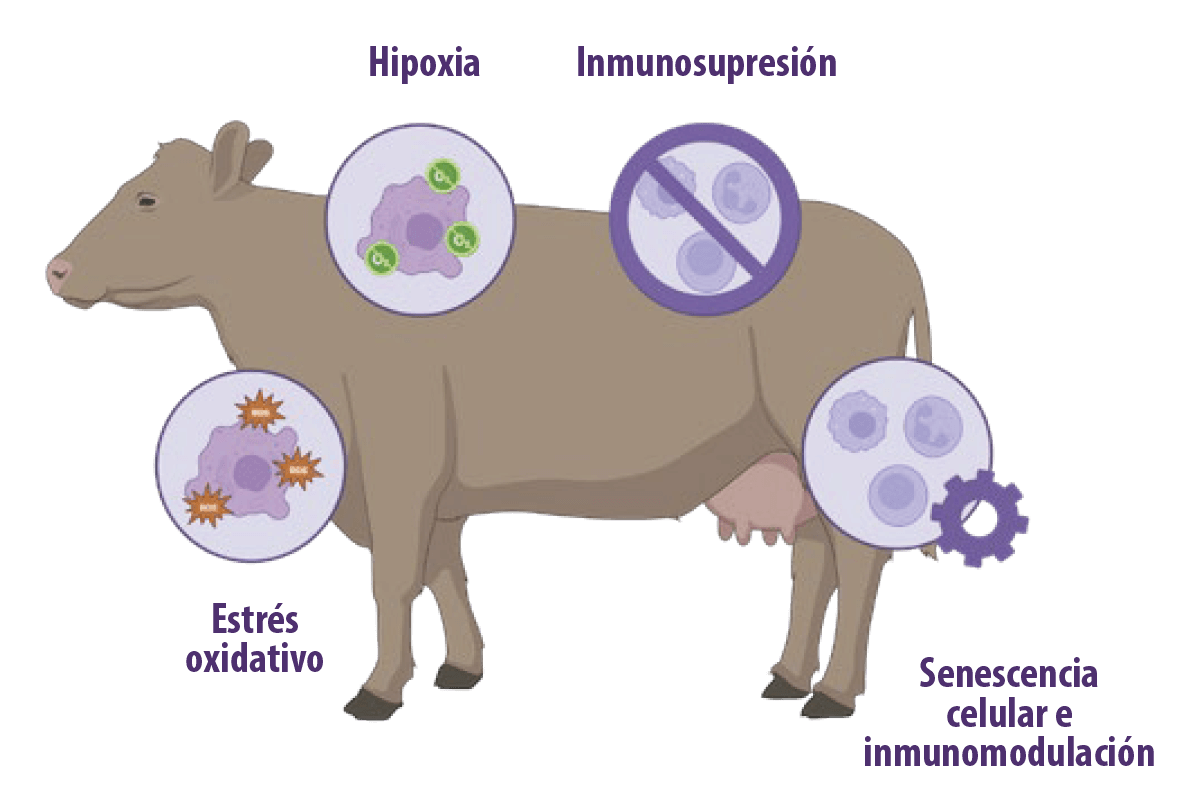
Se ha demostrado que las micotoxinas tienen efectos inmunosupresores en función de: Por ejemplo, la aflatoxina B1 (AFB1) tiene consecuencias inmunotóxicas, como la alteración de la inmunidad innata y adquirida/adaptativa (Meissonnier et al., 2008; Mohsenzadeh et al., 2016). En los rumiantes, se ha confirmado que las micotoxinas inducen estrés oxidativo, hipoxia e inmunosupresión. Además, la evidencia emergente muestra que las micotoxinas tienen el potencial de inducir senescencia celular, que está implicada en sus efectos inmunomoduladores (You et al., 2023).
![]() La micotoxina o micotoxinas implicadas
La micotoxina o micotoxinas implicadas![]() La concentración
La concentración![]() El parámetro estudiado
El parámetro estudiado
Toxinas procedentes de Penicillium P. roqueforti y P. paneum producen varios metabolitos secundarios con efectos inmunosupresores, antibacterianos y otros efectos toxicológicos no bien definidos para los animales (Storm et al., 2008; Storm et al., 2014b). Toxinas procedentes de Monascus ruber Basándose en resultados in vitro, se han documentado efectos inmunotóxicos de la citrinina a dosis muy altas (Stec et al., 2008).
Toxinas procedentes de Fusarium Las toxinas derivadas de Fusarium, principalmente el deoxinivalenol (DON) y la fumonisina B1 (FB1), pueden alterar drásticamente los mecanismos de defensa del intestino, reduciendo la integridad epitelial, la proliferación celular y la producción de moco o aumentando la permeabilidad intestinal, así como la producción de inmunoglobulinas y citoquinas (Antonissen et al., 2014). Por ejemplo, A. fumigatus produce varias micotoxinas, como la gliotoxina y los tremórgenos, que son tóxicas para el ganado. ⇰ La gliotoxina, un inmunosupresor, ha estado presente en animales infectados por A. fumigatus (Bauer et al., 1989). En un modelo de insecto, se ha demostrado el papel de la gliotoxina en el aumento de la virulencia de A. fumigatus (Reeves et al., 2004). Varios metabolitos de hongos Fusarium, conocidos colectivamente como toxinas de Fusarium, han mostrado efectos deletéreos en humanos y ganado al atacar los sistemas inmunológico y hepático (Bondy y Pestka, 2000b; Trenholm et al., 1984).
Efectos de las micotoxinas en el sistema inmunitario de los rumiantes
En rumiantes, la AFB1, la ocratoxina A (OTA) y el DON son las tres micotoxinas que han recibido la mayor atención académica y que se han analizado de forma más rutinaria en entornos clínicos. Se ha descubierto que estas micotoxinas no solo suprimen las respuestas inmunitarias, sino que también inducen la inflamación e incluso aumentan la susceptibilidad a los patógenos (Sun et al., 2023a). Se teoriza que, con el desarrollo de la micosis, las micotoxinas producidas por los hongos invasores pueden suprimir la inmunidad, aumentando así su infectividad (Whitlow y Hagler Jr, 2010).
Leucocitos y recuento leucocitario diferencial
Los mismos autores añadieron que la capacidad fagocítica de los granulocitos de todos los terneros se redujo sustancialmente en la semana 5, mientras que la actividad de los monocitos empezó a disminuir incluso antes en el estudio. ⇰ La disminución de la expresión génica en los terneros tratados indica que la utilización del hierro puede verse afectada negativamente por la exposición a DON/FUM (Roberts et al., 2021b).![]() En un caso experimental de micotoxicosis en terneros durante 3 semanas, se produjo leucocitosis con linfocitosis, monocitosis y neutropenia. Sin embargo, 1,7 mg de DON y 3,5 mg de fumonisinas (FUM) por kg de ración total fueron insuficientes para causar efectos citotóxicos significativos en los leucocitos mononucleares circulantes en estos animales (Roberts et al., 2021b).
En un caso experimental de micotoxicosis en terneros durante 3 semanas, se produjo leucocitosis con linfocitosis, monocitosis y neutropenia. Sin embargo, 1,7 mg de DON y 3,5 mg de fumonisinas (FUM) por kg de ración total fueron insuficientes para causar efectos citotóxicos significativos en los leucocitos mononucleares circulantes en estos animales (Roberts et al., 2021b).![]() En un estudio con terneros alimentados con una dieta control, los linfocitos CD8+ disminuyeron durante las dos primeras semanas del período de tratamiento, mientras que los animales alimentados con una dieta tratada (DON y FUM) tenían poblaciones de linfocitos CD4-CD8+ significativamente más altas durante la semana 2 (Roberts et al., 2021b).
En un estudio con terneros alimentados con una dieta control, los linfocitos CD8+ disminuyeron durante las dos primeras semanas del período de tratamiento, mientras que los animales alimentados con una dieta tratada (DON y FUM) tenían poblaciones de linfocitos CD4-CD8+ significativamente más altas durante la semana 2 (Roberts et al., 2021b).![]() Se ha concluido que las células bovinas son más sensibles al DON que las de otras especies ganaderas (Novak et al., 2018). Sin embargo, no se ha evaluado formalmente su efecto sobre la condición corporal o el nivel de crecimiento (Pestka, 2008).
Se ha concluido que las células bovinas son más sensibles al DON que las de otras especies ganaderas (Novak et al., 2018). Sin embargo, no se ha evaluado formalmente su efecto sobre la condición corporal o el nivel de crecimiento (Pestka, 2008).![]() Se ha sugerido que la relación CD4:CD8 podría ser un candidato a biomarcador de la exposición temprana a DON en el ganado vacuno, que puede ser atenuada por la toxicidad coocurrente de fumonisinas (Taranu et al., 2010).
Se ha sugerido que la relación CD4:CD8 podría ser un candidato a biomarcador de la exposición temprana a DON en el ganado vacuno, que puede ser atenuada por la toxicidad coocurrente de fumonisinas (Taranu et al., 2010).![]() El análisis RNA-Seq ha revelado 217 genes de expresión diferencial entre terneros tratados y terneros control, en los que la exposición a micotoxinas conduce generalmente a una disminución de la expresión de características determinadas.
El análisis RNA-Seq ha revelado 217 genes de expresión diferencial entre terneros tratados y terneros control, en los que la exposición a micotoxinas conduce generalmente a una disminución de la expresión de características determinadas.![]() Estudios anteriores han demostrado alteraciones en los mecanismos celulares de transporte de oxígeno por la administración in vitro de fumonisinas (Osweiler et al., 1993; Yin et al., 1996).
Estudios anteriores han demostrado alteraciones en los mecanismos celulares de transporte de oxígeno por la administración in vitro de fumonisinas (Osweiler et al., 1993; Yin et al., 1996).![]() En un estudio experimental, se ha demostrado que las micotoxinas reducen la actividad fagocítica en terneros en fase de acabado, independientemente de la exposición previa a las micotoxinas (Roberts et al., 2021a).
En un estudio experimental, se ha demostrado que las micotoxinas reducen la actividad fagocítica en terneros en fase de acabado, independientemente de la exposición previa a las micotoxinas (Roberts et al., 2021a).
Respuesta inflamatoria, quimiotaxis de neutrófilos e inmunoglobulinas
Los mismos autores descubrieron que la exposición temprana a micotoxinas se acompañaba de un aumento numérico de la abundancia de neutrófilos, pero al mismo tiempo, los ensayos funcionales mostraban una ligera disminución de la fagocitosis de granulocitos y del estallido oxidativo. Además, las vías relacionadas con inmunoglobulinas estaban reforzadas en los animales expuestos a DON/FUM el día 21.![]() En un estudio experimental en terneros de engorde, la exposición a DON/FUM indujo un aumento de los tiempos de respuesta inflamatoria en los días 7 y 21, junto con los tiempos de quimiotaxis de neutrófilos en el día 7 (Roberts et al., 2021a).
En un estudio experimental en terneros de engorde, la exposición a DON/FUM indujo un aumento de los tiempos de respuesta inflamatoria en los días 7 y 21, junto con los tiempos de quimiotaxis de neutrófilos en el día 7 (Roberts et al., 2021a).![]() Los efectos de DON en los niveles de inmunoglobulinas en animales de laboratorio han sido revisados previamente (Bondy y Pestka, 2000a), mostrando alteraciones en la producción de inmunoglobulinas de una manera dependiente de la clase. Sin embargo, las alteraciones en la producción de anticuerpos son un importante resultado toxicológico no lineal en el ganado (Dänicke et al., 2018).
Los efectos de DON en los niveles de inmunoglobulinas en animales de laboratorio han sido revisados previamente (Bondy y Pestka, 2000a), mostrando alteraciones en la producción de inmunoglobulinas de una manera dependiente de la clase. Sin embargo, las alteraciones en la producción de anticuerpos son un importante resultado toxicológico no lineal en el ganado (Dänicke et al., 2018).
En concreto, la AFB1 aumenta la síntesis de IFN-gamma, una citoquina Th1 implicada en la respuesta inmunitaria mediada por células, y disminuye la síntesis de IL-4, una citoquina Th2 implicada en la respuesta humoral (Pierron et al., 2016).
![]() Las herramientas de análisis DIA y DAVID revelaron los efectos de los tratamientos dietéticos con micotoxinas en el transcriptoma del ganado vacuno, mostrando una inhibición consistente de la adhesión focal, la señalización ECM y las vías de señalización PI3K-Akt (Roberts et al., 2021a).
Las herramientas de análisis DIA y DAVID revelaron los efectos de los tratamientos dietéticos con micotoxinas en el transcriptoma del ganado vacuno, mostrando una inhibición consistente de la adhesión focal, la señalización ECM y las vías de señalización PI3K-Akt (Roberts et al., 2021a).![]() Los estudios in vitro han demostrado un efecto supresor de las aflatoxinas (AF) sobre los niveles de citoquinas inflamatorias en el ganado (Kurtz y Czuprynski, 1992).
Los estudios in vitro han demostrado un efecto supresor de las aflatoxinas (AF) sobre los niveles de citoquinas inflamatorias en el ganado (Kurtz y Czuprynski, 1992).![]() En los cerdos, la exposición a las micotoxinas inhibe la proliferación de linfocitos y altera la producción de citoquinas.
En los cerdos, la exposición a las micotoxinas inhibe la proliferación de linfocitos y altera la producción de citoquinas.
Se ha demostrado que DON, nivalenol (NIV), zearalenona (ZEN) y FB1 modulan las mucinas secretoras MUC5AC y MUC5B, así como la secreción total de glicoproteínas similares a las mucinas, todas las cuales son componentes esenciales de la inmunidad de las mucosas del huésped (Wan et al., 2014).![]() Cambios significativos en algunos factores de coagulación de la vía extrínseca en los corderos intoxicados y la determinación del tiempo de protrombina podrían utilizarse como indicadores de aflatoxicosis en corderos (Fernández et al., 1995).
Cambios significativos en algunos factores de coagulación de la vía extrínseca en los corderos intoxicados y la determinación del tiempo de protrombina podrían utilizarse como indicadores de aflatoxicosis en corderos (Fernández et al., 1995).
Susceptibilidad a la infección y fracaso de la vacunación La exposición a micotoxinas puede afectar a la gravedad de la infección de algunos agentes patógenos, como bacterias, virus y parásitos. Sus mecanismos de acción específicos incluyen tres aspectos: Se ha documentado una mayor susceptibilidad a la infección asociada a las micotoxinas en condiciones experimentales y naturales.
⇰ La presencia de micotoxinas en los piensos puede provocar una disminución de la inmunidad vacunal y la aparición de enfermedades incluso en manadas vacunadas correctamente (Pierron et al., 2016). En otros estudios, el ganado expuesto a mezclas de micotoxinas fue colonizado por dos o más STEC, lo que sugiere que las micotoxinas facilitan la coinfección (Baines et al., 2011a; Baines et al., 2011b). En los corderos, la aflatoxicosis experimental reveló que los niveles de albúmina y alfa-globulina eran más bajos en los corderos intoxicados que en el grupo de control. Aunque las concentraciones de beta-globulina no variaron, a lo largo del experimento se observaron aumentos de los niveles de gamma-globulinas en los corderos intoxicados. ⇰ Estos resultados sugieren que la AF provoca un fallo en la inmunidad adquirida de los corderos al disminuir la producción de anticuerpos y alterar las proteínas séricas (Fernández et al., 1997). Sin embargo, en otro experimento, los resultados indican que la disminución de la ganancia media diaria fue el indicador más sensible de aflatoxicosis en corderos, lo que demuestra que la alteración de la respuesta inmunitaria podría hacer a los animales más susceptibles a las enfermedades infecciosas (Fernández et al., 2000).![]() En terneros, se ha demostrado que la exposición a las AF aumenta la susceptibilidad a Escherichia coli productora de toxina Shiga (STEC) (Baines et al., 2013a).
En terneros, se ha demostrado que la exposición a las AF aumenta la susceptibilidad a Escherichia coli productora de toxina Shiga (STEC) (Baines et al., 2013a).![]() La alteración de la proliferación de linfocitos y de la producción de citoquinas puede explicar los fallos vacunales que se han observado in vivo.
La alteración de la proliferación de linfocitos y de la producción de citoquinas puede explicar los fallos vacunales que se han observado in vivo.![]() Los efectos sinérgicos entre los virus y las micotoxinas se han estudiado ampliamente en el ganado porcino (Gan et al., 2022; Gan et al., 2018) y las consecuencias de la ingestión de piensos contaminados con micotoxinas son una mayor susceptibilidad a las enfermedades infecciosas, la reactivación de infecciones crónicas y una menor eficacia de las vacunas (Pierron et al., 2016).
Los efectos sinérgicos entre los virus y las micotoxinas se han estudiado ampliamente en el ganado porcino (Gan et al., 2022; Gan et al., 2018) y las consecuencias de la ingestión de piensos contaminados con micotoxinas son una mayor susceptibilidad a las enfermedades infecciosas, la reactivación de infecciones crónicas y una menor eficacia de las vacunas (Pierron et al., 2016).![]() La exposición de terneros a 1-3 ppb de AF y 50-350 ppb de FUM facilitó la aparición de brotes asociados a STEC. Además, la inclusión in vitro de 0,02 ppb de AF en los medios de crecimiento de las STEC dio lugar a una mayor producción de citotoxinas y citotoxicidad, lo que pone de relieve el papel de las micotoxinas en la patogénesis de las STEC (Baines et al., 2013b).
La exposición de terneros a 1-3 ppb de AF y 50-350 ppb de FUM facilitó la aparición de brotes asociados a STEC. Además, la inclusión in vitro de 0,02 ppb de AF en los medios de crecimiento de las STEC dio lugar a una mayor producción de citotoxinas y citotoxicidad, lo que pone de relieve el papel de las micotoxinas en la patogénesis de las STEC (Baines et al., 2013b).
![]() Un experimento realizado por Dzidic et al. (2010) indicó que las ovejas alimentadas con 300 mg de ácido micofenólico/oveja/ día de ensilado contaminado no mostraron efectos de inmunodepresión.
Un experimento realizado por Dzidic et al. (2010) indicó que las ovejas alimentadas con 300 mg de ácido micofenólico/oveja/ día de ensilado contaminado no mostraron efectos de inmunodepresión.
Aunque se ha confirmado que las micotoxinas modulan los efectos de las bacterias en los animales y aumentan su virulencia, también se ha sugerido que las cepas de L. acidophilus CIP 76.13T y L. delbrueckii subsp. bulgaricus CIP 101027T pueden incluirse en los piensos para reducir la contaminación por micotoxinas (Ragoubi et al., 2021).![]() Dado que la exposición a micotoxinas puede ser perjudicial para determinadas poblaciones microbianas intestinales, el uso de bacterias beneficiosas puede paliar estos efectos. Por ejemplo, Lactobacillus es un género crítico para desintoxicar la OTA in vivo (Guerre, 2020; Jin et al., 2021; Sun et al., 2023b).
Dado que la exposición a micotoxinas puede ser perjudicial para determinadas poblaciones microbianas intestinales, el uso de bacterias beneficiosas puede paliar estos efectos. Por ejemplo, Lactobacillus es un género crítico para desintoxicar la OTA in vivo (Guerre, 2020; Jin et al., 2021; Sun et al., 2023b).
Antonissen, G., Martel, A., Pasmans, F., Ducatelle, R., Verbrugghe, E., Vandenbroucke, V., Li, S., Haesebrouck, F., Van Immerseel, F.,Croubels, S., 2014. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases. Toxins 6, 430-452.Baines, D., Erb, S., Lowe, R., Turkington, K., Sabau, E., Kuldau, G., Juba, J., Masson, L., Mazza, A., Roberts, R., 2011a. A prebiotic, Celmanax™, decreases Escherichia coli O157: H7 colonization of bovine cells and feed-associated cytotoxicity in vitro. BMC research notes 4, 1-13. Baines, D., Erb, S., Turkington, K., Kuldau, G., Juba, J., Masson, L., Mazza, A., Roberts, R., 2011b. Mouldy feed, mycotoxins and Shiga toxin-producing Escherichia colicolonization associated with Jejunal Hemorrhage Syndrome in beef cattle. BMC Veterinary Research 7, 1-8. Baines, D., Sumarah, M., Kuldau, G., Juba, J., Mazza, A., Masson, L., 2013a. Aflatoxin, fumonisin and Shiga toxin-producing Escherichia coli infections in calves and the effectiveness of Celmanax®/Dairyman’s Choice™ applications to eliminate morbidity and mortality losses.Toxins (Basel) 5, 1872-1895. Baines, D., Sumarah, M., Kuldau, G., Juba, J., Mazza, A., Masson, L., 2013b. Aflatoxin, fumonisin and shiga toxin-producing Escherichia coli infections in calves and the effectiveness of Celmanax®/Dairyman’s Choice™ applications to eliminate morbidity and mortality losses.Toxins 5, 1872-1895. Bauer, J., Gareis, M., Bott, A., Gedek, B., 1989. Isolation of a mycotoxin (gliotoxin) from a bovine udder infected with Aspergillusfumigatus. Journal of Medical and Veterinary Mycology 27, 45-50. Bondy, G.S., Pestka, J.J., 2000a. Immunomodulation by fungal toxins. Journal of Toxicology and Environmental Health Part B: CriticalReviews 3, 109-143. Bondy, G.S., Pestka, J.J., 2000b. Immunomodulation by fungal toxins. J Toxicol Environ Health B Crit Rev 3, 109-143. Dänicke, S., Winkler, J., Meyer, U., Kersten, S., Wernike, K., Beer, M., Frahm, J., 2018. Antibody response of growing German Holstein bulls to a vaccination against bovine viral diarrhea virus (BVDV) is influenced by Fusarium toxin exposure in a non-linear fashion. Mycotoxin research 34, 123-139. Dzidic, A., Meyer, H.H., Bauer, J., Pfaffl, M.W., 2010. Long-term effects of mycophenolic acid on the immunoglobulin and inflammatory marker-gene expression in sheep white blood cells. Mycotoxin research 26, 235-240.Fang, M., Hu, W., Liu, B., 2022. Protective and detoxifying effects conferred by selenium against mycotoxins and livestock viruses: A review. Front Vet Sci 9, 956814. Fernandez, A., Hernandez, M., Sanz, M.C., Verde, M.T., Ramos, J.J., 1997. Serological serum protein fraction and responses to Brucellamelitensis in lambs fed aflatoxins. Vet Hum Toxicol 39, 137-140. Fernández, A., Hernández, M., Verde, M.T., Sanz, M., 2000. Effect of aflatoxin on performance, hematology, and clinical immunology in lambs. Can J Vet Res 64, 53-58. Fernández, A., Ramos, J.J., Saez, T., Sanz, M.C., Verde, M.T., 1995. Changes in the coagulation profile of lambs intoxicated with aflatoxin in their feed. Vet Res 26, 180-184. Fink-Gremmels, J., 2008. The role of mycotoxins in the health and performance of dairy cows. Vet J 176, 84-92. Gan, F., Hou, L., Xu, H., Liu, Y., Chen, X., Huang, K., 2022. PCV2 infection aggravates OTA-induced immunotoxicity in vivo and in vitro. Ecotoxicology and Environmental Safety 235, 113447. Gan, F., Zhou, Y., Qian, G., Huang, D., Hou, L., Liu, D., Chen, X., Wang, T., Jiang, P., Lei, X., 2018. PCV2 infection aggravates ochratoxinA-induced nephrotoxicity via autophagy involving p38 signaling pathway in vivo and in vitro. Environmental Pollution 238, 656-662. Guerre, P., 2020. Mycotoxin and gut microbiota interactions. Toxins 12, 769.Jin, J., Beekmann, K., Ringø, E., Rietjens, I.M., Xing, F., 2021. Interaction between food-borne mycotoxins and gut microbiota: A review. Food Control 126, 107998. Kurtz, R.S., Czuprynski, C.J., 1992. Effect of aflatoxin B1 on in vitro production of interleukin-1 by bovine mononuclear phagocytes.Veterinary immunology and immunopathology 34, 149-158. Meissonnier, G.M., Pinton, P., Laffitte, J., Cossalter, A.-M., Gong, Y.Y., Wild, C.P., Bertin, G., Galtier, P., Oswald, I.P., 2008. Immunotoxicity of aflatoxin B1: impairment of the cell-mediated response to vaccine antigen and modulation of cytokine expression. Toxicology and applied pharmacology 231, 142-149. Mohsenzadeh, M.S., Hedayati, N., Riahi-Zanjani, B., Karimi, G., 2016. Immunosuppression following dietary aflatoxin B1 exposure: a review of the existing evidence. Toxin Reviews 35, 121-127. Novak, B., Vatzia, E., Springler, A., Pierron, A., Gerner, W., Reisinger, N., Hessenberger, S., Schatzmayr, G., Mayer, E., 2018. Bovine peripheral blood mononuclear cells are more sensitive to deoxynivalenol than those derived from poultry and swine. Toxins 10, 152. Oh, S.-Y., Balch, C.G., Cliff, R.L., Sharma, B.S., Boermans, H.J., Swamy, H., Quinton, V.M., Karrow, N.A., 2013. Exposure to Penicillium mycotoxins alters gene expression of enzymes involved in the epigenetic regulation of bovine macrophages (BoMacs). Mycotoxin research29, 235-243. Oswald, I.P., Marin, D.E., Bouhet, S., Pinton, P., Taranu, I., Accensi, F., 2005. Immunotoxicological risk of mycotoxins for domestic animals. Food Addit Contam 22, 354-360. Osweiler, G., Kehrli, M., Stabel, J., Thurston, J., Ross, P., Wilson, T., 1993. Effects of fumonisin-contaminated corn screenings on growth and health of feeder calves. Journal of animal science 71, 459-466. Pestka, J.J., 2008. Mechanisms of deoxynivalenol-induced gene expression and apoptosis. Food additives and contaminants 25,1128-1140. Pierron, A., Alassane-Kpembi, I., Oswald, I.P., 2016. Impact of mycotoxin on immune response and consequences for pig health. AnimNutr 2, 63-68. Ragoubi, C., Quintieri, L., Greco, D., Mehrez, A., Maatouk, I., D’Ascanio, V., Landoulsi, A., Avantaggiato, G., 2021. Mycotoxin Removal by Lactobacillus spp. and Their Application in Animal Liquid Feed. Toxins (Basel) 13. Reeves, E.P., Messina, C., Doyle, S., Kavanagh, K., 2004. Correlation between gliotoxin production and virulence of Aspergillus fumigatusin Galleria mellonella. Mycopathologia 158, 73-79. Roberts, H.L., Bionaz, M., Jiang, D., Doupovec, B., Faas, J., Estill, C.T., Schatzmayr, D., Duringer, J.M., 2021a. Effects of deoxynivalenol and fumonisins fed in combination to beef cattle: Immunotoxicity and gene expression. Toxins 13, 714. Roberts, H.L., Bionaz, M., Jiang, D., Doupovec, B., Faas, J., Estill, C.T., Schatzmayr, D., Duringer, J.M., 2021b. Effects of Deoxynivalenol and Fumonisins Fed in Combination to Beef Cattle: Immunotoxicity and Gene Expression. Toxins (Basel) 13. Stec, J., Rachubik, J., Szczotka, M., Kuźmak, J., 2008. Effects of penicillium mycotoxins: citrinin, ochratoxin A, and patulin on in vitro proliferation of bovine lymphocytes. Bull. Vet. Inst. Pulawy 52, 163-167.Storm, I., Sørensen, J.L., Rasmussen, R.R., Nielsen, K.F., Thrane, U., 2008. Mycotoxins in silage. Stewart Postharvest Rev 4, 1-12. Storm, I.M., Rasmussen, R.R., Rasmussen, P.H., 2014a. Occurrence of pre- and post-harvest mycotoxins and other secondary metabolites in Danish maize silage. Toxins (Basel) 6, 2256-2269.Storm, I.M.D., Rasmussen, R.R., Rasmussen, P.H., 2014b. Occurrence of pre-and post-harvest mycotoxins and other secondary metabolites in Danish maize silage. Toxins 6, 2256-2269. Sun, Y., Song, Y., Long, M., Yang, S., 2023a. Immunotoxicity of Three Environmental Mycotoxins and Their Risks of Increasing Pathogen Infections. Toxins (Basel) 15.Sun, Y., Song, Y., Long, M., Yang, S., 2023b. Immunotoxicity of Three Environmental Mycotoxins and Their Risks of Increasing Pathogen Infections. Toxins 15, 187. Taranu, I., Marin, D.E., Burlacu, R., Pinton, P., Damian, V., Oswald, I.P., 2010. Comparative aspects of in vitro proliferation of human and porcine lymphocytes exposed to mycotoxins. Archives of Animal Nutrition 64, 383-393. Trenholm, H.L., Hamilton, R.M., Friend, D.W., Thompson, B.K., Hartin, K.E., 1984. Feeding trials with vomitoxin (deoxynivalenol)-contaminated wheat: effects on swine, poultry, and dairy cattle. J Am Vet Med Assoc 185, 527-531. Vieira, M.L., Johann, S., Hughes, F.M., Rosa, C.A., Rosa, L.H., 2014. The diversity and antimicrobial activity of endophytic fungi associated with medicinal plant Baccharis trimera (Asteraceae) from the Brazilian savannah. Can J Microbiol 60, 847-856. Wan, L.Y., Allen, K.J., Turner, P.C., El-Nezami, H., 2014. Modulation of mucin mRNA (MUC5AC and MUC5B) expression and protein production and secretion in Caco-2/HT29-MTX co-cultures following exposure to individual and combined Fusarium mycotoxins. ToxicolSci 139, 83-98. Whitlow, L., Hagler Jr, W., 2010. Mycotoxin effects in dairy cattle. Mid-South Ruminant.Yin, J.-J., Smith, M.J., Eppley, R.M., Page, S.W., Sphon, J.A., 1996. Effects of Fumonisin B1on Oxygen Transport in Membranes. Biochemical and biophysical research communications 225, 250-255. You, L., Nepovimova, E., Valko, M., Wu, Q., Kuca, K., 2023. Mycotoxins and cellular senescence: the impact of oxidative stress, hypoxia, and immunosuppression. Arch Toxicol 97, 393-404.
![]() BIBLIOGRAFÍA
BIBLIOGRAFÍA




 Prevención de micotoxicosis
Prevención de micotoxicosis