Mursal Abdulkadir Hersi1, Dogukan Kaya2 y Ercument Genc1*
1Departamento de Ingeniería Pesquera y Acuícola, Facultad de Agricultura, Universidad de Ankara, Ankara, Turquía
2Centro de Investigación y Aplicaciones Agrícolas, Universidad Tokat Gaziosmanpasa, Tokat, Turquía
Autor correspondiente: [email protected]
Las micotoxinas son sustancias tóxicas y potencialmente cancerígenas producidas por diferentes tipos de hongos, teniendo las enfermedades inducidas por estas toxinas graves consecuencias económicas para la industria acuícola.
Actualmente, se dispone de diferentes métodos de mecanismos químicos, microbiológicos y físicos que pueden eliminar o reducir el efecto de las micotoxinas.
 En la primera parte de esta revisión, repasamos las principales micotoxinas que suponen una amenaza para la industria acuícola y sus efectos sobre las especies acuáticas.
En la primera parte de esta revisión, repasamos las principales micotoxinas que suponen una amenaza para la industria acuícola y sus efectos sobre las especies acuáticas.
El riesgo de las micotoxinas en los piensos acuícolas
Se espera que el sistema mundial de suministro de alimentos esté sometido a una enorme presión hacia finales del 2050, cuando se prevé que la población humana alcance los 10.000 millones (Millington y Cleland 2017). Este aumento de la población humana supondrá una enorme demanda de proteínas animales y productos pesqueros (Tilman y Clark, 2014).
La industria pesquera también ha provocado el agotamiento de las especies acuáticas salvajes.
La pesca de captura ya no se considera una fuente sostenible para abastecer nuestra creciente demanda de proteínas. Por ello, la acuicultura se considera el mejor candidato para satisfacer nuestras necesidades de proteína animal (Subasinghe et al., 2009).
![]() Con la expansión del sector acuícola, aumenta la demanda de piensos acuícolas, que son parte integrante del coste de producción y representan aproximadamente el 60% del coste total de producción de los peces en los sistemas de cría intensivos y superintensivos (Alceste y Jory, 2000).
Con la expansión del sector acuícola, aumenta la demanda de piensos acuícolas, que son parte integrante del coste de producción y representan aproximadamente el 60% del coste total de producción de los peces en los sistemas de cría intensivos y superintensivos (Alceste y Jory, 2000).
Los piscicultores de las regiones tropicales y en vías de desarrollo, utilizan piensos producidos localmente en vez de importados porque éstos suelen ser caros.
 Para fabricar pellets de pienso locales, los productores utilizan residuos animales y plantas locales como la soja, el maíz, el arroz y muchos otros granos (Liti et al. 2005). Dado que no se toman medidas de bioseguridad vitales durante el proceso de formulación de los piensos, éstos suelen ser susceptibles de contaminarse con mohos antes y después del almacenamiento (Almeida et al., 2012) y algunos de ellos pueden producir micotoxinas.
Para fabricar pellets de pienso locales, los productores utilizan residuos animales y plantas locales como la soja, el maíz, el arroz y muchos otros granos (Liti et al. 2005). Dado que no se toman medidas de bioseguridad vitales durante el proceso de formulación de los piensos, éstos suelen ser susceptibles de contaminarse con mohos antes y después del almacenamiento (Almeida et al., 2012) y algunos de ellos pueden producir micotoxinas.
Las micotoxinas son sustancias tóxicas y potencialmente cancerígenas producidas por diferentes tipos de hongos (Zain et al., 2012).
La formación y la concentración de micotoxinas en la acuicultura se ven afectadas principalmente por la temperatura y la humedad. Sin embargo, hay muchos otros elementos que también afectan al crecimiento de los mohos, por ejemplo:
 El movimiento del agua
El movimiento del agua Sustratos
Sustratos Los niveles de pH
Los niveles de pH Las condiciones de almacenamiento de los piensos
Las condiciones de almacenamiento de los piensos Abundancia e interacciones microbianas
Abundancia e interacciones microbianas
(Di Gregorio et al., 2014)
Las infecciones provocadas por las micotoxinas se conocen como micotoxicosis y dependen de la dosis, la especie, la edad y la duración de la intoxicación.
Dependiendo del tipo de micotoxina, pueden observarse diferentes síntomas patológicos en las especies afectadas, como anemia, lesiones hepáticas y renales, hemorragias, mayor susceptibilidad a otras enfermedades e incluso la muerte (Jaynes et al., 2007).
![]() Las enfermedades inducidas por micotoxinas causan graves pérdidas económicas en la industria acuícola (Di Gregorio et al. 2014).
Las enfermedades inducidas por micotoxinas causan graves pérdidas económicas en la industria acuícola (Di Gregorio et al. 2014).
Por ello, en los últimos años, los investigadores se han esforzado por examinar posibles estrategias de descontaminación de micotoxinas en la acuicultura (Bovo et al., 2012). Para prevenir la aparición de micotoxinas, se recomiendan fuertes medidas de bioseguridad antes y después del almacenamiento de los alimentos acuícolas (Di Gregorio et al. 2014). Sin embargo, la aparición de micotoxinas es difícil de evitar (Kendra y Dyer, 2007).
Ocurrencia y toxicidad de las micotoxinas en la acuicultura
Los estudios sobre el impacto negativo de las micotoxinas en los animales se han centrado principalmente en el ganado terrestre y no en las especies de acuicultura (Pestka, 2007). No fue hasta el brote de aflatoxinas en la industria de la trucha arco iris en la década de 1960, cuando los investigadores comenzaron a hacer un esfuerzo para estudiar los efectos de las micotoxinas en la acuicultura (Gonçalves et al., 2018).
Debido al mayor coste de los ingredientes de los piensos acuícolas y del aceite de pescado en particular, los investigadores han tratado de identificar posibles fuentes de proteínas alternativas. Las proteínas vegetales pueden ser un excelente sustituto del aceite de pescado en los piensos acuícolas, ya que son rentables y están disponibles a gran escala (Anater et al. 2016).
Actualmente, las proteínas vegetales, como las semillas oleaginosas y los granos, se incluyen en la mayoría de los piensos acuícolas formulados para peces de aguas cálidas, como la tilapia, la carpa y el siluro (Marijani et al., 2019).
![]() Este tipo de pienso es muy vulnerable a la contaminación fúngica, por lo que la aparición de micotoxinas es inevitable (Marijani et al., 2017).
Este tipo de pienso es muy vulnerable a la contaminación fúngica, por lo que la aparición de micotoxinas es inevitable (Marijani et al., 2017).
Según Berthiller et al. (2007), se conocen más de 400 tipos de micotoxinas en todo el mundo y, entre ellas, las aflatoxinas son las más conocidas por su frecuencia de incidencia, seguidas de las ocratoxinas y las micotoxinas de Fusarium. Además de estas micotoxinas principales, se detectan en los piensos para peces otras con baja frecuencia de aparición, como el nivalenol, el alternariol y la roquefortina C (Marijani et al., 2017).
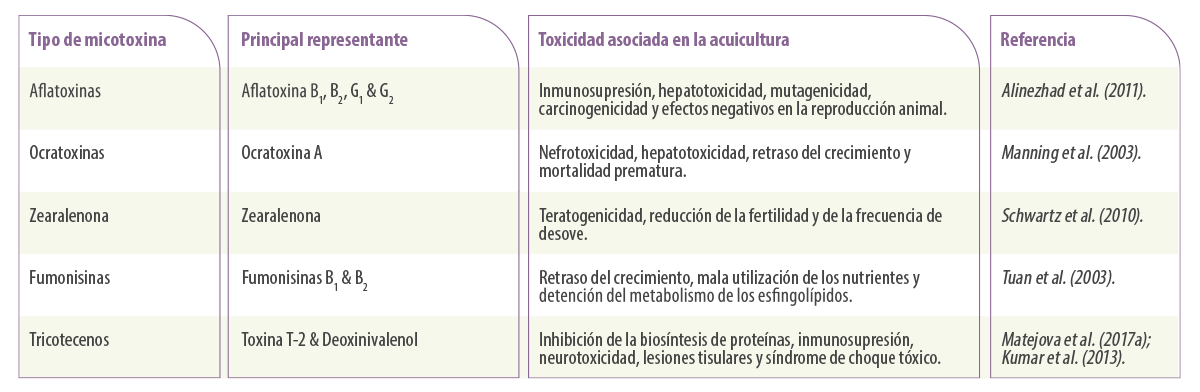
Tabla 1. Principales micotoxinas y su toxicidad asociada en la acuicultura.
Aflatoxinas
Las aflatoxinas son sustancias hidrosolubles producidas por mohos del género Aspergillus, especialmente Aspergillus parasiticus y Aspergillus flavus (Varga et al., 2009).
Hay aproximadamente 20 aflatoxinas detectadas en todo el mundo, pero solo cuatro de ellas (AFB1, AFB2, AFG1 y AFG2) se han estudiado a fondo, simplemente porque son las más tóxicas (Santacroce et al., 2008).
A. parasiticus puede producir todos los compuestos mencionados anteriormente, mientras que A. flavus solo puede producir aflatoxinas B1 y B2. No obstante, ambas especies pueden contaminar las condiciones previas y posteriores al almacenamiento de los alimentos acuícolas (Bryden, 2012).
![]() Las aflatoxinas aparecen principalmente en climas húmedos, pero también se han registrado en regiones tropicales y subtropicales (Ostrowski-Meissner et al. 1995; Marin et al. 2013).
Las aflatoxinas aparecen principalmente en climas húmedos, pero también se han registrado en regiones tropicales y subtropicales (Ostrowski-Meissner et al. 1995; Marin et al. 2013).


Un estudio realizado por Alinezhad et al. (2011), investigó la presencia de aflatoxinas en los ingredientes y piensos formulados para la trucha arco iris.
 Al final del experimento, se detectaron mayores índices de contaminación por AFB1 (presencia tóxica media de 0,067, 0,031, 0,012 y 0,009 mg/kg en la harina de pescado, la soja, el trigo y el pienso para paletas, respectivamente).
Al final del experimento, se detectaron mayores índices de contaminación por AFB1 (presencia tóxica media de 0,067, 0,031, 0,012 y 0,009 mg/kg en la harina de pescado, la soja, el trigo y el pienso para paletas, respectivamente).Los efectos biológicos de las aflatoxinas son peligrosos. El tipo de aflatoxina más potente es la AFB1, que puede:
 Causar graves daños en el hígado
Causar graves daños en el hígado Promover el desarrollo de cáncer
Promover el desarrollo de cáncer Inducir mutaciones genéticas
Inducir mutaciones genéticas Detener el proceso reproductivo
Detener el proceso reproductivo Debilitar sustancialmente el sistema inmunitario
Debilitar sustancialmente el sistema inmunitario
La toxicidad relacionada con las aflatoxinas depende de la concentración, la etapa de la vida y la especie del animal de granja (Hendricks, 1993).
![]() En la acuicultura, las aflatoxinas se identificaron por primera vez en 1963 durante una epizootía de hepatoma en la industria de la trucha cuando los peces fueron alimentados con piensos contaminados con aflatoxinas (Ashley y Halver, 1963). Desde entonces se han notificado casos similares de intoxicación por aflatoxinas en diferentes especies de peces (Ashley et al., 1965; Cagauan et al., 2004; Zhang et al., 2022).
En la acuicultura, las aflatoxinas se identificaron por primera vez en 1963 durante una epizootía de hepatoma en la industria de la trucha cuando los peces fueron alimentados con piensos contaminados con aflatoxinas (Ashley y Halver, 1963). Desde entonces se han notificado casos similares de intoxicación por aflatoxinas en diferentes especies de peces (Ashley et al., 1965; Cagauan et al., 2004; Zhang et al., 2022).
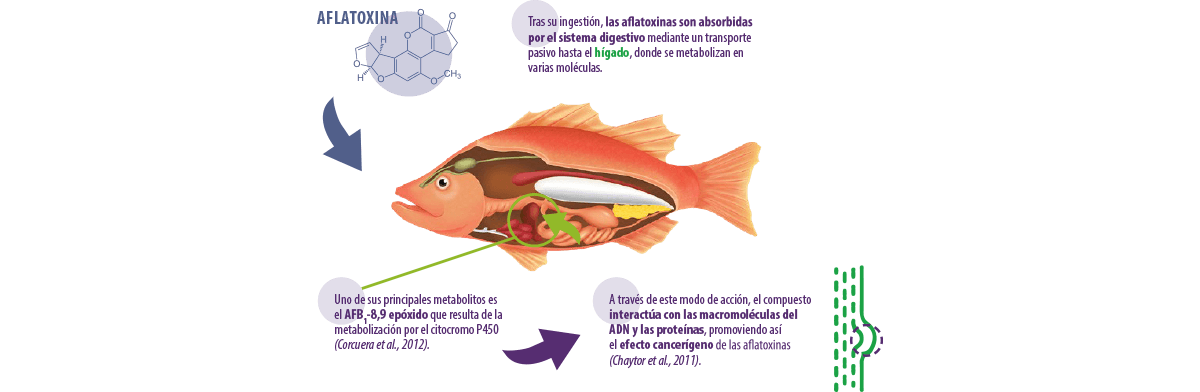
Existen tres fases de la aflatoxicosis: aguda, subaguda y crónica.
AFLATOXICOSIS AGUDA
La fase aguda se produce cuando un animal acuático consume una dosis moderada o elevada de aflatoxinas en poco tiempo, lo que provoca consecuencias para la salud como:
 Anemia
Anemia Branquias blanquecinas o pálidas
Branquias blanquecinas o pálidas Hemorragia
Hemorragia Mala utilización de los nutrientes
Mala utilización de los nutrientes Hepatotoxicidad
Hepatotoxicidad
(Matejova et al., 2017a)
Un experimento de 10 días realizado por Sahoo et al. (2001) con carpas reveló que la ingestión de aflatoxina B1 por parte de Labeo rohita a una dosis de 11,25 mg/kg causó una reducción significativa del apetito, letargo y pérdida de equilibrio.
![]() Cuando se analizó la histomorfología de los tejidos, también encontraron riñones y branquias gravemente dañados, hígado necrótico con dilatación y congestión vascular, así como intestinos desprendidos.
Cuando se analizó la histomorfología de los tejidos, también encontraron riñones y branquias gravemente dañados, hígado necrótico con dilatación y congestión vascular, así como intestinos desprendidos.
Las formas subaguda y crónica se producen cuando los animales están expuestos a dosis bajas de aflatoxina durante un periodo relativamente largo, normalmente unos tres y seis meses, respectivamente.
AFLATOXICOSIS SUBAGUDA
Los síntomas patológicos de la aflatoxicosis subaguda incluyen:
 Inmunosupresión
Inmunosupresión Hepatotoxicidad
Hepatotoxicidad Piel amarillenta
Piel amarillenta Fallo en la adsorción de nutrientes
Fallo en la adsorción de nutrientes
(Santacroce et al., 2008)
En el estudio de Sahoo et al. (2001) se notificaron síntomas como necrosis hepática, dilatación vascular, oclusión y reducción significativa de la respuesta inmunitaria y de las enzimas antioxidantes cuando se administró una dosis de 2,5 mg/kg de aflatoxina B1 a Labeo rohita durante 90 días.
AFLATOXICOSIS CRÓNICA
La fase crónica de la exposición a aflatoxinas se asocia con:
 Carcinogenicidad
Carcinogenicidad Inmunosupresión
Inmunosupresión Hepatotoxicidad
Hepatotoxicidad Mutagenicidad
Mutagenicidad Alteraciones hematológicas
Alteraciones hematológicas

Los principales síntomas histopatológicos crónicos observados en diferentes especies de peces incluyen la insuficiencia hepática, el cese de la ingesta de alimentos, el debilitamiento del sistema inmunitario y la muerte (Santacroce et al., 2008).
Además, un estudio realizado por Shahafve et al. (2017) evaluó los efectos de las dietas que contenían diferentes dosis de aflatoxinas (0,5, 0,7 y 1,4 mg/kg) en la histomorfología de los tejidos de la carpa común (Cyprinus carpio) durante 3 semanas.
![]() Los exámenes patológicos revelaron la existencia de láminas branquiales irregulares y encogidas, hepatocitos hepáticos necróticos e hinchados, congestión vascular, parénquima hepático dañado, dilatación del espacio urinario renal, aumento anormal de las células caliciformes, intestinos desprendidos e inflamación.
Los exámenes patológicos revelaron la existencia de láminas branquiales irregulares y encogidas, hepatocitos hepáticos necróticos e hinchados, congestión vascular, parénquima hepático dañado, dilatación del espacio urinario renal, aumento anormal de las células caliciformes, intestinos desprendidos e inflamación.
Micotoxinas de Fusarium
Los mohos Fusarium producen una variedad de potentes micotoxinas, pero tres de ellas han sido hasta ahora objeto de importantes estudios de investigación (Placinta et al., 2016):
- ⇰ Tricotecenos
- ⇰ Fumonisinas
- ⇰ Zearalenona
A nivel mundial, muchos informes muestran la incidencia de la micotoxina Fusarium en los granos y en los piensos acuícolas, especialmente cuando se encuentran en condiciones de humedad (Pinotti et al., 2016; Bryden, 2012).

TRICOTECENOS
Los tricotecenos son micotoxinas producidas por especies de hongos pertenecientes a distintos géneros como Fusarium, Myrothecium y Trichothecium (Tamm y Breitenstein, 1984). Hay cuatro tricotecenos bien conocidos:
- ⇰ Deoxinivalenol (DON)
- ⇰ Toxina T-2
- ⇰ Diacetoxiscirpenol (DAS)
- ⇰ Nivalenol (NIV)
(Escrivá et al., 2015)
Estos compuestos contaminan los cereales, por ejemplo, el maíz, la soja, el trigo y otros granos similares, todos los cuales son componentes importantes de los piensos acuícolas (Meronuck y Xie, 1999).
Los animales expuestos a los tricotecenos durante mucho tiempo muestran diversos signos clínicos, como:
 Cese de la alimentación
Cese de la alimentación Movimiento lento
Movimiento lento Restricción del crecimiento
Restricción del crecimiento Lesiones tisulares
Lesiones tisulares
Las dosis más altas de esta micotoxina también desencadenan un síndrome de choque tóxico, lo que finalmente resulta en la mortalidad (Matejova et al., 2017a).
TOXINA T-2
Un experimento realizado por Poston et al. (1982) evaluó los efectos adversos de dosis mayores y menores (2,5 y 15 mg/kg) de toxina T-2 en truchas (Oncorhynchus mykiss).
![]() Los resultados indicaron una reducción de la tasa de crecimiento y de los parámetros de utilización del pienso en los grupos que ingirieron niveles tóxicos más bajos, mientras que los expuestos a dosis más altas mostraron intestinos desprendidos, hemorragias y bazos significativamente dañados.
Los resultados indicaron una reducción de la tasa de crecimiento y de los parámetros de utilización del pienso en los grupos que ingirieron niveles tóxicos más bajos, mientras que los expuestos a dosis más altas mostraron intestinos desprendidos, hemorragias y bazos significativamente dañados.
Otro estudio realizado por Manning et al. (2003) examinó el efecto biológico de cuatro dosis diferentes de toxina T-2 (0,63, 1,3, 2,5 y 5 mg/kg) sobre el crecimiento y la histomorfología de los tejidos del bagre de canal (Ictalurus punctatus).
![]() En este estudio se observó una reducción significativa de la tasa de crecimiento y de los índices de utilización del pienso, así como de lesiones en el intestino y el hígado.
En este estudio se observó una reducción significativa de la tasa de crecimiento y de los índices de utilización del pienso, así como de lesiones en el intestino y el hígado.
Un estudio más reciente de Matejova et al. (2017) evaluó el efecto de 5,3 mg/kg de toxina T-2 en la dieta sobre los índices de crecimiento, inmunológicos y hematológicos de la carpa común (Cyprinus carpio) durante 30 días.
![]() En este estudio se observaron parámetros hematológicos afectados negativamente, como la hemoglobina, los glóbulos rojos y blancos, y la reducción de las enzimas antioxidantes, así como lesiones en los tejidos.
En este estudio se observaron parámetros hematológicos afectados negativamente, como la hemoglobina, los glóbulos rojos y blancos, y la reducción de las enzimas antioxidantes, así como lesiones en los tejidos.

DON
El deoxinivalenol, también llamado vomitoxina, es generalmente menos tóxico pero más común que la toxina T-2. Al igual que otros tricotecenos, se encuentra en los cereales, especialmente en el trigo y el maíz, contaminando los piensos acuícolas que contienen cualquiera de estos granos (Marin et al., 2013).
Los signos patológicos de la ingestión de vomitoxina en las especies acuícolas incluyen:
 Retraso del crecimiento
Retraso del crecimiento Degeneración y desprendimiento del intestino
Degeneración y desprendimiento del intestino Inflamación
Inflamación Mala utilización de los nutrientes
Mala utilización de los nutrientes Inmunosupresión
Inmunosupresión
(Hooft et al., 2011)
Huang et al. (2020) evaluaron cómo el deoxinivalenol en cinco dosis diferentes (0,03, 0,32, 0,63, 0,92 y 1,24 mg/kg) afectó a la histomorfología de las branquias de la carpa herbívora (Ctenopharyngodan idella) durante 2 meses.
![]() Los resultados de este estudio mostraron una considerable reducción de la capacidad antioxidante de los peces, así como lesiones y heridas tanto en las branquias como en sus uniones estrechas.
Los resultados de este estudio mostraron una considerable reducción de la capacidad antioxidante de los peces, así como lesiones y heridas tanto en las branquias como en sus uniones estrechas.
FUMONISINAS
Las fumonisinas son producidas principalmente por Fusarium verticillioides y F. proliferatum, que son especies que se encuentran frecuentemente contaminando el maíz. Entre los diferentes tipos de esta micotoxina, la más conocida es la Fumonisina B1 (Scott, 2012).
En la acuicultura, las fumonisinas están relacionadas con:
 Retraso del crecimiento
Retraso del crecimiento Mala utilización de los nutrientes
Mala utilización de los nutrientes Detención del metabolismo de los esfingolípidos
Detención del metabolismo de los esfingolípidos
(Tuan et al., 2003)
Las fumonisinas tienen una larga cadena de hidrocarburos que se asemeja a la esfingosina, una enzima que ayuda a catalizar la alquilación y diacilación de los esfingolípidos durante el metabolismo de los lípidos.
⇰ La fumonisina B1, por lo tanto, actúa como un inhibidor de la síntesis de esfingolípidos que es crucial para las estructuras de las membranas y las lipoproteínas (Wang et al., 1992).

Claudino-Silva et al. (2018) examinaron la toxicidad de las dietas que contenían Fumonisina B1 y B2 en varias dosis (20, 40 y 60 mg/ kg) sobre el crecimiento y la utilización del alimento de la tilapia (Oreochromis niloticus).
![]() Al final de este ensayo, se detectó una reducción significativa del crecimiento, en la producción de la hormona del crecimiento y una mala utilización de los nutrientes.
Al final de este ensayo, se detectó una reducción significativa del crecimiento, en la producción de la hormona del crecimiento y una mala utilización de los nutrientes.
ZEARALENONA
La zearalenona es otra micotoxina de Fusarium producida principalmente por Fusarium culmorum y Fusarium graminearum, que aparece en diferentes granos como el maíz y el trigo (Henderson y Smith, 1991).
La producción de ZEN está asociada a condiciones de alta humedad y baja temperatura, y se relaciona con alteraciones reproductivas en los animales expuestos (Placinta et al., 1999).
⇰ Los metabolitos producidos por la zearalenona son estructuralmente similares a los estrógenos naturales y, al imitar a estas hormonas, se unen a los receptores de estrógeno deteniendo la reproducción del animal (Kumar et al., 2013).
En un experimento de tres semanas realizado por Schwartz et al. (2010) en el que se investigaron los efectos de la zearalenona en la reproducción del pez cebra (Danio rerio), se descubrió que reducía tanto la fertilidad como la frecuencia de desove del pez. Resultados similares se reportaron en un estudio realizado por Woźny et al. (2015) con trucha arcoíris.
OCRATOXINAS
Las ocratoxinas son metabolitos secundarios tóxicos producidos por hongos pertenecientes a los géneros Aspergillus y Penicillium. Entre los grupos de ocratoxinas, la ocratoxina A (OTA) es la más frecuente y es conocida por su toxicidad para el riñón y el hígado en los animales domésticos (Manning y Wyatt, 1984) y los residuos en la carne del animal expuesto (Guillamont et al., 2005).
⇰ Una tasa de utilización del alimento significativamente menor, retraso del crecimiento, mortalidad prematura y riñón e hígado necróticos son algunos de los signos clínicos reportados en especies acuícolas expuestas a la OTA (Manning et al., 2003).
Un estudio realizado por Hagelberg et al. (1989) evaluó cómo tres dosis diferentes de OTA (4, 6 y 8 mg/kg) afectaban a la histomorfología del hígado y el riñón de la trucha arco iris.
![]() Los resultados mostraron que los grupos alimentados con dietas que contenían 4 mg/kg de OTA presentaban daños renales y hepáticos moderados, mientras que los que recibieron 8 mg/kg mostraron hepatotoxicidad y nefrotoxicidad graves.
Los resultados mostraron que los grupos alimentados con dietas que contenían 4 mg/kg de OTA presentaban daños renales y hepáticos moderados, mientras que los que recibieron 8 mg/kg mostraron hepatotoxicidad y nefrotoxicidad graves.
De forma similar, El-Sayed et al. (2009) examinaron la sensibilidad y los síntomas clínicos de la lubina (Dicentrarchus labrax) alimentada con dietas suplementadas con OTA a una dosis de 9,23 mg/kg.
![]() El letargo, la pérdida de equilibrio, y la hemorragia dorsal y la erosión de la superficie ventral, fueron algunos de los signos clínicos observados antes de la muerte. Al mismo tiempo, la necropsia reveló un hígado necrótico con grave dilatación y congestión vascular, así como riñones dañados.
El letargo, la pérdida de equilibrio, y la hemorragia dorsal y la erosión de la superficie ventral, fueron algunos de los signos clínicos observados antes de la muerte. Al mismo tiempo, la necropsia reveló un hígado necrótico con grave dilatación y congestión vascular, así como riñones dañados.
Un estudio más reciente realizado por Baldissera et al. (2020) investigó los efectos de la OTA (2,4 mg/kg en el alimento) sobre el crecimiento, la utilización del alimento y las enzimas antioxidantes del tambaqui (Colossoma macropomum).
![]() En este estudio se reportó una reducción significativa de los índices de crecimiento y utilización del alimento, así como mayores enzimas antioxidantes en los músculos de los peces.
En este estudio se reportó una reducción significativa de los índices de crecimiento y utilización del alimento, así como mayores enzimas antioxidantes en los músculos de los peces.

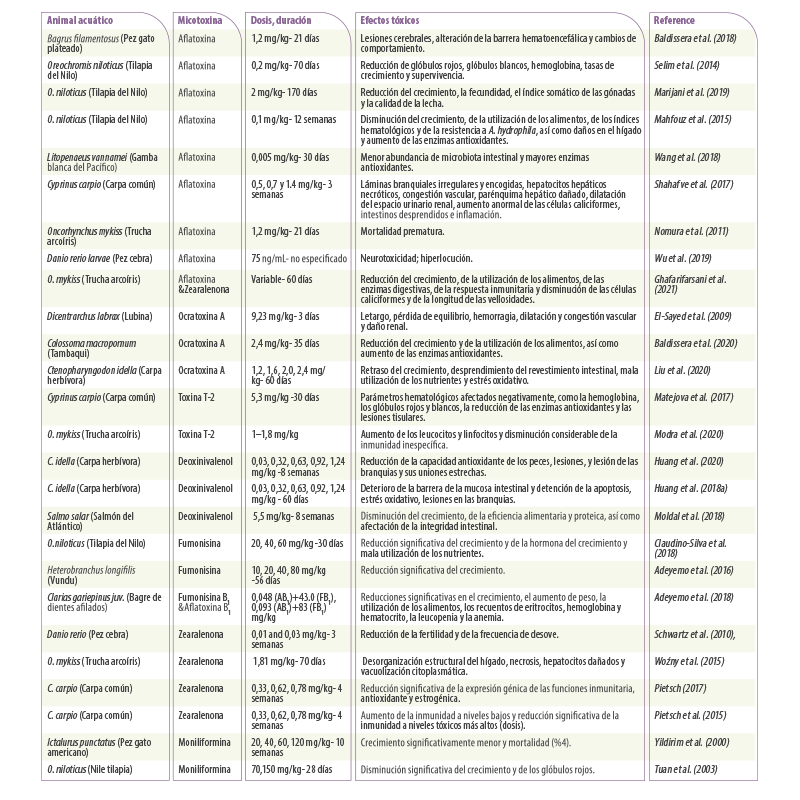
Tabla 2. Resumen de estudios recientes sobre el efecto de las micotoxinas en diferentes animales acuáticos. Se revisan la dosis, la duración y la toxicidad.
REFERENCIAS
Adeyemo, B.T., Tiamiyu, L.O., Ayuba, V.O. and Cheikyula, J.O., 2016. Effects of dietary fumonisin B1 on hematology and growth performance of the clariid fish Heterobranchus longifilis. J. Agric. Vet. Sci, 9, 26-33.
Adeyemo, B.T., Tiamiyu, L.O., Ayuba, V.O., Musa, S. and Odo, J., 2018. Effects of dietary mixed aflatoxin B1 and fumonisin B1 on growth performance and hematology of juvenile Clarias gariepinus catfish. Aquaculture, 491, 190-196.
Alceste, C. and Jory, D.E., 2000. Tilapia alternative protein sources in tilapia feed formulation. Aquaculture Magazine-Arkansas, 26(4), 70-75.
Alinezhad, S., Tolouee, M., Kamalzadeh, A., Motalebi, A.A., Nazeri, M., Yasemi, M., Shams, G.M., Tolouei, R. and Razzaghi, A.M., 2011. Mycobiota and aflatoxin B1 contamination of rainbow trout (Oncorhynchus mykiss) feed with emphasis to Aspergillus section Flavi. Iranian Journal of Fisheries, 10(3), 363-374.
Almeida, I.F.M., Martins, H.M.L., Santos, S.M.O., Freitas, M.S., da Costa, J.M.G.N. and d´ Almeida Bernardo, F.M., 2011. Mycobiota and aflatoxin B1 in feed for farmed sea bass (Dicentrarchus labrax). Toxins, 3(3), 163-171.
Anater, A., Manyes, L., Meca, G., Ferrer, E., Luciano, F.B., Pimpao, C.T. and Font, G., 2016. Mycotoxins and their consequences in aquaculture: A review. Aquaculture, 451, 1-10.
Ashley, L.M. and Halver, J.E., 1963. Multiple metastasis of rainbow trout hepatoma. Transactions of the American Fisheries Society, 92(4), 365-371.
Ashley, L.M., Halver, J.E., Gardner, W.K. and Wogan, G.N., 1965, January. Crystalline aflatoxins cause trout hepatoma. In Federation proceedings (9650 Rockville Pike, Bethesda, MD 20814-3998: Federation Amer. Soc. Exp. Biol. 24 (2),627
Baldissera, M.D., Souza, C.F., da Silva, J.A., Barroso, D.C., Glória, E.M., Mesadri, J., Wagner, R., Baldisserotto, B. and Val, A.L., 2020. Dietary ochratoxin A (OTA) decreases growth performance and impairs the muscle antioxidant system and meat fatty acid profiles in juvenile tambaqui (Colossoma macropomum). Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 236, 108803.
Baldissera, M.D., Souza, C.F., Zeppenfeld, C.C., Descovi, S.N., Moreira, K.L.S., da Rocha, M.I.U., da Veiga, M.L., da Silva, A.S. and Baldisserotto, B., 2018. Aflatoxin B1-contaminated diet disrupts the blood–brain barrier and affects fish behavior: involvement of neurotransmitters in brain synaptosomes. Environmental Toxicology and Pharmacology, 60, 45-51.
Bovo F, Corassin CH, Rosim RE, Oliveira CAF. (2012). Efficiency of actic acid bacteria strains for decontamination of aflatoxin M1 in phosphate buffer saline solution and in skimmed milk. Food Bioprocess Tech, 5:1-5
Bryden, W.L., 2012. Mycotoxin contamination of the feed supply chain: Implications for animal productivity and feed security. Animal Feed Science and Technology, 173(1-2), 134-158.
Cagauan, A.G., Tayaban, R.H., Somga, J.R. and Bartolome, R.M., 2004, September. Effect of aflatoxin contaminated feeds in Nile tilapia (Oreochromis niloticus L.). In: Abstract of the 6th International Symposium on Tilapia in Aquaculture (ISTA 6) Section: Health Management and Diseases, Manila, Philippines (Vol. 12, pp. 16).
Chaytor, A.C., Hansen, J.A., Van Heugten, E., See, M.T. and Kim, S.W., 2011. Occurrence and decontamination of mycotoxins in swine feed. Asian-Australasian Journal of Animal Sciences, 24(5), 723-738.
Claudino-Silva, S.C., Lala, B., Mora, N.H.A.P., Schamber, C.R., Nascimento, C.S., Pereira, V.V., Hedler, D.L. and Gasparino, E., 2018. Challenge with fumonisins B1 and B2 changes IGF-1 and GHR mRNA expression in liver of Nile tilapia fingerlings. World Mycotoxin Journal, 11(2), 237-245.
Corcuera, L.A., Vettorazzi, A., Arbillaga, L., Gonzalez-Peñas, E. and De Cerain, A.L., 2012. An approach to the toxicity and toxicokinetics of aflatoxin B1 and ochratoxin A after simultaneous oral administration to fasted F344 rats. Food and Chemical Toxicology, 50(10), 3440-3446.
Di Gregorio, M.C., Neeff, D.V.D., Jager, A.V., Corassin, C.H., Carão, Á.C.D.P., Albuquerque, R.D., Azevedo, A.C.D. and Oliveira, C.A.F., 2014. Mineral adsorbents for prevention of mycotoxins in animal feeds. Toxin Reviews, 33(3), 125-135.
El-Sayed, Y.S., Khalil, R.H. and Saad, T.T., 2009. Acute toxicity of ochratoxin-A in marine water-reared sea bass (Dicentrarchus labrax L.). Chemosphere, 75(7), 878-882.
Escrivá, L., Font, G. and Manyes, L., 2015. In vivo toxicity studies of fusarium mycotoxins in the last decade: A review. Food and Chemical Toxicology, 78, 185-206.
Berthiller, F. Sulyok, M.Krska, R. and Schuhmacher, R., 2007. Chromatographic methods for the simultaneous determination of mycotoxins and their conjugates in cereals, International Journal of Food Microbiology, 119(1-2), 33–37.
Ghafarifarsani, H., Imani, A., Niewold, T.A., Pietsch-Schmied, C. and Moghanlou, K.S., 2021. Synergistic toxicity of dietary aflatoxin B1 (AFB1) and zearalenone (ZEN) in rainbow trout (Oncorhynchus mykiss) is attenuated by anabolic effects. Aquaculture, 541, 736793.
Gonçalves, R.A., Naehrer, K. and Santos, G.A., 2018. Occurrence of mycotoxins in commercial aquafeeds in Asia and Europe: a real risk to aquaculture? Reviews in Aquaculture, 10(2), 263-280.
Guillamont, E.M., Lino, C.M., Baeta, M.L., Pena, A.S., Silveira, M.I.N. and Vinuesa, J.M., 2005. A comparative study of extraction apparatus in HPLC analysis of ochratoxin A in muscle. Analytical and Bioanalytical Chemistry, 383(4), 570-575.
Hagelberg, S., K. Hult, and R. Fuchs. 1989. Toxicokinetics of ochratoxin A in several species and its plasma binding properties. Journal of Applied Toxicology, 9:91–96.
Henderson, R.S. and Smith, J.E. eds., 1991. Mycotoxins and animal foods. CRC Press.
Hendricks, J.D., 1993. Carcinogenicity of aflatoxins in nonmammalian organisms. In: The toxicology of aflatoxins: human health, veterinary and agricultural significance. Eds: Eaton, D. L.; Groopman, J. D., 103 136. Academic Press, San Diego, USA.
Hooft, J.M., Encarnação, P. and Bureau, D.P., 2011. Rainbow trout (Oncorhynchus mykiss) is extremely sensitive to the feed-borne Fusarium mycotoxin deoxynivalenol (DON). Aquaculture, 311(1-4), 224-232.
Huang, C., Feng, L., Liu, X.A., Jiang, W.D., Wu, P., Liu, Y., Jiang, J., Kuang, S.Y., Tang, L. and Zhou, X.Q., 2020. The toxic effects and potential mechanisms of deoxynivalenol on the structural integrity of fish gill: Oxidative damage, apoptosis and tight junctions disruption. Toxicon, 174, 32-42.
Huang, C., Wu, P., Jiang, W.D., Liu, Y., Zeng, Y.Y., Jiang, J., Kuang, S.Y., Tang, L., Zhang, Y.A., Zhou, X.Q. and Feng, L., 2018a. Deoxynivalenol decreased the growth performance and impaired intestinal physical barrier in juvenile grass carp (Ctenopharyngodon idella). Fish & Shellfish Immunology, 80, 376-391.
Jaynes, W.F., Zartman, R.E. and Hudnall, W.H., 2007. Aflatoxin B1 adsorption by clays from water and corn meal. Applied Clay Science, 36(1-3), 197-205.
Kendra, D.F. and Dyer, R.B., 2007. Opportunities for biotechnology and policy regarding mycotoxin issues in international trade. International Journal of Food Microbiology, 119(1-2), 147-151.
Kumar, V., Roy, S., Barman, D., Kumar, A., Paul, L. and Meetei, W.A., 2013. Importance of mycotoxins in aquaculture feeds. Aquaculture Asia, 18(1), 25-29.
Liti, D., Cherop, L., Munguti, J. and Chhorn, L., 2005. Growth and economic performance of Nile tilapia (Oreochromis niloticus L.) fed on two formulated diets and two locally available feeds in fertilized ponds. Aquaculture Research, 36(8), 746-752.
Liu, X., Wu, P., Jiang, W.D., Liu, Y., Jiang, J., Kuang, S.Y., Tang, L., Zhou, X.Q. and Feng, L., 2020. Effects of dietary ochratoxin a on growth performance and intestinal apical junctional complex of juvenile grass carp (Ctenopharyngodon idella). Toxins, 13(1), 11.
Mahfouz, M.E. and Sherif, A.H., 2015. A multiparameter investigation into adverse effects of aflatoxin on Oreochromis niloticus health status. The Journal of Basic & Applied Zoology, 71, 48-59.
Manning, B. B., R. M. Ulloa, M. H. Li, E. H. Robinson, and G. E. Rottinghaus. 2003. Ochratoxin A fed to channel catfish (Ictalurus punctatus) causes reduced growth and lesions of hepatopancreatic tissue. Aquaculture, 219:739–750.
Manning, R.O. and Wyatt, R.D., 1984. Effect of cold acclimation of broiler chicks on susceptibility to acute aflatoxicosis. Poultry Science, 63, p.24S.
Marijani, E., Charo-Karisa, H., Gnonlonfin, G.J.B., Kigadye, E. and Okoth, S., 2019. Effects of aflatoxin B1 on reproductive performance of farmed Nile tilapia. International Journal of Veterinary Science and Medicine, 7(1), 35-42.
Marijani, E., Wainaina, J.M., Charo-Karisa, H., Nzayisenga, L., Munguti, J., Gnonlonfin, G.J.B., Kigadye, E. and Okoth, S., 2017. Mycoflora and mycotoxins in finished fish feed and feed ingredients from smallholder farms in East Africa. The Egyptian Journal of Aquatic Research, 43(2), 169-176.
Marin, S., A. J. Ramos, G. Cano-Sancho, and V. Sanchis. 2013. Mycotoxins: occurrence, toxicology, and exposure assessment. Food and Chemical Toxicology, 60: 218–237.
Matejova, I., Faldyna, M., Modra, H., Blahova, J., Palikova, M., Markova, Z., Franc, A., Vicenova, M., Vojtek, L., Bartonkova, J. and Sehonova, P., 2017b. Effect of T-2 toxin-contaminated diet on common carp (Cyprinus carpio L.). Fish & Shellfish Immunology, 60, 458-465.
Matejova, I., Svobodova, Z., Vakula, J., Mares, J. and Modra, H., 2017a. Impact of mycotoxins on aquaculture fish species: a Review. Journal of the World Aquaculture Society, 48(2), 186-200.
Meronuck, R.A., 1994. Mycotoxins in feed. Feedstuffs (USA). Millington, K.A. and Cleland, J. 2017. Counting people and making people count: Key sources of population projections, K4D Helpdesk Report. Brighton, UK: Institute of Development Studies. https://opendocs.ids.ac.uk/opendocs/handle/20.500.12413/13013
Modra, H., Palikova, M., Hyrsl, P., Bartonkova, J., Papezikova, I., Svobodova, Z., Blahova, J. and Mares, J., 2020. Effects of trichothecene mycotoxin T-2 toxin on haematological and immunological parameters of rainbow trout (Oncorhynchus mykiss). Mycotoxin Research, 36(3), 319-326.
Moldal, T., Bernhoft, A., Rosenlund, G., Kaldhusdal, M. and Koppang, E.O., 2018. Dietary deoxynivalenol (DON) may impair the epithelial barrier and modulate the cytokine signaling in the intestine of Atlantic salmon (Salmo salar). Toxins, 10(9), 376.
Nomura, H., Ogiso, M., Yamashita, M., Takaku, H., Kimura, A., Chikasou, M., Nakamura, Y., Fujii, S., Watai, M. and Yamada, H., 2011. Uptake by dietary exposure and elimination of aflatoxins in muscle and liver of rainbow trout (Oncorhynchus mykiss). Journal of Agricultural and Food Chemistry, 59(9), 5150-5158.
Ostrowski-Meissner HT, LeaMaster BR, Duerr EO, Walsh WA (1995) Sensitivity of the Pacific white shrimp, Penaeus vannamei, to aflatoxin B1. Aquaculture, 131: 155-164.
Pestka, J.J., 2007. Deoxynivalenol: Toxicity, mechanisms and animal health risks. Animal feed science and technology, 137(3-4), 283-298.
Pietsch, C., 2017. Zearalenone (ZEN) and its influence on regulation of gene expression in carp (Cyprinus carpio L.) liver tissue. Toxins, 9(9), 283.
Pietsch, C., Junge, R. and Burkhardt-Holm, P., 2015. Immunomodulation by zearalenone in carp (Cyprinus carpio L.). BioMed Research International, 2015, 420702.
Pinotti, L., Ottoboni, M., Giromini, C., Dell’Orto, V. and Cheli, F., 2016. Mycotoxin contamination in the EU feed supply chain: A focus on cereal byproducts. Toxins, 8(2), 45.
Placinta, C.M., D’Mello, J.F. and Macdonald, A.M.C., 1999. A review of worldwide contamination of cereal grains and animal feed with Fusarium mycotoxins. Animal Feed Science and Technology, 78(1-2), 21-37.
Poston, H.A., Coffin, J.L. and Combs, G.F., 1982. Biological effects of dietary T-2 toxin on rainbow trout, Salmo gairdneri. Aquatic Toxicology, 2(2), 79-88.
Sahoo, P.K., Mukherjee, S.C., Nayak, S.K. and Dey, S., 2001. Acute and subchronic toxicity of aflatoxin B1 to rohu, Labeo rohita (Hamilton). Indian Journal of Experimental Biology, 39(5), 453-458.
Santacroce, M. P., M. C. Conversano, E. Casalino, O. Lai, C. Zizzadoro, G. Centoducati, and G. Crescenzo. 2008. Aflatoxins in aquatic species: metabolism, toxicity and perspectives. Reviews in Fish Biology and Fisheries, 18:99-130.
Schwartz, P., Thorpe, K.L., Bucheli, T.D., Wettstein, F.E. and Burkhardt-Holm, P., 2010. Short-term exposure to the environmentally relevant estrogenic mycotoxin zearalenone impairs reproduction in fish. Science of the Total Environment, 409(2), 326-333.
Selim, K.M., El-hofy, H. and Khalil, R.H., 2014. The efficacy of three mycotoxin adsorbents to alleviate aflatoxin B1-induced toxicity in Oreochromis niloticus. Aquaculture International, 22(2), 523-540.
Shahafve, S., Banaee, M., Haghi, B.N. and Mohiseni, M., 2017. Histopathological study of common carp (Cyprinus carpio) fed aflatoxin-contaminated diets. International Journal of Aquatic Biology, 5(2), 63-70.
Subasinghe, R., Soto, D. and Jia, J. 2009. Global aquaculture and its role in sustainable development. Reviews in Aquaculture, 1(1), 2-9.
Tamm, C. and Breitenstein, W., 1984. The biosynthesis of mycotoxins. In: Mycotoxins: A Study in Secondary Metabolism, Ed.: Steyn, P.S., pp: 69-91. Academic Press, New York, NY.
Tilman, D. and Clark, M. 2014. Global diets link environmental sustainability and human health. Nature, 515, 518-522.
Tuan, N.A., Manning, B.B., Lovell, R.T. and Rottinghaus, G.E., 2003. Responses of Nile tilapia (Oreochromis niloticus) fed diets containing different concentrations of moniliformin or fumonisin B1. Aquaculture, 217(1-4), 515-528.
Varga, J., Frisvad, J. and Samson, R., 2009. A reappraisal of fungi producing aflatoxins. World Mycotoxin Journal, 2(3), 263-277.
Wang, E., Ross, P.F., Wilson, T.M., Riley, R.T. and Merrill Jr, A.H., 1992. Increases in serum sphingosine and sphinganine and decreases in complex sphingolipids in ponies given feed containing fumonisins, mycotoxins produced by Fusarium moniliforme. The Journal of Nutrition, 122(8), 1706-1716.
Wang, Y., Wang, B., Liu, M., Jiang, K., Wang, M. and Wang, L., 2018. Aflatoxin B1 (AFB1) induced dysregulation of intestinal microbiota and damage of antioxidant system in Pacific white shrimp (Litopenaeus vannamei). Aquaculture, 495, 940-947.
Woźny, M., Dobosz, S., Obremski, K., Hliwa, P., Gomułka, P., Łakomiak, A., Różyński, R., Zalewski, T. and Brzuzan, P., 2015. Feed-borne exposure to zearalenone leads to advanced ovarian development and limited histopathological changes in the liver of premarket size rainbow trout. Aquaculture, 448, 71-81.
Wu, T.S., Cheng, Y.C., Chen, P.J., Huang, Y.T., Yu, F.Y. and Liu, B.H., 2019. Exposure to aflatoxin B1 interferes with locomotion and neural development in zebrafish embryos and larvae. Chemosphere, 217, 905-913.
Yildirim, M., Manning, B.B., Lovell, R.T., Grizzle, J.M. and Rottinghaus, G.E., 2000. Toxicity of moniliformin and fumonisin B1 fed singly and in combination in diets for young channel catfish Ictalurus punctatus. Journal of the World Aquaculture Society, 31(4), 599-608.
Zain, M.E., 2011. Impact of mycotoxins on humans and animals. Journal of Saudi Chemical Society, 15(2), 129-144.
Zhang, Y., Rossi, W., Yamamoto, F.Y., Velasquez, A.M., Wang, A. and Gatlin, D.M., 2022. Effects of Dietary Aflatoxin B1 on Hybrid Striped Bass (Morone chrysops× M. saxatilis) and Assessment of Supplemental Arginine as a Potential Aflatoxicosis Alleviator. Aquaculture Nutrition, 5161222.




 Prevención de micotoxicosis
Prevención de micotoxicosis