Antonio Gallo
Profesor Asociado, Departamento de Ciencia Animal, Alimentación y Nutrición, Università Cattolica del Sacro Cuore, Italia
Las micotoxinas son moléculas producidas por hongos filamentosos. En concreto, son metabolitos secundarios de mohos pertenecientes a varios géneros.
![]() El término “metabolitos secundarios” se refiere al hecho de que no se atribuye a la micotoxina ninguna función evidente para el crecimiento o la reproducción de los organismos que las producen.
El término “metabolitos secundarios” se refiere al hecho de que no se atribuye a la micotoxina ninguna función evidente para el crecimiento o la reproducción de los organismos que las producen.
Las micotoxinas se producen, principalmente, como resultado de la interacción entre el hongo y el entorno.
Sin el crecimiento fúngico, no hay micotoxinas. Sin embargo, la presencia de mohos no asegura la presencia de micotoxinas.
⇰ Solo determinadas cepas pueden producir micotoxinas y la producción de estas sustancias requiere condiciones ambientales específicas.
Las micotoxinas tienen un bajo peso molecular y son muy estables, provocando una respuesta tóxica, tanto en humanos como en otros animales vertebrados (Gallo et al., 2015).
Los principales hongos micotoxigénicos pertenecen a los géneros Alternaria, Aspergillus, Fusarium, Monascus y Penicillium spp. pero otros géneros, como Chaetomium, Cladosporium, Claviceps, Diplodia, Myrothecium, Phoma, Phomopsis, Pithomyces, Trichoderma y Stachybotrys, también incluyen especies micotoxigénicas.
 La contaminación por micotoxinas representa un problema mundial para diversos productos agrícolas, tanto antes, como después de la cosecha. Estos metabolitos fúngicos se caracterizan por su gran estabilidad térmica, lo que dificulta la detoxificación de la matriz contaminada.
La contaminación por micotoxinas representa un problema mundial para diversos productos agrícolas, tanto antes, como después de la cosecha. Estos metabolitos fúngicos se caracterizan por su gran estabilidad térmica, lo que dificulta la detoxificación de la matriz contaminada.
Figura 1. Principales hongos micotoxigénicos. Alternaria, Aspergillus, Fusarium y Penicillium spp.
Hay unos 18.000 metabolitos secundarios de hongos descritos en la base de datos AntiBase, pero sólo un número limitado de ellos ha recibido atención científica a partir de los años 60 (Gallo et al., 2015).
Las micotoxinas más estudiadas son las reguladas:
- ⇰ Aflatoxinas (AF)
- ⇰ Citrinina
- ⇰ Tricotecenos, como el deoxinivalenol (DON)
- ⇰ Patulina
- ⇰ Ocratoxina A (OTA)
- ⇰ Fumonisinas (FBs)
- ⇰ Zearalenona (ZEN)
- ⇰ Algunas de las principales toxinas de los hongos endofíticos: toxinas del cornezuelo del centeno y la ergotamina
Las micotoxicosis son los síndromes resultantes de la ingestión, el contacto con la piel o la inhalación de estos metabolitos fúngicos por parte de organismos superiores, como los seres humanos y el ganado.
⇰ Las micotoxinas pueden ser teratogénicas, mutagénicas y carcinogénicas y pueden provocar diversos efectos tóxicos, tanto en los seres humanos como en los animales, al ser ingeridas, inhaladas o absorbidas por contacto con la piel.
Los efectos tóxicos de las micotoxinas dependen del:
- ⇰ El tipo de toxina
- ⇰ Dosis
- ⇰ Órgano diana
- ⇰ Sexo, edad y especie
Cuando el ganado ingiere piensos contaminados con micotoxinas, los efectos sobre su salud pueden ser agudos o crónicos
 Los efectos agudos son signos evidentes de enfermedad o incluso de muerte. Sin embargo, la observación de manifestaciones agudas de micotoxicosis es rara en las condiciones de las explotaciones.
Los efectos agudos son signos evidentes de enfermedad o incluso de muerte. Sin embargo, la observación de manifestaciones agudas de micotoxicosis es rara en las condiciones de las explotaciones.
 Los efectos crónicos son otros trastornos menos evidentes, como el rechazo del alimento y la reducción de la ingestión, la productividad, la fertilidad y la inmunosupresión.
Los efectos crónicos son otros trastornos menos evidentes, como el rechazo del alimento y la reducción de la ingestión, la productividad, la fertilidad y la inmunosupresión.
Los efectos agudos y crónicos causan graves pérdidas económicas debido a:
- ⇰ Cambios clínicamente ambiguos en el crecimiento de los animales
- ⇰ Reducción de la ingesta de alimentos o rechazo de los mismos
- ⇰ Alteración de la absorción y el metabolismo de los nutrientes
- ⇰ Efectos endocrinos
- ⇰ Impacto del estado inmunitario
(Fink-Gremmels, 2008)

Los efectos de las micotoxinas en los rumiantes están asociados a una multitud de efectos confusos y es difícil distinguir los efectos debidos a la ingestión de estas toxinas, de otros posibles problemas de salud. Esto se debe a:
1. El efecto de las micotoxinas está relacionado con varios factores (dieta, animal o condiciones ambientales).
2. La coocurrencia de múltipes micotoxinas La presencia simultánea de múltiples micotoxinas tiene efectos interactivos, clasificados como aditivos, antagónicos o sinérgicos (CAST, 2003).
Por tanto, los efectos debidos a la ingestión de múltiples micotoxinas pueden ser similares, menores o, en la mayoría de los casos, mucho mayores que la ingestión de una sola micotoxina.
3. Las micotoxinas pueden ser modificadas, principalmente por la planta que puede producir las micotoxinas ocultas (micotoxinas conjugadas a compuestos polares como la glucosa, el ácido malónico y el glutatión, este compuesto no puede ser cuantificado por los métodos normales de laboratorios).
⇰ Las formas modificadas de una micotoxina probablemente presenten la misma toxicidad que el compuesto original, al ser enlaces específicos hidrolizados en el tracto digestivo.

TOXICIDAD INDUCIDA POR MICOTOXINAS DE FUSARIUM
Los animales pueden desarrollar numerosos síntomas tras el consumo de piensos contaminados con micotoxinas producidas por Fusarium spp., entre los que se incluyen problemas gastrointestinales, heces blandas, diarrea, inmunosupresión y una disminución general del rendimiento, probablemente debido a la reducción de la ingesta de alimentos y al aumento de la susceptibilidad a las enfermedades (causa indirecta) (Seeling et al., 2006).
Las micotoxinas de Fusarium más relevantes y con mayor incidencia son:
- ⇰ ZEN
- ⇰ DON
- ⇰ FB
- ⇰ Toxina T-2 (T2) y toxina HT-2 (HT2)
- ⇰ Nivalenol (NIV)
- ⇰ Diacetoxiscirpenol (DAS)

Micotoxinas de Fusarium y la salud intestinal 
Las micotoxinas de Fusarium pueden afectar a la inmunidad de las mucosas, que consta de un sistema inmunitario innato y otro adaptativo (Figura 2).
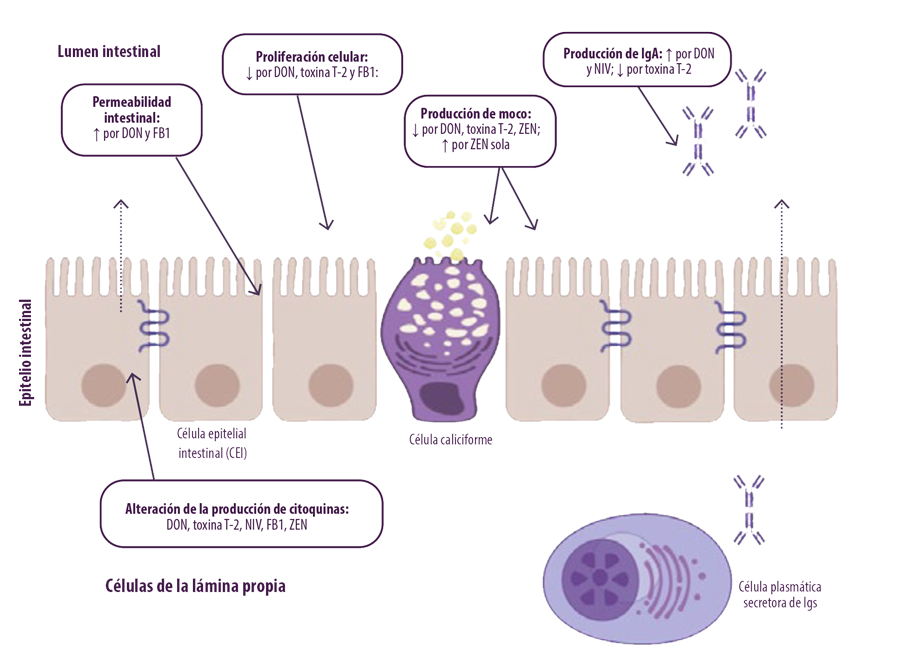
Figura 2. Efecto de las micotoxinas de Fusarium en el epitelio intestinal. Las micotoxinas de Fusarium alteran diferentes mecanismos de defensa intestinal, incluyendo la integridad epitelial, la proliferación celular, la capa de moco, las inmunoglobulinas (Ig) y las citoquinas (adaptado de Antonnisen et al., 2014).
 DON y FB pueden aumentar la permeabilidad del estrato epitelial intestinal humano, porcino y aviar. Además, las micotoxinas producidas por Fusarium pueden afectar negativamente a la viabilidad y proliferación de las células epiteliales intestinales de animales y humanos.
DON y FB pueden aumentar la permeabilidad del estrato epitelial intestinal humano, porcino y aviar. Además, las micotoxinas producidas por Fusarium pueden afectar negativamente a la viabilidad y proliferación de las células epiteliales intestinales de animales y humanos.Las micotoxinas de Fusarium son capaces de atravesar el epitelio intestinal y llegar a la circulación sistémica, afectando al sistema inmunitario.
⇰ Estas toxinas pueden tener efectos inmunoestimulantes o inmunosupresores que dependen de la edad del hospedador, así como de la dosis y la duración de la exposición.
Micotoxinas de Fusarium y estrés oxidativo
Los rumiantes son una fuente potencial de microrganismos o enzimas para la biodegradación de micotoxinas.
Por ejemplo, las micotoxinas son metabolizadas por las enzimas del citocromo P450 a aducto metabolitoguaninaN7 (Figura 3).
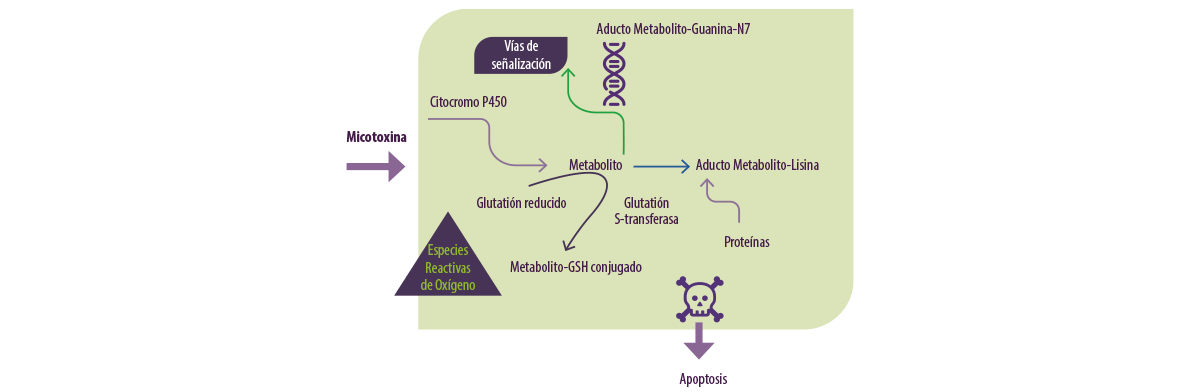
Figura 3. Metabolismo de las micotoxinas en los vertebrados (Adaptado de Omar HEM.,2013).
La citotoxicidad y la generación de ROS (Especies Reactivas de Oxígeno) son mecanismos de toxicidad mediada por micotoxinas.
Las EROs son moléculas químicamente reactivas que contienen oxígeno y que se forman como un subproducto natural del metabolismo normal del oxígeno y tienen un papel importante en la señalización celular y en la homeostasis.
En situaciones de estrés ambiental, los niveles de ROS pueden aumentar drásticamente como resultado del estrés oxidativo.
⇰ El estrés oxidativo se produce cuando la concentración de ROS generada supera la capacidad antioxidante de la célula y da lugar a diversos procesos deletéreos debido a un desequilibrio entre la excesiva formación de ROS y las limitadas defensas antioxidantes.
La célula puede tolerar cantidades pequeñas y moderadas de estrés oxidativo mediante la producción de moléculas antioxidantes, como la vitamina A, C y E, y GSH, así como la activación de enzimas (por ejemplo, CAT, SOD, GPx, glutatión reductasa [GR] y glutatión S-transferasa [GST]) para contrarrestar el exceso de oxidantes.
⇰ Por otro lado, las lipoxigenasas (LPO) pueden provocar daños en las proteínas y la inactivación de las enzimas unidas a la membrana a través de un ataque directo, ya sea por los radicales libres o por la modificación química de sus productos.
EFECTOS DE LAS MICOTOXINAS EN LOS RUMIANTES, CON ESPECIAL ATENCIÓN AL RENDIMIENTO Y LA DIGESTIBILIDAD
En 2015, Gallo et al. revisaron exhaustivamente toda la bibliografía actual sobre micotoxinas, creando un resumen que recogiera todas las pruebas realizadas hasta el momento.

 Nuestros conocimientos actuales evolucionan cada vez más y nos han permitido comprender que aún quedan muchos ensayos por realizar, tanto in vivo como in vitro. También es necesario finalizar el desarrollo de herramientas de detección y diagnóstico rápido, como la instrumentación NIR para el análisis de la calidad del ensilado.
Nuestros conocimientos actuales evolucionan cada vez más y nos han permitido comprender que aún quedan muchos ensayos por realizar, tanto in vivo como in vitro. También es necesario finalizar el desarrollo de herramientas de detección y diagnóstico rápido, como la instrumentación NIR para el análisis de la calidad del ensilado.La Tabla 1 muestra la actualización bibliográfica desde 2015 hasta 2021 de los ensayos realizados in vivo relativos a los efectos de las micotoxinas de Fusarium.
En general, se observaron respuestas relacionadas con el tipo de micotoxinas en:
- ⇰ Comportamiento alimentario y digestibilidad de la dieta
- ⇰ Estado fisiológico e inmunitario
- ⇰ Producción y calidad de la leche
- ⇰ Aspectos reproductivos
- ⇰ Cambios en el peso corporal
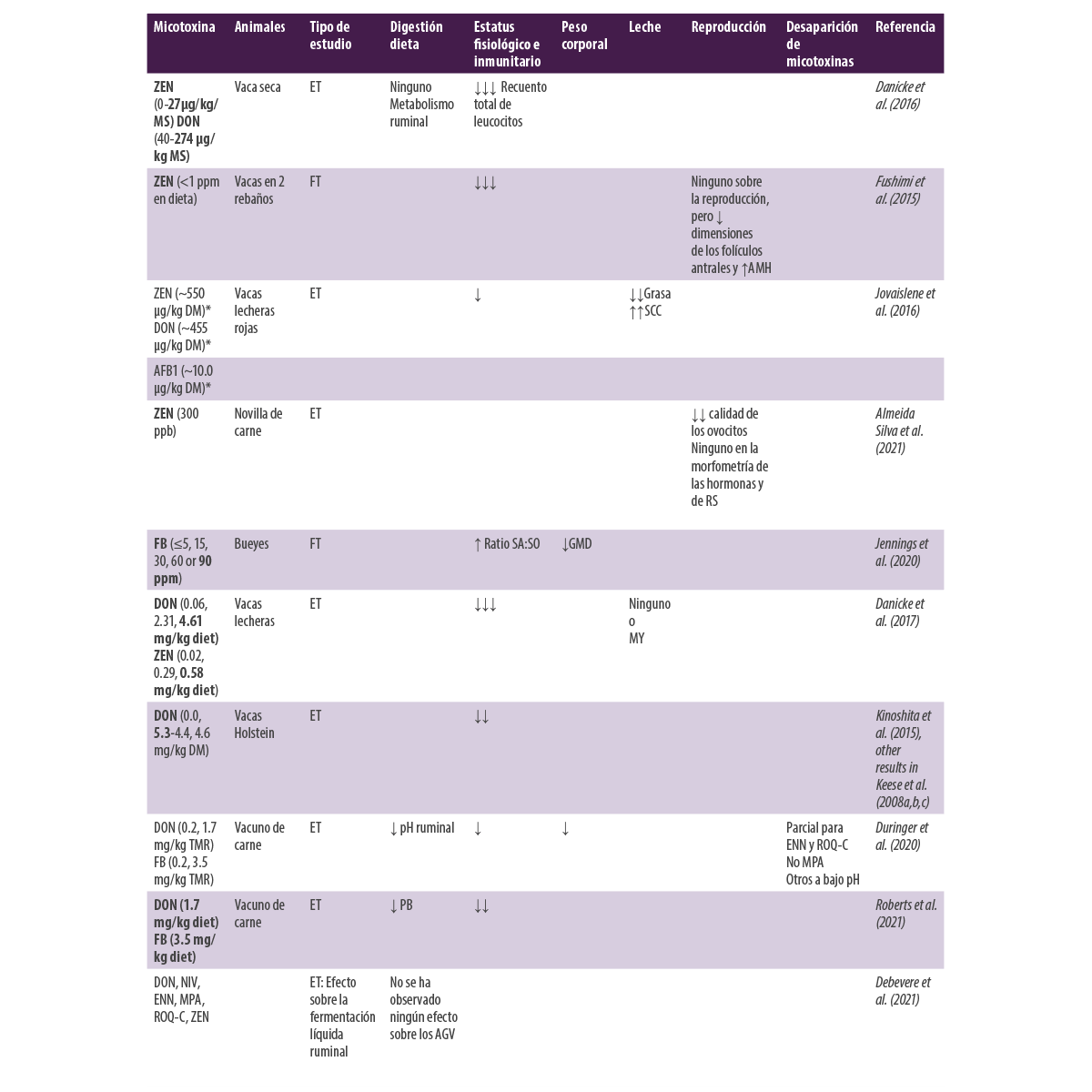
Tabla 1. Efectos de la ingestión de micotoxinas de Fusarium en rumiantes.
* Recalculado a partir de los datos presentados en cada artículo AMH: Hormona antimülleriana; SCC: Recuento de células somáticas; SA:SO ratio: Ratio Esfinganina/Esfingosina; GMD: Ganancia Media Diaria; PB: Proteína Bruta; ENN: Enniatinas; MPA: Ácido micofenólico; ROQ-C: Roquefortina C; AFV: Ácidos Grasos Volátiles
Para una representación más intuitiva, la Figura 4 resume los efectos de 21 ensayos, publicados en revistas revisadas por expertos, que se realizaron para evaluar el efecto de las micotoxinas producidas por Fusarium spp. (es decir, principalmente DON, ZEN y FB).
Algunos ensayos se realizaron con una sola micotoxina, mientras que otros evaluaron el efecto de diferentes micotoxinas al mismo tiempo.
⇰ Cuando se estudiaron micotoxinas con efectos diferentes en el mismo ensayo, cada efecto se atribuyó sólo a la micotoxina responsable y no a todo el complejo de micotoxinas examinadas en el ensayo para el procesamiento de los datos.
Los datos obtenidos se relativizaron en relación al número total de pruebas realizadas y fueron examinadas para una micotoxina en particular, calculando posteriormente cuántas pruebas mostraron un efecto particular, lo que finalmente se expresó en términos de porcentaje de incidencia.
| La Figura 3 muestra, de forma muy intuitiva, que:
⇰ La ZEN está vinculada a los efectos reproductivos. ⇰ Los FBs están vinculados a los efectos sobre la digestibilidad de la dieta, la conducta alimentaria, el estado inmunológico fisiológico y el peso corporal. ⇰ El DON tiene un amplio espectro de acción e implica todas las esferas afectadas por el FB, así como la producción y la calidad de la leche. |
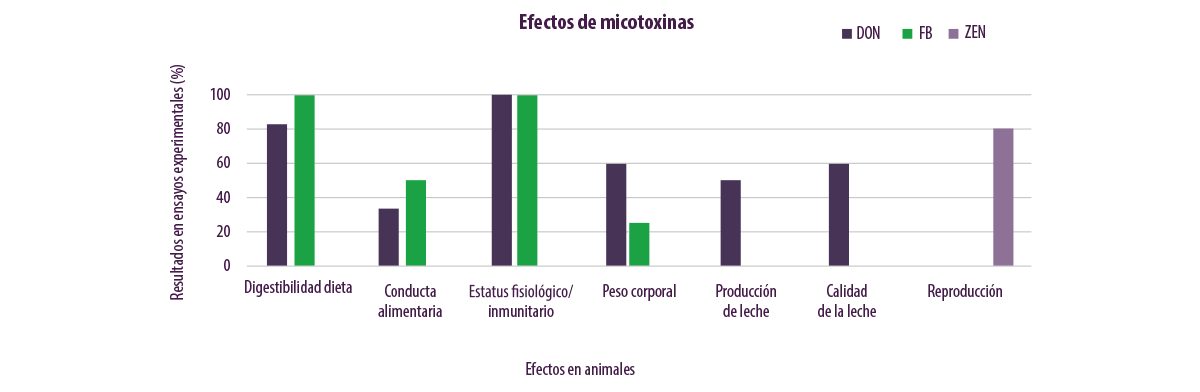
Figura 4. Efectos de 21 ensayos realizados para evaluar el efecto de las micotoxinas DON, ZEN y FB probadas tanto solas como en combinación con otras.
Bibliografía: Duringer J.M. et al; 2020; World Myco. J.- Roberts H. L. et al.; 2021; Toxins- Gallo A. et al; 2020; J. Dairy Sci.- Danicke S. et al.; 2016; Arch. Anim. Nutrit. – Jovaisiene J. et al.; 2016; Pol. Jour. Vet. S. – Kinoshita A. et al.; 2015; J. of Phys. and Anim. Nutr.- Jennings J.S. et al.; 2020; J. Anim. Sci. – Fushimi Y. et al.; 2015; Reprod Dom Anim. – Almeida Silva L. et al.; 2021; Reprod. Dom. Anim. – McKay et al., (2019); Anim. Feed Sci. Technol. – Hildebrand B. et al; 2012; J. Anim. Physiol. Anim. Nutr. – Keese, C.; 2008; Arch. Anim. Nutr. – Keese, C.; 2008; Arch. Anim. Nutr. – Korosteleva, S.N.; 2007; J. Dairy Sci. – Ingalls, J.R.; 1996; Anim. Feed Sci. Technol. – Weaver, G.A.; 1986; Am. J. Vet. Res. – Coppock, R.W.; 1990; Vet. Hum. Toxicol. – Baker, D.C.; 1999; J. Vet. Diagn. Investig.- Osweiler, G.D.; 1993; J. Anim. Sci. – Mathur, S.; 2001; Toxicol. Sci.- Weaver, G.A.; 1986; Am. J. Vet. Res.
En 2008, Fink-Gremmels demostró que los rumiantes son menos susceptibles que los monogástricos, si son alimentados con piensos contaminados con micotoxinas.
El rumen representa una defensa activa, ya que tiene capacidad de fijación de las micotoxinas (son retenidas a través de la fibra, las paredes de la levadura, las paredes bacterianas) o tiene mecanismos de desactivación/degradación de estos metabolitos secundarios (debido a los protozoos o bacterias que están presentes en el rumen).
A diferencia de los monogástricos, que reciben una dieta muy estandarizada, rica en productos amiláceos y pobre en fibra, los rumiantes reciben una dieta extremadamente variada que incluye ensilados obtenidos a partir de diversas matrices (maíz, cebada, trigo, sorgo), heno, forraje, maíz de alta humedad, subproductos, semillas y otros concentrados.
Debido a la necesidad de alimentar a los rumiantes con alimentos que no compitan con la alimentación humana, y para poder reaccionar ante los elevados precios de las materias primas, la formulación de las dietas para rumiantes está cambiando y la inclusión de coproductos y subproductos está aumentando.
 Por ello, es importante evaluar la posible contaminación con micotoxinas reguladas y emergentes de estos nuevos piensos, lo que representa una nueva área de investigación para los nutricionistas de animales. Por ello, es importante evaluar la posible contaminación con micotoxinas reguladas y emergentes de estos nuevos piensos, lo que representa una nueva área de investigación para los nutricionistas de animales. |
 Un ensayo realizado recientemente por Gallo et al. (2020) estudió los efectos de niveles regulares (niveles que se encuentran naturalmente en los alimentos) de contaminación de DON y FBs en la ración mixta total (TMR) sobre el rendimiento, la digestibilidad de la dieta, la calidad de la leche y las enzimas hepáticas del plasma en vacas lecheras.
Un ensayo realizado recientemente por Gallo et al. (2020) estudió los efectos de niveles regulares (niveles que se encuentran naturalmente en los alimentos) de contaminación de DON y FBs en la ración mixta total (TMR) sobre el rendimiento, la digestibilidad de la dieta, la calidad de la leche y las enzimas hepáticas del plasma en vacas lecheras.
El ensayo incluyó a:
- ⇰ Dieta de control (CTR)
- ⇰ Dieta contaminada con micotoxinas (MTX)
- ⇰ Dieta contaminada con micotoxinas añadida con un producto desactivador de micotoxinas (MDP)
Condición corporal y consumo de alimento
No se observaron cambios en la calificación de la condición corporal (CC), la ingesta de materia seca (IMS) y el peso corporal (PC) durante el ensayo cuando las vacas lecheras lactantes fueron alimentadas con las tres dietas experimentales (Figura 5).
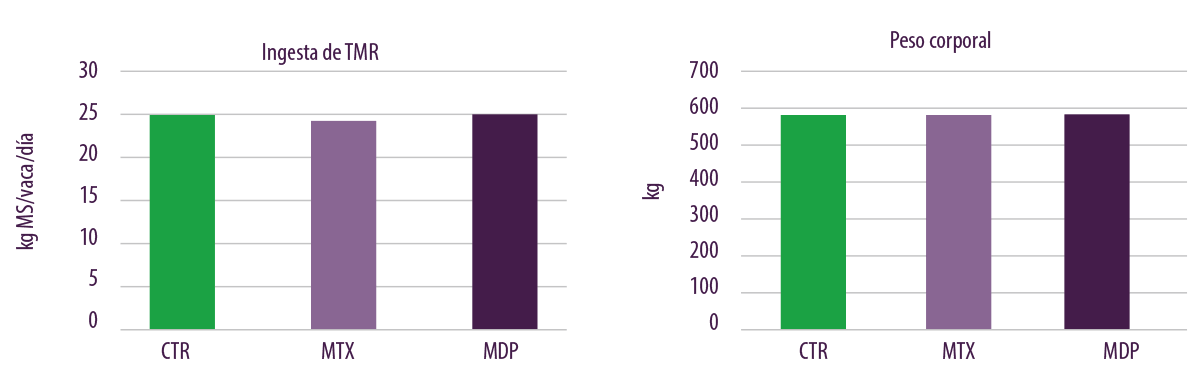
Figura 5. Efectos del nivel habitual de contaminación por micotoxinas sobre la ingesta de TMR y el peso corporal.
Producción y calidad de la leche
|
La comparación de la producción de leche mostró que la dieta MTX provocó una reducción de la producción de leche de 1,34 kg/vaca/día en comparación con la dieta CTR. La dieta MDP provocó una reducción de la producción de leche de 1,14 kg/vaca/día, en comparación con la dieta CTR (Figura 6).
|
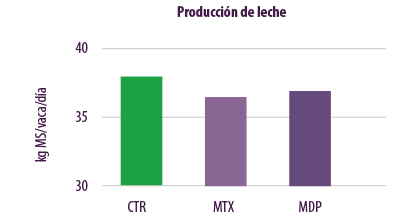
Figura 6. Efectos de niveles regulares de contaminación por micotoxinas en la producción de leche.
En cuanto a los parámetros de calidad de la leche, la firmeza del cuajo y el tiempo de cuajado se vieron afectados negativamente por la dieta MTX en comparación con las otras 2 dietas (dieta CTR y MDP; Figura 7).
⇰ Por tanto, el producto desactivador de micotoxinas tuvo resultados prácticos positivos, siendo capaz de contrarrestar los efectos negativos de las micotoxinas en las propiedades de coagulación del cuajo de la leche.
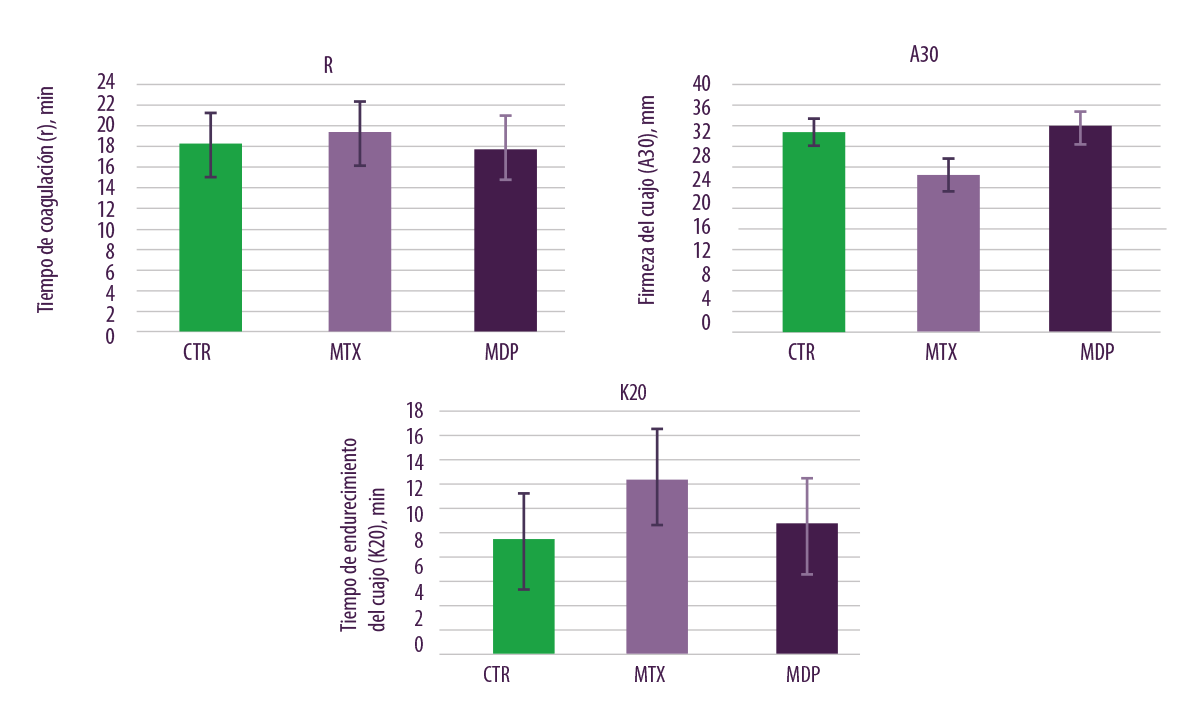
Figura 7. Efectos del nivel regular de contaminación por micotoxinas en el tiempo de coagulación, la firmeza del cuajo y el tiempo de cuajado.
Estado inmunitario
En comparación con la dieta CTR, la dieta MTX dio lugar a una expresión ligeramente inferior de los genes asociados a las funciones inmunitarias e inflamatorias, lo que indica que las micotoxinas de Fusarium tuvieron un efecto inmunosupresor.
| El estudio reveló que las dietas contaminadas con niveles regulares de micotoxinas de Fusarium afectaban negativamente al rendimiento de las vacas lecheras lactantes, a la calidad de la leche, a la digestibilidad de la dieta, al perfil metabólico y a la inmunidad, y que la suplementación con un producto comercial desactivador de micotoxinas contrarrestaba la mayoría de estos efectos negativos, pero no la producción de leche. |
 En 2021, Gallo et al. realizaron un nuevo estudio sobre los efectos de las micotoxinas de Fusarium en el potencial de fermentación in vitro del líquido ruminal muestreado de vacas lecheras lactantes que ingerían dietas contaminadas con niveles regulares de estas micotoxinas.
En 2021, Gallo et al. realizaron un nuevo estudio sobre los efectos de las micotoxinas de Fusarium en el potencial de fermentación in vitro del líquido ruminal muestreado de vacas lecheras lactantes que ingerían dietas contaminadas con niveles regulares de estas micotoxinas.
Se observaron mayores volúmenes finales o tasas de producción de gas a lo largo del tiempo para el inóculo ruminal MDP que para el inóculo MTX (Figura 8), encontrándose una interacción tratamiento-alimentación.
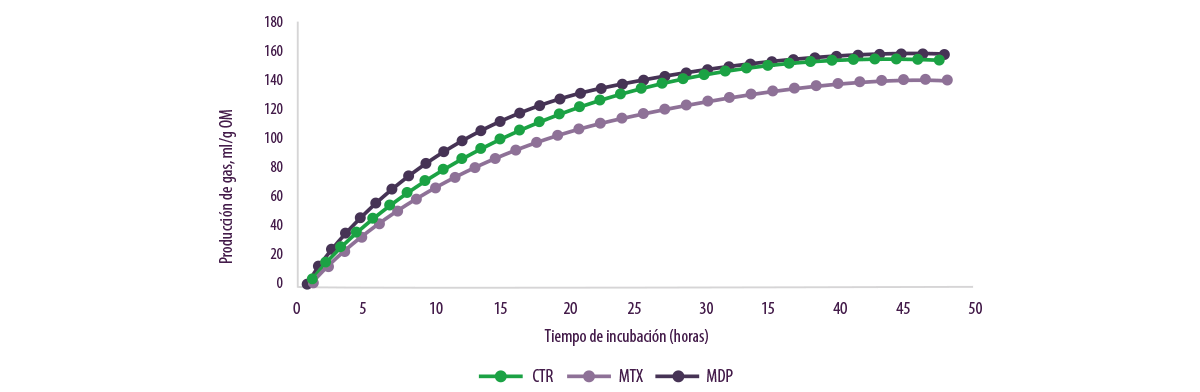
Figura 8. Producción de gas (ml/g OM) en relación con los tres diferentes tratamientos.
Las concentraciones de ácidos grasos volátiles (AGV) no fueron diferentes entre los tratamientos, con la excepción de un ligero aumento del ácido acético en CTR en comparación con MTX (Figura 9).
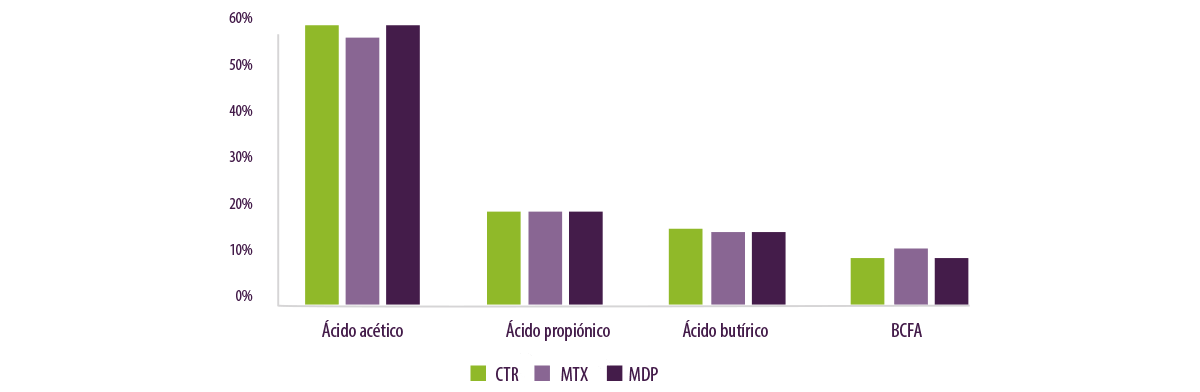
Figura 9. Proporción de AGV en el inóculo ruminal tras 48h.
Gallo et al., en otro artículo publicado en 2021, caracterizaron muestras de ensilado en cuanto a la presencia de sustancias químicas, la comunidad bacteriana y las concentraciones de diversos metabolitos fúngicos.
Los ensilados se agruparon en cinco grupos, en función de las micotoxinas detectadas, y el estudio demostró que el ensilado de maíz puede estar contaminado por un elevado número de micotoxinas reguladas y emergentes.
Esto es consistente con los informes de Santos et al. (2014) que observaron graves pérdidas de PC, mala consistencia de las heces, marcha rígida y signos de laminitis sin signos claros de enfermedad asociados con aumentos irregulares en el recuento de células somáticas y baja producción de leche, excluyendo así enfermedades infecciosas o metabólicas.
⇰ Sin embargo, el análisis visual del ensilado mostró inestabilidad aeróbica y crecimiento de moho en todo el silo, lo que fue confirmado de nuevo por el análisis de la TMR, que mostró una contaminación múltiple por micotoxinas.
Las áreas de investigación actuales y próximas que se están llevando a cabo son:
- ⇰ La creación y mejora del índice de calidad de la fermentación del ensilaje de maíz (reportado por Gallo et al, 2016).
- ⇰ El índice de riesgo de micotoxinas en el ensilado de maíz.
- ⇰ Calibraciones NIR para la caracterización de micotoxinas en el ensilado de maíz.
La aplicación del NIR a la agrupación de ensilajes de maíz para detectar el contenido de micotoxinas, ha dado resultados muy positivos que podrían permitir determinar muy rápidamente si una muestra está contaminada con micotoxinas o no (Figura 10).
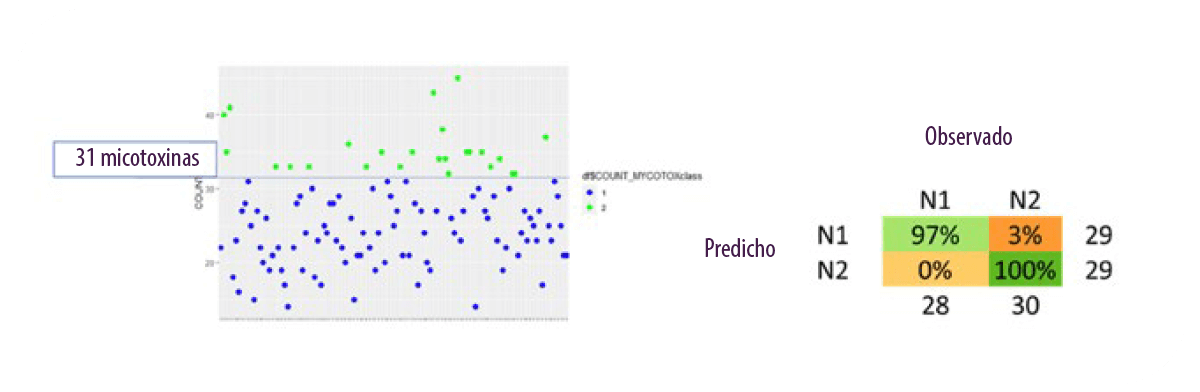
Figura 10. Aplicación de NIR para clasificar el ensilado de maíz en función del contenido de micotoxinas (Discriminant Random Forests analysis). Proyecto de doctorado de Ghilardelli Francesca.
REFERENCIAS
Gallo, A., Giuberti, G., Frisvad, J. C., Bertuzzi, T., & Nielsen, K. F. (2015). Review on mycotoxin issues in ruminants: Occurrence in forages, effects of mycotoxin ingestion on health status and animal performance and practical strategies to counteract their negative effects. Toxins, 7(8), 3057-3111.
Seeling, K., Lebzien, P., Dänicke, S., Spilke, J., Südekum, K. H., & Flachowsky, G. (2006). Effects of level of feed intake and Fusarium toxin‐contaminated wheat on rumen fermentation as well as on blood and milk parameters in cows. Journal of Animal Physiology and Animal Nutrition, 90(3‐4), 103-115.
Antonissen, G., Martel, A., Pasmans, F., Ducatelle, R., Verbrugghe, E., Vandenbroucke, V., Shaoji, L., Haesebrouck F., Van Immerseel, F. & Croubels, S. (2014). The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases. Toxins, 6(2), 430-452.Omar, H. E. M. (2013). Mycotoxins-induced oxidative stress and disease. Mycotoxin and Food Safety in Developing Countries. Rijeka, Croatia: InTech, 63-92.
Omar, H. E. M. (2013). Mycotoxins-induced oxidative stress and disease. Mycotoxin and Food Safety in Developing Countries. Rijeka, Croatia: InTech, 63-92.
Fink-Gremmels, J. (2008). The role of mycotoxins in the health and performance of dairy cows. The Veterinary Journal, 176(1), 84-92.
Gallo, A., Minuti, A., Bani, P., Bertuzzi, T., Cappelli, F. P., Doupovec, B., J. Fass, D. Schatzmayr, & Trevisi, E. (2020). A mycotoxin-deactivating feed additive counteracts the adverse effects of regular levels of Fusarium mycotoxins in dairy cows. Journal of dairy science, 103(12), 11314-11331.
Gallo, A., Ghilardelli, F., Doupovec, B., Faas, J., Schatzmayr, D., & Masoero, F. (2021). Kinetics of gas production in the presence of Fusarium mycotoxins in rumen fluid of lactating dairy cows. JDS Communications, 2(5), 243-247.
Gallo, A., Ghilardelli, F., Atzori, A. S., Zara, S., Novak, B., Faas, J., & Fancello, F. (2021). Co-occurrence of regulated and emerging mycotoxins in corn silage: Relationships with fermentation quality and bacterial communities. Toxins, 13(3), 232.
Santos, R. R., & Fink-Gremmels, J. (2014). Mycotoxin syndrome in dairy cattle: Characterisation and intervention results. World Mycotoxin Journal, 7(3), 357-366.
Gallo, A., Giuberti, G., Bruschi, S., Fortunati, P., & Masoero, F. (2016). Use of principal factor analysis to generate a corn silage fermentative quality index to rank well‐or poorly preserved forages. Journal of the Science of Food and Agriculture, 96(5), 1686-1696.




 Prevención de micotoxicosis
Prevención de micotoxicosis