Panagiotis Tassis
Profesor Adjunto de Medicina y Reproducción Porcina Clínica de Animales de Producción, Facultad de Medicina Veterinaria de la Universidad Aristóteles de Tesalónica (Grecia)
La importancia del rendimiento reproductivo para el éxito de la producción porcina es indudable. Ambas partes, cerdas nulíparas/ multíparas y verracos son la base para una producción adecuada y económicamente viable en las granjas porcinas a nivel global.
⇰ Las líneas genéticas de cerdas hiperprolíficas, así como la alta durabilidad y mayor rendimiento de los verracos son necesarios para satisfacer las crecientes demandas de carne de cerdo de alta calidad.
Numerosos factores importantes, como el manejo reproductivo, la selección de cerdas nulíparas y verracos, la introducción de las cerdas al programa reproductivo de la granja, las condiciones ambientales que afectan al rendimiento reproductivo (ej.: estrés por calor), así como el mantenimiento de un buen estatus sanitario y la satisfacción de los requerimientos nutricionales específicos, deberían recibir atención durante la cría de las cerdas hiperprolíficas y los verracos.
⇰ El control de los principales patógenos víricos o bacterianos porcinos que afectan al tracto genital y al rendimiento reproductivo, así como una adecuada nutrición en términos de requerimientos de ingredientes/nutrientes durante diferentes fases de la gestación y de la vida del verraco, son partes importantes de un correcto manejo reproductivo.

Las micotoxinas son metabolitos secundarios producidos por determinadas especies fúngicas que se pueden encontrar en granos por todo el mundo. Son producidas antes (hongos que son patógenos para los vegetales) o después de la cosecha de los granos, o incluso durante el almacenamiento (hongos saprófitos).
En determinadas regiones, la amenaza de las micotoxinas parece ser mayor, resultando en severos casos de intoxicación (micotoxicosis), con el riesgo que ello supone para los animales y los humanos1.
⇰ El impacto significativo de las micotoxinas incluye la pérdida de vidas humanas y animales, mayores costes sanitarios y veterinarios, y reducción de la producción ganadera2.
Los hongos productores de micotoxinas más importantes pertenecen a los géneros Aspergillus, Penicillium, Fusarium, Alternaria y Claviceps3.
De las más de 500 micotoxinas, algunas son consideradas extremadamente significativas para la salud y el rendimiento porcino.
Concretamente, las aflatoxinas (AF) B1, B2, G1 y G2, el deoxinivalenol (DON), la zearalenona (ZEN), las fumonisinas (FB1, FB2, FB3) y la ocratoxina A (OTA) son considerados como importantes por sus efectos devastadores sobre la producción porcina a nivel global.
Se ha sugerido que otras micotoxinas, como la toxina T-2, el nivalenol o los alcaloides ergóticos, podrían ser moderadamente significativas para el porcino, especialmente en algunas regiones geográficas concretas1,4.
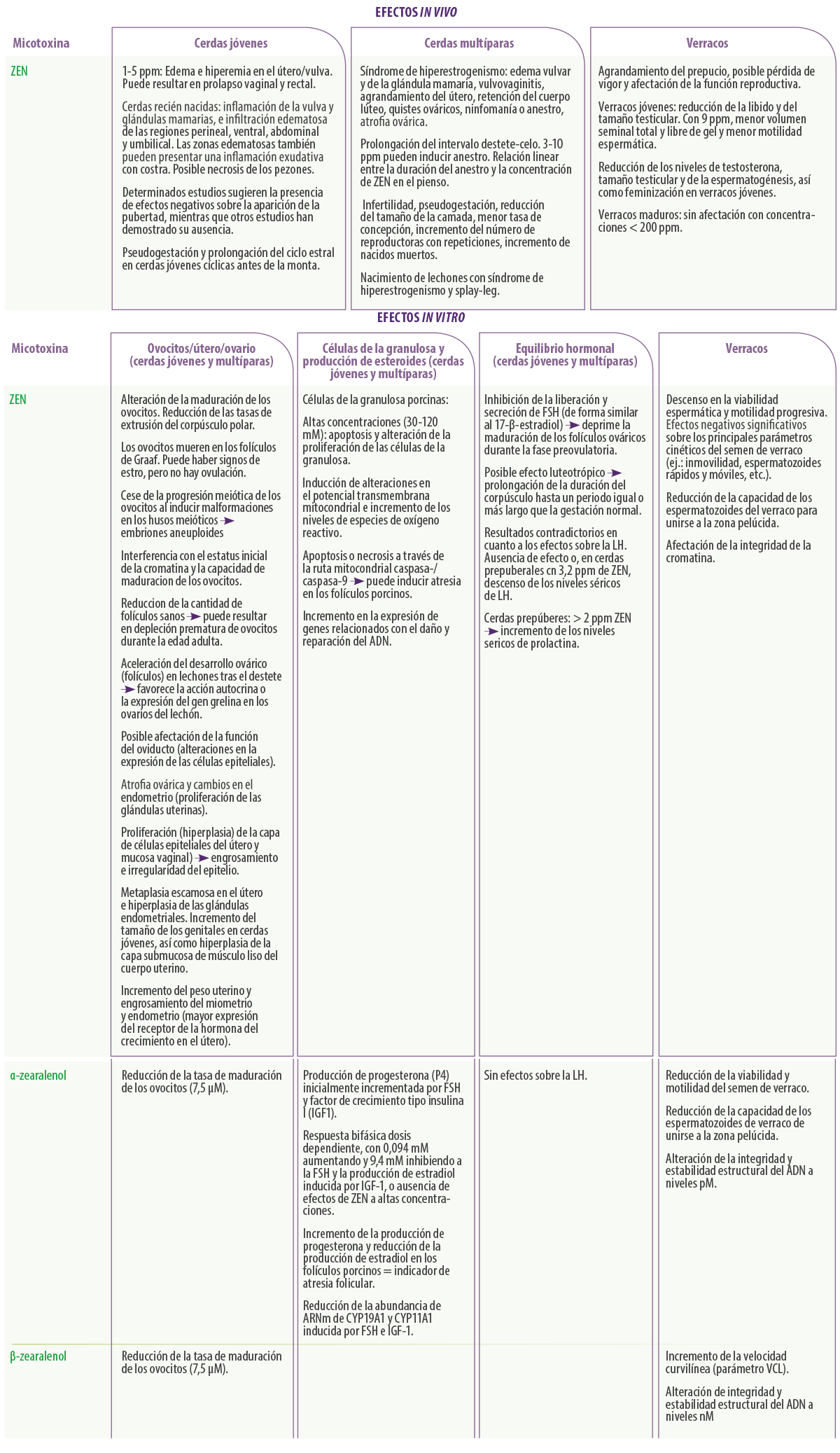
 A pesar de que se ha sugerido que varias micotoxinas inducen o contribuyen al desarrollo de trastornos reproductivos (DON, ZEN, FB, T-2) en varias especies5, es evidente que la más “interesante” en términos de rendimiento reproductivo es la ZEN y sus derivados metabólicos.
A pesar de que se ha sugerido que varias micotoxinas inducen o contribuyen al desarrollo de trastornos reproductivos (DON, ZEN, FB, T-2) en varias especies5, es evidente que la más “interesante” en términos de rendimiento reproductivo es la ZEN y sus derivados metabólicos.
En este artículo trataremos de resumir los efectos de las micotoxinas más importantes, cuando son ingeridos por separados, sobre las dos partes implicadas en la reproducción, la parte femenina (cerdas nulíparas, cerdas multíparas y su descendencia) y la parte masculina que incluye los verracos.
Se describen los efectos predominantemente directos de AF, OTA, DON, T-2, FB y ZEN, ya que la presentación de efectos indirectos (ej.: incremento de la susceptibilidad a infecciones debido a una reducida inmunidad que podría afectar a la reproducción; los efectos de una reducción de la síntesis proteica o el rechazo del alimento sobre la gestación y el peso de la camada) es más o menos extensa a nivel práctico. Los efectos in vivo e in vitro, así como los aspectos hormonales de la alteración de la reproducción según la literatura también se describen.
 Efectos de las Aflatoxinas sobre la reproducción porcina
Efectos de las Aflatoxinas sobre la reproducción porcina
Las aflatoxinas (AFs) son producidas principalmente por Aspergillus flavus, A. parasiticus y A. nomius, detectándose normalmente en maíz, cacahuetes y semillas de algodón.
Las AFs más comunes son AFB1, AFB2, AFG1 y AFG2.
![]() La AFB1 se considera un hepatocarcinógeno activo y es el más importante en términos de toxicidad en porcino6.
La AFB1 se considera un hepatocarcinógeno activo y es el más importante en términos de toxicidad en porcino6.
⇰ El hígado es el principal órgano diana de la AFB1.
Las AFs, a parte de ser hepatotóxicas, tienen efectos mutagénicos y, posiblemente, teratogenicos en los animales.
Han sido categorizados como carcinógenos humanos de Clase 1 por la Agencia Internacional de Investigaciones sobre el Cáncer (IARC).
Las AFs disminuyen la absorción de nutrientes y reducen la ganancia de peso en los cerdos, mientras que la exposición crónica a dosis bajas resulta en ictericia (apariencia pálida-amarillenta del hígado) con puntos hemorrágicos en el hígado y niveles variables de fibrosis y cirrosis, necrosis centrolobulillar difusa y degeneración grasa7.
Pocos estudios conectan las AFs con la reproducción porcina. El aborto no es de esperar en los casos de toxicosis por AF7.
 Las cerdas son capaces de tener una gestación y reproducción normal cuando son alimentadas con niveles de AF entre 500 y 700 ppb, aunque sus lechones muestran retraso en el crecimiento debido la excreción de AF en leche8,9.
Las cerdas son capaces de tener una gestación y reproducción normal cuando son alimentadas con niveles de AF entre 500 y 700 ppb, aunque sus lechones muestran retraso en el crecimiento debido la excreción de AF en leche8,9. Se ha registrado una reducción en el peso de los lechones al nacimiento tras alimentar a las cerdas con pienso con 800 ppb de AFB1 durante la segunda mitad de la gestación y durante la lactación10.
Se ha registrado una reducción en el peso de los lechones al nacimiento tras alimentar a las cerdas con pienso con 800 ppb de AFB1 durante la segunda mitad de la gestación y durante la lactación10.

Se ha sugerido también que AFB1 puede alterar el desarrollo embrionario temprano (la formación del blastocisto se vio alterada por el tratamiento con 1 nM de AFB1) debido a estrés oxidativo (exceso de especies de oxígeno reactivo), inducción de daños en el ADN, alteración de los mecanismos de reparación del ADN, e inducción de la apoptosis y, consecuentemente, autofagia12.
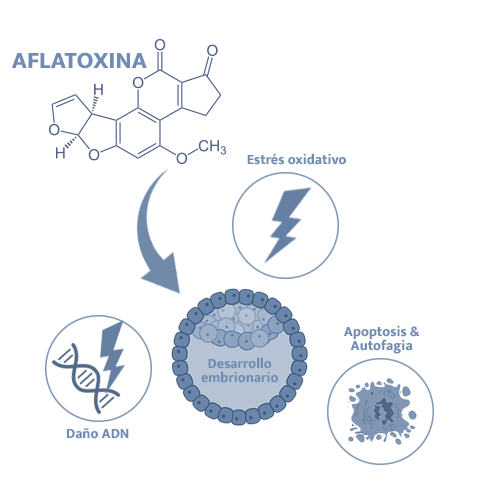
Se han sugerido efectos sobre la eficiencia reproductiva de los verracos13, encontrándose unas bajas concentraciones espermáticas, baja supervivencia de los espermatozoides y una mayor proporción de espermatozoides anormales simultáneamente con elevados niveles de AFB1 en plasma seminal.
 Efectos de la Ocratoxina A sobre la reproducción porcina
Efectos de la Ocratoxina A sobre la reproducción porcina
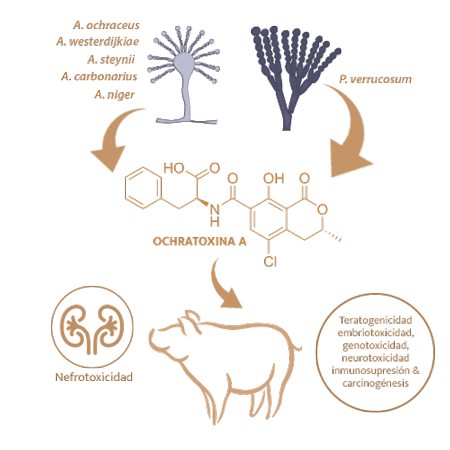
La ocratoxina A (OTA) es producida por varias especies de Aspergillus y Penicillium, como Penicillium verrucosum A. ochraceus, A. westerdijkiae, A. steynii, A. carbonarius y A. niger14.
Su órgano diana primario son los riñones (nefrotoxicidad), aunque puede inducir varios efectos tóxicos como teratogenicidad, embriotoxicidad, genotoxicidad, neurotoxicidad, inmunosupresion y carcinogénesis14,15.
⇰ La OTA ha sido clasificada por la IARC como posible carcinógeno humano (grupo 2B).
En un estudio con verracos (250 kg de peso) que recibieron 0,08 μg/kg de OTA por vía oral durante 6 semanas, se observó una reducción en la viabilidad espermática, motilidad inicial hacia delante y motilidad a las 24 horas de almacenamiento16.
![]() Asimismo, se sugirió que la la OTA (administrada a los verracos en altas concentraciones) podría potencialmente afectar a la producción espermática y la calidad seminal de los verracos al reducir la motilidad inicial y la longevidad de los espermatozoides17.
Asimismo, se sugirió que la la OTA (administrada a los verracos en altas concentraciones) podría potencialmente afectar a la producción espermática y la calidad seminal de los verracos al reducir la motilidad inicial y la longevidad de los espermatozoides17.
![]() Adicionalmente, la OTA afecta negativamente, in vitro, a la maduracion de los ovocitos porcinos (reducida tasa de extrusión del corpúsculo polar de los ovocitos porcinos) con niveles de exposición superiores a 5 μM18.
Adicionalmente, la OTA afecta negativamente, in vitro, a la maduracion de los ovocitos porcinos (reducida tasa de extrusión del corpúsculo polar de los ovocitos porcinos) con niveles de exposición superiores a 5 μM18.
 Efectos de la Fuminosina sobre la reproducción porcina
Efectos de la Fuminosina sobre la reproducción porcina
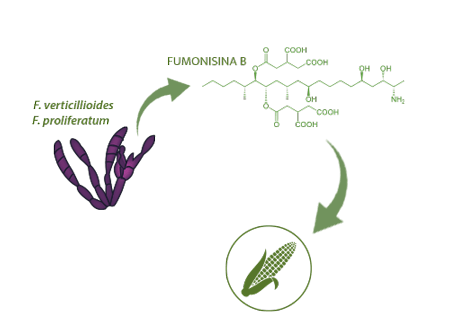
Las fumonisinas B (FBs) son micotoxinas producidas, principalmente, por Fusarium verticillioides y F. proliferatum, habitualmente en maíz.
La predominante FB1 corresponde con el 70% de las FBs y está clasificada como un potencial carcinógeno humano (clase 2B) por la IARC19.
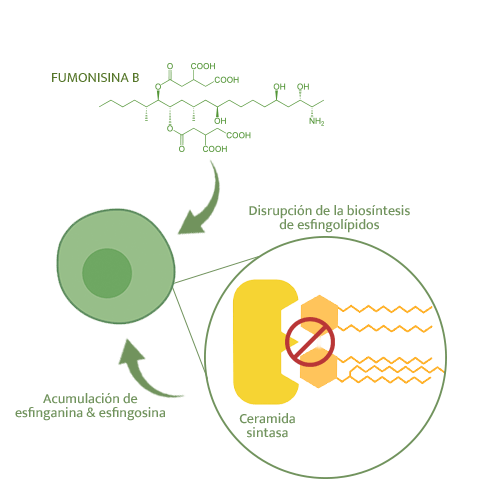
Su principal mecanismo tóxico se basa en la disrupción de la biosíntesis de esfingolípidos, inhibiendo a la ceramida sintasa, lo que resulta en la acumulacion de esfinganina y esfingosina.
La intoxicacion aguda de los cerdos con elevados niveles de FB (>100 ppm) se caracteriza por edema pulmonar7.
Sin embargo, las FBs se han asociado a la alteración de la respuesta inmunitaria [ej.: modificación del equilibrio de citoquinas Th1/Th2 (T-helper 1/T-helper 2)], así como efectos significativos sobre el tracto gastrointestinal.
La FB1 se ha asociado con la induccion de alteraciones de la integridad de la barrera intestinal y de su función/ permeabilidad [ej.: descenso de la resistencia eléctrica transepitelial (TEER), reducción de la expresión de ocludina y E-cadherina en el íleon], así como con la modulación de los procesos digestivos y de absorción (ej.: reducida actividad de la aminopeptidasa en yeyuno) y reducción de la defensa intestinal ante la exposición a patógenos (mayor colonización y excreción de Escherichia coli)7,20.
![]() Con respecto a la reproducción, las FBs también se han relacionado con el retraso en la madurez sexual y alteraciones en la función reproductiva21.
Con respecto a la reproducción, las FBs también se han relacionado con el retraso en la madurez sexual y alteraciones en la función reproductiva21.
⇰ Concretamente, se han propuesto como responsables de la reducción testicular y de las reservas espermáticas del epidídimo y la producción espermática diaria en verracos22,23. Asimismo, se han descrito los efectos negativos sobre la calidad y motilidad espermática 6 meses después de la exposición a las FBs23.
Por otro lado, estudios in vitro demuestran los efectos inhibitorios de la FB1 sobre la proliferación celular de la granulosa24.
 Se observó que la FB1 influye en la capacidad esteroidogénica de las células de la granulosa en porcino (estimulación de la producción de progesterona sin afectar a la producción de estradiol), inhibiendo así su proliferación, lo que podría alterar el crecimiento folicular normal y la supervivencia de los ovocitos en porcino5,24,25.
Se observó que la FB1 influye en la capacidad esteroidogénica de las células de la granulosa en porcino (estimulación de la producción de progesterona sin afectar a la producción de estradiol), inhibiendo así su proliferación, lo que podría alterar el crecimiento folicular normal y la supervivencia de los ovocitos en porcino5,24,25. In vivo, la FB indujo abortos 1-4 días tras la toxicosis aguda espontánea, probablemente, como consecuencia de la anoxia fetal asociada al edema pulmonar severo en la cerda26,27.
In vivo, la FB indujo abortos 1-4 días tras la toxicosis aguda espontánea, probablemente, como consecuencia de la anoxia fetal asociada al edema pulmonar severo en la cerda26,27. La administración de 100 ppm de FB1 a las cerdas durante los últimos 30 días de gestación no condujo a edema pulmonar, abortos o anomalías fetales7.
La administración de 100 ppm de FB1 a las cerdas durante los últimos 30 días de gestación no condujo a edema pulmonar, abortos o anomalías fetales7.
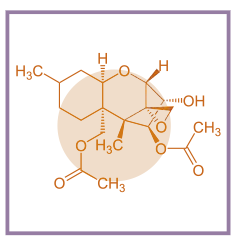 Efectos de los Tricotecenos sobre la reproducción porcina
Efectos de los Tricotecenos sobre la reproducción porcina
Efectos del Deoxinivalenol sobre la reproducción porcina
Todos los tricotecenos son conocidos por sus efectos sobre el rendimiento reproductivo en porcino. El deoxinivalenol (DON) pertenece a la familia de micotoxinas tricotecenos, habiéndose demostrado su capacidad para inhibir significativamente la síntesis proteica.
⇰ Determinadas formas acetiladas y modificadas de la toxina nativa, como 3-acetil-DON (3-Ac-DON), 15-acetil-DON (15-Ac-DON) y DON-3-glucosido [DON3G, principal metabolito vegetal de DON], aparecen simultáneamente en granos25.
La toxicosis por DON se ha asociado a signos gastrointestinales, con disconfort abdominal, diarrea, vómitos, anorexia y reducción
El DON afecta de manera importante la función e integridad de la barrera intestinal, pudiendo modular también la respuesta inmunitaria7,20.
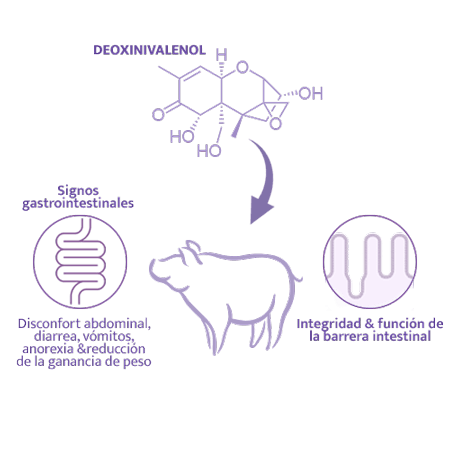
La alteración de la maduración de ovocitos y del desarrollo embrionario, junto con la reducción de la ingesta de alimento, son las principales razones que explican los efectos negativos del DON sobre la reproducción porcina.
⇰ In vivo, la ingestión de pienso contaminado con DON por parte de cerdas jóvenes gestantes podría resultar en una reducción del peso y longitud corporal de los lechones28.
Se ha demostrado que el paso de una cantidad importante de DON a través de la placenta desde las cerdas expuestas a los fetos podría afectar a la función fetal29,30.
Asimismo, se han asociado varios efectos negativos in vivo sobre la fertilidad con el consumo de pienso contaminado simultáneamente con DON y ZEN31.
El DON se ha asociado con determinados efectos reproductivos, principalmente a través de estudios in vitro con ovocitos porcinos.
 Los efectos in vitro del DON incluyen la alteración de la maduración de los ovocitos porcinos como consecuencia de la inducción de anomalías en los husos meióticos y la alteración de la maduración citoplasmática de los ovocitos32,33,34.
Los efectos in vitro del DON incluyen la alteración de la maduración de los ovocitos porcinos como consecuencia de la inducción de anomalías en los husos meióticos y la alteración de la maduración citoplasmática de los ovocitos32,33,34. Además de la alteración de la maduración de los ovocitos inducida por DON, se han presentado hallazgos de autofagia/apoptosis y modificaciones epigenéticas de los ovocitos porcinos35.
Además de la alteración de la maduración de los ovocitos inducida por DON, se han presentado hallazgos de autofagia/apoptosis y modificaciones epigenéticas de los ovocitos porcinos35. Por otro lado, también se ha asociado el DON con efectos dosis-dependientes sobre la proliferación de las células de la granulosa porcinas [efecto bifásico: bajas concentraciones (0,034 mM) de DON resultan en un incremento de la proliferación, mientras que concentraciones superiores (3,4 mM) tienen el efecto contrario], inhibición de la producción de progesterona y estradiol [inducida por FSH y el factor de crecimiento tipo insulina I (IGF-I)] y la abundancia de ARNm de CYP19A1 y CYP11A15,36.
Por otro lado, también se ha asociado el DON con efectos dosis-dependientes sobre la proliferación de las células de la granulosa porcinas [efecto bifásico: bajas concentraciones (0,034 mM) de DON resultan en un incremento de la proliferación, mientras que concentraciones superiores (3,4 mM) tienen el efecto contrario], inhibición de la producción de progesterona y estradiol [inducida por FSH y el factor de crecimiento tipo insulina I (IGF-I)] y la abundancia de ARNm de CYP19A1 y CYP11A15,36. La exposición de explantes ováricos a 10 μM de DON afectó al proceso de maduración folicular, reduciendo la reserva de folículos y, por ende, el número de folículos normales, además de un incremento en el número de ovocitos picnóticos en todas las fases del desarrollo folicular37, mientras que el tratamiento con 1 μM redujo la tasa de extrusión del corpúsculo polar de los ovocitos porcinos18.
La exposición de explantes ováricos a 10 μM de DON afectó al proceso de maduración folicular, reduciendo la reserva de folículos y, por ende, el número de folículos normales, además de un incremento en el número de ovocitos picnóticos en todas las fases del desarrollo folicular37, mientras que el tratamiento con 1 μM redujo la tasa de extrusión del corpúsculo polar de los ovocitos porcinos18.

Efectos de la Toxina T-2 sobre la reproducción porcina
Además del DON, que es el principal representante del grupo de los tricotecenos, según recientes estudios, la toxina T-2 y su forma desacetilada, toxina HT-2, (tricotecenos tipo A) se considera bastante significativo para los cerdos.
Aparecen en los cultivos (ej.: trigo, maíz, cebada), producidas por varias especies de Fusarium, como Fusarium sporotrichioides, F. poae y F. langsethiae, tanto en el campo como durante el almacenamiento.
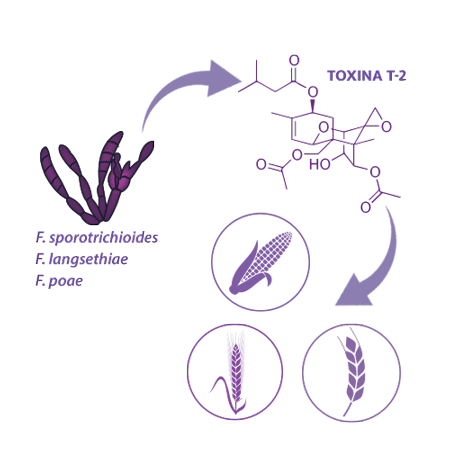
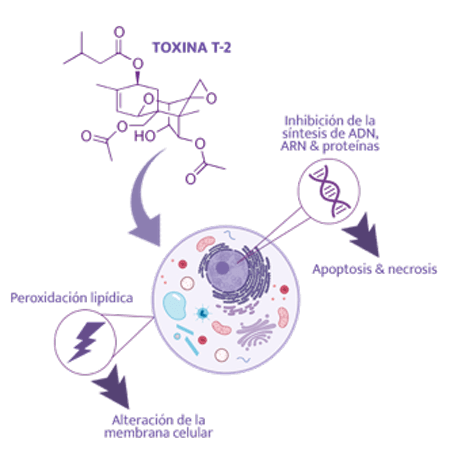
Los cerdos son muy sensibles a sus efectos. La toxina HT-2 es un contaminante natural de los cereales, pero también es el principal metabolito de la toxina T-2, por lo que los efectos de la toxina T-2 pueden atribuirse parcialmente a la toxina HT-2.
En la toxicosis aguda por toxina T-2, se ha observado inflamación serohemorrágica necrótico-ulcerativa del tracto digestivo, vómitos, diarrea, leucopenia (apoptosis de leucocitos), hemorragia, shock y muerte, irritación oral/ dérmica e inmunosupresión.
⇰ Sin embargo, en casos crónicos con ingestión de granos levemente contaminados, se ha observado en los cerdos un retraso en el crecimiento, cese de la ganancia de peso y rechazo del alimento, así como una mayor expresión de genes proinflamatorios38.
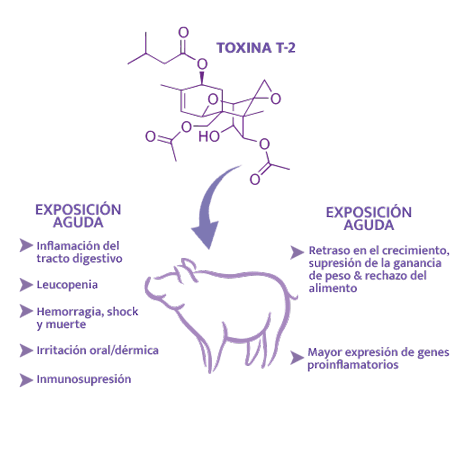
De forma similar al DON, los efectos de los tricotecenos tipo A se han demostrado principalmente a través de estudios in vitro, ya que las alteraciones clínicas reproductivas en cerdos, que podrían atribuirse directamente a sus efectos, no se han presentado.
Según un estudio39, la toxina T-2 podría ser capaz de alterar el crecimiento de la capa de células de la granulosa, afectando también la esteroidogénesis.
 La toxina T-2 demostró tener efectos inhibitorios sobre la producción de esteroides dependiente de IGF-I y FSH en células de la granulosa cultivadas, ya que dosis de 1, 3, 30 y 300 ng/mL inhibieron la producción de estradiol, pero la producción de progesterona se inhibió con dosis de 30 y 300 ng/mL. Se observó un efecto inhibidor sobre el número de células con 3 ng de toxina T-2/mL.
La toxina T-2 demostró tener efectos inhibitorios sobre la producción de esteroides dependiente de IGF-I y FSH en células de la granulosa cultivadas, ya que dosis de 1, 3, 30 y 300 ng/mL inhibieron la producción de estradiol, pero la producción de progesterona se inhibió con dosis de 30 y 300 ng/mL. Se observó un efecto inhibidor sobre el número de células con 3 ng de toxina T-2/mL. También se ha sugerido que el tratamiento de los ovocitos porcinos con 50 nM de toxina HT-2 y concentraciones superiores reducen significativamente la tasa de extrusión del corpúsculo polar18.
También se ha sugerido que el tratamiento de los ovocitos porcinos con 50 nM de toxina HT-2 y concentraciones superiores reducen significativamente la tasa de extrusión del corpúsculo polar18. Los fallos en la maduración de los ovocitos tras el tratamiento con toxina HT-2 también se han sugerido, ya que la toxina inhibió la extrusión del corpúsculo polar de los ovocitos porcinos y la expansión de las células del cúmulo, alterando asimismo la morfología del huso meiótico y la distribución de actina40.
Los fallos en la maduración de los ovocitos tras el tratamiento con toxina HT-2 también se han sugerido, ya que la toxina inhibió la extrusión del corpúsculo polar de los ovocitos porcinos y la expansión de las células del cúmulo, alterando asimismo la morfología del huso meiótico y la distribución de actina40. El estrés oxidativo, la apoptosis y la autofagia fueron otros hallazgos encontrados en los ovocitos tratados en el estudio mencionado.
El estrés oxidativo, la apoptosis y la autofagia fueron otros hallazgos encontrados en los ovocitos tratados en el estudio mencionado.
 Efectos de la Zearalenona sobre la reproducción porcina
Efectos de la Zearalenona sobre la reproducción porcina
La zearalenona (ZEN) es una micotoxina lactona del ácido resorcílico fenólico producida por varias especies de Fusarium, especialmente F. graminearum, y podría sufrir modificaciones en plantas, hongos y animales (prehepático, hepático y extrahepático) debido al metabolismo de fase I y fase II.
⇰ Los principales metabolitos de la ZEN incluyen α-zearalenol, β-zearalenol, α-zearalanol, β-zearalanol, zearalanona (fase I), mientras que las formas conjugadas con glucosa, sulfato y ácido glucurónico son el resultado de la fase II25,41.
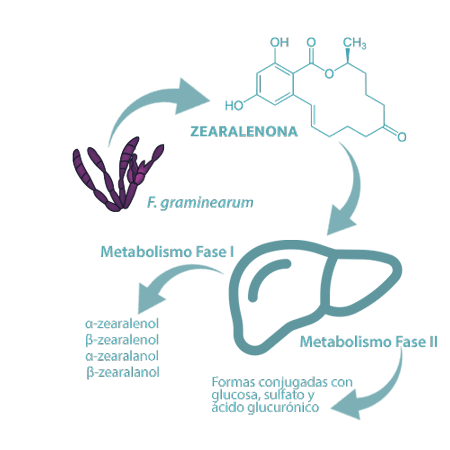
Los cerdos son muy sensibles a la ZEN, ya que la toxina nativa se metaboliza principalmente hacia la producción de α-zearalenol en esta especie, con una mayor potencia estrogénica que ZEN. La toxicosis por ZEN también se ha asociado a un incremento del estrés oxidativo, reducción de la digestibilidad de los nutrientes y retraso en el crecimiento.
⇰ Los efectos tóxicos de la ZEN sobre otros tejidos y sistemas fuera del tracto reproductivo, como el hígado y el sistema inmunitario, también han sido demostrado42,43,44.
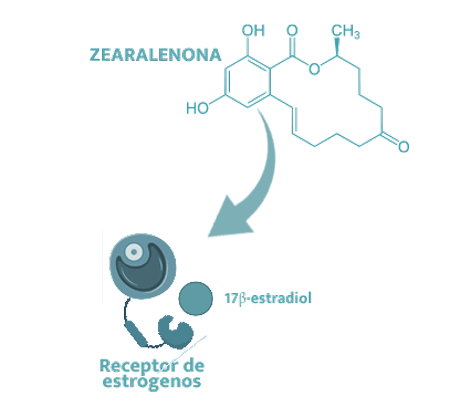
![]() La ZEN se parece tanto al 17β-estradiol que es capaz de unirse a los receptores de estrógeno en varios órganos, induciendo efectos estrogénicos.
La ZEN se parece tanto al 17β-estradiol que es capaz de unirse a los receptores de estrógeno en varios órganos, induciendo efectos estrogénicos.
Sus efectos dependen de la dosis y de la duración de la administración en relación al ciclo estral5. Se considera la micotoxina con mayor impacto sobre la reproducción porcina y parece ser que las cerdas jóvenes son el grupo de edad más sensible a sus efectos.
Durante más de 40 años, los investigadores han demostrado los importantes trastornos reproductivos que aparecen en las cerdas nulíparas y multíparas in vivo tras la ingestión de ZEN (ej.: pseudogestación, reducción de la fertilidad, síndrome de Hiperestrogenismo, reducción del tamaño de las camadas).
Asimismo, los estudios in vitro han demostrado sus efectos negativos sobre la maduración de los ovocitos y la proliferación de las células de la granulosa porcinas7,41.
El paso de ZEN desde las cerdas a los lechones a través de la placenta se ha confirmado, habiéndose detectado ZEN y sus metabolitos en la bilis de los lechones recién nacidos de cerdas alimentadas con pienso contaminado45.
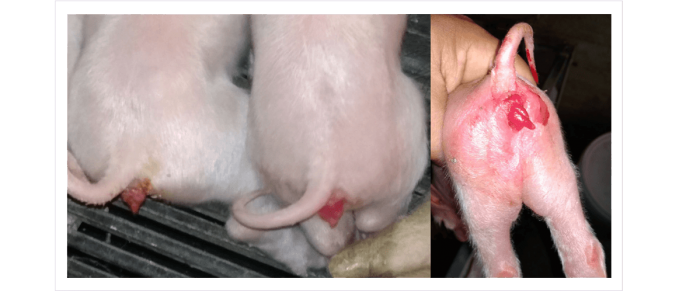
Hiperestrogenismo asociado a ZEN en lechones recién nacidos en granjas porcinas griegas.
En lo que respecta a los efectos de la ZEN sobre la función reproductiva y calidad seminal de los verracos, los resultados in vivo señalan una reducción de los niveles séricos de testosterona, peso testicular y espermatogénesis, habiéndose observado también una feminización y supresión de la libido en verracos jóvenes5. Otros estudios in vitro con semen de verraco muestran toxicidad del ZEN.
Las diversas alteraciones en la calidad y cinética seminal, incluyendo un descenso en la viabilidad espermática y la motilidad progresiva46-48, podrían ser el resultado de la exposición in vitro del semen de verraco a la ZEN.
Adicionalmente, la ZEN y α-zearalenol pueden reducir la capacidad de los espermatozoides de verraco para unirse a la zona pelúcida46, afectando también la integridad de la cromatina espermática48,49.
 CONCLUSIONES
CONCLUSIONES
El diagnóstico de los trastornos reproductivos inducidos por micotoxinas en cerdas y verracos no es una tarea fácil. Tal y como se ha mostrado en esta revisión, la extensión de sus efectos sobre el sistema reproductivo porcino es amplia e incluye una gran variedad de mecanismos directos e indirectos de toxicidad a nivel celular y genómico.
Asimismo, las interacciones in vivo entre las micotoxinas mencionadas y sus efectos finales observados en la eficiencia reproductiva de las cerdas y los verracos no se han dilucidado por completo, y requieren de aclaración.
Hasta ahora, las evidencias indican que la ZEN y α-zearalenol son las micotoxinas con mayor impacto sobre la reproducción porcina y, desde el punto de vista clínico, son probablemente los primeros sospechosos en los casos de reducción de fertilidad en la granja.
⇰ Sin embargo, estos casos suelen incluir la ingestión concomitante de DON con el pienso, debido a la “típica observación” de la contaminación del pienso con varias micotoxinas.

 Desde el punto de vista diagnóstico, la aparición de signos reproductivos asociada a la alteración del pienso en la granja, así como la ausencia del impacto de agentes infecciosos o factores ambientales o de manejo que podrían conducir a trastornos reproductivos, debería tomarse en cuenta a la hora de establecer un diagnóstico diferencial de los casos de ineficiencia reproductiva.
Desde el punto de vista diagnóstico, la aparición de signos reproductivos asociada a la alteración del pienso en la granja, así como la ausencia del impacto de agentes infecciosos o factores ambientales o de manejo que podrían conducir a trastornos reproductivos, debería tomarse en cuenta a la hora de establecer un diagnóstico diferencial de los casos de ineficiencia reproductiva.
⇰ El análisis del pienso es crucial, además de las evidencias de la circulación de micotoxinas/metabolitos en sangre o detectados en tejidos y excreciones.
Desafortunadamente, no existen antídotos frente a las micotoxinas, lo que implica que el control de estos casos requiere la retirada del pienso contaminado o su mezcla con pienso limpio (normalmente con una relación de 1:10), así como la inclusión de agentes que absorban o biotransformen las micotoxinas en metabolitos no tóxicos.
⇰ Asimismo, se debería dar un soporte clínico a los lechones con splay-leg con signos de hiperestrogenismo que no pueden ingerir la cantidad adecuada de calostro/leche.
En la mayoría de los casos, con el tiempo la retirada de las micotoxinas conducirá a una mejora de la fertilidad y parámetros reproductivos mediante los mecanismos de defensa y reparación celular50.
⇰ No obstante, deberá pasar tiempo para poder alcanzar de nuevo las tasas reproductivas de la granja.
El principio es que la prevención de la micotoxicosis debería ser una herramienta básica.
![]() La monitorización regular del pienso (los materiales de enriquecimiento y otras fuentes de fibra pueden contener cantidades significativas de micotoxinas, por lo que también deberían ser analizados) y la inclusión de agentes adecuados que permitan reducir el nivel de micotoxinas disponibles para su absorción a través del tracto gastrointestinal es fundamental51.
La monitorización regular del pienso (los materiales de enriquecimiento y otras fuentes de fibra pueden contener cantidades significativas de micotoxinas, por lo que también deberían ser analizados) y la inclusión de agentes adecuados que permitan reducir el nivel de micotoxinas disponibles para su absorción a través del tracto gastrointestinal es fundamental51.
![]() Un manejo adecuado de las cerdas (ej.: detección adecuada del estro, medidas para contrarrestar el estrés por calor) y el análisis regular de la viabilidad y cinética espermática, junto con la prevención de los agentes infecciosos (ej.: adecuado programa de vacunación de los reproductores), ayudarán a detectar rápidamente las anomalías que podrían asociarse a la micotoxicosis, permitiendo implementar rápidamente el tratamiento y las medidas de prevención.
Un manejo adecuado de las cerdas (ej.: detección adecuada del estro, medidas para contrarrestar el estrés por calor) y el análisis regular de la viabilidad y cinética espermática, junto con la prevención de los agentes infecciosos (ej.: adecuado programa de vacunación de los reproductores), ayudarán a detectar rápidamente las anomalías que podrían asociarse a la micotoxicosis, permitiendo implementar rápidamente el tratamiento y las medidas de prevención.
 REFERENCIAS
REFERENCIAS
1. Streit, E.; Schatzmayr, G.; Tassis, P.; Tzika, E.; Marin, D.; Taranu, I.; Tabuc, C.; Nicolau, A.; Aprodu, I.; Puel, O.; Oswald, I.P. Current Situation of Mycotoxin Contamination and Co-occurrence in Animal Feed—Focus on Europe. Toxins 2012, 4, 788-809.
2. Zain, M.E. Impact of mycotoxins on humans and animals. J Saudi Chem Soc 2011, 15, 129–144.
3. Steyn, P.S. The biosynthesis of mycotoxins. Review de Medecine Veterinaire 1998, 149, 469–478.
4. Doll S., Danicke S. The Fusarium toxins deoxynivalenol (DON) and zearalenone (ZON) in animal feeding. Prevent. Vet. Med. 2011, 102, 132– 145
5. Cortinovis C., Pizzo F., Spicer L.J., Caloni F.. Fusarium mycotoxins: Effects on reproductive function in domestic animals – A review.
Theriogenology 2013, 80, 557–564.
6. Dersjant-Li Y., Verstegen M.W., Gerrits W.J.J. The impact of low concentrations of aflatoxin, deoxynivalenol or fumonisin in diets on growing pigs and poultry. Nutr Res Rev 2003, 16:223–39.
7. Ensley, S.M.; Radke, S.L. Mycotoxins in Grains and Feeds. In Disease of Swine, 11th ed.; Zimmerman, J.J.; Karriker, L.A.; Ramirez, A.; Schwartz, K.J., Stevenson, G.W.; Zhang, J. Eds.; Wiley-Blackwell, Hoboken, NJ, USA, 2019; pp. 1055–1071.
8. Armbrecht B.H., Wiseman H.G., Shalkop W.T. Swine aflatoxicosis. II. The chronic response in brood sows fed sublethal amounts of aflatoxin. Environ Physiol Biochem 1972, 2:77-85.
9. McKnight C.R., Armstrong W.D., Hagler W.M,, Jones E.E.. The effects of aflatoxin on brood sows and the newborn pigs. J Anim Sci 1983, 55(Suppl 1):104.
10. Mocchegiani E., Corradi A., Santarelli L., Tibaldi A., DeAngelis E., Borghetti P., Bonomi A., Fabris N., Cabassi E. Zinc, thymic endocrine activity and mitogen responsiveness (PHA) in piglets exposed to maternal aflatoxicosis B1 and G1. Vet Immunol Immunopathol. 1998, 62(3), 245-260.
11. Liu J., Wang Q.C., Han J., Xiong B., Sun S.C. Aflatoxin B1 is toxic to porcine oocyte maturation. Mutagenesis 2015, 30(4):527-35.
12. Shin K-T., Guo J., Niu Y.-J., Cui X.-S. The toxic effect of aflatoxin B1 on early porcine embryonic development, Theriogenology 2018, 118, 157-163.
13. Picha J, Cerovsky J, Pichova D (1986) Fluctuation in the concentration of sex steroids and aflatoxin B1 in the seminal plasma of boars and its relation to sperm production. Vet Med 1986, 31:347-357.
14. Klarić MS, Rašić D, Peraica M. Deleterious effects of mycotoxin combinations involving ochratoxin A. Toxins 2013, 5(11):1965-87.
15. Yang S, Zhang H, De Saeger S, De Boevre M, Sun F, Zhang S, Cao X., Wang Z. In vitro and in vivo metabolism of ochratoxin A: a comparative study using ultra-performance liquid chromatography-quadrupole/time-of-flight hybrid mass spectrometry. Anal Bioanal Chem 2015, 407(13):3579-89.
16. Biró K., Barna-Vetró I., Pécsi T., Szabó E., Winkler G., Fink-Gremmels J., Solti L. Evaluation of spermatological parameters in ochratoxin A—challenged boars. Theriogenology 2003, 60(2),199-207.
17. Solti L., Pécsi T., Barna-Vetró I., Szász F., Biró K., Szabó E., Analysis of serum and seminal plasma after feeding ochratoxin A with breeding boars. Anim. Reprod. Sci. 1999, 56:2, 123-132.
18. Lu Y, Zhang Y, Liu JQ, Zou P, Jia L, Su YT, Sun YR, Sun SC. Comparison of the toxic effects of different mycotoxins on porcine and mouse oocyte meiosis. Peer J. 2018, 6:e5111.
19. Dilkin P., Direito G., Simas M.M.S., Mallmann C.A., Corrêa B. Toxicokinetics and toxicological effects of single oral dose of fumonisin B1 containing Fusariumverticillioides culture material in weaned piglets. Chemico-Biol. Interact. 2010, 185, 157–160.
20. Grenier B.; Applegate T.J. Modulation of Intestinal Functions Following Mycotoxin Ingestion: Meta-Analysis of Published Experiments in Animals . Toxins 2013, 5, 396-430.
21. EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain), Knutsen H-K, Alexander J, Barreg_ard L, Bignami M, Br€uschweiler B, Ceccatelli S, Cottrill B, Dinovi M., Edler L, Grasl, Kraupp B, Hogstrand C, Hoogenboom LR, Nebbia CS, Petersen A, Rose M, Roudot A-C, Schwerdtle T, Vleminckx C, Vollmer G, Wallace H, Dall’Asta C, Eriksen G-S, Taranu I, Altieri A, Roldan – Torres R., Oswald IP. Scientific opinion on the risks for animal health related to the presence of fumonisins, their modified forms and hidden forms in feed. EFSA Journal 2018, 16(5), 5242, 144 pp.
22. Gbore F.A., Egbunike G.N. Testicular and epididymal sperm reserves and sperm production of pubertal boars fed dietary fumonisin B1.
Anim. Reprod. Sci. 2008, 105, 392–397.
23. Gbore F.A. Reproductive organ weights and semen quality of pubertal boars fed dietary fumonisin B1. Animal 2009, 3, 1133–1137.
24. Cortinovis, C., Caloni F., Schreiber N.B., Spicer L.J. Effects of fumonisin B1 alone and combined with deoxynivalenol or zearalenone on porcine granulosa cell proliferation and steroid production. Theriogenology 2014, 81, 1042–1049.
25. Bertero A., Moretti A., Spicer L. J., Caloni F. Fusarium Molds and Mycotoxins: Potential Species-Specific Effects. Toxins 2018, 10(6), 244.
26. Becker BA, Pace L, Rottinghaus GE, Shelby R, Misfeldt M, Ross PF. Effects of feeding fumonisin B1 in lactating sows and their suckling pigs. Amer J Vet Res 1995, 56:1253–1258
27. Osweiler GD, Ross PF, Wilson TM, Witte PE, Carson TL, Rice LG, Nelson HA (1992) Characterization of an epizootic of pulmonary edema in swine associated with fumonisin in corn screenings. J Vet Diagn Invest 1992, 4:53–59.
28. Friend D.W., Trenholm H.L., Fiser P.S., Thompson B.K., Hartin K.E. Effect on dam performance and fetal development of deoxynivalenol (vomitotoxin) contaminated wheat in the diet of pregnant gilts. Can J Anim Sci 1983, 63:689–98.
29. Goyarts T., Dänicke S., Brüssow K.P., Valenta H., Ueberschär K.H., Tiemann U. On the transfer of the Fusarium toxins deoxynivalenol (DON) and zearalenone (ZON) from sows to their fetuses during days 35–70 of gestation. Toxicol Lett 2007, 171:38–49.
30. Tiemann U, Brüssow KP, Dannenberger D, Jonas L, Pohland R, Jägerd K, et al. The effect of feeding a diet naturally contaminated with deoxynivalenol (DON) and zearalenone (ZON) on the spleen and liver of sow and fetus from day 35 to 70 of gestation. Toxicol Lett 2008, 179:113–7.
31. Dänicke S., Brüssow K.P., Goyarts T., Valenta H., Ueberschär K.H., Tiemann U.. On the transfer of the Fusarium toxins deoxynivalenol (DON) and zearalenone (ZON) from the sow to the full-term piglet during the last third of gestation. Food Chem Toxicol 2007, 45, 1565–74.
32. Alm H., Greising T., Brussow K.P., Torner H., Tiemann U. The influence of the mycotoxins deoxynivalenol and zearalenol on in vitro maturation of pig oocytes and in vitro culture of pig zygotes. Toxicol. In Vitro 2002, 16, 643–8.
33. Malekinejad H., E.J. Schoevers, I.J.J.M. Daemen, C. Zijstra, B. Colenbrander, J. Fink-Gremmels, B.A. Roelen. Exposure of oocytes to the Fusarium toxins zearalenone and deoxynivalenol causes aneuploidy and abnormal embryo development in pigs. Biol. Reprod. 2007, 77, 840–7.
34. Schoevers E.J., Fink-Gremmels J., Colenbrander B., Roelen B.A.. Porcine oocytes are most vulnerable to the mycotoxin deoxynivalenol during formation of the meiotic spindle. Theriogenology 2010, 74, 968–78.
35. Han J., Wang Q.-C., Zhu C.-C., Liu J., Zhang Y., Cui X.-S., Kim N.-H., Sun S.-C. Deoxynivalenol exposure induces autophagy/apoptosis and epigenetic modification changes during porcine oocyte maturation. Toxicol Appl Pharmacol 2016, 300, 70-76.
36. Ranzenigo G., Caloni F., Cremonesi F., Aad P.Y., Spicer L.J.. Effects of Fusarium mycotoxins on steroid production by porcine granulosa cells. Anim. Reprod. Sci. 2008, 107, 115–30.
37. Gerez J.R.; Desto S.S.; Frederico A.P.; Bracarense R.L. Deoxynivalenol induces toxic effects in the ovaries of pigs: An ex vivo approach.
Theriogenology 2017, 90, 94–100.
38. Adhikari M, Negi B, Kaushik N, Adhikari A, Al-Khedhairy AA, Kaushik NK, Choi EH. T-2 mycotoxin: toxicological effects and decontami nation strategies. Oncotarget. 2017, 8(20), 33933-33952.
39. Caloni F., Ranzenigo G., Cremonesi F., Spicer L.J. Effects of a trichothecene, T-2 toxin, on proliferation and steroid production by porcine granulosa cells. Toxicon 2009, 54, 337–344.
40. Zhang G.L., Feng Y.L., Song J.L., Zhou X.S. Zearalenone: A Mycotoxin With Different Toxic Effect in Domestic and Laboratory Animals’ Granulosa Cells. Front Genet. 2018, 9:667.
41. Binder S.B., Schwartz-Zimmermann H.E., Varga E., Bichl G., Michlmayr H., Adam G., Berthiller F.. Metabolism of zearalenone and its major modified forms in pigs. Toxins 2017, 9, 56.
42. Taranu I, Braicu C, Marin DE, Pistol GC, Motiu M, Balacescu L, et al. Exposure to zearalenone mycotoxin alters in vitro porcine intestinal epithelial cells by differential gene expression. Toxicol Lett 2015, 232(1):310-25.
43. Marin DE, Pistol GC, Neagoe I V, Calin L, Taranu I. Effects of zearalenone on oxidative stress and inflammation in weanling piglets.
Food Chem Toxicol 2013, 58, 408–15.
44. EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain), Knutsen H-K, Alexander J, Barregard L, Bignami M, Br€uschweiler B, Ceccatelli S, Cottrill B, Dinovi M, Edler L, Grasl-Kraupp B, Hogstrand C, Hoogenboom LR, Nebbia CS, Petersen A, Rose M, Roudot A-C, Schwerdtle T, Vleminckx C, Vollmer G, Wallace H, Dall’Asta C, D€anicke S, Eriksen G-S, Altieri A, Rold_an-Torres R and Oswald IP, 2017. Scientific opinion on the risks for animal health related to the presence of zearalenone and its modified forms in feed. EFSA Journal 2017;15(7):4851, 123 pp.
45. Schoevers E.J., Santos R.R., Colenbrander B., Fink-Gremmels J., Roelen B.A.J. Transgenerational toxicity of Zearalenone in pigs.
Reprod. Toxicol. 2012, 34(1), 110-119.
46. Tsakmakidis I.A., A.G. Lymberopoulos, C. Alexopoulos, C.M. Boscos, S.C. Kyriakis. In vitro effect of zearalenone and alpha-zearalenol on boar sperm characteristics and acrosome reaction. Reprod Domest Anim 2006, 41, 394–401.
47. Tsakmakidis I.A., A.G. Lymberopoulos, E. Vainas, C.M. Boscos, S.C. Kyriakis, C. Alexopoulos. Study on the in vitro effect of zearalenone and alpha-zearalenol on boar sperm-zona pellucida interaction by hemizona assay application. J. Appl. Toxicol. 2007, 27, 498–505.
48. Benzoni E.; Minervini F.; Giannoccaro A.; Fornelli F.; Vigo D.; Visconti A. Influence of in vitro exposure to mycotoxin zearalenone and its derivatives on swine sperm quality. Reprod Toxicol 2008, 25,461–467.
49. Tsakmakidis I.A., A.G. Lymberopoulos, T.A. Khalifa, C.M. Boscos, A. Saratsi, C. Alexopoulos. Evaluation of zearalenone and alpha zearalenol toxicity on boar sperm DNA integrity. J. Appl. Toxicol. 2008, 28, 681–8.
50. Mostrom M.S. Zearalenone. In: Veterinary Toxicology. Basic and Clinical Principles (2nd ed). Ed.: R.C. Gupta. 2012. Academic Press, San Diego, CA, USA. pp.1266-1271
51. Hennig-Pauka I, Koch FJ, Schaumberger S, Woechtl B, Novak J, Sulyok M, Nagl V. Current challenges in the diagnosis of zearalenone toxicosis as illustrated by a field case of hyperestrogenism in suckling piglets. Porcine Health Manag. 2018, 4:18.
52. Chen X.X., Yang C.W., Huang L.B., Niu Q.S., Jiang S.Z., Chi F. Zearalenone Altered the Serum Hormones, Morphologic and Apoptotic Measurements of Genital Organs in Post-weaning Gilts. Asian-Australas J Anim Sci. 2015, 28(2), 171-9.
53. Dacasto M., Nachtmann C., Ceppa L., Nebbia C. Zearalenone mycotoxicosis in piglets suckling sows fed contaminated grain. Vet. Hum.
Toxicol. 1995, 37, 359–361.
54. Dai M., Jiang S., Yuan X., Yang W., Yang Z., Huang L. Effects of zearalenone-diet on expression of ghrelin and PCNA genes in ovaries of post-weaning piglets. Anim Reprod Sci 2016, 168, 126-137
55. He J., Wei C., Li Y., Liu Y., Wang Y., Pan J., Liu J., Wu Y., Cui S. Zearalenone and alpha-zearalenol inhibit the synthesis and secretion of pig follicle stimulating hormone via the non-classical estrogen membrane receptor GPR30. Moll. Cell. Endocrinol. 2018,Vol 461, 43-54.
56. Kauffold J., Wehrend A. Reproductive disorders in the female pig: Causes, manifestation, diagnostics and approach in herd health care. Tierärztl. Praxis. G, Grosstiere/Nutztiere 2014, 42(3):179–186.
57. Liu XL, Wu RY, Sun XF, Cheng SF, Zhang RQ, Zhang TY, Zhang XF, Zhao Y, Shen W, Li L. Mycotoxin zearalenone exposure impairs genomic stability of swine follicular granulosa cells in vitro. Int J Biol Sci. 2018, 14(3):294-305.
58. Minervini, F.; Dell’Aquila, M.E. Zearalenone and reproductive function in farm animals. Int. J. Mol. Sci. 2008, 9, 2570–2584.
59. Qin X., Cao M., Lai F., Yang F., Ge W., Zhang X., Cheng S., Sun X., Qin G., Shen W., Li L. Oxidative stress induced by zearalenone in porcine granulosa cells and its rescue by curcumin in vitro. PLoS One 2015, 10:e0127551.
60. Teixeira L.C., Montiani-Ferreira F., Locatelli-Dittrich R., Santin E., Alberton G.C. Effects of zearalenone in prepubertal gilts. Pesq. Vet.
Bras. 2011, 31(8), 656-662.
61. Zhou M, Yang L, Yang W, et al. Effects of zearalenone on the localization and expression of the growth hormone receptor gene in the uteri of post-weaning piglets Asian-Australas J Anim Sci 2018, 31(1):32-39.
62. Zhu L. , Yuan H. , Guo C. , Lu Y. , Deng S. , Yang Y. , Wei Q. , Wen L. and He Z. Zearalenone induces apoptosis and necrosis in porcine granulosa cells via a caspase‐3‐ and caspase‐9‐dependent mitochondrial signaling pathway. J. Cell. Physiol. 2012, 227: 1814-1820.




 Prevención de micotoxicosis
Prevención de micotoxicosis