S. Divyashree, B. Shruthi y M.Y. Sreenivasa*
Laboratorio de Micología Aplicada, Departamento de Estudios en Microbiología, Universidad de Mysore, Mysuru-570006, Karnataka, India.
*E-mail del autor correspondiente: [email protected]; [email protected]
Las micotoxinas son metabolitos tóxicos producidos por hongos, que pueden causar enfermedades agudas y crónicas en humanos y animales.
![]() Son moléculas lipofílicas que se absorben principalmente en el intestino y posteriormente se distribuyen a la grasa y otros tejidos blandos, provocando daños renales y hepáticos.
Son moléculas lipofílicas que se absorben principalmente en el intestino y posteriormente se distribuyen a la grasa y otros tejidos blandos, provocando daños renales y hepáticos.
El Centro Internacional de Investigaciones sobre el Cáncer (CIIC) ha clasificado algunas micotoxinas, como las aflatoxinas, las fumonisinas y las ocratoxinas, como carcinógenos del grupo 2B.
Las micotoxinas también contaminan cultivos como cereales, frutos secos, semillas, hortalizas y frutas, causando importantes pérdidas en el sector agrícola.
La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) calcula que el 25 % de los cultivos agrícolas mundiales están afectados por micotoxinas (Eskola et al., 2020).
Con el paso del tiempo, las micotoxinas han recibido una atención considerable, especialmente en las últimas tres décadas y, como resultado, el campo de la micotoxicología está adquiriendo más importancia debido a sus efectos toxicológicos (Sreenivasa et al., 2008 y 2011).
La micotoxicosis es la enfermedad causada por el consumo de micotoxinas por parte de personas y animales a través de alimentos y piensos contaminados con toxinas, que puede provocar inmunodepresión e, incluso, cáncer.
Además, la intoxicación por micotoxinas en el ganado provoca importantes pérdidas económicas en la industria cárnica (Nagaraja, 2016).
Para descontaminar las micotoxinas, se emplean varios métodos de detoxificación, incluyendo estrategias físicas, químicas y biológicas (Deepa & Sreenivasa, 2019).
- ⇰ Los métodos físicos, como el tratamiento térmico y la adsorción, son rápidos, pero pueden afectar a la calidad y el valor nutritivo de los alimentos.
- ⇰ Las técnicas químicas, como la amonificación y la ozonización, son eficaces, pero pueden plantear riesgos para la seguridad alimentaria.
Para hacer frente a estos retos, la detoxificación biológica ha surgido como una alternativa viable, utilizando microorganismos y sus productos. Además, la degradación enzimática representa una estrategia prometedora para la detoxificación selectiva, ofreciendo una solución ecológica, reutilizable y eficaz.
![]() Este método garantiza la seguridad para la salud humana y animal, al tiempo que apoya las prácticas agrícolas sostenibles (Deepa et al., 2017).
Este método garantiza la seguridad para la salud humana y animal, al tiempo que apoya las prácticas agrícolas sostenibles (Deepa et al., 2017).
Micotoxinas y sus propiedades
Las micotoxinas se clasifican en varios grupos en función de:
 Estructura química
Estructura química Actividad biológica
Actividad biológica Hongos responsables de su producción
Hongos responsables de su producción
En la Tabla 1 se muestra un resumen de su clasificación y efectos toxicológicos.

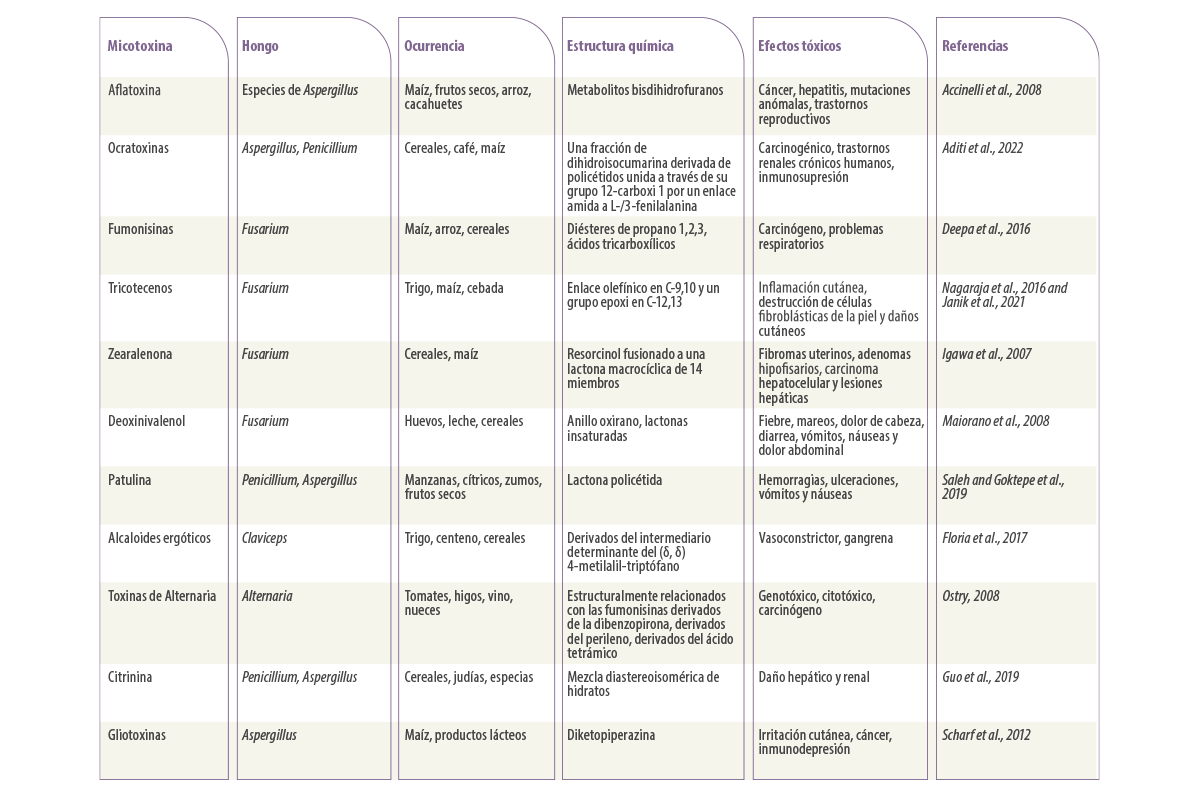
Tabla 1. Algunas de las principales micotoxinas producidas por hongos y sus efectos tóxicos.
Mecanismos de degradación enzimática
Actualmente, las estrategias de degradación biológica han ganado más popularidad que los métodos físicos y químicos.
La degradación biológica de las micotoxinas implica metabolitos activos secretados por microorganismos que alteran la estructura de las micotoxinas, convirtiéndolas en productos menos tóxicos o no tóxicos (Figura 1).
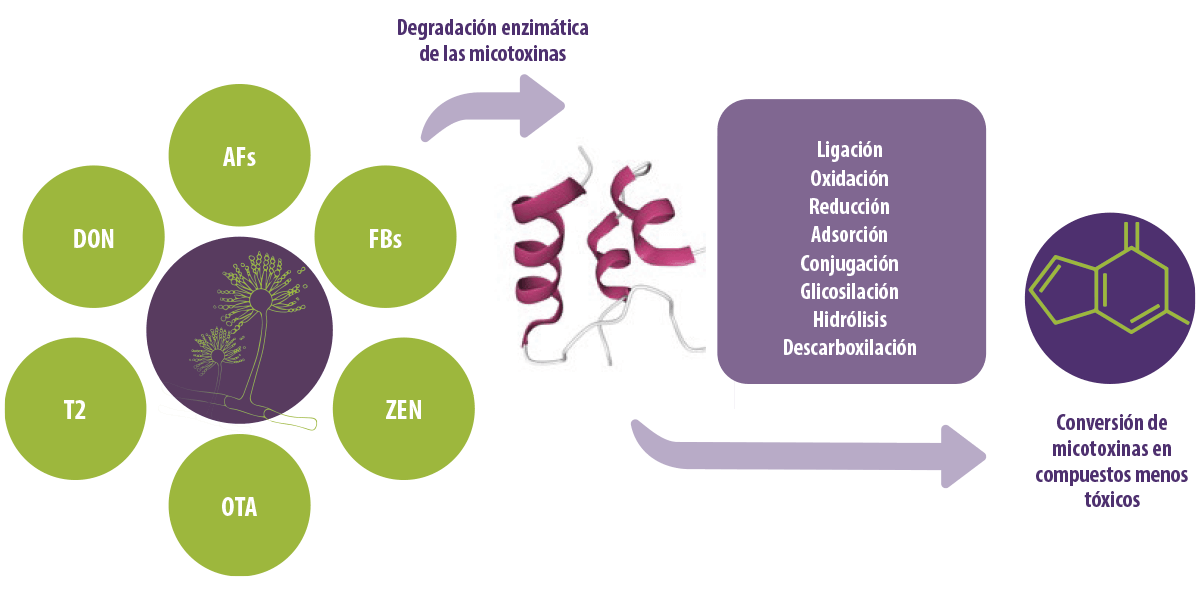
Figura 1. Conversión de micotoxinas en compuestos menos tóxicos mediante enzimas.
La degradación enzimática de las micotoxinas tiene varias ventajas con respecto a la degradación microbiana, como su alta especificidad, eficiencia, rendimiento y facilidad de aplicación (Ji et al., 2016).
![]() Estas enzimas que degradan las micotoxinas proporcionan una gran ventaja con respecto a otros métodos de desintoxicación, ya que garantizan la eliminación segura y eficaz de estas sustancias nocivas.
Estas enzimas que degradan las micotoxinas proporcionan una gran ventaja con respecto a otros métodos de desintoxicación, ya que garantizan la eliminación segura y eficaz de estas sustancias nocivas.

La degradación de las micotoxinas puede producirse de forma extracelular o intracelular (Figura 2).
- ⇰ La degradación extracelular implica la liberación de enzimas o metabolitos por microorganismos que descomponen las micotoxinas fuera de la célula.
- ⇰ La degradación intracelular se produce cuando los microorganismos absorben las micotoxinas y las enzimas del interior de la célula modifican o degradan estos compuestos.
Ambos procesos contribuyen a la detoxificación de las micotoxinas, siendo la degradación extracelular a menudo más rápida y eficiente en algunos casos.
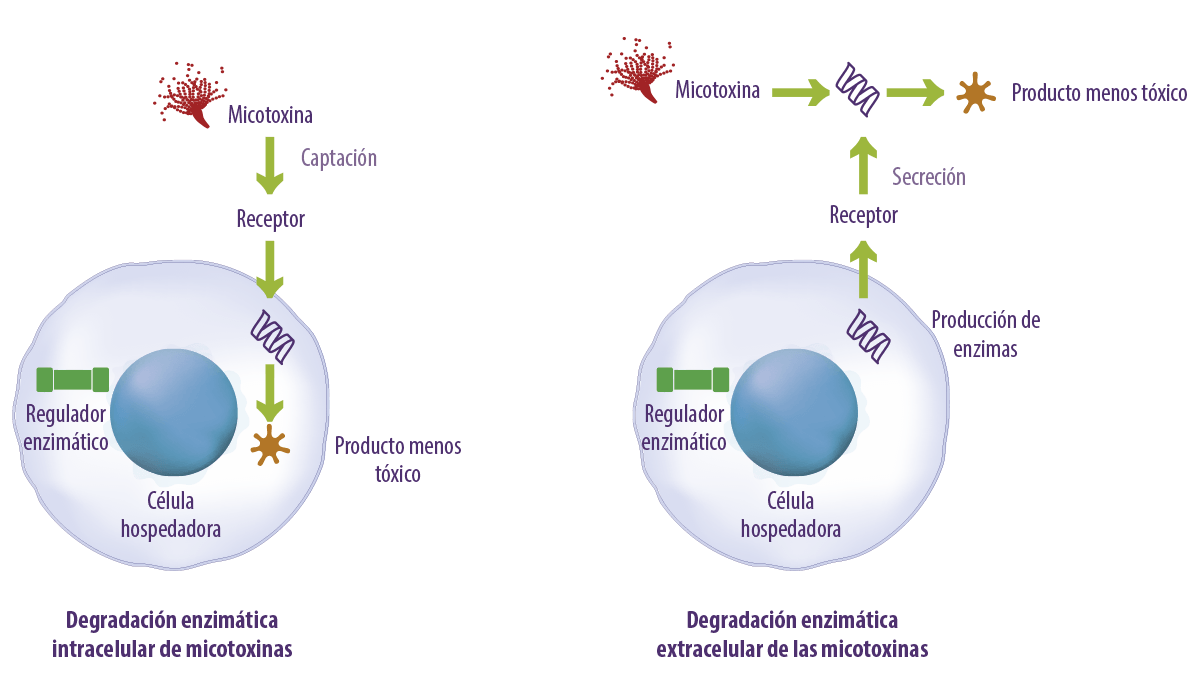
Figura 2. Degradación enzimática intracelular y extracelular de las micotoxinas.
La Tabla 2 recoge una lista de enzimas que degradan las micotoxinas.

Tabla 2. Lista de enzimas que degradan las micotoxinas.
Investigaciones recientes se han centrado en la identificación y desarrollo de estrategias enzimáticas eficaces para la degradación de micotoxinas con el objetivo de mitigar su impacto en la seguridad de alimentos y piensos.
Diversas enzimas de microorganismos y hongos han mostrado resultados prometedores en la descomposición de aflatoxinas en compuestos menos tóxicos, ofreciendo métodos de desintoxicación ecológicos y eficientes.

Degradación de aflatoxinas
Varios estudios notables han demostrado el potencial de la degradación enzimática, destacando diferentes fuentes de enzimas degradadoras de aflatoxinas y sus mecanismos de acción.
 Se desarrolló una estrategia para expresar una enzima degradadora de aflatoxinas del hongo comestible Armillariella tabescens en granos de maíz en desarrollo, controlando eficazmente la contaminación por aflatoxinas en condiciones de cosecha (Schmidt et al., 2021).
Se desarrolló una estrategia para expresar una enzima degradadora de aflatoxinas del hongo comestible Armillariella tabescens en granos de maíz en desarrollo, controlando eficazmente la contaminación por aflatoxinas en condiciones de cosecha (Schmidt et al., 2021).  Las enzimas ligninolíticas de sustrato agotado de hongos (SMS, spent mushroom substrate), un subproducto del cultivo de hongos comestibles, demostraron más del 90 % de degradación de la aflatoxina B1 (AFB1) después de siete días, y la degradación óptima se produjo a pH 8 (Brana et al., 2019).
Las enzimas ligninolíticas de sustrato agotado de hongos (SMS, spent mushroom substrate), un subproducto del cultivo de hongos comestibles, demostraron más del 90 % de degradación de la aflatoxina B1 (AFB1) después de siete días, y la degradación óptima se produjo a pH 8 (Brana et al., 2019).
 La enzima extracelular MADE (Mycobacteria Aflatoxin Degradation Enzyme), aislada a partir de Myxococcus fulvus ANSMO68, ha demostrado una alta eficacia en la degradación de aflatoxinas B1, G1 y M1, logrando una degradación del 72 % de AFB1, 68 % de AFG1 y 64 % de AFM1 después de 48 horas (Zhao et al., 2010).
La enzima extracelular MADE (Mycobacteria Aflatoxin Degradation Enzyme), aislada a partir de Myxococcus fulvus ANSMO68, ha demostrado una alta eficacia en la degradación de aflatoxinas B1, G1 y M1, logrando una degradación del 72 % de AFB1, 68 % de AFG1 y 64 % de AFM1 después de 48 horas (Zhao et al., 2010). La peroxidasa decolorante (Dyp) de Bacillus subtilis SCK6, expresada en E. coli, degradó eficazmente la aflatoxina B1 en presencia de Mn2+ (Qin et al., 2021).
La peroxidasa decolorante (Dyp) de Bacillus subtilis SCK6, expresada en E. coli, degradó eficazmente la aflatoxina B1 en presencia de Mn2+ (Qin et al., 2021).
Degradación de ocratoxinas
Se han estudiado también estrategias enzimáticas para la descomposición de las ocratoxinas, otro grupo de micotoxinas muy preocupantes para la seguridad de alimentos y piensos.
Varios estudios han investigado el potencial de las enzimas fúngicas y vegetales para degradar eficientemente la ocratoxina A (OTA), destacando su aplicación en enfoques de desintoxicación sostenibles.
 Un estudio sobre exoenzimas de la cepa T22 de Trichoderma afroharzianum o su suplementación con peroxidasa, demostró una degradación significativa tanto de la aflatoxina B1 como de la ocratoxina A, proporcionando un método sostenible para detoxificar alimentos y piensos contaminados con micotoxinas (Dini et al., 2022).
Un estudio sobre exoenzimas de la cepa T22 de Trichoderma afroharzianum o su suplementación con peroxidasa, demostró una degradación significativa tanto de la aflatoxina B1 como de la ocratoxina A, proporcionando un método sostenible para detoxificar alimentos y piensos contaminados con micotoxinas (Dini et al., 2022).  Se evaluó la capacidad de la enzima peroxidasa comercial (POD) de Armoracia rusticana para degradar tanto la ocratoxina A (OTA) como la zearalenona (ZEN), logrando una degradación del 27 % y 48 % de OTA y ZEN, respectivamente, en la cerveza después de 6 horas (Garcia et al., 2020).
Se evaluó la capacidad de la enzima peroxidasa comercial (POD) de Armoracia rusticana para degradar tanto la ocratoxina A (OTA) como la zearalenona (ZEN), logrando una degradación del 27 % y 48 % de OTA y ZEN, respectivamente, en la cerveza después de 6 horas (Garcia et al., 2020).
Degradación de zearalenona
Además de las aflatoxinas y las ocratoxinas, la zearalenona (ZEN) es otra micotoxina muy preocupante, sobre todo por sus efectos estrogénicos en el ganado.
Se ha investigado sobre métodos enzimáticos para degradar eficazmente el ZEN, con resultados prometedores tanto de enzimas recombinantes como de origen vegetal.
 Se desarrolló una enzima de fusión recombinante, que combina la zearalenona hidrolasa (ZHD) y la carboxipeptidasa (CP), para lograr una degradación del 100 % del ZEN en 2 horas a pH 7 y 35 °C. En cambio, la CP por sí sola sólo degradó el 60 % del ZEN en 28 horas. La combinación de ZHD-CP y CP también consiguió una degradación del 100 % de la OTA en sólo 30 minutos (Azam et al., 2019).
Se desarrolló una enzima de fusión recombinante, que combina la zearalenona hidrolasa (ZHD) y la carboxipeptidasa (CP), para lograr una degradación del 100 % del ZEN en 2 horas a pH 7 y 35 °C. En cambio, la CP por sí sola sólo degradó el 60 % del ZEN en 28 horas. La combinación de ZHD-CP y CP también consiguió una degradación del 100 % de la OTA en sólo 30 minutos (Azam et al., 2019). Armoracia rusticana mostró una degradación sustancial del ZEN, alcanzando un 64,9% de degradación en una solución modelo después de 6 horas (Garcia et al., 2020).
Armoracia rusticana mostró una degradación sustancial del ZEN, alcanzando un 64,9% de degradación en una solución modelo después de 6 horas (Garcia et al., 2020).

Degradación de fumonisinas
Las fumonisinas son otro grupo de micotoxinas preocupantes, sobre todo por su impacto en la salud animal y su asociación con enfermedades como la leucoencefalomalacia en caballos y el edema pulmonar en cerdos.
Investigaciones recientes han explorado cepas bacterianas y mecanismos enzimáticos capaces de degradar eficazmente las fumonisinas.
 Se utilizó carboxilesterasa recombinante para catalizar la desesterificación de la fumonisina B1 a fumonisina B1 hidrolizada. Cuando se suplementó con 60 U/kg, esta enzima redujo significativamente los niveles de fumonisina B1 en pavos y cerdos (Masching et al., 2016). Esto sugiere que las enzimas recombinantes tienen potencial para desintoxicar piensos y alimentos contaminados con fumonisinas.
Se utilizó carboxilesterasa recombinante para catalizar la desesterificación de la fumonisina B1 a fumonisina B1 hidrolizada. Cuando se suplementó con 60 U/kg, esta enzima redujo significativamente los niveles de fumonisina B1 en pavos y cerdos (Masching et al., 2016). Esto sugiere que las enzimas recombinantes tienen potencial para desintoxicar piensos y alimentos contaminados con fumonisinas. Las carboxilesterasas y las aminotransferasas se han utilizado para degradar sinérgicamente las fumonisinas.
Las carboxilesterasas y las aminotransferasas se han utilizado para degradar sinérgicamente las fumonisinas.
Degradación del deoxinivalenol
El deoxinivalenol (DON), también conocido como vomitoxina, es una micotoxina que suele encontrarse en los cereales y que supone un riesgo importante para la salud animal y la seguridad de los piensos.
Hay estudios recientes que se han centrado en estrategias enzimáticas y microbianas para degradar o detoxificar el DON, convirtiéndolo en compuestos menos tóxicos.
 Una nueva cepa bacteriana, Pelagibacterium halotolerans ANSP101, aislada de agua de mar, transformó con éxito el DON en el menos tóxico 3-cetodeoxinivalenol mediante la oxidación del grupo hidroxilo C3. Esta actividad de degradación del DON se atribuyó a proteínas intracelulares, y la degradación óptima se produjo en cereales y piensos (Zhang et al., 2020).
Una nueva cepa bacteriana, Pelagibacterium halotolerans ANSP101, aislada de agua de mar, transformó con éxito el DON en el menos tóxico 3-cetodeoxinivalenol mediante la oxidación del grupo hidroxilo C3. Esta actividad de degradación del DON se atribuyó a proteínas intracelulares, y la degradación óptima se produjo en cereales y piensos (Zhang et al., 2020).  Se han utilizado eficazmente deshidrogenasas, reductasas, glioxalasas y aciltransferasas para desintoxicar o convertir el DON en intermediarios no tóxicos.
Se han utilizado eficazmente deshidrogenasas, reductasas, glioxalasas y aciltransferasas para desintoxicar o convertir el DON en intermediarios no tóxicos.

CONCLUSIÓN
En conclusión, la contaminación generalizada de alimentos y piensos por micotoxinas ha atraído la atención mundial.
![]() Se han desarrollado diversas estrategias para mitigar este problema, incluidos métodos físicos y químicos, y la detoxificación biológica se perfila como una alternativa segura y eficaz.
Se han desarrollado diversas estrategias para mitigar este problema, incluidos métodos físicos y químicos, y la detoxificación biológica se perfila como una alternativa segura y eficaz.
El uso de microorganismos para la detoxificación de micotoxinas representa un enfoque prometedor para las industrias alimentaria y de piensos, en particular mediante la degradación enzimática.
![]() Este método se valora por su especificidad, eficacia, respeto del medio ambiente y seguridad.
Este método se valora por su especificidad, eficacia, respeto del medio ambiente y seguridad.
Las enzimas específicas desempeñan un papel crucial en la conversión de las micotoxinas tóxicas en compuestos menos nocivos o no tóxicos.

REFERENCIAS
1. Accinelli, C., Abbas, H.K., Vicari, A. and Shier, W.T., 2014. Aflatoxin contamination of corn under different agro-environmental conditions and biocontrol applications. Crop Protection, 63, pp.9-14.
2. Abrunhosa, L., Venâncio, A. and Teixeira, J.A., 2011. Optimization of process parameters for the production of an OTA-hydrolyzing enzyme from Aspergillus niger under solid-state fermentation. Journal of bioscience and bioengineering, 112(4), pp.351-355. https://doi.org/10.1016/j.jbiosc.2011.06.016
3. Azam, M.S., Yu, D., Liu, N. and Wu, A., 2019. Degrading ochratoxin A and zearalenone mycotoxins using a multifunctional recombinant enzyme. Toxins, 11(5), p.301. https://doi.org/10.3390/toxins11050301
4. Adithi G, Rakesh Somashekaraiah, S. Divyashree, B. Shruthi, M Y Sreenivasa 2022. Assessment of probiotic and antifungal activity of Lactiplantibacillus plantarum MYSAGT3 isolated from locally available herbal juice against mycotoxigenic Aspergillus species. Food Bioscience. 102118.
5. Boesch-Saadatmandi, C., Loboda, A., Józkowicz, A., Huebbe, P., Blank, R., Wolffram, S., Dulak, J. and Rimbach, G., 2008. Effect of ochratoxin A on redox-regulated transcription factors, antioxidant enzymes and glutathione-S-transferase in cultured kidney tubulus cells. Food and Chemical Toxicology, 46(8), pp.2665-2671. https://doi.org/10.1016/j.fct.2008.04.023
6. Branà, M.T., Sergio, L., Haidukowski, M., Logrieco, A.F. and Altomare, C., 2020. Degradation of aflatoxin B1 by a sustainable enzymatic extract from spent mushroom substrate of Pleurotus eryngii. Toxins, 12(1), p.49. https://doi.org/10.3390/toxins12010049
7. Deepa N and M Y Sreenivasa. 2017. Fumonisins: A Review on its Global Occurrence, Epidemiology, Toxicity and Detection. Journal of Veterinary Medicine and Research 4(6): 1093.
8. Deepa, N., Nagaraja, H. and Sreenivasa, M.Y., 2016. Prevalence of fumonisin producing Fusarium verticillioides associated with cereals grown in Karnataka (India). Food Science and Human Wellness, 5(3), pp.156-162. https://doi.org/10.1016/j.fshw.2016.07.001
9. Deepa N and M.Y. Sreenivasa. 2019. Biocontrol Strategies for Effective Management of Phytopathogenic Fungi Associated With Cereals, In: Singh JS., Singh DP. (eds) New and Future Developments in Microbial Biotechnology and Bioengineering, Elsevier, pp, 177-189, https://doi.org/10.1016/B978-0-444-64191-5.00013-4
10. de Oliveira Garcia, S., Sibaja, K.V.M., Nogueira, W.V., Feltrin, A.C.P., Pinheiro, D.F.A., Cerqueira, M.B.R., Furlong, E.B. and Garda-Buffon, J., 2020. Peroxidase as a simultaneous degradation agent of ochratoxin A and zearalenone applied to model solution and beer. Food Research International, 131, p.109039.
11. Dini, I., Alborino, V., Lanzuise, S., Lombardi, N., Marra, R., Balestrieri, A., Ritieni, A., Woo, S.L. and Vinale, F., 2022. Trichoderma enzymes for degradation of aflatoxin B1 and ochratoxin A. Molecules, 27(12), p.3959.
12. Eskola, M., Kos, G., Elliott, C.T., Hajšlová, J., Mayar, S. and Krska, R., 2020. Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’of 25%. Critical reviews in food science and nutrition, 60(16), pp.2773-2789. https://doi.org/10.1080/10408398.2019.1658570
13. Fang, J., Sheng, L., Ye, Y., Ji, J., Sun, J., Zhang, Y. and Sun, X., 2023. Recent advances in biosynthesis of mycotoxin-degrading enzymes and their applications in food and feed. Critical Reviews in Food Science and Nutrition, pp.1-17.
14. Guo, W., Zhao, M., Chen, Q., Huang, L., Mao, Y., Xia, N., Teng, J. and Wei, B., 2019. Citrinin produced using strains of Penicillium citrinum from Liupao tea. Food Bioscience, 28, pp.183-191.
15. Heinl, S., Hartinger, D., Thamhesl, M., Vekiru, E., Krska, R., Schatzmayr, G., Moll, W.D. and Grabherr, R., 2010. Degradation of fumonisin B1 by the consecutive action of two bacterial enzymes. Journal of biotechnology, 145(2), pp.120-129.
16. Igawa, T., Takahashi-Ando, N., Ochiai, N., Ohsato, S., Shimizu, T., Kudo, T., Yamaguchi, I. and Kimura, M., 2007. Reduced contamination by the Fusarium mycotoxin zearalenone in maize kernels through genetic modification with a detoxification gene. Applied and Environmental Microbiology, 73(5), pp.1622-1629.
17. Ito, M., Sato, I., Ishizaka, M., Yoshida, S.I., Koitabashi, M., Yoshida, S. and Tsushima, S., 2013. Bacterial cytochrome P450 system catabolizing the Fusarium toxin deoxynivalenol. Applied and environmental microbiology, 79(5), pp.1619-1628.
18. Janik, E., Niemcewicz, M., Podogrocki, M., Ceremuga, M., Stela, M. and Bijak, M., 2021. T-2 toxin—The most toxic trichothecene mycotoxin: Metabolism, toxicity, and decontamination strategies. Molecules, 26(22), p.6868.
19. Ji, C., Fan, Y. and Zhao, L., 2016. Review on biological degradation of mycotoxins. Animal nutrition, 2(3), pp.127-133.
20. Liu, M., Zhang, X., Luan, H., Zhang, Y., Xu, W., Feng, W. and Song, P., 2024. Bioenzymatic detoxification of mycotoxins. Frontiers in microbiology, 15, p.1434987. https://doi.org/10.3389/fmicb.2024.1434987
21. Maiorano, A., Blandino, M., Reyneri, A. and Vanara, F., 2008. Effects of maize residues on the Fusarium spp. infection and deoxynivalenol (DON) contamination of wheat grain. Crop Protection, 27(2), pp.182-188. 007. doi:10.1016/j.cropro.2007.05.004
22. Miedaner, T. and Geiger, H.H., 2015. Biology, genetics, and management of ergot (Claviceps spp.) in rye, sorghum, and pearl millet. Toxins, 7(3), pp.659-678.
23. Nagaraja H., Chennappa G., Poorna Chandra Rao K., Mahadevprasad G., and M Y Sreenivasa. 2016. Diversity of toxic and phytopathogenic Fusarium species occurring on cereals grown in Karnataka state, India. 3Biotech. 6:57
24. Nagaraja H., Chennappa G., Rakesh S, Naik MK, Amaresh YS and M. Y. Sreenivasa. 2016. Antifusarial activity of Azotobacter nigricans against trichothecene-producing Fusarium species associated with cereals. Food Science and Biotechnology. 25(4): 1197-1204. DOI 10.1007/s10068-016-0.
25. Ostry, V., 2008. Alternaria mycotoxins: an overview of chemical characterization, producers, toxicity, analysis and occurrence in foodstuffs. World Mycotoxin Journal, 1(2), pp.175-188.
26. Pereyra, M.G., Martínez, M.P. and Cavaglieri, L.R., 2019. Presence of aiiA homologue genes encoding for N-Acyl homoserine lactone-degrading enzyme in aflatoxin B1 decontaminating Bacillus strains with potential use as feed additives. Food and Chemical Toxicology, 124, pp.316-323. https://doi.org/10.1016/j.fct.2018.12.016
27. Qin, X., Su, X., Tu, T., Zhang, J., Wang, X., Wang, Y., Wang, Y., Bai, Y., Yao, B., Luo, H. and Huang, H., 2021. Enzymatic degradation of multiple major mycotoxins by dye decolorizing peroxidase from Bacillus subtilis. Toxins, 13(6), p.429.
28. Saleh, I. and Goktepe, I., 2019. The characteristics, occurrence, and toxicological effects of patulin. Food and chemical toxicology, 129, pp.301-311.
29. Scharf, D.H., Heinekamp, T., Remme, N., Hortschansky, P., Brakhage, A.A. and Hertweck, C., 2012. Biosynthesis and function of gliotoxin in Aspergillus fumigatus. Applied microbiology and biotechnology, 93, pp.467-472.
30. Schmidt, M.A., Mao, Y., Opoku, J. and Mehl, H.L., 2021. Enzymatic degradation is an effective means to reduce aflatoxin contamination in maize. BMC biotechnology, 21, pp.1-10. https://doi.org/10.1186/s12896-021-00730-6
31. Sreenivasa M.Y., Regina Sharmila Dass, A. P. Charith Raj and G. R. Janardhana. 2011. Mycological evaluation of Maize grains produced in Karnataka (India) for the post harvest fungal contamination. World Applied Sciences Journal, 13(4), 688 – 692.
32. Sreenivasa M Y, Regina Sharmila Dass, A. P. Charith Raj and G. R. Janardhana. 2008. PCR-based detection of genus Fusarium and Fumonisin-producing isolates from freshly harvested Sorghum grains grown in Karnataka, India. Journal of Food Safety, 28: 236-237.
33. Silva, A.C. and Venâncio, A., 2021. Application of laccases for mycotoxin decontamination. World Mycotoxin Journal, 14(1), pp.61-74.
34. Welsch, T. and Humpf, H.U., 2012. HT-2 toxin 4-glucuronide as new T-2 toxin metabolite: enzymatic synthesis, analysis, and species specific formation of T-2 and HT-2 toxin glucuronides by rat, mouse, pig, and human liver microsomes. Journal of Agricultural and Food Chemistry, 60(40), pp.10170-10178. doi.org/10.1021/jf302571y l
35. Zhang, J., Fang, Y., Fu, Y., Jalukar, S., Ma, J., Liu, Y., Guo, Y., Ma, Q., Ji, C. and Zhao, L., 2023. Yeast polysaccharide mitigated oxidative injury in broilers induced by mixed mycotoxins via regulating intestinal mucosal oxidative stress and hepatic metabolic enzymes. Poultry Science, 102(9), p.102862. https://doi.org/10.1016/j.psj.2023.102862
36. Zhang, J., Qin, X., Guo, Y., Zhang, Q., Ma, Q., Ji, C. and Zhao, L., 2020. Enzymatic degradation of deoxynivalenol by a novel bacterium, Pelagibacterium halotolerans ANSP101. Food and Chemical Toxicology, 140, p.111276. https://doi.org/10.1016/j. fct.2020.111276 Get rights and content
37. Zhao, L.H., Guan, S., Gao, X., Ma, Q.G., Lei, Y.P., Bai, X.M. and Ji, C., 2011. Preparation, purification and characteristics of an aflatoxin degradation enzyme from Myxococcus fulvus ANSM068. Journal of Applied Microbiology, 110(1), pp.147-155. https://doi. org/10.1111/j.1365-2672.2010.04867.x



 Prevención de micotoxicosis
Prevención de micotoxicosis