Deepthi B V y M Y Sreenivasa
Departamento de Microbiología, Universidad de Mysore, India.
Email: [email protected]; [email protected]
Las fumonisinas son micotoxinas producidas principalmente por las especies Fusarium verticillioides y Fusarium proliferatum, estando asociadas sobre todo con el maíz y los piensos para avicultura y otros animales de producción (Dass et al., 2008; Sreenivasa et al., 2011; Deepa et al., 2016).
Los cereales y sus subproductos, usados principalmente como ingredientes de los piensos, representan un excelente sustrato para el crecimiento y la reproducción de los hongos, lo que tiene graves consecuencias para la seguridad de los alimentos y los piensos.
En un estudio micológico llevado a cabo por nuestro laboratorio, el 45,37% de las mezclas de alimentos recolectadas en todo Karnataka (India) resultaron estar contaminadas con especies de Fusarium productoras de fumonisinas (Figura 1).
⇰ Además, el estudio reveló una frecuencia de contaminación por Fusarium del 25 % y 64,28 % en los piensos para ganadería y avicultura, respectivamente.
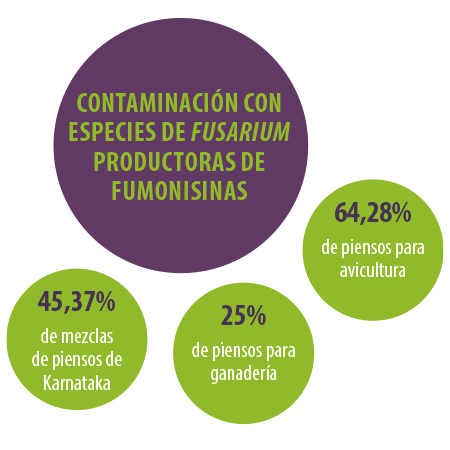
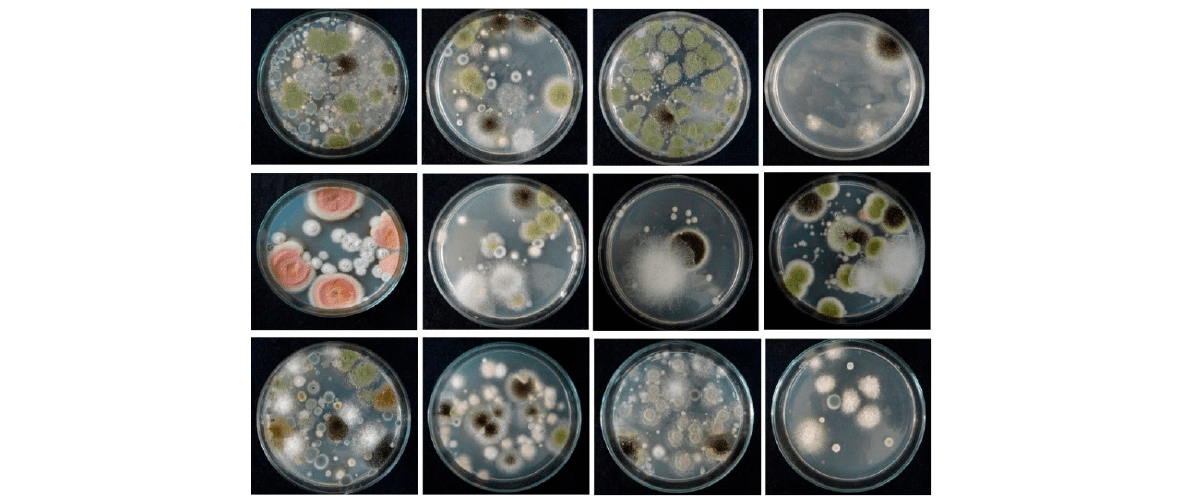
Figura 1. Fusarium y otras especies de hongos micotoxigénicos aislados de mezclas de piensos para ganadería y avicultura.
Por otra parte, otros géneros de hongos como Aspergillus flavus, A. columnaris, A. candidus, A. niger, A. parasiticus, Penicillium, Cladosporium, Rhizopus, Helminthosporium, Mucor, hifas estériles, etc. presentaron una frecuencia del 50% y del 82,1% en los piensos para ganadería y avicultura, respectivamente (Figura 2).
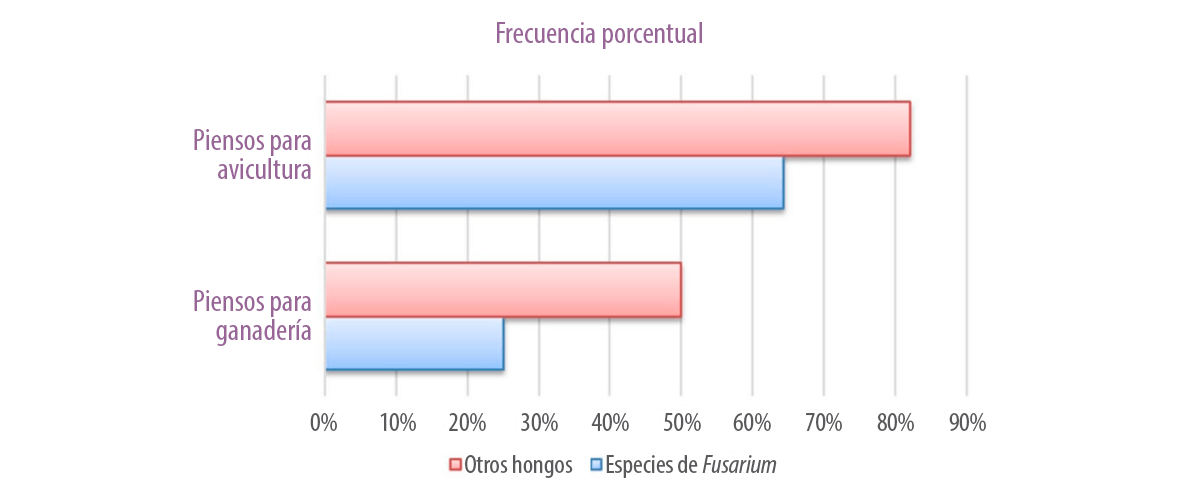
Figura 2. Frecuencia porcentual de los
alimentos para ganadería y avicultura que
muestra la contaminación por Fusarium y
otros hongos.
Las fumonisinas son capaces de inducir efectos tóxicos, tanto agudos como crónicos, en las aves de corral y el ganado. Estos efectos dependen de:
 El tipo de micotoxina
El tipo de micotoxina El nivel y la duración de la exposición
El nivel y la duración de la exposición La especie animal que está expuesta y la edad del animal
La especie animal que está expuesta y la edad del animal
(D’mello et al., 1999)
La toxicidad aguda suele provocar una rápida aparición y una respuesta tóxica evidente, mientras que la toxicidad crónica se caracteriza por una exposición a bajas dosis de toxinas durante un largo período de tiempo, lo que provoca cáncer y otros efectos generalmente irreversibles.
Químicamente, las fumonisinas son metabolitos secundarios tóxicos y cancerígenos que tienen:
- ⇰ Una estructura lineal de 20 carbonos
- ⇰ Un grupo amino en el átomo de carbono 2 (C-2)
- ⇰ Grupos de metilo en C-12 y C-16
- ⇰ Ésteres tricarbálicos en C-14 y C-15
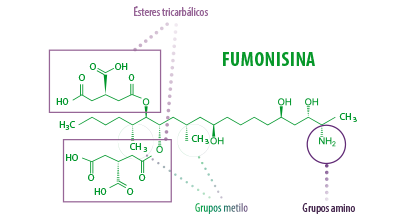
Las fumonisinas se clasifican en cuatro grupos en función de sus diferencias estructurales: A, B, C y P (Musser and Plattner, 1997).
La fumonisina más abundante y tóxica es la fumonisina B1 (FB1):
⇰ Toxicidad: la FB1 es un carcinógeno del Grupo 2B (posiblemente cancerígeno para los humanos) (IARC, 2002). Se ha asociado con efectos hepatotóxicos, neurotóxicos, nefrotóxicos e inmunosupresores en animales y en humanos.
⇰ Absorción: la FB1 se absorbe mal a través del tracto gastrointestinal y se retiene extensamente sin metabolizar en tejidos como el hígado y los riñones.
⇰ Excreción: la FB1 es eliminado en la bilis a través de una cierta recirculación enterohepática mientras ejerce su toxicidad. La toxina también puede terminar en las heces y como trazas de contaminantes en la orina.
Mecanismo de acción de la fumonisin B1
Los aspectos moleculares de la toxicidad inducida por FB1 no se conocen con exactitud y se ha deducido que sus mecanismos celulares tóxicos posteriores son complejos, afectando a muchas dianas moleculares.
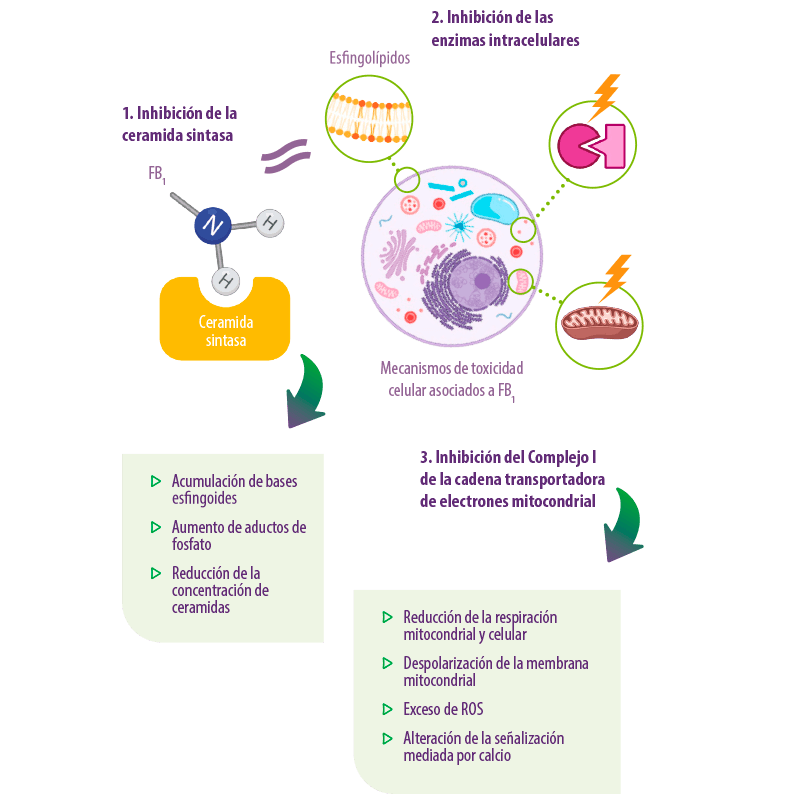
1. Los estudios han atribuido la toxicidad inducida por el FB1 a la similitud estructural entre las fumonisinas y las bases esfingoides (esfinganina y esfingosina) de la capa de esfingolípidos de la membrana celular.
La FB1 tiene un grupo amino primario en el C-2 que inhibe competitivamente a la ceramida sintasa, lo que da lugar a la alteración de la biosíntesis de novo de las ceramidas y, por tanto, la desregulación de la formación del complejo esfingolipídico (Merrill et al., 2001; Riley et al. 2001; Enongene et al. 2002; Riley and Voss, 2006).
⇰ Ello conduce a la acumulación intracelular de bases esfingoides, al aumento de los aductos de fosfato y a la reducción de la concentración de ceramidas, lo que resulta en efectos inhibidores del crecimiento, citotoxicidad, apoptosis, proliferación celular, carcinogenicidad, daños en el ADN (Riley et al., 2001; Voss et al., 2007), alteración de la señalización cAMP y de la proteína quinasa C (Ramljak et al., 2000), alteration of signalling by cAMP and protein kinase C (Huang et al., 1995), y estrés oxidativo (Poersch et al., 2014; Abdellatef and Khalil, 2016; Deepthi et al., 2017).
2. También se ha señalado que la FB1 inhibe otras enzimas intracelulares como las fosfatasas proteicas y la arginosuccinato sintetasa (Jenkins et al., 2000).
3. Además, Domijan and Abramov (2011) demostraron que la FB1 inhibe el Complejo I de la cadena transportadora de electrones mitocondrial de transporte en los cultivos celulares de astrocitos primarios de rata y neuroblastoma humano (SH-SY5Y).
⇰ Esto conduce a una reducción de la tasa de respiración mitocondrial y celular, a la despolarización de la membrana mitocondrial, a la sobreproducción de especies reactivas de oxígeno (ROS) en las mitocondrias y a la alteración de la señalización mediada por calcio.

Efectos tóxicos de la fumonisina B1
La intoxicación por fumonisina B1 es evidente en diferentes animales domésticos y de laboratorio, habiéndose descrito también diferencias en la sensibilidad y los síntomas clínicos (Figura 3).

Figura 3. Efectos tóxicos de la FB1 en aves de corral y ganado.
 El primer síndrome atribuido a la fumonisina B1 fue la LEME, leucoencefalomalacia equina, en la década de los 80, caracterizada por lesiones necróticas letales en el cerebro de los caballos (Marasas et al., 1988).
El primer síndrome atribuido a la fumonisina B1 fue la LEME, leucoencefalomalacia equina, en la década de los 80, caracterizada por lesiones necróticas letales en el cerebro de los caballos (Marasas et al., 1988).
⇰ La fumonisina B1 indujo disfunción cardiovascular en caballos con disminución de la frecuencia cardíaca, menor gasto cardíaco y contractibilidad del ventrículo derecho, lo que podría estar implicado en la patogénesis de las lesiones del sistema nervioso central (Smith et al., 2002).
 La toxicosis por FB1 en cerdos se definió por la presentación de síntomas pulmonares, cardiovasculares y hepáticos. Los animales afectados se volvían anoréxicos, mostrando signos de encefalopatía, pérdida de peso corporal e hiperplasia nodular hepática.erebro de los caballos.
La toxicosis por FB1 en cerdos se definió por la presentación de síntomas pulmonares, cardiovasculares y hepáticos. Los animales afectados se volvían anoréxicos, mostrando signos de encefalopatía, pérdida de peso corporal e hiperplasia nodular hepática.erebro de los caballos.
⇰ Los síntomas en los cerdos se han denominado Edema Pulmonar Porcino (EPP) y “enfermedad porcina misteriosa” (Hollinger and Ekperigin, 1999).
 Durante mucho tiempo, se ha considerado que las aves de corral son menos susceptibles a las fumonisinas, probablemente debido a la falta de fuertes síntomas clínicos incluso con altos niveles de exposición.
Durante mucho tiempo, se ha considerado que las aves de corral son menos susceptibles a las fumonisinas, probablemente debido a la falta de fuertes síntomas clínicos incluso con altos niveles de exposición.
⇰ Las características clínicas de la enfermedad incluyen diarrea, pérdida de peso, aumento del peso del hígado y mal rendimiento.
 Estudios recientes se han centrado en los efectos subclínicos de las fumonisinas y revelan que el tracto intestinal de las aves es muy sensible a la exposición a las fumonisinas.
Estudios recientes se han centrado en los efectos subclínicos de las fumonisinas y revelan que el tracto intestinal de las aves es muy sensible a la exposición a las fumonisinas.
⇰ Dombrink-Kurtzman et al., (1992, 1993) demostraron que las FB1 y FB2 producen efectos citotóxicos en los linfocitos del pavo, y modifican morfológicamente los macrófagos peritoneales, disminuyendo su viabilidad y potencial fagocitario.
⇰ Se ha demostrado que la exposición crónica a fumonisinas en aves de corral tiene efectos adversos en el sistema inmunitario, aumentando su susceptibilidad a los patógenos y disminuyendo su respuesta vacunal (Voss et al., 2007).
⇰ Además, la ingestión de fumonisinas afecta a la expresión de proteínas relacionadas con las respuestas pro- y antiinflamatorias en el tracto intestinal de los broilers (Grenier and Applegate., 2013).

 Las ratas y ratones se han utilizado ampliamente durante décadas como organismo modelo para estudiar la micotoxicosis humana, especialmente en lo que respecta al potencial cancerígeno de las micotoxinas.
Las ratas y ratones se han utilizado ampliamente durante décadas como organismo modelo para estudiar la micotoxicosis humana, especialmente en lo que respecta al potencial cancerígeno de las micotoxinas.
⇰ Pozzi et al., (2000) observaron apoptosis en células hepáticas, estudiando los efectos de la administración oral prolongada de fumonisina B1 y aflatoxina B1 en ratas.
⇰ Theumer et al., (2002) detectaron alteraciones inmunobiológicas producidas por la ingestión de FB1 en un modelo de micotoxicosis subcrónica experimental en ratas.
 Se sabe que el ganado vacuno, las ovejas y las cabras son menos sensibles a las fumonisinas. Sin embargo, se puede observar un impacto negativo en la producción de leche/lana, la reproducción y el crecimiento, cuando los animales están expuestos a FB1 durante períodos de tiempo más largos.
Se sabe que el ganado vacuno, las ovejas y las cabras son menos sensibles a las fumonisinas. Sin embargo, se puede observar un impacto negativo en la producción de leche/lana, la reproducción y el crecimiento, cuando los animales están expuestos a FB1 durante períodos de tiempo más largos.
⇰ Un estudio in vitro realizado por Bernabucci et al. (2011) mostró un aumento de la producción de malondialdehido (MDA) en las células mononucleares de sangre periférica de bovinos tratados con 35 y 70 μg/mL de FB1.
 Un estudio de Goel et al., (1994) mostró un aumento de las proporciones de Sa:So en suero, hígado, riñón y músculo de bagres alimentados con ≥10 mg FB1/kg de alimento tras 12 semanas de tratamiento.
Un estudio de Goel et al., (1994) mostró un aumento de las proporciones de Sa:So en suero, hígado, riñón y músculo de bagres alimentados con ≥10 mg FB1/kg de alimento tras 12 semanas de tratamiento.
 Orsi et al. (2009) y Gbore et al. (2010) informaron de un aumento de enzimas séricas, urea y creatinina en conejos a los que se administraron dosis orales de FB1.
Orsi et al. (2009) y Gbore et al. (2010) informaron de un aumento de enzimas séricas, urea y creatinina en conejos a los que se administraron dosis orales de FB1.
 Se han descrito la incidencia epidemiológica de cáncer de esófago en seres humanos debido al consumo de alimentos contaminados con fumonisinas en diversas partes del mundo, como Sudáfrica, América Central, Asia (Rheeder et al., 1992; Chelule et al., 2001; Marasas et al., 2004) y en la población negra de Charleston (Carolina del Sur) (Sydenham et al., 1991).
Se han descrito la incidencia epidemiológica de cáncer de esófago en seres humanos debido al consumo de alimentos contaminados con fumonisinas en diversas partes del mundo, como Sudáfrica, América Central, Asia (Rheeder et al., 1992; Chelule et al., 2001; Marasas et al., 2004) y en la población negra de Charleston (Carolina del Sur) (Sydenham et al., 1991).
⇰ También se documentaron observaciones similares en China (Yoshizawa et al., 1994; Abnet et al., 2001), Italia (Franceschi et al., 1990), y Brasil (Van der Westhuizen et al., 2003).
También se informó de un brote de una enfermedad relacionada con la FB1 debido al consumo de sorgo y maíz contaminados con altos niveles de fumonisinas en la India, caracterizado por la aparición aguda de dolor abdominal y diarrea (Bhat and Krishnamachari, 1977).
El consumo de maíz contaminado con FB1 también se ha asociado con defectos del tubo neural (debido a la reducción de la absorción de ácido fólico a través del receptor de folato) en los lactantes humanos de la población rural de Sudáfrica y China septentrional (Marasas et al., 2004).
Factores de estrés ambiental relacionados con la aparición de micotoxinas
 La dificultad crítica para evaluar el riesgo de diferentes micotoxinas para la salud animal y humana estriba en los múltiples factores que afectan a la colonización fúngica y la producción de micotoxinas en los alimentos o los piensos.
La dificultad crítica para evaluar el riesgo de diferentes micotoxinas para la salud animal y humana estriba en los múltiples factores que afectan a la colonización fúngica y la producción de micotoxinas en los alimentos o los piensos.Las condiciones ambientales (factores físicos) suelen propiciar el rápido deterioro de los alimentos por los hongos y la producción de micotoxinas nocivas, lo que da lugar a una importante disminución de la calidad de los alimentos.
Los factores abióticos o las condiciones de estrés determinan el alcance de la colonización fúngica y la biosíntesis de las micotoxinas en los cultivos, los alimentos y los piensos. Entre ellos se incluyen:
- ⇰ Humedad relativa
- ⇰ Fluctuaciones de temperatura (calor, frío, enfriamiento, congelación)
- ⇰ Salinidad
- ⇰ Sequía
- ⇰ Nutrientes
- ⇰ Intensidad luminosa
- ⇰ Ozono
- ⇰ pH
- ⇰ Estrés anaeróbico
(Wang et al., 2003; Mitchell et al., 2004; Agarwal and Grover, 2006; Hirel et al., 2007; Cavanagh et al., 2008; Munns and Tester, 2008; Chinnusamy and Zhu, 2009; Marin et al., 2010b; Mittler and Blumwald, 2010; Faneli et al., 2012)
 Las condiciones óptimas para el crecimiento de hongos no son necesariamente las óptimas para la producción de toxinas.
Las condiciones óptimas para el crecimiento de hongos no son necesariamente las óptimas para la producción de toxinas.
En condiciones naturales, la combinación de dos o más factores como la sequía y la salinidad, la humedad relativa y la temperatura, el calor y la salinidad, la temperatura extrema y la alta intensidad luminosa, etc., puede tener repercusiones en la proliferación fúngica.
⇰ Estos factores ambientales influyen en el crecimiento de los hongos, el metabolismo y la biosíntesis de las micotoxinas, y son esenciales para comprender el proceso general y evitar la producción de micotoxinas y el deterioro de los alimentos o los piensos.

Gestión de la contaminación por fumonisinas
Los efectos negativos del consumo de alimentos o piensos contaminados con micotoxinas han recibido mucha atención en el ámbito público y científico en los últimos años.
⇰ Esto ha generado un interés hasta ahora sin precedentes hacia el desarrollo de nuevos procedimientos de detoxificación.
Las Buenas Prácticas Agrícolas (BPA) y las Buenas Prácticas de Fabricación (BPF) son métodos viables para reducir al mínimo la aparición de micotoxinas en las condiciones de los campos.
Sin embargo, aún persiste una gran brecha a nivel mundial en lo que respecta a la aplicación de estas prácticas.
Además, la contaminación por micotoxinas puede prevenirse parcialmente mediante la adaptación de metodologías adecuadas de procesamiento e instalaciones de almacenamiento de cereales, granos, alimentos y piensos.
La eliminación segura de las fumonisinas de los piensos es fundamental, ya que el sector avícola y ganadero experimenta las consecuencias de problemas de salud y grandes pérdidas económicas asociadas a las fumonisinas.
 Sin embargo, la detoxificación de la toxinas no puede lograrse plenamente, ya que su producción está modulada por factores ambientales.
Sin embargo, la detoxificación de la toxinas no puede lograrse plenamente, ya que su producción está modulada por factores ambientales.
Se ha demostrado que la mayoría de las estrategias físicas y químicas seguidas para reducir la contaminación por micotoxinas son bastante ineficaces o difíciles de implementar en el proceso de producción (Pearson et al., 2004). Además, la resistencia fúngica a los tratamientos químicos se ha generalizado en la actualidad (Davidson, 2001).
El método de detoxificación más utilizado en la industria avícola y ganadera es el uso de adsorbentes de micotoxinas (agentes secuestrantes) en los piensos, pero suelen ser adsorbentes de aflatoxinas y tienen mucha menos afinidad por las fumonisinas u otras micotoxinas.
 Por lo tanto, un método de control biológico sería una alternativa eficiente para el manejo de las fumonisinas (Figura 4).
Por lo tanto, un método de control biológico sería una alternativa eficiente para el manejo de las fumonisinas (Figura 4).
Figura 4. Estrategias de manejo de micotoxinas en las industrias avícola y ganadera.
Se ha demostrado que muchas especies bacterianas y fúngicas como Flavobacterium aurantiacum, Corynebacterium rubrum, Candida lipolitica, Aspergillus niger, Trichoderma viride, Armillariella tabescens, especies de Nuerospora species, especies de Rhizopus, especies de Mucor, etc., degradan enzimáticamente las micotoxinas (Bata and Lasztity, 1999; Ciegler et al., 1966).
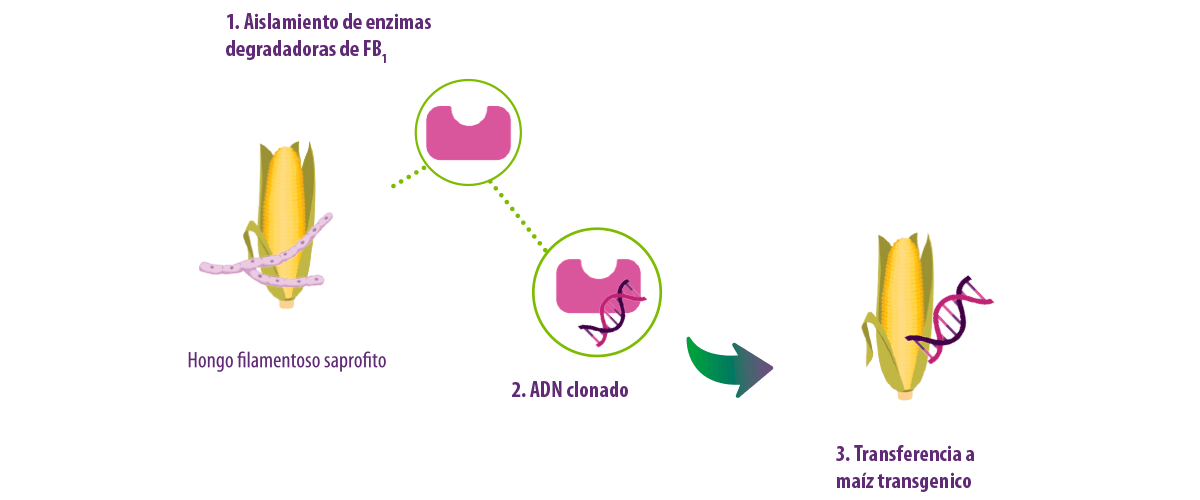
Se han aislado enzimas capaces de degradar las fumonisinas de un hongo saprofito filamentoso que crece en el maíz y los genes correspondientes se han clonado y transferido en el maíz transgénico (Blackwell et al., 1999).
Entre los agentes de biocontrol, las bacterias probióticas ácido-lácticas (BAL) representan una aplicación potente e interesante, ya que se utilizan ampliamente en los productos alimenticios fermentados y en los piensos para prolongar su vida útil.
Además, las bacterias ácido-lácticas son organismos GRAS “Generalmente Considerados Seguros” (USFDA, 2017) que tienen una gran versatilidad metabólica y capacidad para producir una amplia gama de productos finales metabólicos.
Los posibles mecanismos involucrados en la efectividad antimicótica de las BAL incluyen:

La inhibición de la producción de micotoxinas por parte de las BAL se debe a la competencia microbiana, el agotamiento de los nutrientes, el bajo pH y la producción de metabolitos secundarios de bajo peso molecular estables al calor (Batish et al., 1997; Gourama and Bullerman, 1997; Laitila et al., 2002).
⇰ El mecanismo por el cual las BAL detoxifican las micotoxinas aún está por dilucidar. Sin embargo, varios informes sugieren la naturaleza adsorbente de las BAL a las micotoxinas.
⇰ Los lactobacilos también producen metabolitos antimicóticos como ácidos orgánicos, peróxido de hidrógeno, compuestos proteínicos, ácidos grasos hidroxílicos y compuestos fenólicos, lo que ofrece valiosas oportunidades para la conservación de los alimentos, así como para la elaboración de suplementos alimentarios o para la medicina veterinaria (Magnusson et al., 2003; Kecerova et al., 2004; Gerez et al., 2009; Bilkova et al., 2011; Cortes- Zavaleta et al., 2014; Deepthi et al., 2016).
⇰ Sustancias similares a las bacteriocinas y otros compuestos de peso molecular bajo y medio producidos por el Lactobacillus también han demostrado tener propiedades antimicóticas (Rouse et al., 2008; Kos et al., 2011; Al Kassaa et al., 2014).
La mayoría de los estudios sobre micotoxinas están orientados a las aflatoxinas, prestándose menos atención a la contaminación por fumonisina B1 en los alimentos/ piensos y su toxicidad en los seres humanos/animales.
Tener una clara comprensión de la interferencia de las fumonisinas en los organismos vivos, seguida del desarrollo de trastornos crónicos, es de inmenso valor.
Además, la exploración de las BAL probióticas como potentes agentes antimicóticos y como herramienta para la biodegradación de las fumonisinas, protegerá a los alimentos/piensos de la infestación de hongos.
Estas especies probióticas también actúan como bioconservantes de alimentos/piensos y también tienen efectos aditivos en la salud, el rendimiento y la producción.
⇰ Posteriormente, esto conduce a un aumento de la producción de alimentos/piensos, así como a una mejora de la calidad de los alimentos/piensos y de las condiciones comerciales/económicas de los países.

 REFERENCIAS
REFERENCIAS
Abdellatef, A.A., Khalil, A.A., 2016. Ameliorated effects of Lactobacillus delbrueckii subsp lactis DSM 20076 and Pediococcus acidilactici NNRL B-5627 on Fumonisin B1-induced Hepatotoxicity and Nephrotoxicity in rats. Asian J. Pharm. Sci. 11, 326–336.
Abnet, C.C., Borkowf, C.B., Qiao, Y-L., Albert, P.S., Wang, E., Merrill, Jr A.H., Mark, S.D., Dong, Z-W., Taylor, P.R., Dawsey, S.M., 2001. Sphingolipids as biomarkers of fumonisin exposure and risk of esophageal squamous cell carcinoma in China. Cancer Causes & Control. 12(9), 821-828.
Agarwal, S., Grover, A., 2006. Molecular biology, biotechnology and genomics of flooding-associated low O2 stress response in plants. Crit. Rev. Plant Sci. 25, 1-21.
AlKassaa, I., Hamze, M., Hober, D., Chihib, N.E., Drider, D., 2014. Identification of vaginal lactobacilli with potential probiotic properties isolated from women in North Lebanon. Microb. Ecol. 67, 722–734.
Bata, A., Lasztity, R., 1999. Detoxification of mycotoxin contaminated food and feed by microorganisms. Trends Food Sci. Tech. 10, 223–228.
Batish,V.K., Roy,U., Lal,R., Grower, S., 1997. Antifungal attributes oflacticacidbacteria-areview. Crit. Rev. Biotechnol. 17, 209–225.
Bernabucci, U., Colavecchia, L., Danjeli, P.P., Basirico, L., Lacetera, N., Nardone, A., Ronchi, B., 2011. Aflatoxin B1 and fumonisin B1 affect the oxidative status of bovine peripheral blood mononuclear cells. Toxicologu in Vitro. 25(3), 684-691.
Bhat, R.V, Krishnamachari, K.A.V.R., 1977. Follow-up study of aflatoxic hepatitis in parts of western India. Indian J. Med. Res. 66, 55–58.
Bilkova, A., Sepova, H.K., Bukovsky, M., Bezakova, L., 2011. Antibacterial potential of lactobacilli isolated from a lamb. Vet. Med. 56, 319–324.
Blackwell, B.A., Gilliam, J.T., Savard, M.E., David Miller, J., Duvick, J.P., 1999. Oxidative deamination of hydrolyzed fumonisin B1 (AP1) by cultures of Exophiala spinifera. Nat Toxins. 7, 31–38.
Cavanagh, C., Morell, M., Mackey, I., Powell, W., 2008. Frpm mutations to MAGIC: resources for gene discovery, validation and delivery in crop plants. Curr. Opin. Plant Biol. 11, 215-221.
Chelule, P.K., Ggaleni, N., Dutton, M.F., Chuturgoon, A.A., 2001. Exposure of rural and urban populations in Kwazulu Natal, South Africa, to fumonisin B1 in maize. Environ. Health Perspect. 109(3), 253-256.
Chinnusamy, V., Zhu, J.K., 2009. Epigenetic regulation of stress responses in plants. Curr. Opin. Plant Biol. 12, 133-139.
Ciegler, A., Lillehoj, E., Peterson, R., Hall, H., 1966. Microbial detoxification of aflatoxin. J. Appl. Microbiol. 14(6), 934–939.
Cortés-Zavaleta, O., López-Malo, A., Hernández-Mendoza, A., García, H.S., 2014. Antifungal activity of lactobacilli and its relationship with 3-phenyllactic acid production. Int. J. Food Microbiol. 173, 30–35.
Dass, R.S., Sreenivasa, M.Y., Janardhana, G.R., (2007) High incidence of Fusarium verticillioides in animal and poultry feed mixtures produced in karnataka, India. Plant Pathol. J. 6, 174-178.
Davidson, P.M., 2001. Chemical preservatives and natural antimicrobial compounds. In: Doyle MP, Beuchat LR, Montville TJ, editors. Food Microbiology – Fundamentals and Frontiers. 2nd Ed. American Society for Microbiology, Washington, DC. p.593-627.
Deepa, N., Nagaraja, H., Sreenivasa, M.Y., 2016. Prevalence of fumonisin producing Fusarium verticillioides associated with cereals grown in Karnataka (India). Food Science and Human Wellness. 5(3), 156-162.
Deepthi, B.V., Poornachandra Rao, K., Chennappa, G., Naik, M.K., Chandrashekara, K.T., Sreenivasa, M.Y., 2016. Antifungal attributes of Lactobacillus plantarum MYS6 against Fumonisin producing Fusarium proliferatum associated with poultry feeds. PLoS ONE. 11(6), e0155122.
Deepthi, B.V., Rakesh Somashekaraiah, Poornachandra Rao, K., Deepa, N., Dharanesha, N.K., Girish, K.S., Sreenivasa, M.Y., 2017. Lactobacillus plantarum MYS6 ameliorates fumonisinB1-induced hepatorenal damage in broilers. Front Microbiol. 8:2317.
D’mello, J., Placinta, C., Macdonald, A., 1999. Fusarium mycotoxins: A review of global implications for animal health, welfare and productivity. Anim. Feed Sci. Technol. 80, 183-205.
Dombrink-Kurtzman, M.A., Bennett, G.A., Richard, J.L., 1992. Avian lymphocytes as in vitro models to predict fumonisin cytotoxicity. FASEB J. 6, A2007.
Dombrink-Kurtzman, M.A., Javed, T., Bennett, G.A., Richard, J.L., Marie Cote, L., Buck, W.B., 1993. Lymphocyte cytoxicity and erythrocytic abnormalities induced in broiler chicks by fumonisins B 1 and B1 and moniliformin from Fusarium proliferatum. Mycpahologia. 124, 47-54.
Domijan, A.M., Abramov, A.Y., 2011. Fumonisin B1 inhibits mitochondrial respiration and deregulates calcium homeostasis – Implication to mechanism of cell toxicity. Int. J. Biochem. Cell Biol. 43, 897–904.
Enongene, E.N., Sharma, R.P., Bhandari, N., Miller, J.D., Meredith, F.I., Voss, K.A., Riley, R.T., 2002. Persistence and reversibility of the elevation in free sphingoid bases induced by fumonisin inhibition of ceramide synthase. Toxicol. Sci. 67, 173-181.
Faneli, F., Schmidt-Heydt, M., Haidukowski, M., Geisen, R., Logrieco, A., Mule, G., 2012. Influence of light on growth, fumonisin biosynthesis and FUM1 gene expression by Fusarium proliferatum. Int. J. Food Microbiol. 153, 148-153.
Franceschi, S., Bidoli, E., Baron, A.E., La Vecchia, C., 1990. Maize and risk of cancer of the oral cavity, pharynx and oesophagus in north-eastern Italy. J. Natl. Cancer. Inst. 82, 1407-1411.
Gbore, F.A., Akele, O., 2010. Growth performance, haematology and serum biochemistry of female rabbits (Oryctolagus cuniculus) fed dietary fumonisin. Veterinarski Arhiv. 80(3), 431-443.
Gerez, C.L., Torino, M.I., Rollan, G., Valdez, G.F., 2009. Prevention of bread mould spoilage by using lactic acid bacteria with antifungal properties. Food Control. 20, 144-148.
Goel, S., Lenz, S.D., Lumlertdacha, S., Lovell, R.T., Shelby, R.A., Li, M., Riley, R.T., Kemppainen, B.W., 1994. Sphingolipid levels in catfish consuming Fusarium moniliforme corn culture material containing fumonisins. Aquatic Toxicol. 30, 285-294.
Gourama, H., Bullerman, L.B., 1997. Anti-aflatoxigenic activity of Lactobacillus casei pseudoplantarum. Int. J. Food Microbiol. 34, 131-143.
Grenier, B., Applegate, T., 2013. Modulation of intestinal functions following mycotoxin ingestion: Meta-analysis of published experiments in animals. Toxins.5, 396–430.
Hirel, B., Le Gouis, J., Ney, B., Gallais, A., 2007. The challenge of improving nitrogen use efficiency in crop plants: towards a more central role for genetic variability and quantitative genetics within integrated approaches. J. Exp. Bot. 58, 2369-2387.
Hollinger, K., Ekperigin, H,E. 1999 Mycotoxicosis in food producing animals. Vet. Clin. N. Am. Food A. 15, 133–165.
Huang, C., Dickman, M., Henderson, G., Jones, C., 1995. Repression of protein kinase C and stimulation of cyclic AMP response elements by fumonisin, a fungal encoded toxin which is a carcinogen. Cancer Res. 55, 1655-1659.
Jenkins, G.R., Tolleson W.H., Newkirk, D.K., Robert, D.W., Rowland, K.L., Seheki, T., Koyabashi, K., Howard, P.C., Melchior, W.B. 2000 Identification of fumonisin B1 as an inhibitor of argininosuccinate synthetase using fumonisin affinity chromatography and in vitro kinetic studies. J. Biochem. Mol. Toxicol. 14, 320–328.
Kecerová, K., Pristaš, P., Javorský, P., 2004. Bacteriocin production and sensitivity. Folia Microbiol. 49, 172–174. doi: 10.1007/BF02931395
Kos, B., Beganovi´C.J., Jurasic, L., Svadumovic, M., Lebos Pavunc, A., Uroic, K., Suskovic, J., 2011. Coculture-inducible bacteriocin biosynthesis of different probiotic strains by dairy starter culture Lactococcus lactis. Mljekarstvo. 61, 273–282.
Laitila, A., Alakomi, H.L., Raaska, L., Mattila-Sandholm, T., Haikara, A., 2002. Antifungal activities of two Lactobacillus plantarum strains against Fusarium moulds in vitro and in malting of barley. J. Appl. Microbiol. 93, 566-576.
Magnusson, J., Ström, K., Roos, S., Sjörgen, J., Schnürer, J., 2003. Broad and complex antifungal activity among environmental isolates of lactic acid bacteria. FEMS Microbiol. Lett. 219, 129-135.
Marasas, W.F.O., Kellerman, T.S., Gelderblom, W.C. A., Coetzer, J.A.W., Thiel, P.G., van der Lugt, J.J., 1988. Leukoencephalomalacia in a horse induced by fumonisin B1 isolated from Fusarium moniliforme. Onder. J. Vet. Res. 55, 197-203.
Marasas, W.F., Riley, R.T., Hendricks, K.A., Stevens, V.L., Sadler, T.W., Waes, J.G., Missmer, S.A., Cabrera, J., Torres, O., Gelderblom, W.C., Allegood, Jl, Martinez, C., Maddox, J., Miller, J.D., Starr, L., Sullards, M.C., Roman, A.V., Voss, K.A., Wang, E., Merrill, A.H. Jr., 2004. Fumonisins disrupt sphingolipid metabolism, folate transport, and neural tube development in embryo culture and in vivo: A potential risk factor for human neural tube defects among populations consuming fumonisin contaminated maize. J. Nutr. 134, 711-716
Marin, P., Magan, N., Vazquez, C., Gonzab.ez-Jaen, M.Y., 2010b. Differential effect of environmental conditions on growth and regulation of the fumonisin biosynthetic gene FUM1 in the maize pathogens and fumonisin-producers Fusarium verticillioides and Fusarium proliferatum. FEMS Microbiology Ecology. 73, 303-311.
Merrill, A.H., Jr, Sullards, M.C., Wang, E., Voss, K.A., Riley, R.T. 2001. Sphingolipid metabolism: Roles in signal transduction and disruption by fumonisins. Environ. Health Perspect. 109(Suppl. 2), 283–289.
Mitchell, D., Parra, R., Aldred, D., Magan, N., 2004. Water and temperature relations of growth and ochratoxin A production by Aspergillus carbonarius strains from grapes in Europe and Israel. J. Appl. Microbiol. 97, 439-445.
Mittler, R., Blumwald, E., 2010. Genetic engineering for modern agriculture: challenges and perspectives. Annu. Rev. Plant Pathol. 61, 443-462.
Munns, R., Tester, M., 2008. Mechanisms of salinity tolerance. Annu. Rev. Plant Biol. 59, 651-681.
Musser S M, Plattner R D. 1997. Fumonisin composition in cultures of Fusarium moniliforme, Fusarium proliferatum, and Fusarium nygami. J. Agric. Food Chem. 45(4), 1169-1173.
Orsi, R.B., Dilkin, P., Xavier, J.G., Aquino, S., Rocha, L.O., Correa, B., 2009. Acute toxicity of a single gavage dose of fumonisin B1 in rabbits. Chemico-Biological interactions. 179, 351-355.
Pearson, T., Wicklow, D., Pasikatan, M., 2004. Reduction of aflatoxin and fumonisin contamination in yellow corn by high-speed dual-wavelength sorting. Cereal Chem. 81, 490–498.
Poersch, A.B., Trombetta, F., Braga, A.C.M., Boeira, S.P., Oliveira, M.S., Dilkin, P., Mallmann, C.A., Fighera, M.R., Royes, L.F.F., Oliveira, M.S., Furian, A.F., 2014. Involvement of oxidative stress in subacute toxicity induced by fumonisin B1 in broiler chicks. Vet. Microbiol. 1988, 6–11.
Pozzi, C.R., Correa, B., Xavier, J.g., Direito, G.M., Orsi, R.B., Matarazzo, S.V., 2000. Effects of prolonged oral administration of fumonisin B1 and aflatoxin B1 in rats. Mycopathologia. 151, 21-27.
Ramljak, D., Calvert, R.J., Wiesenfeld, P.W., Diwan, B.A., Catipovic, B., Marasas, W.F.O., Victor, T.C., Anderson, L.M., Gelderblom, W.C.A., 2000. A potential mechanism for fumonisin B1-mediated hepatocarconigenesis: cyclin D1 stabilization associated with activation of Akt and inhibition of GSK-3β activity. Carcinogenesis. 21(8), 1537-1546.
Rheeder, J.P., Marasas, W.F.O., Thiel, P.G., Sydenham, E.W., Shephard, G.S., van Schalkwyk, D.J., 1992. Fusarium moniliforme and fumonisins in corn in relation to human esophageal cancer in Transkei. Phytopathol. 82, 353-357.
Riley, R.T., Enongene, E., Voss, K.A., Norred, W.P., Meredith, F.I., Sharma, R.P., Spitsbergen, J., Williams, D.E., Carlson, D.B., Merrill, A.H. Jr., 2001. Sphingolipid perturbations as mechanism for fumonisin carcinogenesis. Environ. Health Perspect. 109, 301-308.
Riley, R.T., Voss, K.A., 2006. Differential sensitivity of rat kidney and liver to fumonisin toxicity:Organ-specific differences in toxin accumulation and sphingoid base metabolism. Toxicol. Sci. 92, 335-345.
Rouse, S., Harnett, D., Vaughan, A., van Sinderen, D., 2008. Lactic acid bacteria with potential to eliminate fungal spoilage in foods. J. Appl. Microbiol. 104, 915-923.
Smith, G.W., Constable, P.D., Foreman, J.H., Eppley, R.M., Waggoner, A.L., Tumbleson, M.E., Waschek, W.M., 2002. Cardiovascular changes associated with intravenous administration of fumonisin B1 in horses. Am. J. Vet. Res. 63(4), 538-545.
M.Y. Sreenivasa, Regina Sharmila Dass, A. P. Charith Raj and G. R. Janardhana. 2011. Mycological evaluation of Maize grains produced in Karnataka (India) for the post harvest fungal contamination. World Applied Sciences Journal, 13(4), 688 – 692.
Sydenham, E.W., Shephard, G.S., Thiel, P.G., Marasas, W.F.O., Stockenstrom, S., 1991. Fumonisin contamination of commercial corn based human foodstuffs. J. Agric. Food Chem. 39, 2014-2018.
Tabata, S., Kamimura, H., Ibe, A., Hashimoto, H., Tamura, Y. 1994. Degradation of aflatoxins by food additives. J. Food Prot. 57, 42–47.
Tardieu, D., Bailly, J.D., Benard, G., Tran, T.S., Guerre, P., 2004. Toxicity of maize containing known levels of fumonisin B1 during force-feeding of ducks. Poult. Sci. 83, 1287–1293.
Tardieu, D., Bailley, J.-D., Skiba, F., Metayer, J.-P., Grosjean, F., Guerre, P., 2007. Chronic toxicity of fumonisins in turkeys. Poult. Sci. 86,
1887-1893.
Taubel, M., 2005. Isolierung und Charakterisierung von Mikroorganismen zur biologischen Inaktivierung von Fumonisinen. Doctoral Thesis. University of Natural Resources and Applied Life Sciences. Vienna, Austria. The International Agency for Research on Cancer (IARC). Monographs on the evaluation of carcinogenic risks to humans: Some traditional herbal medicines, some mycotoxins, naphthalene and styrene. 2002; 82.
Theumer, M.G., Lopez, A.G., Masih, D.T., Chulze, S.N., Rubinstein, H.R., 2002. Immunobiological effects of fumonisin B1 in experimental subchronic mycotoxicosis in rats. Clin. Diagn. Lab Immunol. 9(1), 149-155. U.S. Food and Drug Administration, 2017. GRAS Notices. http://www.accessdata.fda. gov/scripts/fdcc/?set=GRASNotices (Accessed 08.02. 17).
Van der Westhuizrn, L., Shephard, G.S., Scussel, V.M., Costa, L.L.F., Vismer, H.F., Rheeder, J.P., Marasas, W.F.O., 2003. Fumonisin contamination and Fusarium incidence in corn from Santa Catarina, Brazil. J. Agric. Food Chem. 51(18), 5574-5578.
Voss, K.A., Smith, G.W., Haschek, W.M., 2007. Fumonisins: Toxicokinetics, mechanism of action and toxicity. Anim. Feed Sci. Technol. 137, 299–325.Waalwijk, C., van der Lee, T., de Vries, I., Hesselink, T., Arts, J., Kema, G.H.J., 2004. Synteny in toxigenic Fusarium species: the fumonisin gene cluster and the mating type region as examples. Eur. J. Plant Pathol. 110, 533-544.
Wang, W., Vinocur, B., Altman, A., 2003. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance. Planta. 218, 1-14.
Yoshizawa, T., Yamashita, A., Luo, Y., 1994. Fumonisin occurrence in corn from highand low-risk areas for human esophageal cancer in China. Appl. Environ. Microbiol. 60, 1626-1629.




 Prevención de micotoxicosis
Prevención de micotoxicosis