Irene Teixido
Doctoranda y profesora ayudante en Ciencia y Tecnología de los Alimentos, Universidad de Lleida
La dieta de los animales incluye una combinación de piensos diseñados no solo para cubrir sus requerimientos nutricionales al menor coste posible, sino también para garantizar su salud, bienestar y rendimiento productivo.
Los cereales son uno de los ingredientes más comunes en la formulación de piensos, ya que proporcionan la mayor parte de los nutrientes esenciales para el ganado.
⇰ Entre los cereales más utilizados en la industria de piensos se encuentran el maíz, el trigo, la cebada, el sorgo y la avena1.

 La avena (Avena sativa L.) es un cultivo de gran relevancia, especialmente en países del hemisferio norte.
La avena (Avena sativa L.) es un cultivo de gran relevancia, especialmente en países del hemisferio norte.
Tradicionalmente utilizada para la alimentación animal, aunque su consumo humano ha aumentado considerablemente en los últimos años debido a sus destacadas propiedades nutricionales y multifuncionales2.
La avena es susceptible a la contaminación por diversas especies de hongos, tanto en el campo como en el almacenamiento postcosecha.
![]() Estos hongos pueden dañar la estructura del grano, reduciendo su calidad y rendimiento.
Estos hongos pueden dañar la estructura del grano, reduciendo su calidad y rendimiento.
 Además, muchas de estas especies fúngicas pueden producir metabolitos secundarios tóxicos, conocidos como micotoxinas, que representan un riesgo para la salud animal y humana3.
Además, muchas de estas especies fúngicas pueden producir metabolitos secundarios tóxicos, conocidos como micotoxinas, que representan un riesgo para la salud animal y humana3.
PRINCIPALES HONGOS Y MICOTOXINAS EN LA AVENA
Fusarium
Fusarium es el moho más común en la avena y es responsable de la enfermedad conocida como “Fusarium Head Blight”.
 La producción de sus micotoxinas está fuertemente influenciada por las condiciones climáticas y, por lo tanto, varía según la región de cultivo4.
La producción de sus micotoxinas está fuertemente influenciada por las condiciones climáticas y, por lo tanto, varía según la región de cultivo4.
Las micotoxinas de Fusarium más relevantes en la avena incluyen:
 Zearalenona (ZEN)
Zearalenona (ZEN)  Fumonisinas (principalmente la B1)
Fumonisinas (principalmente la B1) Tricotecenos tipo A y B
Tricotecenos tipo A y B
Entre los tricotecenos tipo A destacan las toxinas T-2, HT-2 y el diacetoxiscirpenol (DAS).
Entre los tricotecenos tipo B se encuentran el deoxinivalenol (DON) y el nivalenol (NIV). Además, algunas formas glucosiladas, como DON-3- glucósido (DON-3-G) y T-2-glucósido, pueden estar presentes5,6,7,8.
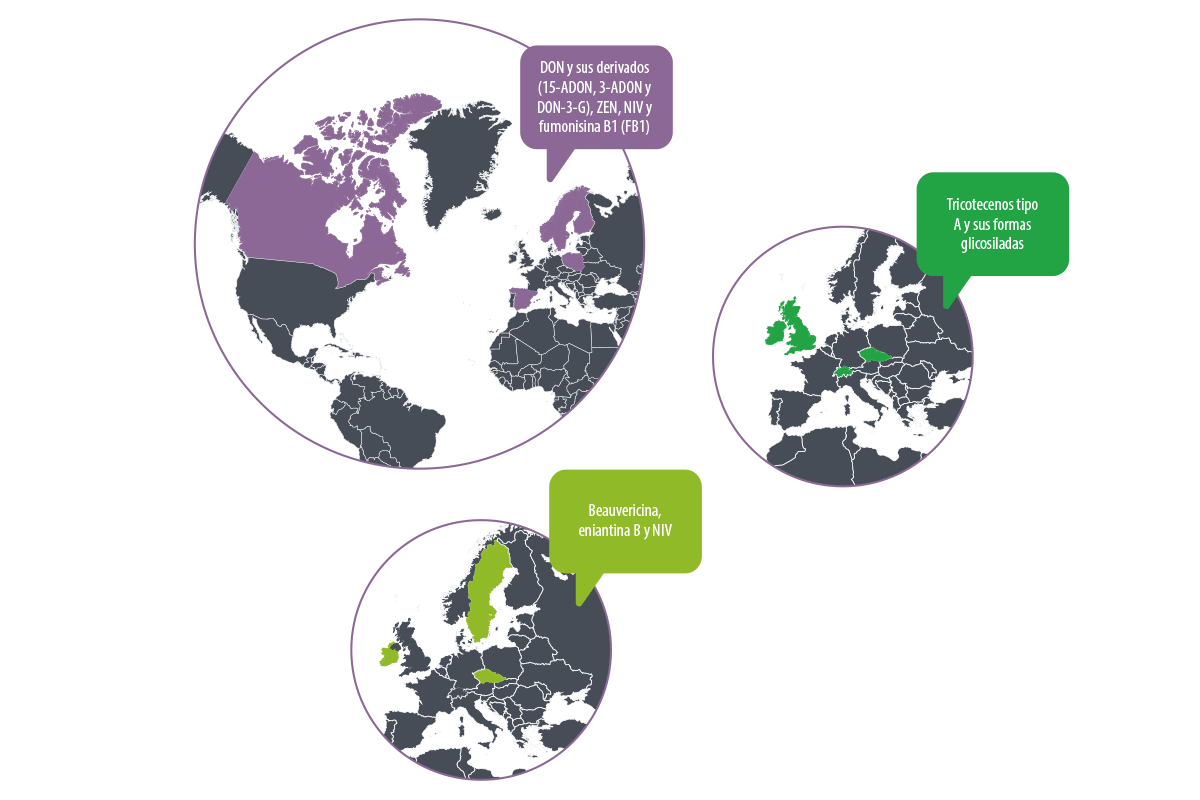
En estudios realizados en Suecia, Finlandia, Polonia, Noruega, Canadá y España, se ha observado una mayor contaminación por DON y sus derivados (15-acetilDON, 3-acetilDON y DON-3-G), ZEN, NIV y fumonisina B1 (FB1)7,9,10,11,12,13.
Por otro lado, en países como Reino Unido, Irlanda, República Checa y Suiza, predominan los tricotecenos tipo A y sus formas glicosiladas, debido a la variabilidad en las especies de Fusarium presentes en cada región5,6,14,15.
Asimismo, en la avena pueden detectarse micotoxinas emergentes de Fusarium, como enniatinas, beauvericina, ácido fusárico y fusarenon-X.
⇰ En estudios realizados en la Checa, Suecia e Irlanda, se ha identificado una presencia significativa de beauvericina y enniatina B, correlacionada con altos niveles de NIV5,10,14.
Alternaria
Las micotoxinas de Alternaria han sido menos estudiadas, pero también se han encontrado en la avena y pueden representar un riesgo para la salud.
Entre ellas destacan16:
 Alternariol (AOH)
Alternariol (AOH) Alternariol monometil éter (AME)
Alternariol monometil éter (AME) Tentoxina (TEN)
Tentoxina (TEN) Ácido tenuazónico (TeA)
Ácido tenuazónico (TeA)
Se ha observado que el contenido de AOH en la avena es superior al de otros cereales como el trigo y la cebada.
Asimismo, el contenido de TEN es elevado en la avena, similar al del trigo, y su combinación con TeA es frecuente.

Penicillium y Aspergillus
Las micotoxinas de Penicillium y Aspergillus suelen aparecer en la avena tras la cosecha.
Penicillium produce principalmente ocratoxinas, como la ocratoxina A (OTA) y la ocratoxina B (OTB), mientras que Aspergillus también puede generar ocratoxinas, aunque es más conocido por la producción de aflatoxinas.
![]() No obstante, estas micotoxinas rara vez alcanzan niveles preocupantes en la avena utilizada en la alimentación animal5,7,19.
No obstante, estas micotoxinas rara vez alcanzan niveles preocupantes en la avena utilizada en la alimentación animal5,7,19.
La esterigmatocistina, una micotoxina emergente producida por Aspergillus, se ha detectado ocasionalmente en la avena, aunque con baja frecuencia5.

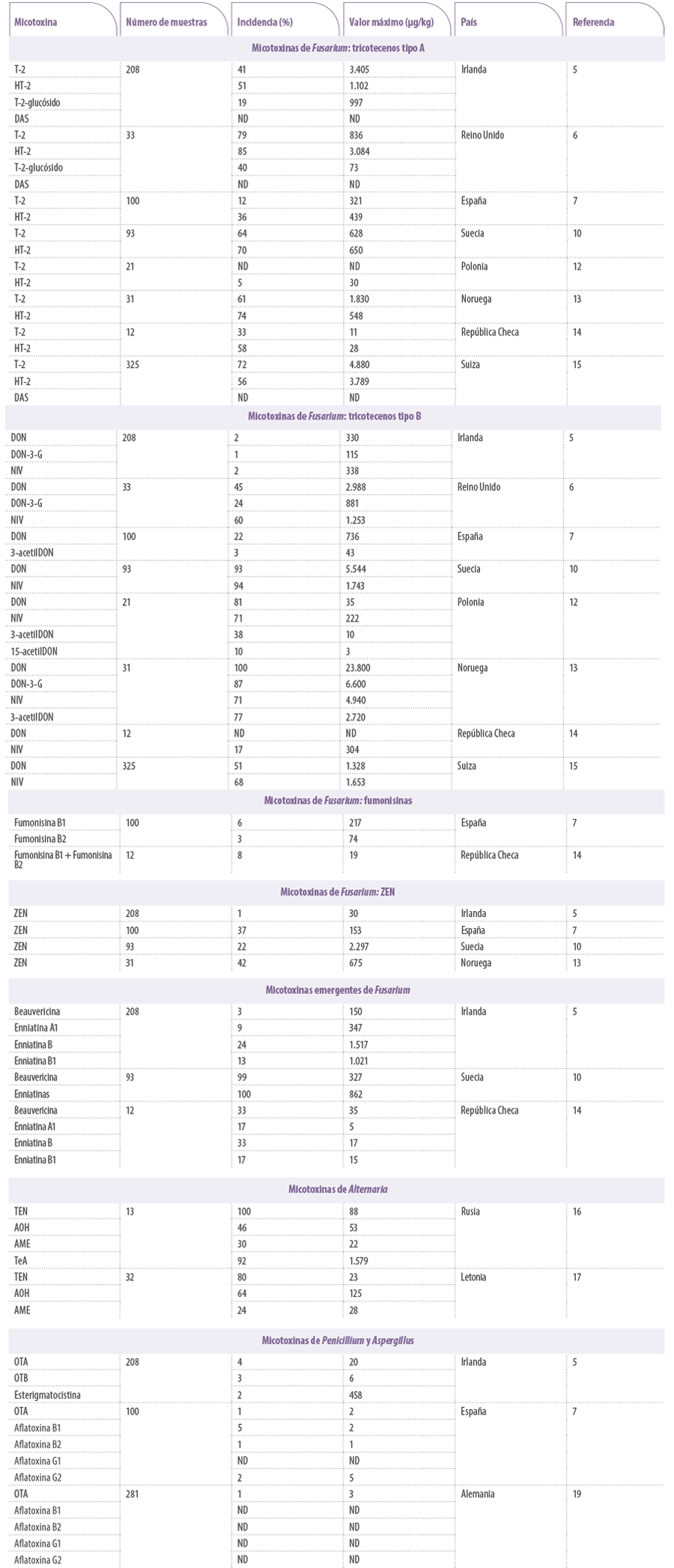
Tabla 1. Incidencia, valor máximo y país de detección de diferentes micotoxinas de Fusarium, Alternaria, Penicillium y Aspergillus en muestras de piensos o materias primas analizadas en distintos estudios europeos. ND: no disponible. DON: deoxinivalenol; ZEN: zearalenona; OTA: ocratoxina A; AOH: alternariol; AME: metil éter de alternariol; TEN: tentoxina; TeA: ácido tenuazónico; OTB: ocratoxina B; DAS: diacetoxiscirpenol.
REGULACIÓN DE MICOTOXINAS EN LA ALIMENTACIÓN ANIMAL
Los límites y recomendaciones para las micotoxinas en piensos están establecidos en diversas directivas y recomendaciones de la Unión Europea (UE):
 Directiva 2003/100/EC de la Comisión de 31 de octubre de 2003 por la que se modifica el anexo I de la Directiva 2002/32/CE del Parlamento Europeo y del Consejo sobre sustancias indeseables en la alimentación animal. Este incluye un límite máximo para la aflatoxina B1 (AFB1) en estos productos20.
Directiva 2003/100/EC de la Comisión de 31 de octubre de 2003 por la que se modifica el anexo I de la Directiva 2002/32/CE del Parlamento Europeo y del Consejo sobre sustancias indeseables en la alimentación animal. Este incluye un límite máximo para la aflatoxina B1 (AFB1) en estos productos20.-
Este incluye un límite máximo para la aflatoxina B1 (AFB1) en estos productos20.
 Recomendación de la Comisión de 17 de agosto de 2006, sobre la presencia de DON, ZEN, OTA y fumonisinas en productos destinados a la alimentación animal21.
Recomendación de la Comisión de 17 de agosto de 2006, sobre la presencia de DON, ZEN, OTA y fumonisinas en productos destinados a la alimentación animal21. Recomendación de la Comisión de 4 de noviembre de 2013, que modifica la Recomendación 2006/576/CE en lo que respecta a las toxinas T-2 y HT-2 en piensos22.
Recomendación de la Comisión de 4 de noviembre de 2013, que modifica la Recomendación 2006/576/CE en lo que respecta a las toxinas T-2 y HT-2 en piensos22. Recomendación de la Comisión (UE) 2016/1319 de 29 de julio de 2016, que modifica la Recomendación 2006/576/CE en lo que respecta a DON, ZEN y OTA en alimentos para mascotas23.
Recomendación de la Comisión (UE) 2016/1319 de 29 de julio de 2016, que modifica la Recomendación 2006/576/CE en lo que respecta a DON, ZEN y OTA en alimentos para mascotas23.
En la legislación de la UE, solo es obligatorio cumplir con los límites establecidos para la AFB1, mientras que los niveles de DON, ZEN, OTA, toxinas T-2 y HT-2, y la suma de FB1 y la fumonisina B2 (FB2) se consideran recomendaciones.
IMPACTO DE LAS MICOTOXINAS EN LA PRODUCCIÓN ANIMAL
Las micotoxinas de Fusarium y Alternaria son las más comunes en la avena, por lo que pueden estar presentes en los productos de alimentación animal elaborados con este cereal, afectando a la salud y el rendimiento del ganado.
Micotoxinas de Fusarium
Tricotecenos tipo A
Los tricotecenos tipo A, como la toxina T-2 y HT-2, son altamente tóxicos para los animales.
La toxina T-2, en particular, ocasiona:
 Reducción del consumo de alimento
Reducción del consumo de alimento Pérdida de peso
Pérdida de peso Necrosis oral
Necrosis oral Hemorragias internas en cerdos y aves
Hemorragias internas en cerdos y aves Daño en el tracto gastrointestinal
Daño en el tracto gastrointestinal
Además, puede causar inmunosupresión, aumentando la susceptibilidad a infecciones, y puede afectar a la producción de leche en vacas.
La toxina HT-2, aunque algo menos tóxica, también interfiere con la síntesis de proteínas y afecta a la función inmunitaria y al crecimiento de los animales, lo que puede disminuir la eficiencia productiva24.

Tricotecenos tipo B
El DON y el NIV son los principales tricotecenos tipo B.
El DON, conocido como “vomitoxina”:
 Es ampliamente reconocido por inducir vómitos y rechazo de alimento en cerdos, lo que provoca una disminución en la ganancia de peso.
Es ampliamente reconocido por inducir vómitos y rechazo de alimento en cerdos, lo que provoca una disminución en la ganancia de peso. Reduce la eficiencia alimentaria y afecta a la respuesta inmunitaria, lo que aumenta la susceptibilidad a infecciones.
Reduce la eficiencia alimentaria y afecta a la respuesta inmunitaria, lo que aumenta la susceptibilidad a infecciones. Altera la barrera intestinal, facilitando la entrada de patógenos.
Altera la barrera intestinal, facilitando la entrada de patógenos.
El NIV, aunque menos tóxico que el DON, también reduce el crecimiento en cerdos y aves, y altera la función intestinal, lo que incrementa el riesgo de infecciones y otros problemas digestivos24.
ZEN
La ZEN es una micotoxina con actividad estrogénica que puede provocar trastornos reproductivos en animales, especialmente en cerdos.
Su toxicidad se debe a su capacidad de unirse a los receptores de estrógenos, generando efectos endocrinos, inmunotóxicos y carcinogénicos.
En hembras ocasiona:
 Hiperestrogenismo
Hiperestrogenismo Infertilidad
Infertilidad Agrandamiento de la vulva
Agrandamiento de la vulva Abortos
Abortos
En machos:
 Reduce la calidad del semen
Reduce la calidad del semen Afecta al desarrollo testicular
Afecta al desarrollo testicular
También se han descrito problemas reproductivos en bovinos y peces, donde reduce la fertilidad, afecta el crecimiento y puede acumularse en el músculo25,26.
Fumonisinas
Las fumonisinas, especialmente la FB1, interfieren en el metabolismo de los esfingolípidos, causando:
 Leucoencefalomalacia en caballos y edema pulmonar en cerdos.
Leucoencefalomalacia en caballos y edema pulmonar en cerdos. Daño hepático y renal en diversas especies.
Daño hepático y renal en diversas especies. Posibles efectos carcinogénicos y alteraciones metabólicas.
Posibles efectos carcinogénicos y alteraciones metabólicas. Afectación hepática y renal en peces, donde reducen el crecimiento y el consumo de alimento, alteran la conversión alimenticia y pueden generar lesiones en el cerebro y el páncreas.
Afectación hepática y renal en peces, donde reducen el crecimiento y el consumo de alimento, alteran la conversión alimenticia y pueden generar lesiones en el cerebro y el páncreas.

Micotoxinas de Alternaria
Estas micotoxinas presentan efectos genotóxicos, mutagénicos y carcinogénicos en humanos y animales28.
⇰ La exposición prolongada puede aumentar el riesgo de enfermedades crónicas y afectar la integridad del ADN.
El TeA es un potente inhibidor de la síntesis de proteínas y se considera más tóxico que AOH y AME.
 Puede provocar alteraciones en el metabolismo celular y reducir la eficiencia alimentaria en animales.
Puede provocar alteraciones en el metabolismo celular y reducir la eficiencia alimentaria en animales.
Aunque su toxicidad en mamíferos es relativamente baja, la TEN es una toxina que afecta el desarrollo de los cloroplastos en las plantas.
![]() Su impacto en animales es menor en comparación con otras micotoxinas de Alternaria29.
Su impacto en animales es menor en comparación con otras micotoxinas de Alternaria29.
Micotoxinas emergentes
Las micotoxinas emergentes detectadas recientemente en la avena, como el NIV, el DAS, las enniatinas, la beauvericina, el ácido fusárico, el fusarenon-X y la esterigmatocistina, pueden generar diversos efectos adversos en la salud animal.
 Estas micotoxinas tienen el potencial de afectar el sistema gastrointestinal, reproductivo, la eficiencia en la conversión alimentaria y pueden inducir procesos inflamatorios.
Estas micotoxinas tienen el potencial de afectar el sistema gastrointestinal, reproductivo, la eficiencia en la conversión alimentaria y pueden inducir procesos inflamatorios.

MÉTODOS DE ANÁLISIS DE LAS MICOTOXINAS EN AVENA
El análisis de micotoxinas en avena es esencial para garantizar la seguridad alimentaria y el cumplimiento de las regulaciones vigentes.
 La detección precisa de estos compuestos es un desafío debido a su baja concentración, distribución heterogénea y la presencia de formas conjugadas8,31.
La detección precisa de estos compuestos es un desafío debido a su baja concentración, distribución heterogénea y la presencia de formas conjugadas8,31.

Métodos de cribado
Estos métodos permiten una detección rápida y preliminar de micotoxinas en avena.
Son utilizados para evaluar grandes volúmenes de muestras y proporcionar resultados rápidos, aunque con menor precisión que los métodos cromatográficos. Estos incluyen1,32:
 ELISA (Ensayo por inmunoadsorción ligado a enzimas): método ampliamente utilizado debido a su rapidez y facilidad de uso.
ELISA (Ensayo por inmunoadsorción ligado a enzimas): método ampliamente utilizado debido a su rapidez y facilidad de uso.-
Se aplica para la detección de micotoxinas como DON, ZEN y OTA. Sin embargo, puede presentar interferencias con la matriz de la muestra, lo que afecta la precisión del resultado.
 Biosensores: incorporan anticuerpos o aptámeros que permiten detectar micotoxinas a través de señales ópticas o electroquímicas.
Biosensores: incorporan anticuerpos o aptámeros que permiten detectar micotoxinas a través de señales ópticas o electroquímicas. -
Son una tecnología emergente con potencial para mejorar la rapidez y especificidad del análisis, aunque requieren una validación más extensa antes de su uso rutinario.
 Dispositivos de flujo lateral: son herramientas de detección rápida y portátil, ideales para el análisis en campo o en condiciones de emergencia.
Dispositivos de flujo lateral: son herramientas de detección rápida y portátil, ideales para el análisis en campo o en condiciones de emergencia. -
Funcionan mediante la captación de micotoxinas en una muestra, generando una señal visual (como una línea de color) en una tira reactiva. Aunque son rápidos y fáciles de usar, su sensibilidad y precisión pueden ser inferiores a las de métodos más avanzados, por lo que generalmente se utilizan para cribado inicial.
Métodos cromatográficos
Estos métodos ofrecen una mayor precisión y especificidad en la detección de micotoxinas, aunque requieren equipos especializados y mayor tiempo de análisis1,32.
 Cromatografía líquida de alta resolución (HPLC): técnica ampliamente utilizada en la determinación de micotoxinas.
Cromatografía líquida de alta resolución (HPLC): técnica ampliamente utilizada en la determinación de micotoxinas.-
Se emplea con detectores UV, de fluorescencia (FLD) o acoplada a espectrometría de masas (MS), permitiendo la detección simultánea de múltiples micotoxinas. Su principal ventaja es la precisión y sensibilidad en la detección.
 Cromatografía de gases (GC-MS): se utiliza principalmente para micotoxinas volátiles o aquellas que requieren derivatización previa.
Cromatografía de gases (GC-MS): se utiliza principalmente para micotoxinas volátiles o aquellas que requieren derivatización previa. -
Aunque ofrece gran sensibilidad, su aplicación es más limitada debido a la complejidad del procedimiento analítico.
Métodos no invasivos
Actualmente, se están explorando nuevas técnicas para la detección de micotoxinas en avena sin necesidad de preparación destructiva de la muestra33,34,35,36.
Un ejemplo de ello es la espectroscopía de infrarrojo cercano (NIR).
Esta técnica permite la detección de micotoxinas de forma rápida y sin destrucción de la muestra, lo que las hace ideales para el análisis en tiempo real.
Sin embargo, requiere calibraciones específicas y puede verse afectada por la variabilidad de la matriz, lo que limita su aplicabilidad en algunos casos.

CONCLUSIÓN
El monitoreo y control de micotoxinas de Fusarium y Alternaria en la avena destinada a la alimentación animal es fundamental, ya que su presencia puede afectar la salud y el rendimiento del ganado.
La elección del método de análisis depende de factores como el tipo de micotoxina, la sensibilidad requerida y la infraestructura disponible.
Mientras que los métodos de cribado, como ELISA, los dispositivos de flujo lateral y los biosensores, permiten una detección rápida y preliminar, las técnicas cromatográficas siguen siendo la referencia por su precisión y capacidad de detectar múltiples micotoxinas.
El desarrollo de nuevas tecnologías, como biosensores avanzados y técnicas espectroscópicas, abre nuevas posibilidades para mejorar la rapidez y accesibilidad de los análisis.
![]() A medida que estas herramientas evolucionen, su integración en sistemas automatizados facilitará un control más eficiente.
A medida que estas herramientas evolucionen, su integración en sistemas automatizados facilitará un control más eficiente.
BIBLIOGRAFÍA
1. C. S. Pereira, S. C. Cunha, and J. O. Fernandes, “Prevalent mycotoxins in animal feed: Occurrence and analytical methods,” Toxins, vol. 11, no. 5, p. 290, 2019. DOI:10.3390/toxins11050290.
2. G. F. Alemayehu, S. F. Forsido, Y. B. Tola, and E. Amare, “Nutritional and phytochemical composition and associated health benefits of oat (Avena sativa) grains and oat-based fermented food products,” Biomolecules, vol. 13, no. 5, p. 730, 2023. DOI: 10.1155/2023/2730175.
3. S. Marin, A. J. Ramos, G. Cano-Sancho, and V. Sanchis, “Mycotoxins: Occurrence, toxicology, and exposure assessment,” Food and Chemical Toxicology, vol. 62, pp. 59–75, 2013. DOI: 10.1016/j.fct.2013.07.047.
4. A. Bjørnstad and H. Skinnes, “Resistance to Fusarium infection in oats (Avena sativa L.),” Cereal Research Communications, vol. 36, no. 1, pp. 57–62, 2008. DOI:10.1556/CRC.36.2008.Suppl.B.9.
5. L. De Colli et al., “Natural co-occurrence of multiple mycotoxins in unprocessed oats grown in Ireland with various production systems,” Toxins, vol. 13, no. 3, p. 188, 2021. DOI: 10.3390/toxins13030188.
6. N. Daud et al., “Free and modified mycotoxins in organic and conventional oats (Avena sativa L.) grown in Scotland,” Toxins, vol. 15, no. 4, p. 247, 2023. DOI: 10.3390/toxins15040247.
7. A. Tarazona, J. V. Gómez, F. Mateo, M. Jiménez, and E. M. Mateo, “Potential health risk associated with mycotoxins in oat grains consumed in Spain,” Toxins, vol. 13, no. 6, p. 421, 2021. DOI: 10.3390/toxins13060421.
8. I. Teixido-Orries et al., “Mapping variability of mycotoxins in individual oat kernels from batch samples: Implications for sampling and food safety,” Toxins, vol. 17, no. 1, p. 34, 2025. DOI: 10.3390/toxins17010034.
9. W. Yan, D. Pageau, R. Martin, A. Cummiskey, and B. Blackwell, “Is deoxynivalenol contamination a serious problem for oat in eastern Canada?,” Crop Science, vol. 57, no. 1, pp. 88–98, 2017. DOI: 10.2135/cropsci2016.04.0263.
10. E. Fredlund et al., “Deoxynivalenol and other selected Fusarium toxins in Swedish oats—Occurrence and correlation to specific Fusarium species,” International Journal of Food Microbiology, vol. 167, no. 2, pp. 276–283, 2013. DOI: 10.1016/j.ijfoodmicro.2013.06.026.
11. A. Bernhoft, P. E. Clasen, A. B. Kristoffersen, and M. Torp, “Less Fusarium infestation and mycotoxin contamination in organic than in conventional cereals,” Food Additives and Contaminants – Part A, vol. 27, no. 6, pp. 842–852, 2010. DOI: 10.1080/19440041003645761.
12. J. Perkowski et al., “A comparison of contents of group A and B trichothecenes and microbial counts in different cereal species,” Food Additives and Contaminants – Part B: Surveillance, vol. 5, no. 3, pp. 151–159, 2012. DOI: 10.1080/19393210.2012.675591.
13. A. V. Nathanail et al., “Simultaneous determination of major type A and B trichothecenes, zearalenone, and certain modified metabolites in Finnish cereal grains with a novel liquid chromatography-tandem mass spectrometric method,” Analytical and Bioanalytical Chemistry, vol. 407, no. 16, pp. 4745–4755, 2015. DOI:10.1007/s00216-015-8676-4.
14. I. Polišenská, O. Jirsa, K. Vaculová, M. Pospíchalová, S. Wawroszova, and J. Frydrych, “Fusarium mycotoxins in two hulless oat and barley cultivars used for food purposes,” Foods, vol. 9, no. 8, p. 1037, 2020. DOI: 10.3390/foods9081037.
15. T. Schöneberg et al., “Occurrence of Fusarium species and mycotoxins in Swiss oat Impact of cropping factors,” European Journal of Agronomy, vol. 92, pp. 123–132, 2018. DOI: 10.1016/j.eja.2017.09.004.
16. A. S. Orina, O. P. Gavrilova, N. N. Gogina, P. B. Gannibal, and T. Y. Gagkaeva, “Natural occurrence of Alternaria fungi and associated mycotoxins in small-grain cereals from the Urals and West Siberia regions of Russia,” Toxins, vol. 13, p. 223, 2021. DOI: 10.3390/toxins.
17. I. Reinholds et al., “Mycotoxins in cereals and pulses harvested in Latvia by nanoLC Orbitrap MS,” Food Additives and Contaminants – Part B: Surveillance, vol. 14, no. 2, pp. 115–123, 2021. DOI: 10.1080/19393210.2021.1892204.
18. B. Kosiak, M. Torp, E. Skjerve, and B. Andersen, “Alternaria and Fusarium in Norwegian grains of reduced quality – A matched pair sample study,” International Journal of Food Microbiology, vol. 93, no. 1, pp. 51–62, 2004. DOI: 10.1016/j.ijfoodmicro.2003.10.006.
19. J. C. Meyer, I. Hennies, D. Wessels, and K. Schwarz, “Survey of mycotoxins in milling oats dedicated for food purposes between 2013 and 2019 by LC–MS/MS,” Food Additives and Contaminants – Part A: Chemistry, Analysis, Control, Exposure and Risk Assessment, vol. 38, no. 11, pp. 1934–1947, 2021. DOI: 10.1080/19440049.2021.1950931.
20. European Commission, “Commission directive 2003/100/EC of 31 October 2003 amending Annex I to Directive 2002/32/EC of the European Parliament and of the Council on undesirable substances in animal feed,” Official Journal of the European Union, vol. L285/33, 2003. Available: www.efsa.europa.eu.
21. European Commission, “Commission recommendation on the presence of deoxynivalenol, zearalenone, ochratoxin A, T-2 and HT-2 and fumonisins in products intended for animal feeding,” Official Journal of the European Union, vol. L229/7, 2006. Available: www.efsa.europa.eu.
22. European Commission, “Commission recommendation of 27 March 2013 on the presence of T-2 and HT-2 toxin in cereals and cereal products,” Official Journal of the European Union, vol. L, no. 91, pp. 12–15, 2013. DOI: 10.2903/j.efsa.2011.2481.
23. European Commission, “Commission recommendation (EU) 2016/1319 of 29 July 2016 amending Recommendation 2006/576/EC as regards deoxynivalenol, zearalenone and ochratoxin A in pet food,” Official Journal of the European Union, vol. 208, pp. 58–60, 2016. Available: www.efsa.europa.eu.
24. M. Polak-Śliwińska and B. Paszczyk, “Trichothecenes in food and feed, relevance to human and animal health and methods of detection: A systematic review,” Molecules, vol. 26, no. 2, p. 454, 2021. DOI: 10.3390/molecules26020454.
25. M. E. Bezerra da Rocha, F. F. da Chagas Oliveira, F. E. Feitosa Maia, M. I. Florindo Guedes, and D. Rondina, “Mycotoxins and their effects on human and animal health,” Food Control, vol. 35, pp. 208–219, 2014. DOI: 10.1016/j.foodcont.2013.08.021.
26. R. A. Gonçalves, K. Naehrer, and G. A. Santos, “Occurrence of mycotoxins in commercial aquafeeds in Asia and Europe: A real risk to aquaculture?,” Risk Analysis Quarterly, vol. 51, no. 6, pp. 1313–1325, 2018. DOI: 10.1111/raq.12159.
27. R. A. Gonçalves, J. Dias, and D. Schatzmayr, “Effect of low levels of fumonisin contamination on gilthead seabream (Sparus aurata),” Journal of World Aquaculture Society, vol. 51, no. 6, pp. 1313–1325, 2020. DOI: 10.1111/jwas.12730.
28. J. Alexander et al., “Scientific Opinion on the risks for animal and public health related to the presence of Alternaria toxins in feed and food,” EFSA Journal, vol. 9, no. 10, p. 2407, 2011. DOI: 10.2903/j.efsa.2011.2407.
29. J. Lou, L. Fu, Y. Peng, and L. Zhou, “Metabolites from Alternaria fungi and their bioactivities,” Molecules, vol. 18, no. 5, p. 5891, 2013. DOI: 10.3390/molecules18055891.
30. O. Kolawole, W. Siri-Anusornsak, A. Petchkongkaew, and C. Elliott, “A systematic review of global occurrence of emerging mycotoxins in crops and animal feeds, and their toxicity in livestock,” 2024, KeAi Communications Co. doi: 10.1016/j.emcon.2024.100305.
31. S. A. Tittlemier and T. B. Whitaker, “Current sampling plans can introduce high variance in mycotoxin testing results as demonstrated by the online FAO Mycotoxin Sampling Tool,” World Mycotoxin Journal, vol. 16, no. 2, pp. 115–126, 2023. DOI: 10.3920/WMJ2022.2804.
32. K. M. Koczula and A. Gallotta, “Lateral flow assays,” Essays in Biochemistry, vol. 60, no. 1, pp. 111–120, 2016. DOI: 10.1042/EBC20150012.
33. I. Teixido-Orries, F. Molino, F. Gatius, V. Sanchis, and S. Marín, “Near-infrared hyperspectral imaging as a novel approach for T-2 and HT-2 toxins estimation in oat samples,” Food Control, vol. 153, p. 109952, 2023. DOI: 10.1016/j.foodcont.2023.109952.
34. I. Teixido-Orries, F. Molino, A. Femenias, A. J. Ramos, and S. Marín, “Quantification and classification of deoxynivalenol-contaminated oat samples by near infrared hyperspectral imaging,” Food Chemistry, vol. 375, p. 135924, 2023. DOI: 10.1016/j.foodchem.2023.135924.
35. S. Tekle, I. Mage, V. H. Segtnan, and A. Bjornstad, “Near-infrared hyperspectral imaging of Fusarium-damaged oats (Avena sativa L.),” Cereal Chemistry, vol. 92, no. 1, pp. 73–80, 2015. DOI: 10.1094/CCHEM-04-14-0074-R.
36. S. Tekle, Å. Bjørnstad, H. Skinnes, Y. Dong, and V. H. Segtnan, “Estimating deoxynivalenol content of ground oats using VIS-NIR spectroscopy,” Cereal Chemistry, vol. 90, no. 3, pp. 181–185, 2013. DOI: 10.1094/CCHEM-07-12-0084-R.




 Prevención de micotoxicosis
Prevención de micotoxicosis