S. Divyashree y M. Y. Sreenivasa
Laboratorio de micología aplicada, DoS en Microbiología, Universidad de Mysore, Mysore, India
Email: [email protected]; [email protected]
La avicultura se ha convertido en una actividad económica esencial y un sector agrícola importante en todo el mundo. Los piensos para aves de corral son uno de los elementos más caros y representan hasta el 70% del coste total de la producción avícola.
Las complicaciones microbianas son uno de los aspectos más importantes de la producción avícola, ocasionando importantes pérdidas económicas en todo el mundo.
⇰ En este artículo, revisamos varias complicaciones microbianas y sus actuales estrategias de prevención, principalmente, el uso de probióticos como agentes terapéuticos de nueva generación para combatir los patógenos nocivos transmitidos por los alimentos, así como sus aplicaciones adicionales en la producción avícola.

Infecciones microbianas en la industria avícola
Las complicaciones microbianas ocasionadas por bacterias, virus, hongos y sus toxinas, han sido señaladas en todo el mundo como un problema importante en la producción de aves de corral y de los piensos.
Contaminación bacteriana 
Las infecciones bacterianas son la principal causa de gastroenteritis de origen alimentario en los seres humanos a nivel mundial, debido al consumo de productos avícolas contaminados (Weill et al., 2006).
La contaminación de los productos avícolas con Salmonella spp., Escherichia coli, Listeria monocytogenes, Campylobacter spp. y Clostridium perfringens puede rastrearse hasta el tracto gastrointestinal (ciego), donde tienen una gran actividad al colonizar eficazmente las células epiteliales del intestino (Pascual et al., 1999).
Estos microorganismos disminuyen los mecanismos de defensa del organismo, generando un desequilibrio en el microbioma intestinal, lo que lleva a la proliferación de patógenos más dañinos y provoca alteraciones fisiológicas como:
 Septicemia
Septicemia
 Meningitis
Meningitis
 Encefalitis
Encefalitis
 Vómitos
Vómitos
 Diarrea
Diarrea
 Digestión inadecuada
Digestión inadecuada
 Pérdida de apetito y mala absorción de nutrientes, lo que a su vez reduce la inmunocompetencia y la productividad
Pérdida de apetito y mala absorción de nutrientes, lo que a su vez reduce la inmunocompetencia y la productividad
También pueden provocar trastornos autoinmunes, insuficiencia renal y parálisis temporal, pudiendo ocasionar daños nerviosos permanentes y la muerte.
En el caso de la industria avícola, estas infecciones provocan grandes pérdidas económicas (Dharma et al., 2008).
Contaminación fúngíca 
La contaminación fúngica, principalmente con micotoxinas, es decir, metabolitos secundarios tóxicos producidos por hongos filamentosos o mohos como Aspergillus spp. (aflatoxinas, ocratoxinas), Fusarium spp. (deoxinivalenol, fumonisinas, zearalenona y tricotecenos) y Penicillium spp. (ocratoxina A y patulina), provoca altas tasas de mortalidad y morbilidad en la producción avícola.
 Debido a su toxicidad directa y a sus efectos mutagénicos, teratogénicos, carcinogénicos e inmunosupresores, así como a su carácter esporádico, suponen un riesgo importante en términos de detección y predicción, ya que tienden a acumularse en los piensos avícolas (Hussain et al., 2010).
Debido a su toxicidad directa y a sus efectos mutagénicos, teratogénicos, carcinogénicos e inmunosupresores, así como a su carácter esporádico, suponen un riesgo importante en términos de detección y predicción, ya que tienden a acumularse en los piensos avícolas (Hussain et al., 2010).
Contaminación vírica 
Además de los patógenos bacterianos y fúngicos, los patógenos virales gastrointestinales también están implicados en las infecciones de origen alimentario.
Una gran variedad de enfermedades víricas, como la viruela aviar (Avipoxvirus), la enfermedad de Newcastle (Paramixovirus), la bronquitis infecciosa y de las codornices (virus de la gripe), la leucosis linfoide (Retrovirus), la enfermedad de Marek (virus del herpes de los pollos) y la bursitis infecciosa (Birnavirus) se dan en las especies avícolas.
Se cree que los virus presentes en las secreciones respiratorias, las heces, la sangre y los órganos de las aves vivas, son el principal factor de riesgo para las infecciones humanas por el consumo de productos derivados de las aves de corral (Rodríguez- Díaz y Monedero, 2013). De ahí la necesidad de controlar estas complicaciones microbianas.
Manejo de la situación actual de las complicaciones microbianas y problemas relacionados
Los antibióticos promotores del crecimiento (APC), como la estreptomicina, la avoparcina, la tetraciclina, la bacitracina, la clortetracilina, la tilosina, la neomicina, la oxitetraciclina, la virginiamicina, la trimetoprima/suifonamida, las lincosamidas, las cefalosporinas, etc., se han utilizado en la producción avícola durante las últimas cinco décadas para controlar las enfermedades microbianas.
Sin embargo, el uso de promotores del crecimiento antibióticos y hormonales en la producción avícola está prohibido en la Unión Europea desde 2006 (Jha et al., 2020) debido a la creciente evidencia de transferencia de genes de resistencia a los antibióticos y alergias desde los animales de granja a los seres humanos (Vieco-Saiz et al., 2019).
También se ha señalado que los APC alteran el microbioma intestinal y, en consecuencia, la modulación del sistema inmunitario, además de afectar negativamente a la ganancia de peso, disminuyendo sustancialmente la producción. Sin embargo, la eliminación de los APC ha aumentado la incidencia de enfermedades en los animales (Bajagai et al., 2016; Jha et al., 2019).
Muchos aditivos para piensos son conocidos por sus propiedades antimicrobianas. Por ello, los fitobióticos (aditivos para piensos de origen vegetal), los ácidos orgánicos, la quitina, los ácidos grasos de cadena media (ácido caproico, ácido cáprico, ácido láurico y ácido caprílico) y larga (ácidos grasos poliinsaturados), los prebióticos, las enzimas, los péptidos antimicrobianos, las IgY hiperinmunes, los bacteriófagos y las arcillas se han utilizado como alternativas para reproducir los efectos de los APC.
Sus efectos positivos incluyen:
 Prevención de enfermedades microbianas
Prevención de enfermedades microbianas
 Inmunomodulación
Inmunomodulación
 Mejora de la calidad de los productos avícolas
Mejora de la calidad de los productos avícolas
 Mejora de la ingesta de alimentos y del índice de conversión alimentaria (IC)
Mejora de la ingesta de alimentos y del índice de conversión alimentaria (IC)
Sin embargo, estos aditivos para piensos tienen varias desventajas, por ejemplo:
 Los fitobióticos tienen partes tóxicas (Ogbuewu et al., 2020).
Los fitobióticos tienen partes tóxicas (Ogbuewu et al., 2020).
 Los ácidos orgánicos han mostrado inestabilidad, corrosividad y olor desagradable, pudiendo alterar las bacterias lácticas presentes en el tracto gastrointestinal (El-Hack et al., 2020).
Los ácidos orgánicos han mostrado inestabilidad, corrosividad y olor desagradable, pudiendo alterar las bacterias lácticas presentes en el tracto gastrointestinal (El-Hack et al., 2020).
 Khempaka et al. (2006) informaron de la reducción de la digestibilidad y el rendimiento del crecimiento en pollos debido al uso de quitina como aditivo alimentario.
Khempaka et al. (2006) informaron de la reducción de la digestibilidad y el rendimiento del crecimiento en pollos debido al uso de quitina como aditivo alimentario.
 Los ácidos grasos de cadena media y larga provocan enfermedades coronarias y problemas de depresión (Thapa, 2020).
Los ácidos grasos de cadena media y larga provocan enfermedades coronarias y problemas de depresión (Thapa, 2020).
 Los tensioactivos tienen efectos bactericidas y bacteriostáticos, pero pueden causar contaminación ambiental dejando rastros en los medios terrestres y acuáticos (Viegas y Sa-Correia, 1991).
Los tensioactivos tienen efectos bactericidas y bacteriostáticos, pero pueden causar contaminación ambiental dejando rastros en los medios terrestres y acuáticos (Viegas y Sa-Correia, 1991).
 Otros aditivos para piensos dependen de la dosis y muestran efectos secundarios adversos.
Otros aditivos para piensos dependen de la dosis y muestran efectos secundarios adversos.

Figura 1. Diferentes aditivos para piensos utilizados en la producción avícola.

El método de detoxificación más empleado en la industria avícola es el uso de adsorbentes de micotoxinas de amplio espectro (agentes secuestrantes) en los piensos.
⇰ Es habitual utilizar una combinación de Picrorhiza kurroa, carbón activado, aluminosilicato de calcio hidratado (HSCAS), manano-oligosacáridos (MOS), ácidos orgánicos tamponados y antioxidantes. Sin embargo, estos compuestos tienen menos afinidad por las micotoxinas (Huang et al., 2019).
 Teniendo en cuenta todos estos inconvenientes, los agentes probióticos alternativos de biocontrol han demostrado su versatilidad y compatibilidad para disminuir los problemas de resistencia bacteriana a los antibióticos, prevenir y controlar enfermedades, disminuir las tasas de mortalidad y mejorar el crecimiento de los animales de granja. De ahí que puedan ser útiles en la industria avícola.
Teniendo en cuenta todos estos inconvenientes, los agentes probióticos alternativos de biocontrol han demostrado su versatilidad y compatibilidad para disminuir los problemas de resistencia bacteriana a los antibióticos, prevenir y controlar enfermedades, disminuir las tasas de mortalidad y mejorar el crecimiento de los animales de granja. De ahí que puedan ser útiles en la industria avícola.
Tratamientos basados en probióticos frente a las complicaciones microbianas
El término «Probiótico» es una palabra griega que significa «pro vida». Los probióticos han ido adquiriendo mayor relevancia terapéutica a lo largo de los años con el aumento de los conocimientos científicos sobre su asociación con la salud intestinal y la inmunidad, lo que redunda en el bienestar general de los animales/humanos. Suelen tener un origen natural, ya que proceden de productos alimentarios o vegetales fermentados y/o del tracto intestinal de animales y humanos (Clarke et al., 2012).

 La FAO/OMS (Organización de las Naciones Unidas para la Agricultura y la Alimentación/ Organización Mundial de la Salud, 2001) definió estos organismos beneficiosos como “Microbios vivos que, cuando se administran en cantidades adecuadas, afectan beneficiosamente a la salud del huésped”.
La FAO/OMS (Organización de las Naciones Unidas para la Agricultura y la Alimentación/ Organización Mundial de la Salud, 2001) definió estos organismos beneficiosos como “Microbios vivos que, cuando se administran en cantidades adecuadas, afectan beneficiosamente a la salud del huésped”.
Los organismos probióticos potenciales no son patógenos y están generalmente reconocidos como seguros (GRAS). Son capaces de resistir los efectos de los jugos gástricos/intestinales, mostrando:
 Un perfil de resistencia a los antibióticos
Un perfil de resistencia a los antibióticos
 Tolerancia a la bilis
Tolerancia a la bilis
 Adhesión a las células epiteliales intestinales
Adhesión a las células epiteliales intestinales
 Producción de sustancias antimicrobianas como bacteriocinas, ácidos orgánicos, ésteres, ácidos grasos, diacetilo, reuterina, reutericiclina y peróxido de hidrógeno que presenta propiedades antimicrobianas
Producción de sustancias antimicrobianas como bacteriocinas, ácidos orgánicos, ésteres, ácidos grasos, diacetilo, reuterina, reutericiclina y peróxido de hidrógeno que presenta propiedades antimicrobianas
(Coman et al., 2014)
Además, el antagonismo es una de las estrategias más importantes de control de los probióticos basada en dos mecanismos básicos:
1. Exlusión competitiva:
 Competencia por los nutrientes
Competencia por los nutrientes
 Producción de compuestos antimicrobianos
Producción de compuestos antimicrobianos
 Prevención de la adhesión de patógenos a las células epiteliales
Prevención de la adhesión de patógenos a las células epiteliales
 Reducción de la biodisponibilidad de las toxinas
Reducción de la biodisponibilidad de las toxinas
2. La modulación inmunitaria que implica la estimulación de los sistemas de defensa del hospedador (Solis-cruz et al., 2018; Patlan et al., 2019).
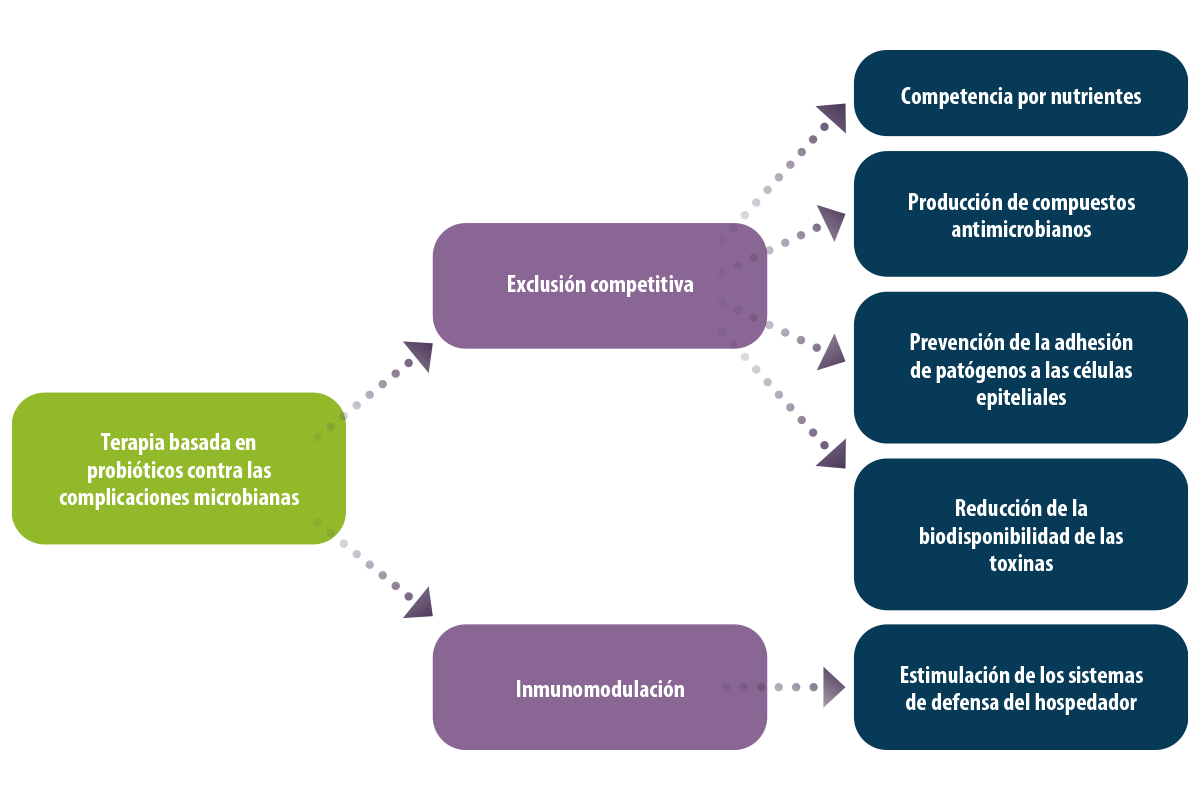
Figura 2. Terapia basada en probióticos para combatir los patógenos dañinos en la industria avícola.
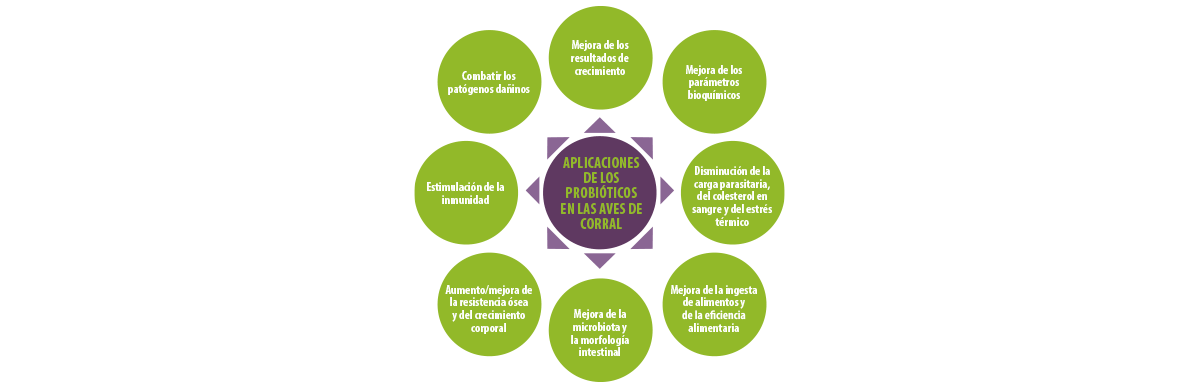
Figura 3. Aplicaciones de los probióticos en la producción avícola.
Probióticos frente a bacterias patógenas 
Los probióticos han sido ampliamente evaluados y validados frente a los patógenos bacterianos.
Se han publicado numerosos artículos sobre el uso de probióticos como alternativa a los antibióticos al reducir el crecimiento de patógenos como Salmonella paratyphi (Divyashree et al., 2021), E. coli (Tsai et al., 2010), Listeria monocytogenes (Gil De Los Santos et al., 2012) y Clostridium perfringens (Santos, 2012) en modelos in vitro e in vivo. Por ejemplo:

Saccharomyces cerevisiae, al 0,4% y al 0,8%, redujo la carga microbiana gastrointestinal de E. coli, Micrococcus spp., Klebsiella spp., Staphylococcus spp., Campylobacter spp. y Clostridium perfringens en ponedoras (Hassanein et al., 2010).
Pollos de engorde suministrados Lactobacillus salivarius por vía oral presentaron una prevención eficaz de la colonización intestinal de Campylobacter jejuni (Saint-Cyr et al., 2017). En otro estudio, la administración de bacteriocinas (250 mg) de Lactobacillus salivarius y Paenibacillus polymyxa mostró una reducción de la colonización de C. jejuni (Timbermont et al., 2010).

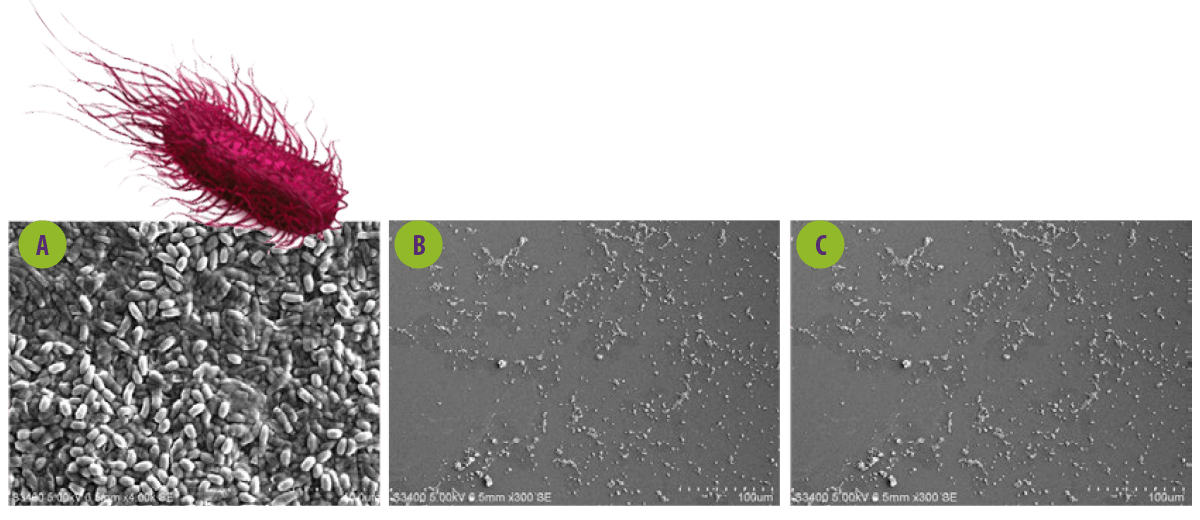
Figura 4. Imagen de microscopía electrónica de barrido del efecto del sobrenadante libre de células de los probióticos sobre las biofilms de Salmonella. A. MEB de Salmonella paratyphi ATCC 9150. B y C. S. paratyphi tratada con Lactobacillus spp.
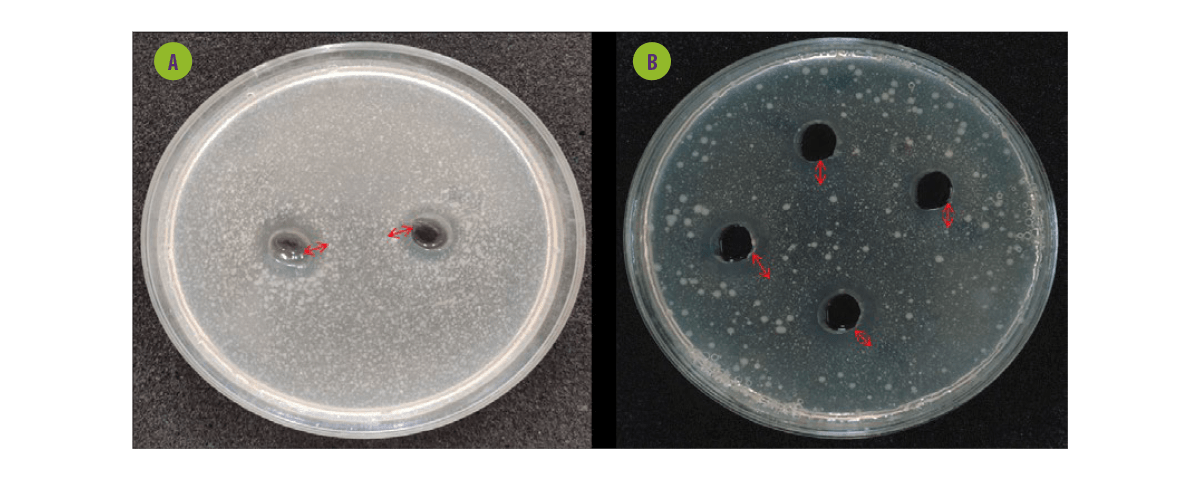
Figura 5. Ensayo de difusión en pocillos de agar de probióticos frente a bacterias patógenas transmitidas por los alimentos. A. Sobrenadante de probióticos libre de células sobre Escherichia coli. B. Sobrenadante de probióticos libre de células sobre Salmonella paratyphi.
Probióticos frente a hongos y sus micotoxinas 
Los probióticos son bien conocidos por su actividad antifúngica y por inactivar las micotoxinas en las aves de corral.
![]() Un estudio realizado por Deepthi et al. (2017), señaló el papel significativo de L. plantarum MYS6 en la mitigación de la toxicidad inducida por FB1 (fumonisina producida por Fusarium verticilliodes) en los órganos vitales y el posterior estrés oxidativo en los pollos de engorde.
Un estudio realizado por Deepthi et al. (2017), señaló el papel significativo de L. plantarum MYS6 en la mitigación de la toxicidad inducida por FB1 (fumonisina producida por Fusarium verticilliodes) en los órganos vitales y el posterior estrés oxidativo en los pollos de engorde.
![]() Lacticaseibacillus brevis MYSN105 y L. plantarum MYS6 mostraron una potencial actividad antagonista al producir alteraciones morfológicas, como micelios dañados y conidios deformados, en F. verticillioides y F. proliferatum productores de fumonisinas, respectivamente, en ensayos in vitro (Somashekaraiah et al., 2021; Deepthi et al., 2016).
Lacticaseibacillus brevis MYSN105 y L. plantarum MYS6 mostraron una potencial actividad antagonista al producir alteraciones morfológicas, como micelios dañados y conidios deformados, en F. verticillioides y F. proliferatum productores de fumonisinas, respectivamente, en ensayos in vitro (Somashekaraiah et al., 2021; Deepthi et al., 2016).
![]() El sobrenadante libre de células (SLC) de la cepa MYS44 de Lactobacillus plantarum se ha sugerido como un potencial agente de detoxificación debido a su actividad antifúngica y su capacidad para reducir el nivel de aflatoxina B1 (34,2%) producida por Aspergillus parasiticus MTCC 411 (Rao et al., 2017).
El sobrenadante libre de células (SLC) de la cepa MYS44 de Lactobacillus plantarum se ha sugerido como un potencial agente de detoxificación debido a su actividad antifúngica y su capacidad para reducir el nivel de aflatoxina B1 (34,2%) producida por Aspergillus parasiticus MTCC 411 (Rao et al., 2017).

Figura 6. Uso de probióticos contra especies de Aspergillus.
A. Actividad antifúngica de Lactobacillus frente a Aspergillus flavus.
B. Actividad antifúngica de Lactobacillus frente a Aspergillus parasiticus

Figura 7. Uso de probióticos contra especies de Fusarium. La actividad antifúngica de los aislados de LAB se probó contra F. sporotrichioides (1), F. equiseti (2), F. poea (3), F. avenaceum (4), F. verticillioides (5), F. graminearum (6), A. parasiticus (7) y Rhizopus oryzae (8).
A. Placas de control de hongos tras 7 días de incubación.
B. Actividad antifúngica del aislado Lactobacillus plantarum MYSRD 71 tras 7 días de incubación contra todas las especies fúngicas evaluadas.
Se han realizado varios estudios para evaluar la capacidad de neutralización de micotoxinas de varias cepas probióticas como Propionibacterium, L. rhamnosus GG, L. plantarum, L. casei, especies de Bacillus y E. faecium (Danicke y Doll, 2010).
⇰ Por ejemplo, Saccharomyces cerevisiae pudo adsorber zearalenona y ocratoxina en condiciones gastrointestinales simuladas en un ensayo de unión a micotoxinas (Armando et al., 2012).
En los estudios realizados por Patlan et al. (2019), los probióticos de Bacillus spp. fueron capaces de biodegradar la aflatoxina B1 en modelos in vitro e in vivo de broilers.
En otro estudio, L. casei y L. reuteri redujeron el estrés oxidativo inducido por aflatoxinas en ratones (Hernández-Mendoza et al., 2011).
Probióticos para el control de patógenos virales 
Los probióticos también se han utilizado para controlar los virus en las aves de corral.
![]() La administración de L. paracasei protegió frente a la diarrea inducida por rotavirus (Pant et al., 2006), mientras que un estudio realizado por Wen et al. (2009) con L. acidophilus y L. reuteri disminuyó las infecciones por rotavirus al aumentar el IFN- ץ y la IL-4 en el suero.
La administración de L. paracasei protegió frente a la diarrea inducida por rotavirus (Pant et al., 2006), mientras que un estudio realizado por Wen et al. (2009) con L. acidophilus y L. reuteri disminuyó las infecciones por rotavirus al aumentar el IFN- ץ y la IL-4 en el suero.
![]() Naseem et al. (2012) reportaron que los broilers alimentados con dietas suplementadas con proteína de Lactobacillus tenían mayores títulos de anticuerpos en comparación con los controles frente a la bursitis infecciosa, la enfermedad de la influenza y el virus de la enfermedad de Newcastle.
Naseem et al. (2012) reportaron que los broilers alimentados con dietas suplementadas con proteína de Lactobacillus tenían mayores títulos de anticuerpos en comparación con los controles frente a la bursitis infecciosa, la enfermedad de la influenza y el virus de la enfermedad de Newcastle.
Aplicaciones adicionales de los probióticos en las aves de corral
Efectos de los probióticos en el crecimiento 
En la producción avícola, se utilizan varias estrategias para mejorar el número de huevos puestos, aumentar el peso del huevo y mejorar la calidad de la cáscara, el colesterol de la yema, la calidad de la albúmina y la calidad de la carne.
La administración de probióticos con las dietas de las gallinas mejora la puesta al aumentar la retención de nitrógeno y calcio, así como el consumo diario de alimento.
⇰ Se ha propuesto que los probióticos aumentan la producción de ácidos grasos de cadena corta (SCFA) y la tasa de fermentación intestinal, proporcionando nutrientes a las células epiteliales intestinales, lo que también conduce a una mejor asimilación de minerales (Alagawany et al., 2018).
Un estudio realizado por Abd EI-Hack et al. (2017) demostró que la suplementación con probióticos de múltiples cepas aumentaba la producción de huevos, incluyendo el peso de la albúmina y la yema, el peso y el tamaño del huevo, y la resistencia y el grosor de la cáscara del huevo en comparación con el grupo de control.
Disminución de la carga parasitaria, del colesterol en sangre y efecto significativo sobre el estrés térmico 
 Recientemente, investigadores han demostrado que la suplementación dietética de probióticos disminuye el nivel de colesterol, lipoproteínas de muy baja densidad (VLDL) y triglicéridos en la sangre (Kanani et al., 2018; Shirley et al., 2017).
Recientemente, investigadores han demostrado que la suplementación dietética de probióticos disminuye el nivel de colesterol, lipoproteínas de muy baja densidad (VLDL) y triglicéridos en la sangre (Kanani et al., 2018; Shirley et al., 2017).
 Lee et al. (2007) demostraron que la suplementación de probióticos aumenta la resistencia a la coccidiosis (depresión del crecimiento) y reduce el nivel de infección por Eimeria tenella y E. acervulina en las aves de corral.
Lee et al. (2007) demostraron que la suplementación de probióticos aumenta la resistencia a la coccidiosis (depresión del crecimiento) y reduce el nivel de infección por Eimeria tenella y E. acervulina en las aves de corral.
 El estrés térmico aumenta la colonización de patógenos y la inmunosupresión, favoreciendo la aparición de infecciones (Ursell et al., 2012). A este respecto, se ha demostrado que alimentar a los broilers con probióticos mitiga el impacto del estrés térmico, al mantener una microbiota intestinal sana en condiciones ambientales estresantes y aumentar la longitud de las vellosidades.
El estrés térmico aumenta la colonización de patógenos y la inmunosupresión, favoreciendo la aparición de infecciones (Ursell et al., 2012). A este respecto, se ha demostrado que alimentar a los broilers con probióticos mitiga el impacto del estrés térmico, al mantener una microbiota intestinal sana en condiciones ambientales estresantes y aumentar la longitud de las vellosidades.
Estimulación de la inmunidad y mejora de los parámetros bioquímicos 
Los patógenos deben superar obstáculos (la barrera física del epitelio, los efectos inhibidores de la microbiota intestinal y la respuesta del sistema inmunitario del hospedador) para colonizar el tracto intestinal y provocar con éxito una infección. Sin embargo, los probióticos son bien conocidos por la modulación de los entornos intestinales.
![]() Se unen a los receptores Toll-like de las células centinela (células epiteliales y dendríticas del intestino) y activan las vías NF-κB y MAP quinasa (Bai et al., 2013).
Se unen a los receptores Toll-like de las células centinela (células epiteliales y dendríticas del intestino) y activan las vías NF-κB y MAP quinasa (Bai et al., 2013).
⇰ Esta activación provoca la supresión o la expresión de genes que regulan la presentación de antígenos, así como efectos citoprotectores a través de la activación inmunitaria, la respuesta inflamatoria y la expresión de factores antimicrobianos (Kemgang et al., 2014).
![]() Sus beneficios incluyen el aumento de la adhesión de las bacterias beneficiosas a la mucosa intestinal, la mejora de la barrera epitelial y la inhibición de la adhesión de patógenos (Broom y Kogut, 2018).
Sus beneficios incluyen el aumento de la adhesión de las bacterias beneficiosas a la mucosa intestinal, la mejora de la barrera epitelial y la inhibición de la adhesión de patógenos (Broom y Kogut, 2018).
Numerosos estudios han demostrado el impacto de los probióticos en los parámetros bioquímicos, por ejemplo, la mejora de los niveles de glucosa en sangre, ácidos grasos poliinsaturados omega 6 y esenciales (ácido linoleico y ácido linolénico) y propionato (SCFA) en la yema de huevo (Tang et al., 2016; Ejtahed et al., 2012; Trautwein et al., 1998).
Mejora de la resistencia ósea y aumento del crecimiento corporal, de la ingesta de alimentos y de la eficiencia alimentaria 
Los probióticos modulan el entorno intestinal, mejoran la función de barrera y promueven el crecimiento de los animales de corral (Deepthi et al., 2017). Al colonizar el intestino, compiten con los patógenos por los nutrientes y evitan su establecimiento. Además, aumentan el peso corporal, la ingesta de alimentos y la eficiencia alimentaria (Jadhav et al., 2015).

Además, la suplementación con probióticos en la alimentación de las aves de corral también mejoró el grosor de la pared medial y lateral de la tibia y el índice tibiotarsal, que son indicadores de la resistencia ósea.
Influencia de los probióticos en la microbiota y morfología intestinal 

Se ha demostrado que la suplementación de probióticos para el tratamiento dietético influye en la longitud de las vellosidades intestinales y disminuye la profundidad de las criptas al mejorar el desarrollo de la microbiota intestinal para el control de la población de patógenos.
⇰ Por lo tanto, las criptas de los enterocitos reemplazan las células que se han perdido debido a la inflamación en la punta de la vellosidad mediante una proliferación continua (Cox y Dalloul.2009: Awad et al., 2009).
CONCLUSIONES

REFERENCIAS
Abd El-Hack, M.E.; Mahgoub, S.A.; Alagawany, M.; Ashour, E.A., 2017. Improving productive performance and mitigating harmful emissions from laying hen excreta via feeding on graded levels of corn DDGS with or without Bacillus subtilis probiotic. J. Anim. Physiol. Anim. Nutr. 101, 904–913.
Alagawany, M.; Abd El-Hack, M.E.; Farag, M.R.; Sachan, S.; Karthik, K.; Dhama, K.,2018. The use of probiotics as eco-friendly alternatives for antibiotics in poultry nutrition. Environ. Sci. Pollut. Res. 25, 10611–10618.
Angel, R.; Dalloul, R.A. & Doerr, J., 2005. Performance of broilers chickens fed diets supplemented with a direct-fed microbial. Poultry Science, Vol.84, (August 2005), pp. 1222-1231, ISSN 1525-3171.
Armando, M. R.; Pizzolitto, R. P.; Dogi, C. A.; Cristofolini, A.; Merkis, C,; Poloni, V. L., et al. 2012. Adsorption of ochratoxin A and zearalenone by potential probiotic Saccharomyces cerevisiae strains and its relation with cell wall thickness. Journal of Applied Microbiology, 113, 256–264.
Awad, W. S; Ghareeb and J. Bohm, 2009. Probiotic and symbiotic on growth performance, organ weights and intestinal histomorphology of broiler chickens. Poultry Science, 88: 49-56.
Bajagai, Y.S.; Klieve, A.V.; Dart, P.J.; Bryden, W.L.,2016. Animal Production and Health Div Probiotics. In Animal Nutrition: Production, Impact and Regulation; Food and Agriculture Organization of the United Nations: Rome, Italy; ISBN 978-92-5-109333-7.
Bai, S.P.; Wu, A.M.; Ding, X.M.; Lei, Y.; Bai, J.; Zhang, K.Y.; Chio, J.S.,2013. Effects of probiotic-supplemented diets on growth performance and intestinal immune characteristics of broiler chickens. Poult. Sci. 92, 663–670
Clarke G.; Cryan, J.F.; Dinan, T.G.; et al. 2012. Review article: probiotics for the treatment of irritable bowel syndrome: focus on lactic acid bacteria. Aliment Pharmacol Ther 35(4):403–413
Coman, M. M.; Verdenelli, M. C.; Cecchini, C.; Silvi, S.; Orpianesi, C.; Boyko, N.; & Cresci, A., 2014. In vitro evaluation of antimicrobial activity of Lactobacillus rhamnosus IMC 501®, Lactobacillus paracasei IMC 502® and SYNBIO® against pathogens. Journal of Applied Microbiology, 117(2), 518–527. doi:10.1111/jam.12544
Cox, C.M.; and R. Dalloul,, 2009. Immuno-modulatory role of probiotics in poultry and potential in ova application. Beneficial microbes, 61: 45-52
Danicke, S.; & Doll, S., 2010. A probiotic feed additive containing spores of Bacillus subtilis and B. licheniformis does not prevent absorption and toxic effects of the Fusarium toxin deoxynivalenol in piglets. Food and Chemical Toxicology, 48, 152–158
Deepthi, B.V.; Poornachandra Rao, K.; Chennapa, G.; Naik, M.K.; Chandrashekara, K.T.; Sreenivasa, M.Y., 2016 Antifungal Attributes of Lactobacillus plantarum MYS6 against Fumonisin Producing Fusarium proliferatum Associated with Poultry Feeds. PLoS ONE 11(6): e0155122. https://doi.org/10.1371/journal.pone.0155122
Deepthi, B. V.; Somashekaraiah, Rakesh; Poornachandra Rao, K.; Deepa, N.; Dharanesha, N. K.; Girish, K. S.; Sreenivasa, M. Y. 2017. Lactobacillus plantarum MYS6 Ameliorates Fumonisin B1-Induced Hepatorenal Damage in Broilers. Frontiers in Microbiology, 8, 2317–. doi:10.3389/fmicb.2017.02317
Dhama, K.; Mahendran, M.; Simmi Tomar,; and Chauhan, R. S., 2008. Beneficial effects of probiotics and prebiotics in livestock and poultry: the current perspectives. Intas Polivet, 9(1): 1-13.
Huang, W.; Chang, J.; Wang, P.; Liu, C.; Yin, Q.; Song, A.; Gao, T.; Dang, X.; & Lu, F. ,2019. Effect of Compound Probiotics and Mycotoxin Degradation Enzymes on Alleviating Cytotoxicity of Swine Jejunal Epithelial Cells Induced by Aflatoxin B₁ and Zearalenone. Toxins, 11(1), 12. https://doi.org/10.3390/toxins11010012
Ejtahed, H.S.; Mohtadi-Nia, J.; Homayouni-Rad, A.; Niafar, M.; Asghari-Jafarabadi, M.; and Mofid, V., 2012. Probiotic yogurt improves antioxidant status in type 2 diabetic patients. Nutrition. 28, 539-543.
El-Hack, M.A.; Shafi, M.; Alghamdi, W.; Abdelnour, S.; Shehata, A.; Noreldin, A.; Ashour, E.; Swelum, A.; Al-Sagan, A.; Alkhateeb, M. et al. 2020. Black Soldier Fly (Hermetia illucens) Meal as a Promising Feed Ingredient for Poultry: A Comprehensive Review. Agriculture 10, 339.
Gil de los Santos, J. R.; Storch, O. B.; Fernandes, C. G., & Gil-Turnes, C., 2012. Evaluation in broilers of the probiotic properties of Pichia pastoris and a recombinant P. pastoris containing the Clostridium perfringens alpha toxin gene. Veterinary Microbiology, 156, 448–451.
Hassanein, S.M.; Soliman, N.K., 2010. Effect of Probiotic (Saccharomyces cerevisiae) Adding to Diets on Intestinal Microflora and Performance of Hy-Line Layers Hens. Journal of American Science. 6:159-169
Hernandez-Mendoza, A.; Gonza´lez-Co´rdova, A. F.; Vallejo-Cordoba, B.; & Garcia, H. S., 2011. Effect of oral supplementation of Lactobacillus reuteri in reduction of intestinal absorption of aflatoxin B1 in rats. Journal of Basic Microbiology, 51, 263–268.
Hussain, Z.; Muhammad Zargham Khan, Ahrar Khan; Ijaz Javed; Muhammad Kashif Saleemi; Sultan Mahmood; Muhammad Rafique Asi., 2010. Residues of aflatoxin B1 in broiler meat: Effect of age and dietary aflatoxin B1 levels. , 48(12), 0–3307. doi:10.1016/j.fct.2010.08.016
Jadhav, K.; Katoch, S.; Sharma, V.K.; Mane, B.G., 2015. Probiotics in Broiler Poultry Feeds: A Review. J. Anim. Nutr. Physiol. 1, 4–16
Jha, R.; Fouhse, J.M.; Tiwari, U.P.; Li, L., 2019. Willing, B.P. Dietary Fiber and Intestinal Health of Monogastric Animals. Front. Vet. Sci. 6, 48.
Jha, R.; Razib Das,; Sophia Oak and Pravin Mishra., 2020. Probiotics (Direct-Fed Microbials) in Poultry Nutrition and Their Effects on Nutrient Utilization, Growth and Laying Performance, and Gut Health: A Systematic Review. Animals 10, 1863; doi: 10.3390/ani10101863.
Kanani, P.B.; Hosseintabar, B. G.; Youvalari, S.A.; Seidavi, A.; Ragni, M.; Laudadio, V., and Tufarelli, V., 2018. Effects of using artemisia annua leaves, probiotic blend, and organic acids on performance, egg quality, blood biochemistry, and antioxidant status of laying hens. The Journal of Poultry Science 56:120-127.
Kemgang, T.S.; Kapila, S.; Shanmugam, V.P.; Kapila, R., 2014. Cross-talk between probiotic lactobacilli and host immune system. J. Appl. Microbiol. 117, 303–319
Khempaka, S.; Mochizuki, M.; Koh, K.; Karasawa, Y., 2006. Effect of Chitin in Shrimp Meal on Growth Performance and Digestibility in Growing Broilers. J. Poult. Sci. 43, 339–343.
Lee, S.H.; Lillehoj, H.S.; Dalloul, R.A.; Park, D.W.; Hong, Y.H.; Lin, J.J., 2007. Influence of pediococcus-based probiotic on coccidiosis in broiler chickens. Poultry Science. 86:63-66.
Naseem, S.; Rahman, S.U.; Shafee, M.; Sheikh, A.A.; Khan. A..2012. Immunomodulatory and growth-promoting effect of a probiotic supplemented in the feed of broiler chicks vaccinated against infectious bursal disease. Brazilian Journal of Poultry Science. 14:109-113.
Ogbuewu, I.; Okoro, V.; Mbajiorgu, C., 2020. Meta-analysis of the influence of phytobiotic (pepper) supplementation in broiler chicken performance. Trop. Anim. Health Prod. 52, 17–30.
Pant, N.; Hultberg, A.; Zhao, Y. F.; Svensson, L.; Pan-Hammarstrom, Q.; Johansen, K., et al. 2006. Lactobacilli expressing variable domain of llama heavy-chain antibody fragments (lactobodies) confer protection against rotavirus-induced diarrhea. The Journal of Infectious Diseases, 194, 1580–1588.
Pascual, M.; Hugas, M.; Badiola, J.I.; Monfort, J.M.; Garriga, M., 1999. Lactobacillus salivarius CTC2197 prevents Salmonella enteritidis colonization in chickens. Applied Environmental Microbiology. 65:4981-4986
Patlan, D.H.; Bruno Solis-Cruz,; Billy M. Hargis and Guillermo Tellez., 2019. The Use of Probiotics in Poultry Production for the Control of Bacterial Infections and Aflatoxins. DOI: org/10.5772/intechopen.88817.
Poornachandra Rao, K.; Deepthi, B. V.; Rakesh, S.; Ganesh, T.; Achar, Premila; Sreenivasa, M. Y. 2017. Antiaflatoxigenic Potential of Cell Free Supernatant from Lactobacillus plantarum MYS44 Against Aspergillus parasiticus. Probiotics and Antimicrobial Proteins, doi:10.1007/s12602-017-9338-y
Rakesh, Somashekaraiah.; Walid, M.; Adithi, G.; Udith, J.; Riad, H.; and M Y Sreenivasa. 2021. Probiotic and Antifungal Attributes of Levilactobacillus brevis MYSN105, Isolated From an Indian Traditional Fermented Food Pozha. Frontiers in Microbiology. 12:696267. doi: 10.3389/fmicb.2021.696267,
Rodriguez-Diaz, J.; and V. Monedero., 2013. Probiotics against digestive tract viral infections. In Bioactive food as detary interventions for liver and gastrointestinal disease, ed. V. R. Preedy. San Diego, Academic Press, 271–84
Saint-Cyr.; Manuel Jimmy.; Haddad, Nabila.; Taminiau, Bernard.; Poezevara, Typhaine.; Quesne, Ségolène.; Amelot, Michel.; Daube, Georges Chemaly, Marianne.; Dousset, Xavier.; Guyard-Nicodème, Muriel., 2016. Use of the potential probiotic strain Lactobacillus salivarius SMXD51 to control Campylobacter jejuni in broilers. International Journal of Food Microbiology, S016816051630349X–. doi:10.1016/j.ijfoodmicro.2016.07.003
Shirley, G.H.T.; Chin, C.S.; Kalavathy, R.; Wan, Z. S.; Hee, K.W.; and Yin,W.; 2017. Performance, biochemical and haematological responses, and relative organ weights of laying hens fed diets supplemented with prebiotic, probiotic and Symbiotic. BMC Veterinary Research 13:2-12.
Solis-Cruz, B.; Hernandez-Patlan, D.; Hargis, B.; Téllez G., 2018. Control of Aflatoxicosis in Poultry Using Probiotics and Polymers [Online First]. In: Micotoxins-Impact and management strategies. IntechOpen; DOI: 10.5772/intechopen.76371. Available from: https://www.intechopen.com
Tang, C.; Hoo, P.C.; Tan, L.T.; Pusparajah, P.; Khan, T.M.; Lee, L.H.; Goh, B.H., and Chan, K.G., 2016. Golden needle mushroom: A culinary medicine with evidenced-based biological activities and health promoting properties. Front. Pharmacol. 7, 474- 482.
Thapa, P., 2020. Application of micro algae in poultry nutrition: A review. J. Agric. Nat. Resour.
Timmerman, H.M.; Veldman, A.; Van Den Elsen, E.; Rombouts, F.M., Beynen, A.C., 2006. Mortality and growth performance of broilers given drinking water supplemented with chicken specific probiotics. Poultry Science. 85(8):1383-1388.
Trautwein, E.A.; Rieckhoff, D. and Erbersdobler, H. F., 1998. Dietary inulin lowers plasma cholesterol and triacylglycerol and alters biliary bile acid profile in hamsters. J. Nutr. 128, 1937-1943
Tsai, Y. T.; Cheng, P. C., & Pan, T. M., 2010. Immunomodulating activity of Lactobacillus paracasei subsp. paracasei NTU 101 in enterohemorrhagic Escherichia coli O157H7- infected mice. Journal of Agricultural and Food Chemistry, 58, 11265–11272.
Ursell, L. K.; Clemente, J. C.; Rideout, J. R.; Gevers, D.; Caporaso, J. G., & Knight, R., 2012. The interpersonal and intrapersonal diversity of human-associated microbiota in key body sites. The Journal of Allergy and Clinical Immunology, 129, 1204–1208. https://doi.org/10.1016/j.jaci.2012.03.010
Vieco-Saiz, N.; Belguesmia, Y.; Raspoet, R.; Auclair, E.; Gancel, F.; Kempf, I., & Drider, D., 2019. Benefits and inputs from lactic acid bacteria and their bacteriocins as alternatives to antibiotic growth promoters during food-animal production. Frontiers in Microbiology, 10, 57.
Viegas, C.A.; Sa-Correia, I., 1991. Activation of plasma membrane ATPase of Saccharomyces cerevisiae by octanoic acid. J. Gen. Microbiol. 137, 645–651
Weill, F X.; Guesnier, F.; Guibert, V.; Timinouni, M.; Demartin, M.; Polomack, L., et al., 2006. Multidrug resistance in Salmonella enterica serotype Typhimurium from humans in France (1993 to 2003). Journal of Clinical Microbiology, 44, 700–708
Wen, K.; Azevedo, M. S. P.; Gonzalez, A.; Zhang, W.; Saif, L. J.; Li, G. H., et al., 2009. Toll-like receptor and innate cytokine responses induced by lactobacilli colonization and human rotavirus infection in gnotobiotic pigs. Veterinary Immunology and Immunopathology, 127, 304–315




 Prevención de micotoxicosis
Prevención de micotoxicosis