Abdelhacib Kihal
Departamento de Ciencia Animal y Alimentaria, Universitat Autònoma de Barcelona, España
La presencia de micotoxinas en los piensos es un problema relevante en la industria de la alimentación animal.
Entre los más de 400 tipos de micotoxinas, un grupo de seis micotoxinas representan un alto riesgo para la salud animal y las ganancias productivas, siendo tres especies principales de mohos responsables de su producción:
- ⇰ Fusarium
⇰ Aspergillus
⇰ Penicillium
![]() El desarrollo fúngico depende de las condiciones climáticas donde la temperatura, la humedad y la sequía influyen en el tipo de moho y, como consecuencia, en el tipo de micotoxinas producidas (Schatzmayr y Streit, 2013; Moretti et al., 2019).
El desarrollo fúngico depende de las condiciones climáticas donde la temperatura, la humedad y la sequía influyen en el tipo de moho y, como consecuencia, en el tipo de micotoxinas producidas (Schatzmayr y Streit, 2013; Moretti et al., 2019).

Los adsorbentes de micotoxinas (ADS) pueden reducir la carga de micotoxinas en el tracto gastrointestinal del animal, clasificándose en:
- ⇰ Inorgánicos, como las arcillas y el carbón activado.
- ⇰ Orgánicos, como la pared celular de levaduras.
La unión de las micotoxinas a los adsorbentes se debe principalmente a:
Interacciones químicas
La capacidad de intercambio catiónico involucra diferentes tipos de enlaces como:
- ⇰ Ion-dipolo
- ⇰ Fuerzas de Van der Walls
- ⇰ Enlaces de hidrógeno

Características físicas
- ⇰ Tamaño de los poros del adsorbente
- ⇰ Estructura y forma de la micotoxina
Estas propiedades no son específicas para adsorber micotoxinas, sino que moléculas orgánicas como los amino ácidos o vitaminas también pueden ser absorbidas.
Por ejemplo, Kihal et al. (2020) y Barrientos- Velázquez, (2016) reportaron que la bentonita tiene capacidad para adsorber amino ácidos al 44% y vitaminas al 49%.
La capacidad de adsorción de los adsorbentes de micotoxinas se determina mediante diferentes pruebas in vitro que simulan el tracto gastrointestinal de los animales.
 Estas pruebas sirven como una herramienta de selección para evaluar el porcentaje de adsorción de micotoxinas un tipo de adsorbente antes de pasar los productos con los mejores resultados a pruebas in vivo.
Estas pruebas sirven como una herramienta de selección para evaluar el porcentaje de adsorción de micotoxinas un tipo de adsorbente antes de pasar los productos con los mejores resultados a pruebas in vivo.
Con la ventaja de ser sencillas, rápidas y económicas, estas pruebas se han utilizado ampliamente, pero en ciertas condiciones, generan una variabilidad entre los estudios, siendo necesario que el método esté estandarizado y validado con pruebas in vivo.
 El objetivo de este estudio fue de revisar diferentes estudios in vitro publicados en la bibliografía para evaluar la capacidad de adsorción de micotoxinas de diferentes adsorbentes.
El objetivo de este estudio fue de revisar diferentes estudios in vitro publicados en la bibliografía para evaluar la capacidad de adsorción de micotoxinas de diferentes adsorbentes.
Materiales y métodos
Se realizó una búsqueda bibliográfica exhaustiva para identificar estudios que evaluaron la capacidad de adsorción de micotoxinas in vitro de distintos adsorbentes.
La búsqueda utilizó como palabras clave:
- ⇰ Seis micotoxinas: aflatoxina (AF), deoxinivalenol (DON), fumonisina (FUM), ocratoxina A (OTA), toxina T-2 y zearalenona (ZEN).
- ⇰ Ocho adsorbentes: carbón activado (CA), bentonita, zeolita, clinoptilolita, sepiolita, montmorillonita, aluminosilicato de calcio y sodio hidratado (HSCAS) y pared celular de levaduras (LEV).
- ⇰ Capacidad de adsorción in vitro.
Los estudios se retuvieron si:
- A. Se describía el tipo del adsorbente.
- B. El adsorbente se evaluó individualmente.
- C. Se describía el medio de incubación del experimento.
Los datos recopilados incluyeron las variables predictoras:
 La micotoxina y el adsorbente
La micotoxina y el adsorbente El pH del medio y el tipo de medio de incubación utilizado
El pH del medio y el tipo de medio de incubación utilizado
En general, los artículos seleccionados utilizaron el modelo de concentración única con incubación a un solo valor de pH o con el cambio de un pH bajo a pH alto:
- ⇰ Cuando se utilizaba un solo valor de pH, los medios de incubación fueron: agua, metanol:agua o ácido clorhídrico:agua.
- ⇰ Cuando se utilizaba un cambio de pH (método a dos pasos), se usaron medios de incubación para imitar el pH del tracto gastrointestinal usando medios de fosfato, acetato o citrato. También se identificaron otros medios para simular la digestión gastrointestinal utilizando un medio con enzimas digestivas (pepsina, sales biliares y pancreatina), fluido ruminal o jugo gástrico.
La variable respuesta porcentaje de adsorción se analizó mediante el PROC MIXED de SAS (versión 9.4; SAS Institute Inc., Cary, NC).

Resultados y discusión
Efecto de los medios de incubación sobre la capacidad de adsorción de los adsorbentes
Los estudios in vitro se utilizan para evaluar la capacidad de adsorción de los adsorbentes, pero los resultados pueden verse afectados por las condiciones de incubación que pueden influir en la interacción entre los adsorbentes y las micotoxinas.
El reparto de los datos de adsorción incluidos en el análisis se clasifica en 6 diferentes medios de incubación, la Figura 1 representa el porcentaje de datos para cada medio de incubación.
 El método de dos pasos representó el 69% del total de los datos (Figura 1).
El método de dos pasos representó el 69% del total de los datos (Figura 1).
Los medios de agua y el tracto gastrointestinal simulado representaron el 10% de los datos, los medios de jugo gástrico el 6%, el ácido clorhídrico:agua el 3% y el metanol:agua el 2%.
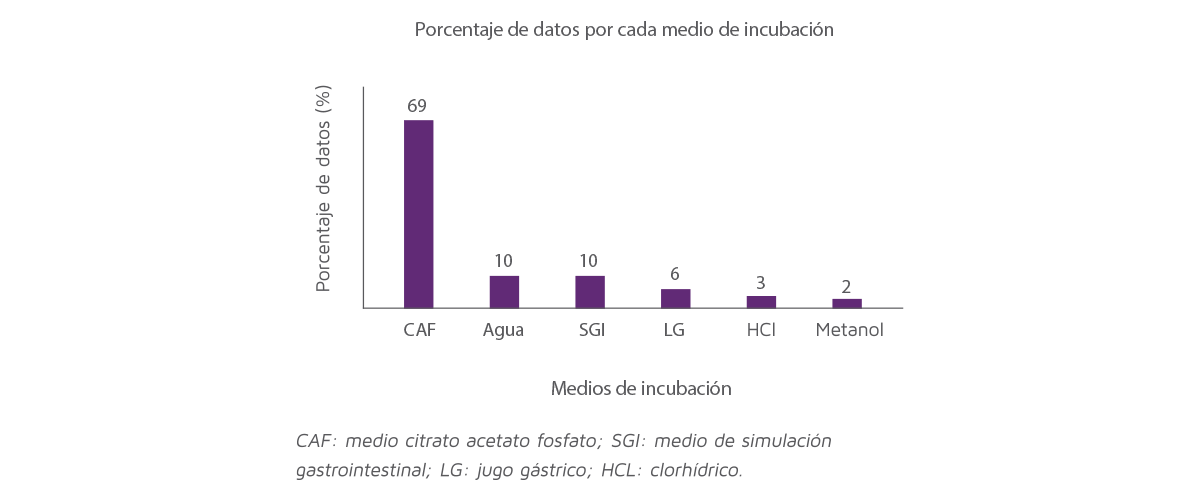
Figura 1. Distribución de los datos incluidos en el análisis entre los diferentes medios de incubación.
El análisis del efecto de los medios sobre la capacidad de adsorción mostró que el jugo gástrico era el único método que difería de los otros métodos de dos pasos (P < 0,05) y, debido a que los resultados se vieron afectados por este método y representaron solo el 6% de los datos, fueron eliminados del conjunto de datos.
La capacidad de adsorción general de diferentes adsorbentes de micotoxinas
La Figura 2 muestra la repartición de datos dentro de los estudios incluidos en este análisis. La gráfica de la izquierda muestra la capacidad de adsorción media para cada de los 8 adsorbentes de micotoxinas para las 6 micotoxinas representadas en la gráfica de la derecha.
Entre los adsorbentes analizados, las LEV y la bentonita tuvieron el mayor número de observaciones (36% y 29% del total de los datos, respectivamente) y la clinoptilolita y la sepiolita tuvieron el menor número de observaciones (2% y 1% de los datos, respectivamente).
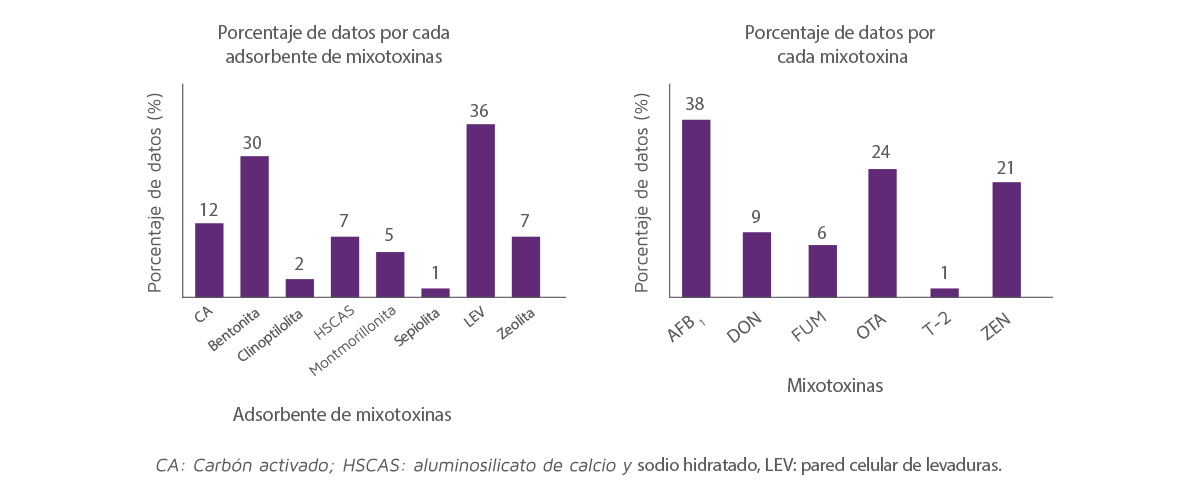
Figura 2. Distribución de los datos incluidos en el análisis para las micotoxinas (derecha) y adsorbentes de micotoxinas (izquierda).
La Tabla 1 muestra los resultados de adsorción de cada adsorbente por cada micotoxina.
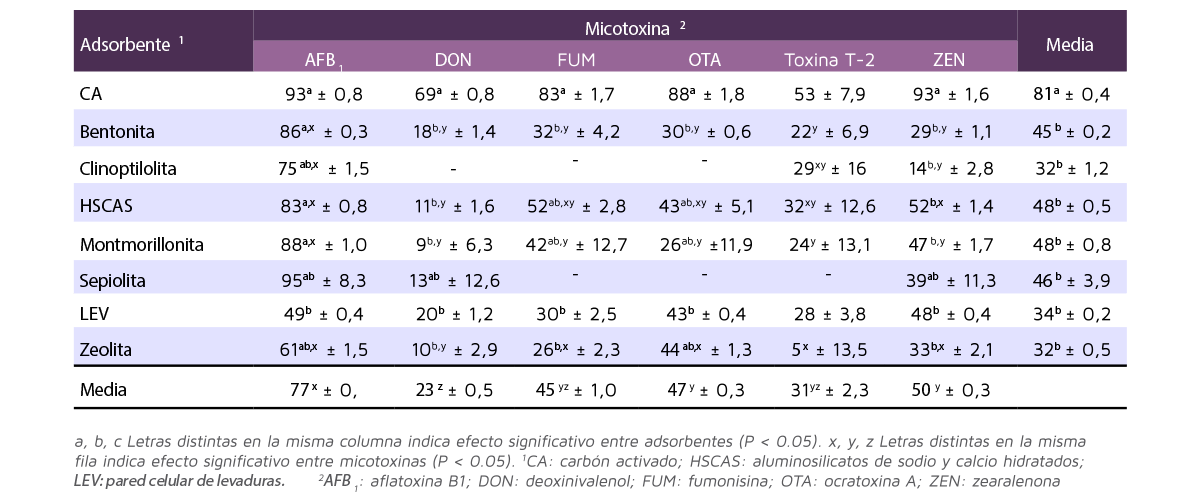
Tabla 1. Porcentaje de adsorción de cada adsorbente de micotoxinas por cada micotoxina (Media ± SEM; adaptada de Kihal et al., 2022).
La capacidad de adsorción fue más alta para el CA (media del 81%) y no fue diferente entre las micotoxinas (rango entre el 53% con la toxina T-2 y el 93% con AFB1).
El resto de adsorbentes tuvieron menor adsorción en comparación con el CA, pero fueron similares entre sí, variando desde el 32% para zeolita hasta el 48% para HSCAS.
- ⇰ La adsorción media del HSCAS (48%) fue más alta para la AFB1 y ZEN, y más baja para el DON.
- ⇰ La adsorción media de la montmorillonita (48%) y bentonita (45%) fue alta para la AFB1 y baja para las demás micotoxinas.
- ⇰ La adsorción media de la sepiolita (46%) y LEV (34%) fue similar entre las micotoxinas, con un rango del 13-20% para el DON y 49% para la AF. Sin embargo, no había datos en los estudios incluidos en el análisis para evaluar la capacidad de adsorción de la sepiolita para las fumonisinas, OTA y toxina T-2.
- ⇰ La adsorción media de la clinoptilolita (32%) fue alta para AFB1 y baja para ZEN, e igual que la sepiolita, para el DON, las fumonisinas y OTA no había datos incluidos.
- ⇰ La adsorción de zeolita (32%) fue alta para la AFB1 y baja para el DON.
⇰ La adsorción media de la bentonita (45%) fue alta para la AFB1 y baja para las otras micotoxinas.
La mayor capacidad de adsorción del CA podría estar relacionada con su mecanismo de adsorción.
CARBÓN ACTIVADO
El tamaño de los poros del CA (nanómetros, nm) es más grande que el espacio interlaminar de las arcillas (angstrom, Å). Por tanto, las micotoxinas con estructuras químicas complejas pueden ingresar más fácilmente en los poros del CA. Además, la activación del CA mejora la capacidad de unión de micotoxinas polares y no polares, lo que lo hace menos selectivo y adsorbe diferentes tipos de micotoxinas.

En los estudios incluidos en esta revisión, las arcillas fueron menos efectivas, con una capacidad de adsorción similar entre los diferentes tipos.
ARCILLAS
El mecanismo de adsorción de las arcillas se basa en su capacidad de intercambio catiónico que incluye diferentes interacciones iónicas débiles. Las variaciones entre las micotoxinas pueden estar asociadas con la capacidad de intercambio de cationes y el espacio interlaminar, lo que varía entre diferentes tipos de arcillas según su origen (Nuryono et al., 2012; De Mil et al., 2015).

PARED CELULAR DE LEVADURAS
La capacidad de adsorción media de la LEV fue similar a la de las arcillas, aunque el mecanismo de adsorción es diferente y se basa en la combinación de estructuras de β-glucanos y micotoxinas (Jouany, 2007, Yiannikouris et. al, 2013).
AFLATOXINAS
La adsorción media fue la más alta para la AFB1 (77%) entre todas las micotoxinas, siendo la más alta para el CA (93%), la bentonita (86%) y la montmorillonita (88%) y la más baja para la LEV (49%).
Dos características principales permiten una alta adsorción de AFB1 a los adsorbentes inorgánicos:
- ⇰ La estructura química pequeña y plana que favorece su entrada en el espacio interlaminar de las arcillas y los poros del CA.
- ⇰ La alta polaridad que facilita la interacción iónica con los adsorbentes.
En cambio, estas propiedades no facilitan su adsorción a LEV.

FUMONISINA & TOXINA T-2
Las propiedades de las aflatoxinas son diferentes a las de otros tipos de micotoxinas como la fumonisina (peso molecular = 721 g/mol) y la toxina T-2 (peso molecular = 466 g/mol), cuyas estructuras químicas son mayores que la de las aflatoxinas (peso molecular = 312 g/mol) y con muchas ramificaciones.
Esta conformación estructural puede limitar la entrada de estas micotoxinas al espacio interlaminar de los adsorbentes a base de arcillas y, en consecuencia, disminuir su capacidad de adsorción.
DEOXINIVALENOL
A pesar de que el peso molecular del DON (296 g/ mol) es menor que el de la AFB1, su adsorción fue menor que la de la AFB1 (77% frente a 23%).
En este caso, podría sugerirse que la baja capacidad de adsorción del DON no está relacionada con su peso molecular o tamaño estructural, sino con sus propiedades químicas, como la baja polaridad o el alto número de átomos estereocéntricos (2 vs 7 para AFB1 y DON, respectivamente) que representan los dobles enlaces incluidos en la estructura química de la micotoxina y pueden afectar las interacciones de los enlaces con los cationes del adsorbente.
El DON tuvo la adsorción media más baja (23%), con la adsorción más alta al CA (69%) y la más baja a LEV (20%), bentonita (18%), HSCAS (11%), zeolita (10%) y montmorillonita (9%), pero la adsorción de sepiolita (13%) no fue diferente debido al bajo número de observaciones (n = 2).
La baja adsorción del DON podría deberse a su hidrofobicidad atribuida a ciclos aromáticos que limitan su unión a los adsorbentes con características hidrofílicas.
ZEARALENONA & OCRATOXINA A
Además de la AFB1, la ZEN (50%) y la OTA (47%) tuvieron una adsorción media similar.
Para la ZEN, la adsorción al CA fue más alta (93%) y más baja en el resto de los adsorbentes (media de 38%), excepto para la sepiolita que no fue diferente (39%) probablemente debido al pequeño número de tratamientos reportados (n = 3).
De manera similar, la adsorción de OTA al CA fue más alta (88%) y más baja en el caso de las LEV (43%) y la bentonita (22%).
Joannis-Cassan et al. (2011) indicaron que el alto potencial de las LEV para adsorber OTA se debe a la alta correlación de manoproteínas en la LEV que representa el factor clave en la adsorción de la OTA. En cambio, para otras micotoxinas, los β-glucanos son el principal factor de adsorción.
FUMONISINAS & TOXINA T-2
Las fumonisinas y la toxina T-2 fueron las micotoxinas con menos observaciones (6% y 1%, respectivamente).
Para las fumonisinas (adsorción media de 45%), la capacidad de adsorción fue mayor en el caso del CA (83%) y menor en bentonita (32%), LEV (30%) y zeolita (26%).
Para la T-2 (media de 31%) la adsorción no fue diferente entre los adsorbentes (varía de 5,3% con zeolita a 53% con CA).
Hay investigaciones limitadas disponibles sobre la capacidad de adsorción de la toxina T-2. Carson y Smith (1983) y Bratich et al. (1990) señalaron que la adsorción de T-2 depende de la dosis del adsorbente y sugirieron que su dosis debe ser 10 veces mayor que la dosis habitual utilizada para la adsorción de aflatoxinas.
Varios estudios han reportado la prevalencia de diferentes tipos de micotoxinas en todo el mundo (Streit et al., 2013; Eloska et al., 2019; Gruber-Dorninger et al., 2019) y los resultados del análisis de las muestras fueron coherentes entre los estudios.
![]() Streit et al. (2013) reportaron datos sobre la prevalencia de micotoxinas entre 2004 y 2011 y demostraron que el DON (64%) y las fumonisinas (63%) fueron los principales contaminantes de los alimentos. Sin embargo, la aparición de las aflatoxinas solo fue importante en el sudeste de Asia, donde aumentó del 33% en 2004 al 70% en 2011. Los autores atribuyeron la alta incidencia de aflatoxinas en esta región al clima cálido de las regiones del sur.
Streit et al. (2013) reportaron datos sobre la prevalencia de micotoxinas entre 2004 y 2011 y demostraron que el DON (64%) y las fumonisinas (63%) fueron los principales contaminantes de los alimentos. Sin embargo, la aparición de las aflatoxinas solo fue importante en el sudeste de Asia, donde aumentó del 33% en 2004 al 70% en 2011. Los autores atribuyeron la alta incidencia de aflatoxinas en esta región al clima cálido de las regiones del sur.
![]() Más tarde, Gruber- Dorninger et al. (2019) reportaron datos sobre la aparición de micotoxinas entre 2008 y 2017, y los resultados también mostraron una alta incidencia de DON (64%) y fumonisinas (60%) y una menor aparición de aflatoxinas (23%).
Más tarde, Gruber- Dorninger et al. (2019) reportaron datos sobre la aparición de micotoxinas entre 2008 y 2017, y los resultados también mostraron una alta incidencia de DON (64%) y fumonisinas (60%) y una menor aparición de aflatoxinas (23%).
![]() Eskola et al. (2019) compararon la prevalencia de micotoxinas de los conjuntos de datos de EFSA (EFSA Ref. 17238686; PAD 2017 017) y de Biomin (Kovalsky et al., 2016), y los resultados mostraron incidencias similares entre los dos conjuntos de datos con la incidencia más alta para la ZEN (80%) y el DON (60%).
Eskola et al. (2019) compararon la prevalencia de micotoxinas de los conjuntos de datos de EFSA (EFSA Ref. 17238686; PAD 2017 017) y de Biomin (Kovalsky et al., 2016), y los resultados mostraron incidencias similares entre los dos conjuntos de datos con la incidencia más alta para la ZEN (80%) y el DON (60%).
Efecto del pH sobre la capacidad de adsorción de los adsorbentes de micotoxinas
Los valores de pH de los medios de incubación se agruparon en 4 rangos:
- ⇰ Bajo: pH 1-4 (42% de los datos)
- ⇰ Intermedio: pH 5-6 (17% de los datos)
- ⇰ Alto: pH 7-9 (33% de los datos)
- ⇰ Métodos de dos pasos (de bajo a alto pH) registrando solo los valores finales de adsorción del procedimiento de incubación.
El análisis de los datos mostró que el pH tiene tendencia en afectar la adsorción de OTA y ZEN (P < 0,08):
- ⇰ La adsorción de OTA fue más alta con el pH de dos pasos (58%) y más baja con el pH bajo (53%) e intermedio (32%).
- ⇰ La adsorción de ZEN fue más alta con el pH de dos pasos (58%) y más baja con el pH bajo (47%), intermedio (49%) y alto (45%).
 Los resultados mostraron que la adsorción de OTA y ZEN es más eficiente cuando se utiliza el método de pH de dos pasos.
Los resultados mostraron que la adsorción de OTA y ZEN es más eficiente cuando se utiliza el método de pH de dos pasos.Es razonable pensar que el pH afecta más la adsorción de moléculas polares (Thieu y Pettersson, 2008).
Sin embargo, las fumonisinas y las aflatoxinas son las micotoxinas más polares y su adsorción no se vio afectada por el pH. Por el contrario, la ZEN es la micotoxina menos polar y se vio afectada por el pH. En este sentido, otros factores podrían influir en la adsorción de micotoxinas como el tamaño y la estructura molecular o la solubilidad.
El análisis de datos también reveló el efecto del pH sobre la capacidad de adsorción de los adsorbentes (Figura 3).
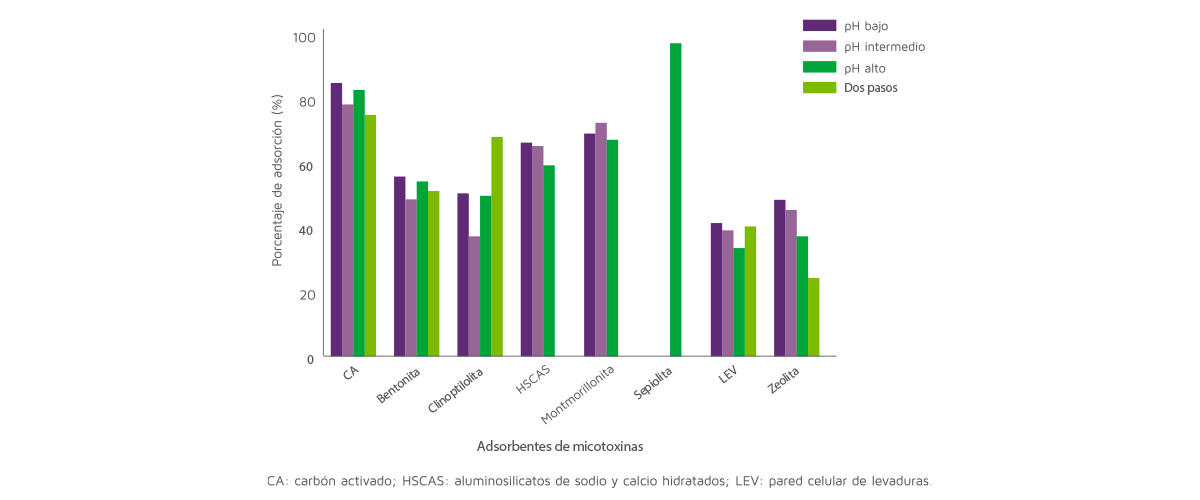
Figura 3. Efecto del pH sobre la capacidad de adsorción de los adsorbentes.
Concretamente, la capacidad de adsorción de las LEV se vio afectada por el pH (P < 0,05) y fue mayor con el pH bajo (43%) y menor con el pH alto (35%).
Estos resultados son consistentes con los de Faucet-Marquis et al. (2014) que reportaron que la capacidad de adsorción de las LEV es mayor a pH bajo o neutro al mejorar la estabilidad de los β-glucanos, responsables de la capacidad de adsorción de las LEV.
CONCLUSIONES
La presencia de micotoxinas en las materias primas se ve afectada por muchos factores y su prevalencia puede cambiar a favor de algunas micotoxinas sobre otras.
La adsorción de micotoxinas en los ensayos in vitro es variable, observándose en los estudios incluidos en esta revisión una mayor capacidad de adsorción en el caso del CA.
En lo que respecta a las micotoxinas, la adsorción de AFB1 fue la más alta y la del DON la más baja.
El pH de los medios in vitro afecta la capacidad de adsorción de LEV, con la mayor adsorción a pH bajo, así como la de OTA y ZEN.
En general, cuando los adsorbentes se utilizan a las dosis recomendadas son efectivas para reducir la biodisponibilidad de las micotoxinas. Sin embargo, es difícil seleccionar el adsorbente apropiado para cada micotoxina.
REFERENCIAS
Bratich, P. M., W. B. Buck, and W. M. Haschek. 1990. Prevention of T-2 toxin-induced morphologic effects in the rat by highly activated charcoal. Arch. Toxicol. 64:251-3. doi:10.1007/BF02010733
Carson, M. S., and T. K. Smith. 1983. Role of bentonite in prevention of T-2 toxicosis in rats. J. Anim. Sci. 57:1498-506. doi:10.2527/jas1983.5761498x
De Mil, T., M. Devreese, S. Baere, E. Van Ranst, M. Eexkhout, P. Backer, and S. Croubels. 2015. Characterization of 27 mycotoxin binders and the relation with in vitro zearalenone adsorption at a single concentration. Toxins. 7:21-33. doi:10.3390/toxins7010021
Eskola, M., G. Kos, C. T. Elliott, J. Hajšlová, S. Mayar, and R. Krska. 2019. Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’ of 25%. Crit. Rev. Food Sci. Nutr. 60:2773-2789. doi:10.1080/10408398.2019.1658570
Faucet-Marquis, V., C. Joannis-Cassan, K. Hadjeba-Medjdoub, N. Ballet, and A. Pfohl-Leszkowicz. 2014. Development of an in vitro method for the prediction of mycotoxin binding on yeast-based products: case of aflatoxin B1, zearalenone and ochratoxin A. App. Micr. Biotech. 98:7583:7596.
Gruber-Dorninger, C., T. Jenkins, and G. Schatzmayr. 2019. Global mycotoxin occurrence in feed: a ten-year survey. Toxins. 11:375. doi:10.3390/toxins11070375
Joannis-Cassan, C., M. Tozlovanu, K. Hadjeba-medjdoub, N. Ballet, and A. Pfohl-leszkowicz. 2011. Binding of zearalenone, aflatoxin b1, and ochratoxin a by yeast-based products: A method for quantification of adsorption performance. J. Food Protec. 74:1175-1185. doi:10.4315/0362-028X.JFP-11-023
Jouany, J. P. 2007. Methods for preventing, decontaminating and minimizing the toxicity of mycotoxins in feeds. Anim. Feed. Sci. Technol. 137:342-362. doi:10.1016/j.anifeedsci.2007.06.009
Jouany, J. P., A. Yiannikouris, and G. Bertin. 2009. Risk assessment of mycotoxins in ruminants and ruminant products. Opt. Mediterr. 85:205-224.
Kihal, A., M. E. Rodríguez-Prado, and S. Calsamiglia. 2022. The efficacy of mycotoxin binders to control mycotoxins in feeds and the potential risk of interactions with nutrient: a review. J. Anim. Sci. 100:1-14. doi:10.1093/jas/skac328
Kovalsky, P., G. Kos, K. Nährer, C. Schwab, T. Jenkins, G. Schatzmayr, M. Sulyok, and R. Krska. 2016. Co-occurrence of regulated, masked and emerging mycotoxins and secondary metabolites in finished feed and maize – An extensive survey. Toxins 8 (12):363. doi:10. 3390/toxins8120363
Moretti, A., M. Pascale, and A. F. Logrieco. 2019. Mycotoxin risks under a climate change scenario in Europe. Trends in Food Sci. Technol. 84:38-40. doi:10.1016/j.tifs.2018.03.008
Nuryono, N., A. Agus, S. Wedhastri, Y. M. S. Maryudhani, D. Pranowo, Yunianto, and E. Razzazi-Fazeli. 2012. Adsorption of aflatoxin B1 in corn on natural zeolite and bentonite. Indo. J. Chem. 12:279 – 28. doi:10.22146/ijc.21343
Schatzmayr, G., and E. Streit. 2013. Global occurrence of mycotoxins in the food and feed chain: facts and figures. World Mycotoxin J. 6: 213-222. doi:10.3920/WMJ2013.1572
Streit, E., K. Naehrer, I. Rodrigues, and G. Schatzmayr. 2013. Mycotoxin occurrence in feed and feed raw materials worldwide: long-term analysis with special focus on Europe and Asia. J. Sci. Food Agric. 93:2892–2899. doi:10.1002/jsfa.6225
Thieu, N. Q., and H. Pettersson. 2015. In vitro evaluation of the capacity of zeolite and bentonite to adsorb aflatoxin B1 in simulated gastrointestinal fluids. Mycotox. Res. 24:124-129. doi:10.1007/BF03032338
Yiannikouris, A., H. Kettunen, J. Apajalahti, E. Pennala, and C. A. Moran. 2013 Comparison of the sequestering properties of yeast cell wall extract and hydrated sodium calcium aluminosilicate in three in vitro models accounting for the animal physiological bioavailability of zearalenone. Food. Addit. Contam. 30:1641-1650. doi:10.1080/19440049.2013.809625




 Prevención de micotoxicosis
Prevención de micotoxicosis