Abdelhacib Kihal
FDVM, MSc, PhD en Producción Animal
Departamento de Ciencia Animal y Alimentaria, Universitat Autònoma de Barcelona, España
Las micotoxicosis ocurren como consecuencia del consumo de alimentos contaminados con micotoxinas.
![]() Los efectos inducidos son subclínicos y difíciles de diagnosticar, pero provocan pérdidas productivas importantes.
Los efectos inducidos son subclínicos y difíciles de diagnosticar, pero provocan pérdidas productivas importantes.
Se han identificado más de 400 micotoxinas, seis de ellas clasificadas como altamente tóxicas y frecuentes en la alimentación animal:
- ⇰ Aflatoxinas
- ⇰ Ocratoxina A
- ⇰ Fumonisinas
- ⇰ Deoxinivalenol
- ⇰ Zearalenona
- ⇰ Toxina T-2
(Krska et al., 2016)

 Un informe reciente indicó que más del 88% de las muestras de alimentos analizadas en 2019 contenían más de una micotoxina (Gruber-Dorninger et al., 2019).
Un informe reciente indicó que más del 88% de las muestras de alimentos analizadas en 2019 contenían más de una micotoxina (Gruber-Dorninger et al., 2019).Entre los diferentes métodos de control de micotoxinas (Figura 1), los adsorbentes de micotoxinas (ADS) son una estrategia eficaz para secuestrar micotoxinas en su matriz y evitar su absorción a través del tracto gastrointestinal (GI) de los animales (Čolović et al., 2019).
⇰ De esta forma, el complejo micotoxina-ADS pasa a través del tracto GI de los animales y se excreta con las heces (Gimeno y Martins, 2007).
La Autoridad Europea de Seguridad Alimentaria (EFSA, 2011) exige que la eficacia del adsorbente de micotoxinas se evalúe mediante una prueba in vitro y dos in vivo.
Estas pruebas deben demostrar una alta afinidad y rapidez para adsorber micotoxinas a una baja tasa de inclusión de los adsorbentes de micotoxinas en las dietas que permita un alto grado de adsorción, pero sin interferencia con otros nutrientes.
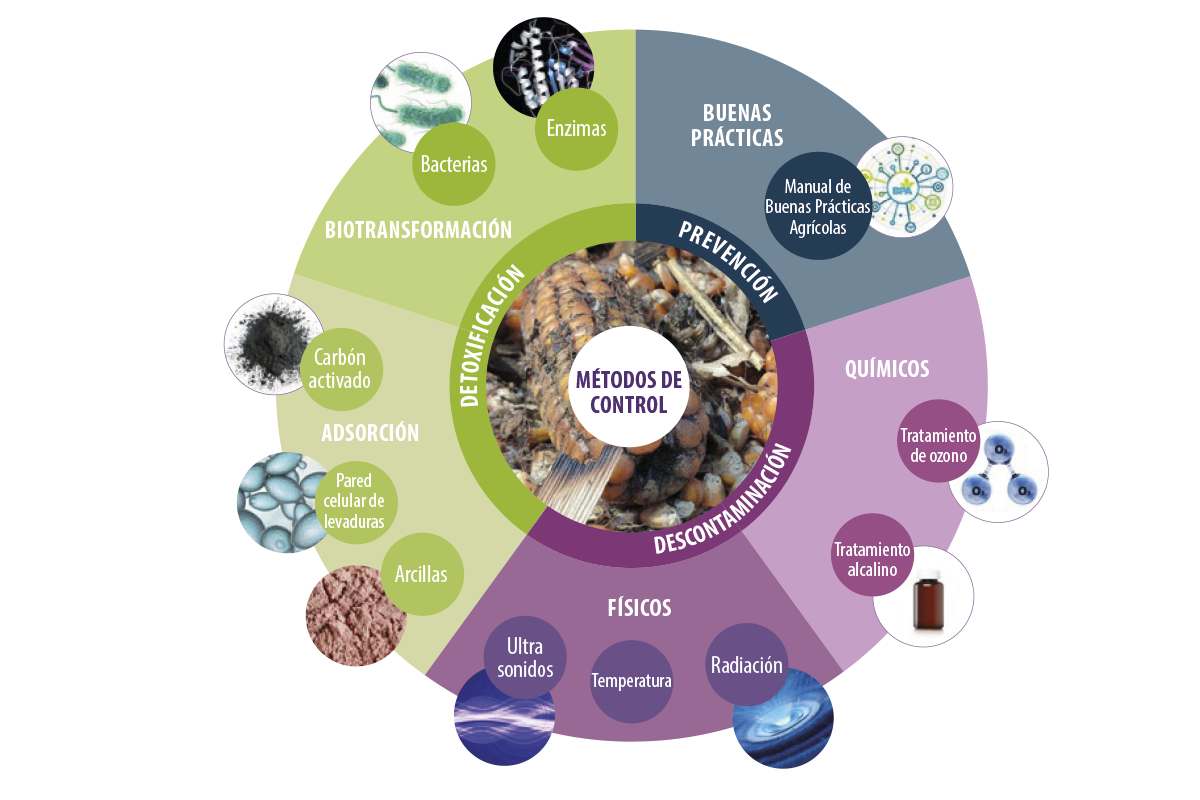
Figura 1. Diferentes métodos de control de micotoxinas.
Clasificación de los adsorbentes de micotoxinas
Los adsorbentes de micotoxinas se clasifican, por su naturaleza, en dos grandes grupos:
- ⇰ Adsorbentes inorgánicos
- ⇰ Adsorbentes orgánicos
Adsorbentes inorgánicos
SILICATOS
Los silicatos representan el grupo más importante de los adsorbentes inorgánicos.
⇰ Las láminas tetraédricas son la base de estos adsorbentes en las que se forman diferentes subgrupos de silicato en combinación con diferentes iones minerales en estructuras bidimensionales o tridimensionales (Figura 2).
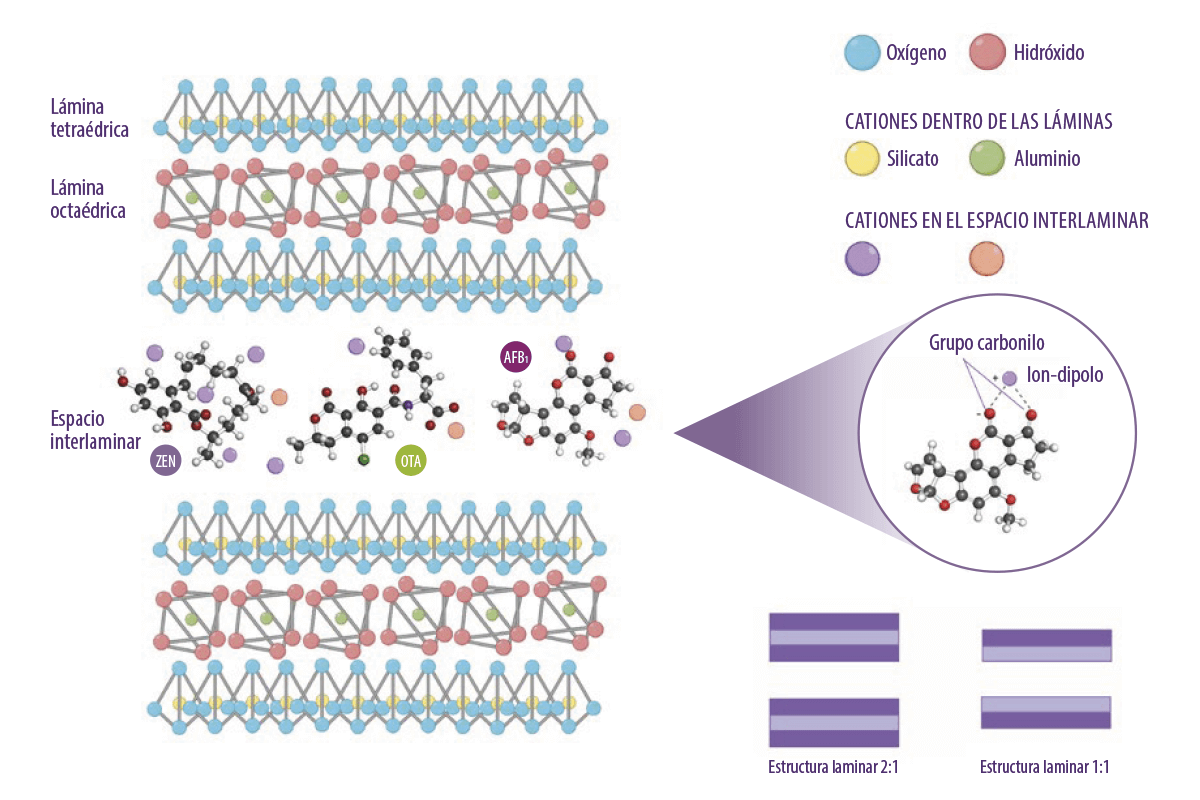
Figura 2. Estructura molecular de láminas octaédricas y tetraédricas de tectosilicato, y una ilustración de la contribución de los iones al mecanismo de adsorción de las micotoxinas (Kihal et al., 2022; creado con BioRender.com).
FILOSILICATOS
Los filosilicatos constituyen el primer grupo de los silicatos. Se forman apilando láminas tetraédricas y octaédricas en dos combinaciones principales:
- ⇰ Una lámina tetraédrica y octaédrica 1:1
- ⇰ Dos láminas tetraédricas y una octaédrica en el medio 2:1
(Figura 2, Murray, 2007)
El espacio interlaminar que queda entre las laminas y la presencia de cationes de diferentes cargas son responsables de determinar la capacidad de adsorción de micotoxinas.
TECTOSILICATOS
El segundo grupo de silicatos es el de los tectosilicatos que se forman mediante el ensamblaje de múltiples estructuras tetraédricas en forma tridimensional.
⇰ Esta disposición genera diferentes poros de la misma dimensión dando una estructura de anillo o jaula. Los poros formados por la estructura tridimensional son la base de la capacidad de adsorción donde los cationes de potasio y calcio presentes dentro interactúan con las micotoxinas (Nadziakiewicza et al., 2019).

CARBÓN ACTIVADO
Aparte de los silicatos, el carbón activado también se clasifica como un adsorbente inorgánico.
Se trata de un polvo no soluble formado por la carbonización de compuestos orgánicos que contienen carbón mediante un proceso de calentamiento por pirólisis a temperaturas de hasta 2.000ºC (Galvano et al., 1996).
⇰ El polvo resultante requiere un proceso de activación necesario para adquirir una mayor capacidad de adsorción a través de procesos químicos o físicos que permiten el desarrollo de un gran número de estructuras altamente porosas (Figura 3).

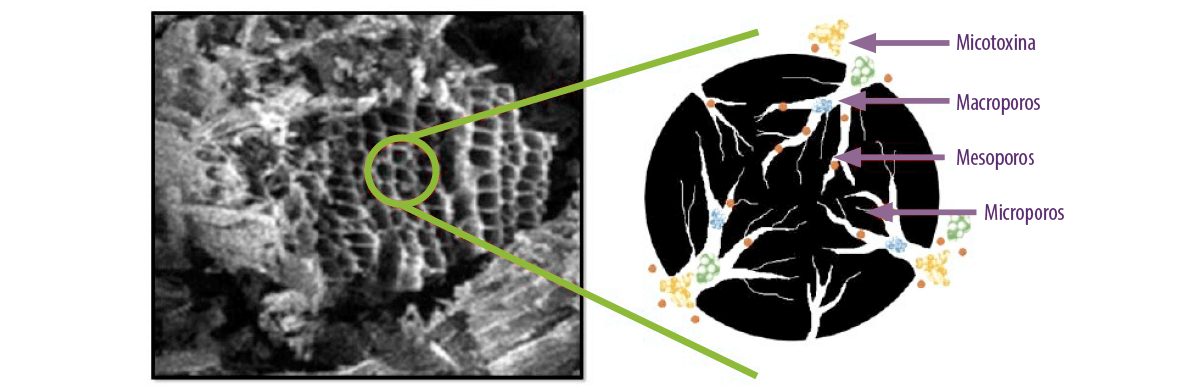
Figura 3. Vista microscópica de microporos de carbón activado y cómo se adsorben las micotoxinas y nutrientes dentro de los poros dependiendo de su tamaño molecular (Kihal et al., 2022).
Adsorbentes orgánicos
PAREDES CELULARES DE LEVADURAS
El adsorbente más importante de este grupo son las paredes celulares de levaduras (LEV), siendo sus β-D-glucanos el principal factor que les otorga su capacidad de adsorción.
⇰ Esta capacidad aumenta a medida que aumenta la proporción de β-D-glucanos presentes en la cepa de levadura (Yiannikouris et al., 2004).
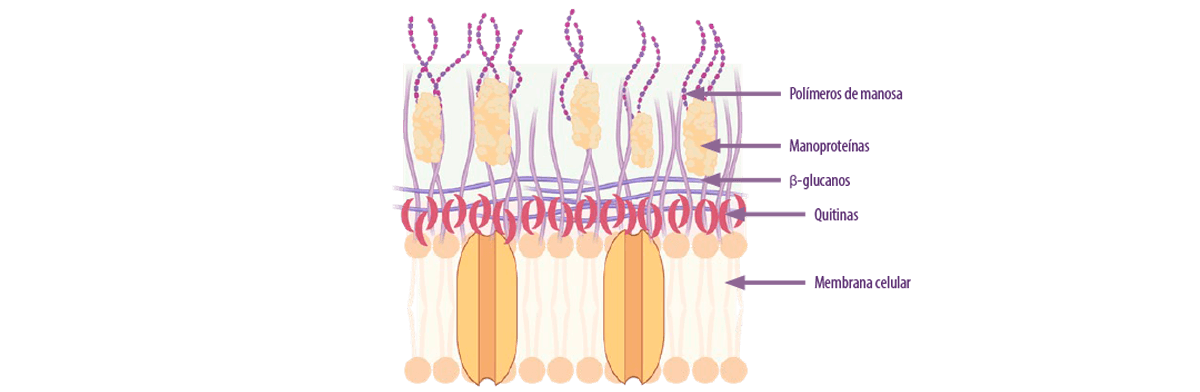
Figura 4. Composición de las diferentes capas de la pared celular de la levadura (Kihal et al., 2022; creado con BioRender).
Efectividad de los adsorbentes
La capacidad de adsorción de micotoxinas está determinada por factores relacionados con el adsorbente, pero también con las características fisicoquímicas de las micotoxinas.
Propiedades de los adsorbentes de micotoxinas
SILICATOS
La capacidad de intercambio de cationes y las cargas netas totales de la superficie determinan la capacidad de los adsorbentes de silicato para adsorber micotoxinas. Sin embargo, esta capacidad de intercambio depende, en gran medida, del pH del adsorbente.
![]() Cada adsorbente tiene su propio pH, pH en el punto cero de carga, en el que la superficie del adsorbente tiene cargas positivas y negativas iguales.
Cada adsorbente tiene su propio pH, pH en el punto cero de carga, en el que la superficie del adsorbente tiene cargas positivas y negativas iguales.
⇰ Si el pH del medio es inferior al del adsorbente, los iones de hidrógeno se unen al adsorbente que pierde su carga.
⇰ Si el pH del medio es superior al del adsorbente, este liberará iones de hidrógeno y expondrá cargas negativas, aumentando la capacidad de atraer cationes responsables de la interacción con las micotoxinas.
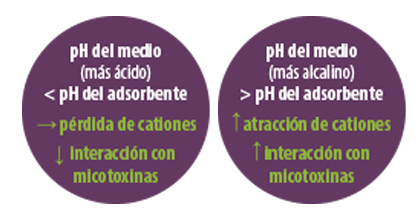
Además de la unión catiónica externa, el espacio interlaminar del adsorbente de micotoxinas también juega un importante papel, de forma que, cuanto mayor sea este espacio, mayor será la capacidad de adsorción del adsorbente de micotoxinas.
CARBON ACTIVADO
Para el carbón activado, el mecanismo de adsorción depende de factores como el tamaño de los poros y el área superficial (Goto et al., 2015).
A diferencia de los minerales arcillosos, el mecanismo de adsorción del carbón activado se debe a interacciones hidrofóbicas y enlaces pi.
Además, el tamaño de los poros y su distribución dentro del carbón activado también son factores limitantes que determinan la eficacia de la adsorción.
PAREDES CELULARES DE LEVADURAS
El mecanismo de adsorción de las paredes celulares de levaduras se debe principalmente a los β-glucanos.
Los enlaces involucrados en esta interacción son:
- ⇰ Los enlaces de Van der Walls entre el ciclo aromático de las micotoxinas y el anillo de β-D-glucopiranosa de la LEV.
- ⇰ Los enlaces de hidrógeno entre los grupos hidroxilo, cetona y lactona de las micotoxinas y el grupo hidroxilo de las unidades de glucosa de β-D-glucanos en las LEV.
(Jouany et al., 2005)

Propiedades de las micotoxinas
Las características fisicoquímicas de las micotoxinas también afectan la capacidad de adsorción de los adsorbentes (Galvano et al., 1997).
Las micotoxinas se pueden clasificar en función de su:
- ⇰ Polaridad
- ⇰ Solubilidad
- ⇰ Estructura química

POLARIDAD
La polaridad de las micotoxinas refleja la disposición de carga dentro de la molécula, pudiendo clasificarse como polar o no polar.
SOLUBILIDAD
La solubilidad de las micotoxinas en el medio es importante para su adsorción.
⇰ La mayoría son solubles en diferentes disolventes orgánicos. Sin embargo, su solubilidad en agua depende de su polaridad, siendo las micotoxinas más polares las más solubles.
ESTRUCTURA QUÍMICA
La estructura química, el tamaño y la forma de la molécula también afectan a su adsorción. La adsorción de micotoxinas tiene una relación directa con el tamaño de las moléculas.
⇰ En este sentido, las micotoxinas con un tamaño pequeño, como las aflatoxinas, se adsorben mejor que micotoxinas con un tamaño más grande, como el caso de las fumonisinas.

Métodos para determinar la capacidad de adsorción de los adsorbentes de micotoxinas
La capacidad de adsorción de los adsorbentes de micotoxinas se determina principalmente mediante pruebas in vitro.
![]() Estas pruebas tienen la ventaja de ser simples, rápidas y económicas.
Estas pruebas tienen la ventaja de ser simples, rápidas y económicas.
Generalmente, estas pruebas consisten en la incubación de las micotoxinas con los adsorbentes a diferentes dosis en un medio que simule la digestión intestinal en condiciones de pH, tiempo y temperatura determinados.
Existen otros modelos más complejos, pero con menos frecuencia de aplicación, como el modelo gastrointestinal dinámico que imita las condiciones del estómago y del intestino delgado de forma continua, o los modelos ex vivo basados en el enriquecimiento de células vivas.
⇰ Estas pruebas de adsorción tienen muchas limitaciones que dan como resultado una gran variabilidad entre estudios.
REFERENCIAS
Čolović, R., N. Puvaca, F. Cheli, G. Avantaggiato, D. Greco, O. Duragic, and L. Pinotti. 2019. Decontamination of mycotoxin-contaminated feedstuffs and compound feed. Toxins. 11:617. doi:10.3390/toxins11110617
European Food Safety Authority (EFSA), 2011. Opinion of the Scientific Panel on Additives and Products or Substances used in Animal Feed (FEEDAP Panel) on the safety and efficacy of bentonite (dioctahedral montmorillonite) as feed additive for all species. EFSA J. 9:2007. doi:10.2903/j.efsa.2014.3694
Galvano, F., A. Pietri, B. Fallico, T. Bertuzzi, S. Scire, M. Galvano, and R. Maggiore. 1996. Activated carbons: in vitro affinity for aflatoxin B1 and relation of adsorption ability to physicochemical parameters. J. Food Protec. 59:545-550. doi:10.4315/0362-028X-59.5.545
Galvano, F., A. Pietri, T. Bertuzzi, M. Bognanno, L. Chies, A. Angelis, and M. Galvano. 1997. Activated carbons: in vitro affinity for fumonisin B1 and relation of adsorption ability to physicochemical parameters. J. Food Protec. 60:985-991. doi:10.4315/0362-028X-60.8.985
Gimeno, A., and M. L. Martins. 2007. Micotoxinas y micotoxicosis en animales y humanos. Special nutrients. 1st edition. Douglas road, Miami, FL. USA. pp, 128.
Goto, T., Y. Amano, M. Machida, and F. Imazeki. 2015. Effect of polarity of activated carbon surface, solvent and adsorbate on adsorption of aromatic compounds from liquid phase. Chem. Pharm. Bull. 63:726-730. doi:10.1248/cpb.c15-00039
Gruber-Dorninger, C., T. Jenkins, and G. Schatzmayr. 2019. Global mycotoxin occurrence in feed: a ten-year survey. Toxins. 11:375. doi:10.3390/toxins11070375
Jouany, J. P., A. Yiannikouris, and G. Bertin. 2005. How yeast cell wall components can alleviate mycotoxicosis in animal production and improve the safety of edible animal products. J. Anim. Sci. 14:171-190. doi:10.22358/jafs/70361/2005
Kihal, A., M. E. Rodríguez-Prado, and S. Calsamiglia. 2022. The efficacy of mycotoxin binders to control mycotoxins in feeds and the potential risk of interactions with nutrient: a review. J. Anim. Sci. 100:1-14. doi:10.1093/jas/skac328
Kogan, G., and A. Kocher. 2007. Role of yeast cell wall polysaccharides in pig nutrition and health protection. Livest. Sci. 109:161-165. doi:10.1016/j.livsci.2007.01.134
Krska, R., M. de Nijs, O. McNerney, M. Pichler, J. Gilbert, S. Edwards, M. Suman, N. Magan, V. Rossi, H. J. van der Fels-Klerx, F. Bagi, B. Poschmaier, M. Sulyok, F. Berthiller, and H. P. van Egmond. 2016. Safe food and feed through an integrated toolbox for mycotoxin management: the MyToolBox approach. World Mycotox. J. 9:487- 495. doi:10.3920/WMJ2016.2136
Murray, H. H. 2007. Developments in clay science. Occurrences, processing and applications of kaolins, bentonites, palygorskitesepiolite, and common clays. Vol 2, 1 180. Elsevier Science & Technology, UK.
Nadziakiewicza, M., S. Kehoe, and P. Micek. 2019. Physico-chemical properties of clay minerals and their use as a health promoting feed additive. Animals. 9:714. doi:10.3390/ani9100714
Yiannikouris, A., J. François, L. Poughon, C. G. Dussap, G. Bertin, G. Jeminet, and J. P. Jouany. 2004. Adsorption of zearalenone by β-D-Glucans in the Saccharomyces cerevisiae cell wall. J. Food Prot. 67:1195-1200. doi:10.4315/0362-028x-67.6.1195




 Prevención de micotoxicosis
Prevención de micotoxicosis